呋虫胺对斑马鱼胚胎-幼鱼生长发育及细胞凋亡的影响
孙琦,范咏梅,赖柯华,黄伟康
海南大学环境与植物保护学院,海口570228
呋虫胺对斑马鱼胚胎-幼鱼生长发育及细胞凋亡的影响
孙琦,范咏梅*,赖柯华,黄伟康
海南大学环境与植物保护学院,海口570228
第三代新烟碱类农药呋虫胺作为超高效、广谱性杀虫剂在水稻、蔬菜和水果上广泛应用,因其水溶性高,对水生生物的毒性不容忽视。本研究以斑马鱼胚胎为对象,参考OECD标准,在胚胎受精后30 min内,采用静态法染毒,观察其24 h、48 h、72 h、96 h的生长发育情况,根据死亡数计算呋虫胺对斑马鱼96 h-LC50,采用吖啶橙染色(acridine orange fluorescent,AO-F)和原位末端标记法(TUNEL)2种方法,检测其对斑马鱼96 hpf(hour post-fertilization,hpf)幼鱼的细胞凋亡情况。结果表明:呋虫胺对斑马鱼胚胎的96 h-LC50为10.36 g·L-1(95%置信区间为7.76~12.93 g·L-1),属于微毒;较高浓度的呋虫胺能使斑马鱼的摆尾数、内心率、孵化率降低,对生长发育有延迟的作用,可导致部分斑马鱼色素褪去,出现心包囊肿、卵黄囊肿和尾部畸形的现象。且随着浓度的升高,在斑马鱼头部、腹部、尾部均有明显的细胞凋亡情况加重,其中以心脏和内耳尤为明显,呈规律的剂量-效应关系。
呋虫胺;斑马鱼;细胞凋亡;吖啶橙染色;TUNEL染色
孙琦,范咏梅,赖柯华,等.呋虫胺对斑马鱼胚胎-幼鱼生长发育及细胞凋亡的影响[J].生态毒理学报,2016,11(3):356-364
Sun Q,Fan Y M,Lai K H,et al.Effects of dinotefuran on the embryonic and larvae development and apoptosis in zebrafish(Danio rerio)[J].Asian Journal of Ecotoxicology,2016,11(3):356-364(in Chinese)
农药施用后会通过雨水冲刷、漂移等方式进入水体,危害水生生物的安全[1]。呋虫胺(dinotefuran),由日本三井(Mitsui)化学公司研发,也被称为“呋喃烟碱”,是烟碱类杀虫剂中唯一不含氯原子和芳环的化合物,具有3-四氢呋喃甲基的特征结构(图1),具有超高效、杀虫谱广、毒性低等特点,同时有内吸、胃毒、触杀等多种作用方式,被广泛应用于水稻、果树、蔬菜等众多作物防治半翅目及其他害虫[2]。由于呋虫胺在水中的溶解度大(40 g·L-1、20℃)、土壤吸附性较弱[3],因而更易流失进入水体,对水生生物造成危害。国外研究主要集中在其环境行为方面,例如在空气中喷散呋虫胺,于稻田水中的降解半衰期为5.6 d,土壤中的半衰期为12 d[4];呋虫胺在水和土壤中的光降解行为研究结果表明,在实验室条件下呋虫胺在水中太阳光照射时其光降解速率kDNT为0.20 h-1,半衰期为3.6 h[5]。国内学者通过模拟实验,发现呋虫胺在水中的光解速率随着初始浓度的升高而减慢,随pH的增加而逐渐加快,其在pH为5、7、8和9的条件下的光解半衰期分别为12.42 h、12.06 h、10.84 h和8.45 h[6]。
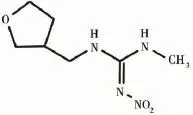
图1 呋虫胺的化学结构式
呋虫胺主要作用于昆虫的烟碱乙酰胆碱受体(nAChRs),是昆虫的乙酰胆碱激动剂,可防治半翅目、鳞翅目、甲虫目、双翅目、直翅目、膜翅目等各种害虫[7],亦有褐飞虱,白背飞虱和灰飞虱对其抗药性监测的报道[8]。目前主要的剂型有水分散粒剂、2%颗粒剂、0.5%粉剂、1%颗粒剂、20%可溶性粒剂等5种[9]。呋虫胺对非靶标类生物的毒性研究也有报道,如对鸟类毒性低,对鹌鹑急性经口LD50>1 000 mg·kg-1[7]。对意大利蜂急性毒性的LC50为0.260 a.i. mg·L-1[10];对小峰熊蜂工蜂24 h的LC50值为0.75 mg·L-1,经过48 h连续胃毒作用的LC50值为0.54 mg·L-1,对小峰熊蜂雄性蜂24 h的LC50值为2.16 mg·L-1[11]。对家蚕急性食下毒性为高毒,其对3龄家蚕的急性食下毒性的LC50为1.2625 mg·L-1[12]。其对哺乳动物相对安全,雄性大鼠急性经口LD50为2 450 mg·kg-1,雌性大鼠2 275 mg·kg-1,雄性小鼠2 840mg·kg-1,雌性小鼠2 000 mg·kg-1。对大鼠急性经皮LD50>2 000 mg·kg-1(雌、雄)[7],无致畸、致癌和致突变性[13]。呋虫胺原药及其2种剂型对3种甲壳纲生物的毒性与风险评价结果表明,呋虫胺对剑水蚤的急性风险较高[1]。还有研究表明,呋虫胺对水蚤(daphnia)的48 h-EC50>1 000 mg·L-1,对水藻(alga)的72 h-EC50>100 mg·L-1,对鲤鱼(carp)的96 h-LD50>100 mg·L-1[7]。因此,研究呋虫胺对非靶标的水生生物毒性显得极为重要,而呋虫胺对斑马鱼的毒性研究国内外仅见其急性毒性的报道[10],尚无其对斑马鱼胚胎毒性的相关研究报道。
细胞凋亡(apoptosis)是由基因控制的细胞自主的有序性死亡,又称为程序性细胞死亡(programmed cell death,PCD)[14]。细胞凋亡的研究方法主要有吖啶橙染色、TUNEL染色及DNA阶梯等,其中通过吖啶橙染色荧光显微镜下观察凋亡细胞的方法简便易操作,使用较普遍。荧光显微镜下,活细胞核染色质呈现均匀分布的黄绿色荧光,胞质呈橘红色荧光,而凋亡细胞核染色质的黄绿色荧光浓聚在核膜内侧,凋亡细胞核的特征性形态可被清晰地辨认[15]。TUNEL是分子生物学和形态学相结合的一种方法,能准确反映细胞凋亡的典型生物化学和形态学特征。大量的DNA双链断裂被认为是凋亡中最显著的特征,因此TUNEL也被认为是检测细胞凋亡的金标准[16]。TUNEL具有灵敏度高、反应快、能检测出极少量的细胞凋亡,被广泛应用于细胞凋亡和神经元退化的检测[17]。DNA阶梯的检测简便易行,费用低廉,应用较普遍。但是,细胞凋亡时核内DNA断裂发生较晚,而且细胞受到其他损伤(如机械损伤、化学物质刺激、紫外线照射等)时也会发生DNA断裂。因此DNA阶梯法鉴定细胞凋亡,早期可能不易捕获证据,而晚期则证据说服力不足,且其只能定性不能定量[16]。本文作者所在项目组也曾利用DNA阶梯方法检测细胞凋亡[18]。综合比较以上3种研究方法,基于定量和准确性的考虑,本文选择了将简便易操作的吖啶橙染色和灵敏度高、反应快的TUNEL染色两种方法结合,在考察呋虫胺原药对斑马鱼胚胎发育毒性的基础上,进行初孵幼鱼的吖啶橙染色、TUNEL染色,研究其诱导斑马鱼初孵幼鱼产生细胞凋亡的情况,为进一步进行毒理学机理研究奠定基础。
1 材料与方法(Materials and methods)
1.1 供试材料
1.1.1 药品及主要试剂
呋虫胺原药购于上海将来实业股份有限公司,有效成分含量为96%,储存于4℃。其他主要试剂如下:磷酸盐缓冲液(PBS)购自上海立菲生物技术有限公司,吖啶橙、3%甲基纤维素、Tween-20、4%多聚甲醛均购自北京索莱宝科技有限公司,Protease K购自北京全式生物技术有限公司,鱼安定购自东京化成工业株式会社,一步法TUNEL试剂盒购自碧云天生物技术研究所。
1.1.2 仪器设备
斑马鱼养殖系统购自北京爱生科技发展有限公司,BX51荧光显微镜和SZX16体视显微镜均购自Olympus公司,PHSJ-4 A实验室pH计购自上海仪电科学仪器股份有限公司,万分之一天平购自梅特勒-托利多仪器有限公司。
1.1.3 供试斑马鱼
斑马鱼饲养:野生AB型斑马鱼(Danio rerio),由国家斑马鱼资源中心引进,斑马鱼养殖系统饲养,每日监控过滤水pH为7.5±0.3,溶氧量≥80%,温度为(26±1)℃,以保证其在最适生长环境下生长。成鱼用新鲜孵化的丰年虫喂养,每日2次,每次足量。斑马鱼胚胎获取:将成熟后的雌雄鱼分开饲养。试验的前一天晚上将雌雄成鱼按照1:2的比例放于产卵盒中,温度为(27±1)℃。用隔离板将雌雄鱼隔开,光照与黑暗的时间比为14 h∶10 h,次日清晨打开隔离板,在光照的刺激下,雄鱼开始追逐雌鱼,雌鱼开始产卵,30 min后收集受精卵,去除饲料和粪便,用孵化液清洗2遍后,放入有孵化液的培养皿中,挑选受精的胚胎待用。孵化液的温度为(26±1)℃,pH为7.2±0.1,含氧量≥80%。
1.2 试验方法
1.2.1 呋虫胺对斑马鱼胚胎急性毒性试验
参照OECD准则[19]进行。试验用受精卵在30 min内染毒,根据预实验的结果,5个试验浓度分别为6 g·L-1、8.97 g·L-1、13.41 g·L-1、20.05 g·L-1和30 g·L-1,另有空白对照CK,因呋虫胺在水中的溶解度高,故无溶剂对照。配好后吸取到24孔培养板中,每孔2 mL。用双目显微镜观察并挑取合格的受精卵,置于培养板中,每孔一粒。每个处理重复3次,于光、暗比为14 h∶10 h的光照培养箱中培养,每24小时观察其死亡数和孵化数等指标,连续观察4 d。依据OECD标准,配制4 mg·L-1的3,4-二氯苯胺溶液作为阳性对照。
1.2.2 吖啶橙染色
配制浓度为2 mg·L-1的吖啶橙工作液,将发育至96 hpf的胚胎整体放入其中,避光染色30 min,用PBS(pH 7.2)清洗3遍,放入培养板中备用。将需要观察的幼鱼用0.08%的Tricaine麻醉。用吸管将麻醉后的幼鱼置于滴有3%甲基纤维素溶液的玻片上。将荧光显微镜的激发光波长调节为450 nm,观察幼鱼的细胞凋亡程度,每条鱼不同角度拍照5张。
1.2.3 TUNEL染色
选用一步法TUNEL细胞凋亡检测试剂盒(红色荧光),C1089,主要的染色步骤如下:将幼鱼用4%多聚甲醛(4%PFA)固定,室温保存4 h,用甲醇和1× PBST(V∶V)进行梯度脱水,梯度依次为0∶1、1∶3、1∶1、3∶1、1∶0,每次5 min,脱水后放置于-20℃。第2天进行梯度复水,将脱水体积比的梯度倒置,但不用纯甲醇清洗,用V(甲醇):V(无菌水)=3:1的比例清洗,之后按甲醇:1×PBST(V∶V)=1:1、1:3、0:1的体积比清洗,每次5 min。每个幼鱼样品中加入500 μg的20 μg·L-1的Protease K,保证样品被浸没,37℃下反应60 min后用1×PBST清洗3~5次,每次5 min,后用4%PFA处理20 min,使Protease K失活,并用1×PBST清洗5次,每次5 min。取TUNEL试剂盒中TdT酶2 μL,荧光标记液48 μL,充分混匀用作酶反应液。最后于37℃避光孵育60 min,荧光显微镜拍摄,每条鱼不同角度拍照5张。
1.2.4 数据统计分析方法
使用SPSS 21.0对96 hpf死亡率数据进行统计分析,得到96-LC50及95%置信区间;统计24 hpf斑马鱼胚胎1 min中内的摆尾数,48 hpf和72 hpf的内心率和96 hpf的孵化率。
2 结果与分析(Results and analysis)
2.1 呋虫胺对斑马鱼胚胎的急性毒性
2.1.1 参比物质控试验
配制4 g·L-1的3,4-二氯苯胺溶液作为阳性对照,染毒96 h后,胚胎死亡率为100%,符合OECD标准大于30%的要求,说明胚胎的敏感性良好。
2.1.2 呋虫胺对斑马鱼急性毒性结果
本实验结果表明,96 h的LC50值为10.36 g·L-1(95%置信区间为7.76~12.93 g·L-1),线性回归方程为y=-1.13+0.11x(表1)。
2.1.3 呋虫胺对斑马鱼胚胎的亚致死效应
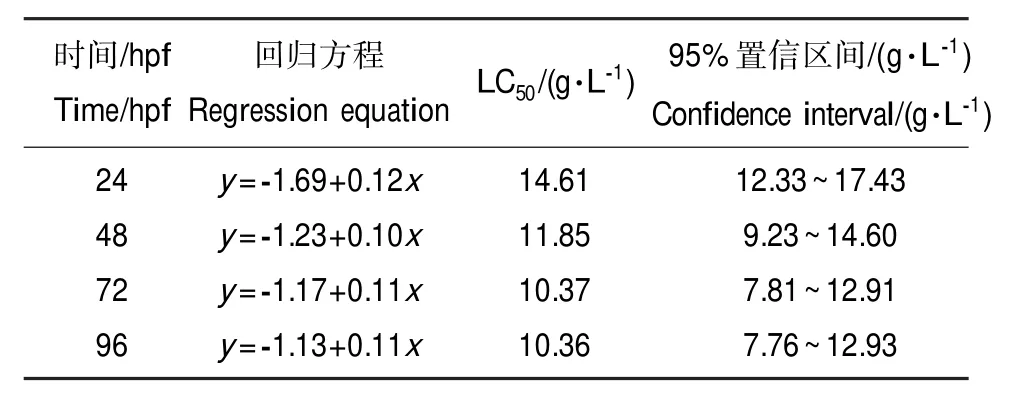
表1 呋虫胺对斑马鱼胚胎的急性毒性Table 1 Acute toxicity of dinotefuran toDanio rerioembryo

图2 不同浓度呋虫胺对10 hpf斑马鱼胚胎发育的影响

图3 不同浓度呋虫胺对24 hpf斑马鱼胚胎发育的影响
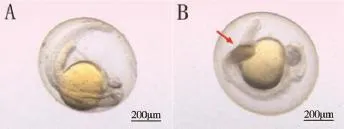
图4 24 hpf正常斑马鱼胚胎(A)与20.05 g·L-1呋虫胺浓度组胚胎(B)尾部对比图
分别记录了胚胎在10 h、24 h、48 h、72 h和96 h的生长发育情况。在10 h时,胚胎发育均进入原肠期,其中空白对照发育正常,处于尾芽期,6 g·L-1的处理组处于90%-外包期,8.97 g·L-1处理组处于胚盾期,13.41 g·L-1和20.05 g·L-1处理组均处于胚环期,30 g·L-1的处理组胚胎已经全部死亡(图2)。结果表明,呋虫胺对斑马鱼胚胎发育有明显的延迟作用,延迟作用与浓度呈正比。

图5 不同浓度呋虫胺对24 hpf斑马鱼胚胎1 min内摆尾数的影响
在发育至24 h时,浓度为13.41 g·L-1和20.05 g ·L-1的处理组出现发育延迟的现象(图3D、3E),表现为尾部未伸展,且20.05 g·L-1浓度组中出现了尾部畸形的情况(图4)。观察24 hpf的1 min内摆尾数如图5,结果表明,随着浓度的升高,摆尾数越来越少。

图6 不同浓度呋虫胺对48 hpf斑马鱼胚胎发育的影响

图7 48 hpf正常斑马鱼幼鱼与20.05 g·L-1呋虫胺浓度组中幼鱼色素和尾部对比图
48 hpf时,畸形情况表现较显著(图6)。空白对照和低浓度6 g·L-1处理胚胎均生长正常,随着浓度的继续升高,每个浓度组都出现了不同程度的卵黄囊肿现象,8.97 g·L-1的处理组中个别胚胎出现心包囊肿,13.41 g·L-1和20.05 g·L-1的胚胎还出现了色素减少的现象,20.05 g·L-1的胚胎和幼鱼出现了心包囊肿和尾部弯曲的现象(图7)。结果表明,在处理的浓度范围内,随着浓度的升高,呋虫胺对斑马鱼胚胎生长发育的影响也越来越严重,主要表现为形态畸形和色素减少。
72 hpf时,空白组和6 g·L-1的处理组均生长正常,绝大多数6 g·L-1处理组生长正常,13.41 g·L-1出现心包囊肿和卵黄囊肿现象(图8),20.05 g·L-1处理组同样出现心包囊肿和卵黄囊肿,同时还伴有血凝结。当胚胎发育到72 h时,空白组和低浓度处理组已经有部分胚胎孵化(初孵幼鱼),其中,8.97 g·L-1处理组出现卵黄囊肿现象,13.41 g·L-1处理组伴有尾部畸形(图9),其余浓度除最高浓度(20.05 g·L-1)未孵化外,初孵幼鱼均生长正常,说明呋虫胺对斑马鱼胚胎的生长发育有延迟的作用。此外,呋虫胺对斑马鱼胚胎的内心率也有一定影响,对48 hpf和72 hpf胚胎的内心率进行统计,结果表明,6 g·L-1呋虫胺能加快斑马鱼胚胎的内心率,且暴露在此浓度呋虫胺下的斑马鱼跟空白对照相比也更加活跃,之后随着浓度的升高,呋虫胺对斑马鱼内心率表现为抑制作用(图10)。

图8 不同浓度呋虫胺对72 hpf斑马鱼胚胎发育的影响

图9 不同浓度呋虫胺对72 hpf斑马鱼初孵幼鱼的影响
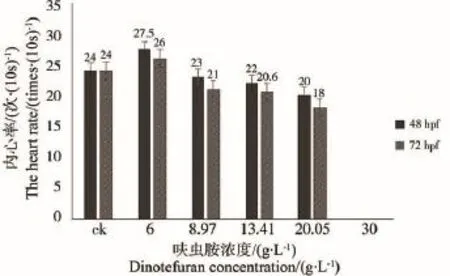
图10 不同浓度呋虫胺对48 hpf和72 hpf斑马鱼胚胎内心率的影响

图11 呋虫胺对96 hpf斑马鱼胚胎及幼鱼的影响

图12 不同浓度呋虫胺对96 hpf斑马鱼胚胎孵化率的影响
96 hpf时,8.97 g·L-1、13.41 g·L-1的处理组均伴有畸形情况出现,包括卵黄囊肿、心包囊肿、尾部畸形,20.05 g·L-1处理组没有孵化,空白组和6 g·L-1处理组的幼鱼生长正常(图11)。随着浓度的升高,斑马鱼胚胎的孵化率逐渐降低(图12),72 hpf时呋虫胺延迟斑马鱼胚胎发育的作用已经初步显现。
2.2 吖啶橙染色
采用吖啶橙(AO)对斑马鱼96 hpf的初孵幼鱼或胚胎进行整体活体染色,在450 nm的荧光下,发出绿色的荧光,而凋亡的细胞的荧光更加明亮,结果表明其对DNA造成了损伤(图13)。
空白对照组没有出现细胞凋亡现象,6 g·L-1和8.97 g·L-1的处理组出现少部分的细胞凋亡,相当数量的细胞凋亡出现在13.41 g·L-1和20.05 g·L-1的处理组中,尤其是在心脏和内耳的部分。
2.3 TUNEL染色
对96 hpf的斑马鱼幼鱼进行TUNEL染色,结果表明,空白对照组没有出现细胞凋亡的现象,6 g· L-1和8.97 g·L-1的处理组出现了少部分的细胞凋亡,头部、腹部、尾部均出现,尤其是在心脏和内耳的部分,但是相当多数量的细胞凋亡出现在13.41 g· L-1和20.05 g·L-1的处理组中(图14)。结果与吖啶橙染色结果相似。
3 讨论(Discussion)
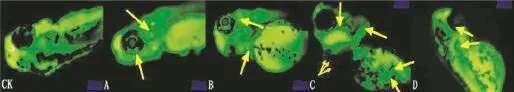
图13 吖啶橙染色法检测呋虫胺诱导斑马鱼胚胎细胞凋亡
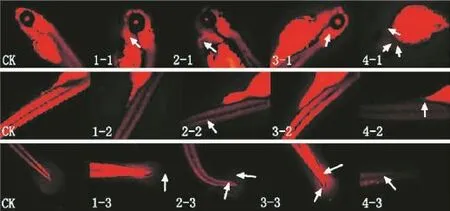
图14 TUNEL染色法检测呋虫胺诱导斑马鱼胚胎细胞凋亡
已有研究表明,呋虫胺对普通鲤鱼LD50>100 mg·L-1,对水蚤EC50(48 h)>1 000 mg·L-1,均为低毒[7],但是对其他水生生物则表现出不同毒性,如糠虾LC50(96 h)为0.79 mg·L-1(高毒),龙虾LC50(48 h)为4.84 mg·L-1(中毒),东方牡蛎LC50(96 h)为141 mg ·L-1(低毒),浮萍EC50>110 mg·L-1(低毒)[20],这可能因为不同生物对农药的生物可利用性以及吸收机制等不同,受到的毒害作用有所不同,而呋虫胺主要作用于乙酰胆碱受体且易溶于水,而乙酰胆碱在糠虾的生长繁殖过程中起着极为重要的作用,因此表现为高毒[21]。
近期吴若函等[8]考察了几种新烟碱类杀虫剂对斑马鱼的急性毒性,结果表明20%呋虫胺悬浮剂对斑马鱼幼鱼96 h-LC50为59.7 mg·L-1,为低毒;本研究结果中呋虫胺原药对斑马鱼胚胎急性毒性96-LC50为10.36 g·L-1,为微毒,在呋虫胺原药的水溶解度的范围内,呋虫胺可使斑马鱼胚胎的摆尾数、内心率、孵化率降低,可导致斑马鱼出现心包囊肿、卵黄囊肿、色素褪去、发育延迟等现象;这说明制剂的毒性比原药的毒性要高,因此,虽然按规定的剂量在田间使用此农药,不会对鱼类造成危害性的影响,但是由于其溶解性好,大量、反复使用时,该药剂对斑马鱼还是有毒性风险的。
同为新烟碱类杀虫剂的吡虫啉和噻虫嗪也可影响斑马鱼的细胞凋亡。陈爱梅等[22]认为,两者均对斑马鱼肝脏细胞的DNA造成了损伤,损伤程度随染毒浓度和染毒时间增高,且吡虫啉对斑马鱼的基因毒性大于噻虫嗪。同为手性农药的茚虫威对斑马鱼急性毒性属于中等毒性[23]。本研究用2种染色方法对96 h的斑马鱼的凋亡信号进行检测,结果显示凋亡细胞均集中在心脏和内耳部分,具有组织特异性,且浓度越高,细胞凋亡越严重,可以为进一步揭示呋虫胺对斑马鱼的毒作用靶器官和毒效应机制提供线索。
(References):
[1] 张文萍,王全胜,徐吉洋,等.呋虫胺原药及两种剂型对三种甲壳纲生物的毒性与风险评价[J].农药环境科学学报,2015,34(8):1478-1485
Zhang W P,Wang Q S,Xu J Y,et al.Toxicity and risk of different formulations of dinotefuran to three crustaceans [J].Journal of Agro-Environmental Science,2015,34(8): 1478-1485(in Chinese)
[2] 张亦冰.新内吸杀虫剂:呋虫胺[J].世界农药,2003,25 (5):46-47
[3] Kurwadkar S T,Dewinne D,Wheat R,et al.Time dependent sorption behavior of dinotefuran,imidacloprid and thiamethoxam[J].Journal of Environmental Science and Health,Part B,2013,48(4):237-242
[4] Sayako Y,Masataka I,Shunsuke N,et al.Runoff and degradation of aerially applied dinotefuran in paddy fields and river[J].Bulletin of Environmental Contamination and Toxicology,2015,94(4):796-800
[5] Sudarshan K,Amanda E,Dustand D W,et al.Modeling photodegradation kinetics of three systemic neonicotinoids -dinotefuran,imidacloprid and thiamethoxam in aqueous and soil environment[J].Environmental Toxicology and Chemistry,2016,9999(12):1-9
[6] 郑立庆,赵源,张磊磊,等.呋虫胺在水中的光化学降解[J].河南师范大学学报:自然科学版,2015,43(1):93-99
Zheng L Q,Zhao Y,Zhang L L,et al.Phtochemistry degradation of dinotefuran in water[J].Journal of Henan Normal University:Natural Science Edition,2015,43(1): 93-99(in Chinese)
[7] Takeo W,Naoko Y,Eiichi Y,et al.Development of a novel insecticide,dinotefuran[J].Journal of Pesticide Science,2005,30(2):122-123
[8] Xi C M,Wei Z,Li X W,et al.Resistance monitoring and cross-resistance patterns of three rice planthoppers,Nilaparvata lugens,Sogatella furciferaandLaodelphax striatellusto dinotefuran in China[J].Pesticide Biochemistry and Physiology,2016
[9] 杨光.巴斯夫推出杀虫剂Alpine(呋虫胺)新剂型[J].农药研究与应用,2012(4):35
[10] 吴若函,丁悦,严海娟,等.新烟碱类杀虫剂对几种环境生物的安全性评价[J].江苏农业科学,2016,44(1): 295-297
[11] 刘佳霖,伍翔,廖秀,等.4种杀虫剂对小峰熊蜂工蜂和雄性蜂的急性经口毒性测定[J].农药,2012,51(6):436-438
Liu J L,Wu X,Liao X,et al.Evaluation the oral toxicity of four pesticides toBombus hypocritaworkers and drones[J].Agrochemicals,2012,51(6):436-438(in Chinese)
[12] 陈伟国,孙海燕,杨一平,等.第三代烟碱类杀虫剂呋虫胺对家蚕的毒性与安全性评价[J].广西蚕业,2015, 52(1):19-22
[13] 朴秀英,嵇莉莉,林荣华,等.新烟碱类杀虫剂登记与管理现状分析[J].中国植保导刊,2015(3):70-74
[14] 矫毓娟,刘江红.细胞凋亡的检测方法[J].中国神经免疫学和神经病学杂志,2004,11(1):53-56
[15] 王嘉宁,郭宁.细胞凋亡的检测技术与方法[J].中国药理学与毒理学杂志,2005,19(6):466-470
Wang J N,Guo N.Techniques and methods of identifyingapoptosis[J].Chinese Journal of Pharmacology and Toxicology,2005,19(6):466-470(in Chinese)
[16] Darzynkiewicz Z,Galkowski D,Zhao H.Analysis of apoptosis TUNEL by cytometry using TUNEL assay[J]. Methods,2008,44(3):250-254
[17] Luo C L,Chen X P,Ni H,et al.Comparison of labeling methods and time course of traumatic brain injury-induced cell death in mice[J].Neural Regeneration Research,2010,5(9):706-709
[18] 李江,赖柯华,冯青,等.螺虫乙酯对斑马鱼的急性毒性及细胞凋亡的影响[J].热带农业科学,2015,35(5): 45-49
Li J,Lai K H,Feng Q,et al.Effects of spirotetramat on acute toxicity and apoptosis of zebra fish[J].Chinese Journal of Tropical Agriculture,2015,35(5):45-49(in Chinese)
[19] OECD.OECD guidelines for the testing of chemicals. Draft proposal for a new guideline,fish embryo toxicity (FET)test[S].Paris:OECD,2013
[20] 柏亚罗,顾林玲,张晓进,等.专利过期重要农药品种手册:2012-2016[M].北京:化学工业出版社,2014
[21] 陈爱梅,王金花,夏晓明,等.不同剂型吡虫啉对蚯蚓和斑马鱼的急性毒性评价[J].农业环境科学学报, 2013,32(9):1758-1763
[22] 陈爱梅.吡虫啉和噻虫嗪对对斑马鱼氧化胁迫及DNA损伤[D].泰安:山东农业大学,2013:29-30
Chen A M.Oxidative stress and DNA damage induced by imidacloprid and thiamethoxam exposure in zebrafish (Danio rerio)[D].Tai’an:Shandong Agricultural University,2013:29-30(in Chinese)
[23] 冯青,赖柯华,黄伟康,等.茚虫威对斑马鱼的急性毒性及遗传毒性[J].生态毒理学报,2015,10(4):226-234
Feng Q,Lai K H,Huang W K,et al.Acute and genetic toxicity of indoxacarb to zebrafish(Brachydanio rerio)[J]. Asian Journal of Ecotoxicology,2015,10(4):226-234(in Chinese)◆
Effects of Dinotefuran on the Embryonic and Larvae Development and Apoptosis in Zebrafish(Danio rerio)
Sun Qi,Fan Yongmei*,Lai Kehua,Huang Weikang
College of Environment and Plant Protection,Hainan University,Haikou 570228,China
15 May 2016 accepted 29 June 2016
Dinotefuran,as one of the third-generation neonicotinoid insecticide,is highly potent pesticide widely used to control insects on rice,vegetables and fruit field.However,the toxicity of dinotefuran to aquatic organism is still unclear.This study is to explore the effect of dinotefuran on the embryonic and larvae development and apoptosis in zebrafish(Danio rerio).According to OECD guidelines,the 96 h acute toxicity test was conducted using 30 min post-fertilization zebrafish by static system,and the treated zebrafish embryonic and larvae development, were observed in 24 h,48 h,72 h and 96 h respectively.The 96 h-LC50of dinotefuran for adolescent zebrafish was calculated using Karber's method.Then using acridine orange fluorescent(AO-F)and TUNEL staining,the apoptosis of 96 hour post-fertilization(hpf)zebrafish larvae was tested.The results showed that the 96 h-LC50of dinotefuran for zebrafish was 10.36 g·L-1,with the 95%confidence interval of 7.76-12.93 g·L-1,which is the slightlytoxic according to the pesticide acute toxicity classification standard.Dinotefuran with higher concentration can reduce the tail swing frequency,heart rate and hatchability ofD.rerio,delay the growing development,lead to the disappearance of the pigment inD.rerioand cause the pericardiac cyst,vitelline cyst and tail deformity.With the increase of dinotefuran concentration,there were obvious apoptosis observed in the head,abdomen and tail of zebrafish,especially in the heart and inner ear.
dinotefuran;zebrafish;apoptosis;acridine orange fluorescent;TUNEL staining
2016-05-15 录用日期:2016-06-29
1673-5897(2016)3-356-09
X171.5
A
10.7524/AJE.1673-5897.20160515001
简介:范咏梅(1968—),女,教授,硕士生导师,农药与农产品质量安全系系主任,主要研究方向农药环境毒理,园艺作物病虫害防治与农产品质量安全风险评估。
国家科技支撑计划项目(2012BAK01B05);海南省教育厅项目(HNJG2014-07)
孙琦(1994-),女,学士,研究方向为植物保护,E-mail:qisun2016@126.com;
*通讯作者(Corresponding author),E-mail:yongmeifan@126.com

