虾夷扇贝毒素(yessotoxin)诱导的栉孔扇贝(Chlamys farreri)体内P糖蛋白转运活性及其分布研究
赵翠琼,高春蕾,姜美洁,贾智慧,王宗兴,王宗灵,#
1.国家海洋局第一海洋研究所,青岛266061
2.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,青岛266061
3.国家海洋局东海预报中心,上海200081
虾夷扇贝毒素(yessotoxin)诱导的栉孔扇贝(Chlamys farreri)体内P糖蛋白转运活性及其分布研究
赵翠琼1,2,3,高春蕾1,2,*,姜美洁1,2,贾智慧1,2,王宗兴1,2,王宗灵1,2,#
1.国家海洋局第一海洋研究所,青岛266061
2.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,青岛266061
3.国家海洋局东海预报中心,上海200081
大量研究表明P-糖蛋白(P-glycoprotein,P-gp)介导的多型异源物质抗性机制(multi-xentiobiotic resistance,MXR)在贝类耐受或抵抗污染水域中有毒有害物质的毒害中具有重要作用,但是该机制在贝类抵抗或耐受食源性毒素方面作用的研究却很少。本研究以栉孔扇贝(Chlamys farreri)为实验动物,向其投喂产虾夷扇贝毒素(yessotoxins,YTXs)的网状原角藻(Protoceratium reticulatum),通过检测栉孔扇贝鳃和消化腺组织中YTX毒素含量随时间的变化情况,结合2种组织中P-gp介导的MXR活性变化及P-gp在组织中的表达和分布,探讨P-gp在扇贝耐受YTX毒素中可能的作用。研究结果表明,随着毒藻暴露时间的延长,栉孔扇贝鳃和消化腺中YTX含量逐渐增加,且具有明显的时间依赖关系。YTX的大量累积虽未导致扇贝死亡,但是仍然对扇贝组织产生不同程度的毒性。苏木精-伊红(hematoxylin-eosin,HE)染色发现,染毒12 h后,栉孔扇贝鳃组织前端出现明显黑化,消化腺组织导管上皮细胞部分脱落入管腔中,腺管内细胞界限模糊,部分腺管崩解。罗丹明B(rhodamine B,RhoB)外排实验表明YTX毒素暴露能显著增强栉孔扇贝鳃和消化腺组织中P-gp的转运活性,暴露12 h后鳃和消化腺RhoB的排出速率就已分别达到对照组的3.8倍和1.4倍,随着暴露时间的延长,P-gp活性略有增强,72 h后开始下降;P-gp的功能性抑制剂维拉帕米(verapamil,VRP)在实验设定的浓度下没有抑制反而增强了RhoB的外排;免疫定位显示,毒素暴露后栉孔扇贝鳃丝前端纤毛柱状细胞及消化腺导管上皮柱状细胞和腺管消化细胞P-gp免疫阳性信号增强,说明YTX毒素暴露提高了P-gp的表达量。综上推断,YTX毒素可能是P-gp的底物,它能够诱导P-gp转运活性增强,并增加P-gp的表达量来参与扇贝对YTX毒素的耐受或抗性;设定浓度的VRP不能抑制P-gp的活性,这可能是由于种属差异造成的,关于VRP对栉孔扇贝P-gp的作用还有待进一步的研究。
虾夷扇贝毒素;栉孔扇贝;网状原角藻;鳃;消化腺;P糖蛋白;罗丹明B;维拉帕米
赵翠琼,高春蕾,姜美洁,等.虾夷扇贝毒素(yessotoxin)诱导的栉孔扇贝(Chlamys farreri)体内P糖蛋白转运活性及其分布研究[J].生态毒理学报,2016,11(3):281-293
Zhao C Q,Gao C L,Jiang M J,et al.Transport activity and distribution of P-glycoprotein induced by yessotoxin in scallopChlamys farreri[J].Asian Journal of Ecotoxicology,2016,11(3):281-293(in Chinese)
多型异源物质抗性机制(multi-xenobiotic resistance,MXR)被认为是水生生物抵抗环境中有害物质的第一道防线[1],P糖蛋白(P-glycoprotein,P-gp)是介导MXR的众多蛋白中的一种,也是目前研究最多最深入的一种蛋白[2]。P-gp通过水解ATP将外源物质(如毒素、药物、重金属等)泵出细胞外,降低有害物质在体内的累积和对机体造成的伤害[2-4],从而提高水生生物对有害物质的抗性或耐受性。所以,P-gp也被认为是ABC转运蛋白超家族中与毒理相关性最高的一种蛋白[5]。目前,P-gp介导的MXR已经在贻贝、扇贝、牡蛎、蛤等双壳贝类体内得到证实。
贝类中P-gp介导的MXR的研究主要集中在贝类对重金属和有机污染物耐受性方面。Kurelec[2]于1992年首次证实了致癌物质苯并[α]芘(benzopyrene,B[α]P)和乙酰氨基芴(2-acetylaminofluorene,2-AAF)诱导紫贻贝(Mytilus galloprovincialis)和河蚌(Anodonta cygnea)鳃组织产生的MXR是由P-gp介导的,其转运活性受到多药耐药机制(multi-drug resistance,MDR)的抑制剂维拉帕米(verapamil,VRP)的抑制。不同浓度的B[α]P染毒实验表明B[α]P能诱导栉孔扇贝(Chlamys farreri)鳃和消化腺组织P-gp的大量表达,并呈明显的剂量依赖性和时间依赖性[6-7]。1996年,Waldmann等[8]报道了长春新碱(3H-vincristine,3H-VCR)和2-AAF均能诱导河蚬(Corbicula fluminea)的鳃组织大量合成P-gp,VRP和星孢菌素(staurosporine,STP)则能抑制P-gp转运活性。李志茹[9]关于镉(Cd)在文蛤(Meretrix lusoria)、毛蚶(M.meretrix)、紫贻贝(M.edulis)和太平洋牡蛎(Crassostrea gigas)等不同双壳贝类体内富集和脱除实验表明,暴露于Cd中的贝类,尤其是毛蚶,其P-gp的表达活性显著增强,且对Cd的富集和脱除过程中均有重要作用。
除上述有机污染物和重金属外,P-gp在贝类对藻毒素的抗性中也发挥了重要作用。以产石房蛤毒素(saxitoxin,STX)的链状亚历山大藻(Alexandrium catanella)为饵料投喂加州贻贝(M.californicus),其鳃组织MXR排出罗丹明B(rhodamine B,RhoB)的量大于未投喂毒藻时[10]。腹泻性贝毒(diarrhetic shellfish poisoning,DSP)中的大田软海绵酸(okaoaic acid, OA)作用于近江牡蛎(C.ariakensis)后,其鳃组织中P-gp活性显著升高,且mRNA的表达显著上调[11]。Svensson等[12]在紫贻贝暴露于OA的实验中发现,贻贝溶酶体的膜上也存在MXR。
我国是一个贝类养殖大国,也是有毒有害赤潮频发的国家。除了发生频率高、影响较为严重的麻痹性贝毒(paralytic shellfish poisoning,PSP)和DSP外,近几年从我国沿海贝类中不断有新的生物毒素被检出,虾夷扇贝毒素(yessotoxins,YTXs)就是其中的一类[13]。
YTXs为脂溶性多环聚醚类化合物,主要由网状原角藻(Protoceratium reticulatum)[14]、多边舌甲藻(Lingulodinium polyedrum)[15]和具刺膝沟藻(Gonyaulax spinifera)[16]等海洋甲藻产生,贝类通过滤食这些有毒藻极易在体内累积和转化YTXs。2010年,高春蕾等[17]首次从中国沿海贝类海湾扇贝(Argopecten irradians)和虾夷扇贝(Patinopecten yessoensis)中检出YTXs,之后不断有从贝类中检出YTXs毒素的报道,而且贝类中YTXs的含量呈逐步增加的趋势,如陈建华等[18]从2011年采自北黄海海域的虾夷扇贝样品中检测到的YTX毒素含量竟高达6.68 ×103μg·kg-1。尽管贝类中累积了如此大量的YTX毒素,但是鲜有报道贝类因此死亡的事件,因此推测P-gp可能在贝类耐受YTXs中发挥了重要作用。
本研究以我国近海重要的经济养殖贝类-栉孔扇贝为实验动物,通过投喂产YTX毒素的毒藻暴露实验,研究YTX毒素暴露前后栉孔扇贝体内P-gp活性的变化、P-gp在扇贝组织中的分布与定位等,阐明YTX毒素累积与P-gp活性及其表达的相关性,为双壳贝类毒素抗性或耐受机制研究提供数据。
1 材料与方法(Materials and methods)
1.1 实验试剂与仪器
主要试剂:甲醇、乙醇、二甲苯、氯化钠(NaCl)、氯化钾(KCl)及其他试剂均为分析纯,购自上海国药集团化学试剂有限公司。SABC免疫组化试剂盒,购自武汉博士德生物工程有限公司。
主要仪器:S10型手提式高速分散器(新芝,宁波),5804R离心机(Eppendorf,Germany),NDK200-2氮吹仪(百典,上海),1200高效液相色谱仪(Agilent,USA),API4000三重四极杆质谱检测器(Applied Biosystems GmbH,Germany),LS-55荧光分光光度计(PerkinElmer, USA),TE2000-U倒置显微镜(Nikon,Japan)。
1.2 藻种及培养条件
本实验所用网状原角藻由国家海洋环境监测中心提供,分离自北黄海海域。
藻种培养所用海水取自青岛石老人海水浴场,盐度为31,pH值为7.9±0.1,砂滤后经过0.45 μm微孔滤膜过滤,转移至三角瓶中高温高压(120℃,0.12 MPa)灭菌冷却至室温,参照Guillard和Hargraves的方法[19]按比例加入无Si的L1培养基(L1-Si),于温度为15℃且光照强度为5 000 lux的恒温恒湿气候室中培养,光暗比为12 h:12 h。取平台期的网状原角藻藻细胞用于贝类投喂实验。
1.3 栉孔扇贝的毒藻投喂
实验用栉孔扇贝,采自青岛太平角养殖场。选择30只健康且大小基本一致((28±1.5)g)的个体,洗净体表污泥,黑暗条件下于塑料培养箱中以3 L砂滤海水:1只扇贝的养殖密度进行暂养驯化10 d,培养温度为15℃。暂养期间进行不间断通气,每24 h更换海水且每12 h投喂螺旋藻粉1次,使其保持良好的生理状态。
实验前12 h停止喂食螺旋藻,准备毒藻投喂。毒藻投喂周期为3 d,期间栉孔扇贝的养殖密度、温度、光暗条件等均与驯化期相同。根据栉孔扇贝清滤率以及网状原角藻的细胞密度,每12 h投喂密度为8.80×106cells·L-1的网状原角藻藻液1次,投喂后水体中有毒藻细胞密度大约为9.78×104cells·L-1。每24 h更换海水,清除培养箱中的残留物,观察栉孔扇贝生理状态。实验过程中,保持培养箱中栉孔扇贝养殖密度以及网状原角藻细胞密度稳定,即每次取出扇贝样品后相应地减少培养箱中海水体积以及毒藻藻液投喂体积。
1.4 藻毒素及扇贝组织中YTXs含量的测定
1.4.1 藻毒素的提取
取平台期的网状原角藻藻液20 mL,低真空条件下25 mm GF/F玻璃纤维膜上过滤。将带有藻细胞的滤膜用4 mL 80%甲醇冰浴中手提式高速分散器破碎,6 500 r·min-1离心10 min,收集上清;重复提取1次,合并2次的上清液,80%甲醇定容至10 mL。氮吹仪吹干粗提液(40℃,N2流),1 mL 80%甲醇重悬,用0.22 μm一次性针头滤器过滤,混匀,备用。
1.4.2 扇贝组织中毒素的提取
毒藻投喂期间,取不同投喂时间(0 h、12 h、24 h、48 h和72 h)的栉孔扇贝各3只,冰上迅速开壳,分别取出完整的鳃和消化腺组织按1 g贝组织:4 mL 80%甲醇的比例,冰浴条件下于玻璃组织研磨器中研磨成组织匀浆,并转移到50 mL离心管中;用涡旋混匀器震荡混匀后,4℃条件下6 000 r·min-1离心15 min,取上清。重复提取1次,合并2次的上清液,并用80%甲醇定容至10 mL,经0.22 μm一次性针头滤器过滤,混匀,备用。
1.4.3 YTXs及其他脂溶性毒素的液相色谱-质谱联用检测
采用液相色谱-串联质谱法进行YTX及其他脂溶性毒素的检测。
液相色谱-质谱系统:Agilent1200液相系统(包括G1311A四元泵、G1313A自动进样器,G1316A柱温箱);API4000三重四极杆质谱检测器,离子源为ESI电喷雾离子源;液相色谱柱为Phenomenex RP C18柱(150 mm×3.0 mm,5 μm)。液相色谱条件:流动相A为水(含0.1%甲酸,5 mmol·L-1甲酸铵),流动相B为95%乙腈水溶液(含0.1%甲酸,5 mmol·L-1甲酸铵);流速为0.3 mL·min-1,进样体积10 μL,柱温30℃,梯度洗脱程序如表1所示。质谱检测条件:采用ESI±切换多参数扫描方式(MRM),各项参数见表2和表3。

表1 液相色谱梯度洗脱程序Table 1 HPLC gradient elution procedures
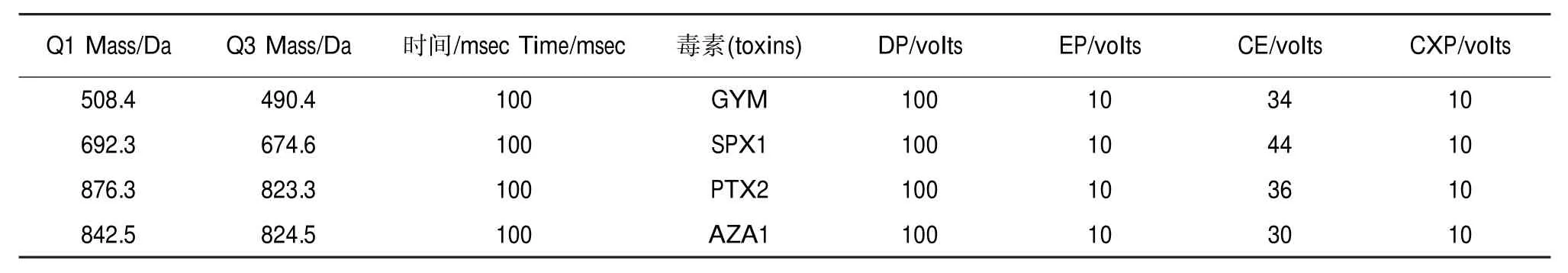
表2 MRM参数(正离子模式)Table 2 The parameters of MRM(positive ion mode)

表3 MRM参数(负离子模式)Table 3 The parameters of MRM(negative ion mode)
1.5 P糖蛋白的活性测定
在毒藻投喂期间,取不同投喂时间(0 h、12 h、24 h、48 h和72 h)的栉孔扇贝各3只,冰上迅速开壳,分别取出鳃和消化腺组织,并快速于分析天平上分别称取约100 mg的2个平行样,用于P-gp活性的测定,剩余组织用于后期石蜡组织切片的制备。
P-gp活性的测定参照Ivanina等[20]的方法,采用RhoB作为P-gp底物。RhoB在鳃和消化腺等组织中短暂积累后,通过测定RhoB排出速率来考察不同组织P-gp活性,用单位pmol RhoB·min-1·g-1来表示。在RhoB外排过程中,采用66.7 μmol·L-1VRP作为抑制剂,观察其对RhoB排出速率的影响。
1.6 P糖蛋白在扇贝组织中的免疫定位
1.6.1 石蜡组织切片的制备
将1.4中解剖的部分鳃和消化腺组织,于Davidson’s AFA固定液中固定,按照常规石蜡组织切片制备方法制作石蜡切片,室温存放。
1.6.2 P糖蛋白免疫定位染色
取组织切片,于二甲苯中脱蜡后经系列浓度梯度的乙醇溶液复水,再以pH 7.2的0.01 mol·L-1PBS溶液洗净。为减少蛋白的非特异性结合,室温条件下以PBS 1∶10稀释的正常山羊血清封闭液孵育30 min,封闭切片。以PBS稀释过的鼠抗P-gp (C219)(Calbiochem,Merck Millipore,Germany)作为一抗孵育切片,4℃过夜后于PBS中浸洗3次,每次5 min。以生物素化山羊抗鼠IgG(博士德,武汉)作为二抗,按照试剂盒说明书要求进行稀释,室温条件下孵育30 min。二抗孵育结束后,用PBS浸洗切片3次,每次5 min。滴加PBS稀释的链霉亲和素-生物素化DyLight 488荧光染料(DyLight 488-SABC)室温孵育30 min后,用PBS冲洗切片5 min停止着色反应。之后,将切片置于PBS中浸洗4次,每次5 min。经过处理的组织切片,使用水溶性封片剂进行封片,并在荧光显微镜下观察组织显色情况,拍照记录。
1.6.3苏木精伊红染色
苏木精-伊红(hematoxylin-eosin,HE)染色过程中,采用传统方法将组织切片脱蜡复水后进行HE染色。苏木精染液染色15 min后,以缓流水冲洗5 min;5%的冰醋酸分化18 s,再通过温水(45℃)冲洗2 min反蓝;伊红染液染色1 min后,以ddH2O冲洗2 min,观察染色结果,并拍照记录。
1.7 数据统计与处理
采用软件SPSS17.0进行单因素方差分析,α= 0.05,数据以M±S.D.表示。
2 结果(Results)
2.1 栉孔扇贝组织中YTX浓度变化
LC-MS/MS检测发现,网状原角藻(北黄海株)主要产YTX(97%)以及极少量的Homo-YTX等毒素,所以本研究在对栉孔扇贝进行毒藻投喂过程中,主要检测扇贝体内YTX浓度的变化及YTX对P-gp的诱导情况。
图1反映了不同染毒时间段栉孔扇贝鳃和消化腺组织中YTX含量的变化情况。从图中可以看出,72 h内,随着染毒时间的增加,栉孔扇贝鳃和消化腺组织中YTX含量均呈逐渐增加的趋势。
投喂毒藻前,栉孔扇贝鳃和消化腺组织中YTX的本底浓度分别为0.26 μg·kg-1组织和0.24 μg·kg-1组织。染毒12 h后,栉孔扇贝鳃和消化腺中YTX浓度分别升高至52.31 μg·kg-1组织和9.68 μg·kg-1组织,为本底浓度的200倍和40倍;染毒72 h后,分别升高至275.20 μg·kg-1组织和134.50 μg·kg-1组织。
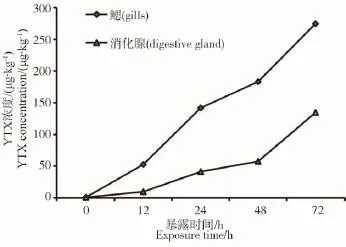
图1 栉孔扇贝腮组织和消化腺中YTX毒素浓度随暴露时间的变化
2.2 YTX对栉孔扇贝组织的毒性作用
HE染色发现,栉孔扇贝在YTX染毒12 h后,鳃丝前侧纤毛柱状细胞区域出现了黑化现象(melanization),与未染毒情况下的鳃组织对比明显(图2);染毒12 h的消化腺组织出现一定程度的损伤,导管中上皮柱状细胞部分脱落入管腔中,腺管内细胞界限模糊,部分腺管崩解,组织中留下腺管解体后的空隙(图3b)。

图2 YTX对栉孔扇贝鳃组织毒性作用(H.E.,200×)
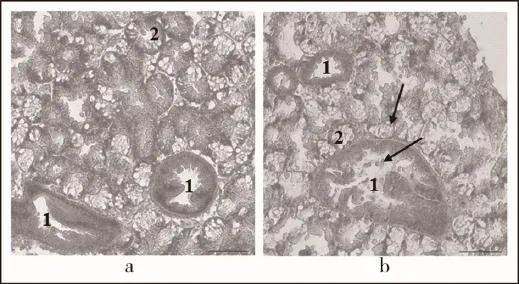
图3 YTX对栉孔扇贝消化腺组织毒性作用(H.E.,200×)
2.3 栉孔扇贝组织中P糖蛋白活性的变化
毒藻投喂前,栉孔扇贝鳃和消化腺组织对RhoB的排出速率分别为282.52 pmol RhoB·min-1·g-1和29.71 pmol RhoB·min-1·g-1;毒藻投喂12 h后,鳃中的RhoB排出速率达到毒藻投喂前的3.8倍,具有显著差异,消化腺的RhoB排出速率也明显升高但与0 h相比差异不显著(图4)。随着毒藻暴露时间的延长,12 h至48 h之间鳃组织中RhoB的排出速率略有升高,但与12 h差异不大,72 h后排出速率略有下降;消化腺组织中的结果恰恰相反,12 h后消化腺组织中RhoB排出速率随着毒素暴露时间的延长持续下降,72 h后与毒素暴露前水平相当。
当向体外海水-RhoB-扇贝组织系统中加入终浓度为66.7 μmol·L-1的P-gp功能抑制剂-VRP后,鳃和消化腺对RhoB的排出速率均明显增大。以毒素暴露12 h为例,在加入VRP后15 min内,鳃对RhoB的排出速率由不加VRP(-VRP)的1 065.47 pmol RhoB·min-1·g-1增大为1 664.08 pmol RhoB· min-1·g-1,增加幅度达1.7倍,统计学分析两者之间差异显著;消化腺对RhoB的排出速率也由43.94 pmol RhoB·min-1·g-1升高为80.63 pmol RhoB·min-1·g-1,增加幅度达1.8倍,差异显著(图5)。随着时间的延长,+VRP处理组和-VRP组的RhoB排除速率均呈下降趋势。如图6所示,栉孔扇贝鳃组织对RhoB的排除速率在1 h内降低了50%以上。

图4 YTX毒素暴露时长对栉孔扇贝鳃和消化腺组织中RhoB排出速率的影响

图5 维拉帕米(VRP)对栉孔扇贝鳃和消化腺组织RhoB排出速率的影响

图6 YTX暴露12 h的离体栉孔扇贝鳃组织排出RhoB的速率随时间的变化
2.4 P糖蛋白在栉孔扇贝中的定位
毒藻投喂前,栉孔扇贝鳃丝的前端可见轻微荧光显色(图7 a),染毒24 h后鳃丝前端的纤毛柱状细胞区域荧光强度增强(图7 b)。消化腺组织中,毒藻投喂前导管的上皮纤毛柱状细胞已有明显的荧光显色,腺管中无荧光显色(图8 a);染毒24 h后,导管上皮纤毛柱状细胞的荧光亮度略大于毒藻投喂前(图8 b),且腺管消化细胞内出现荧光显色,但亮度低于导管纤毛柱状细胞(图8 b)。可见,YTX毒素暴露可使栉孔扇贝鳃和消化腺中P-gp表达量增加,鳃组织中P-gp主要分布在鳃丝前端纤毛柱状细胞内,消化腺则以大的导管和腺管中分布较多。

图7 栉孔扇贝鳃组织P-gp免疫定位情况(100×)

图8 栉孔扇贝消化腺组织中P-gp免疫定位情况(100×)
3 讨论(Discussion)
3.1 YTX对栉孔扇贝组织的毒性效应
毒素累积过程中,栉孔扇贝鳃和消化腺组织中YTX浓度随着时间的延长均呈逐渐增加的趋势(图1)。在毒素累积72 h后,鳃组织中YTX浓度最高,为本底浓度的1 058倍。但在毒藻投喂期间,栉孔扇贝生长状况良好,无一例死亡。可以看出,栉孔扇贝为累积YTX速度较快的物种,且其对YTX的适应能力较强。
尽管YTX的大量累积并未引起栉孔扇贝个体死亡,但是毒素的累积对其产生了一定的毒性效应。在毒藻暴露12 h后,栉孔扇贝前侧纤毛柱状细胞区带就出现了明显的黑化现象(图2b)。该部位由前侧纤毛柱状细胞组成,其胞体内分布有大量线粒体,胞体顶端布满密集的纤毛,相邻鳃丝前侧纤毛相互交错在一起,其摆动能使水流从鳃丝外侧流向内侧[21],即该部位是滤食性的扇贝与水环境或有毒物质密切接触的区域。鳃的黑化现象在扇贝(Argopecten ventricosus)[22]和小狮爪海扇蛤(Nodipecten subnodosus)[23-24]的鳃丝前侧纤毛区域均已得到证实,被认为是毒素造成的毒理学变化。
栉孔扇贝消化腺为复管状腺,由许多具分枝的腺管组成,众多腺管汇集于导管,再经导管开口于胃部。腺管内消化细胞具有胞内消化食物的功能,导管的黏膜上皮含有纤毛柱状细胞,具有运送食物的功能[25]。
同样,暴露于YTX中一段时间后,栉孔扇贝消化腺组织也受到一定程度的损伤,其导管上皮细胞有脱落现象,腺管细胞界限变得不明显且部分腺管出现崩解(图3b,图8b)。消化腺组织的上述变化,也出现在贝类其他有毒化合物的暴露实验中。权赫梅等[26]关于Cd2+对紫贻贝影响的研究表明,消化腺在Cd2+作用下出现导管中吞噬细胞增多、上皮细胞膜系统损伤严重的现象。苗晶晶等[27]用B[α]P处理栉孔扇贝时发现,随时间的延长,其消化腺腺管内细胞界限模糊,细胞膜和亚细胞结构损伤加重导致细胞解体,并加速了腺管的崩解,最终使得导管内吞噬细胞大量聚集。此外,Buratti等[28]研究地中海贻贝体内藻毒素累积和生理参数变化时也发现,YTX与贻贝血细胞体积变小、形状改变以及破碎有关。本实验研究表明,YTX对栉孔扇贝消化腺组织的毒性效应与前人报道的重金属和有机污染物对贝类消化腺组织的毒性效应类似,也与扇贝组织解毒代谢过程相符合。
3.2 栉孔扇贝P糖蛋白介导的MXR转运活性与YTX暴露的关系
在P-gp转运活性测定试验中,染毒12 h后扇贝鳃和消化腺组织的RhoB排出速率与毒素投喂前相比均呈升高趋势,这表明,栉孔扇贝在摄食网状原角藻后,鳃和消化腺细胞由胞质向细胞膜外方向的转运活性增强。
鳃不仅是栉孔扇贝呼吸器官,更是重要的滤食器官,是直接与毒藻及溶解在水体中的毒素接触的器官,是贝体抵御外源毒性化合物的重要生理屏障。大量的研究指出,双壳贝类鳃组织细胞具有MXR转运活性,抗原抗体反应也证实了转运蛋白在鳃组织中表达[2,4,29-31]。但是栉孔扇贝的鳃丝对藻细胞主要起到过滤和分选作用,并不能对其进行消化吸收。鳃中检测到的高含量的YTX主要来自于过滤浓缩的藻,能够作用于鳃组织的则是溶解在水体中的YTX,所以较低浓度的YTX即能够明显提高鳃组织MXR的转运活性。栉孔扇贝的消化腺是毒藻消化和吸收主要场所,藻细胞中的YTX主要在此累积。在毒藻暴露的早期,YTX累积量较低,消化腺细胞的MXR转运活性明显升高;随着暴露时间的延长,YTX累积增多,MXR转运活性开始下降,到毒藻暴露结束时消化腺细胞的转运活性基本与未经毒藻暴露时相当。推测高浓度的YTX可能对消化腺的MXR活性有抑制作用。Iordanov等[32]通过研究与药物接触后核糖体的翻译活性首次证实了YTX为核糖核酸的毒性物质,且对28s rRNA的特殊位点有破坏作用,受到刺激时细胞会对其产生应激反应。Korsenes等[33]也报道了YTX对暴露其中的大鼠成肌细胞L6和小鼠脑瘤细胞BC3H1,具有降解rRNA从而抑制蛋白质的翻译合成、促进细胞凋亡的毒理作用,且该现象具有时间依赖性和组织特异性。结合本研究,推测可能消化腺中累积的高含量的YTX毒素,使得参与MXR转运的转运蛋白的合成受到抑制,导致RhoB的排出速率下降。
另外,水生生物体中与异源物质转运相关的蛋白除了P-糖蛋白外,多药抗药相关蛋白1-5(multidrug resistance associated proteins 1-5,MRP1-5)和乳腺癌抗性蛋白(breastcancer resistance protein,BCRP)也都与MXR相关,这些蛋白都是ABC转运蛋白(ATP binding cassette transporter)超家族中的成员,均具有转运环境或生物体内有毒物质的功能[34]。Luedeking等[5]曾报道,将紫贻贝暴露于2-AAF中,其鳃和消化腺组织内的MRPs含量均有显著增加。Kingtong等[35]以三丁基锡(tributyltin,TBT)作用于印第安岩石牡蛎(Saccostrea forskali)时,其鳃、外套膜和消化腺中均能观察到MRPs表达量增加。
根据本研究中YTX毒素能够明显提高栉孔扇贝MXR转运活性,加之RhoB不仅是P-gp的底物,也是MRPs等蛋白的底物,所以扇贝MXR转运活性增强可能不仅仅是P-gp的贡献,MRPs等转运蛋白可能也有贡献。这一点笔者通过后期荧光定量PCR的研究也初步得到了验证,YTX毒素暴露后,栉孔扇贝组织中转运相关蛋白MRPs的mRNA表达量上调(结果未显示)。关于其他相关转运蛋白活性及表达与YTX毒素暴露的关系还需要更深入的研究。
3.3 P糖蛋白在栉孔扇贝组织中的定位
P-gp的免疫组化定位显示,暴露于YTX环境中24 h后,鳃丝表面顶端细胞(包括前纤毛柱状细胞区和前侧纤毛柱状细胞区)及消化腺导管上皮细胞和腺管消化细胞与对照相比荧光强度明显增强,表明P-gp主要在上述区域存在,这与目前国际上许多研究相一致。Kingtong[35]曾以C219作为一抗对印第安岩石牡蛎的鳃和消化腺组织进行P-gp免疫定位研究,发现位于鳃丝表面的纤毛细胞具有极明显的免疫着色,消化腺组织的消化管腔上皮细胞也有明显着色。Luckenbach和Epel[36]关于污染水域加州贻贝鳃组织的P-gp定位研究也表明,贻贝鳃组织中污染物诱导的P-gp的荧光显色集中于鳃丝直接接触水流的前部细胞顶端。Whalen等[37]关于海参(Tritonia hamnerorum)中P-gp的定位显示,其中肠上皮纤毛柱状细胞的免疫着色明显,表明P-gp定位于海参中肠上皮纤毛柱状细胞。
本研究表明,YTX能够诱导栉孔扇贝P-gp表达量增加,鳃组织中的P-gp主要存在于鳃丝表面长期直接暴露于环境中的前端纤毛柱状细胞区域,消化腺组织中P-gp则存在于与食物接触的导管上皮纤毛柱状细胞和腺管消化细胞中,且腺管内P-gp的分布低于导管上皮细胞。此外,消化腺组织染毒24 h后荧光强度的变化明显低于鳃组织,与P-gp活性测定试验结果以及本研究后续的P-gp荧光定量PCR的结果一致(结果未显示)。
另外,未染毒时,扇贝鳃丝前纤毛柱状细胞区域和消化腺导管上皮纤毛柱状细胞中已有微弱的荧光显色(图7a和图8a),表明无YTX时扇贝组织中已含有少量的P-gp的表达。该结果与图4中0 h鳃和消化腺组织已具有一定的RhoB排出速率相一致。这可能是由于该批栉孔扇贝在养殖海域已接触过诱导P-gp表达的有毒有害物质。
3.4 维拉帕米与栉孔扇贝P糖蛋白的转运活性
钙离子通道阻滞剂VRP,是P-gp的竞争性抑制剂,它能与P-gp竞争性结合,抑制与P-gp偶联的ATPase活性,从而抑制其转运活性。Ivanina等[20]关于不同浓度(0~1 000 μmol·L-1)VRP对牡蛎(Crassostrea virginica)鳃组织P-gp转运RhoB活性的抑制作用的研究表明,66.7 μmol·L-1的VRP是对P-gp活性具有最大抑制作用的最低有效浓度。本文RhoB外排实验中,与-VRP组相比,经66.7 μmol· L-1VRP处理的栉孔扇贝鳃和消化腺组织,其RhoB排出速率没有下降,反而升高,该结果与以往某些研究中VRP能抑制P-gp转运活性的结果矛盾[11,20]。
以同一海域的紫贻贝作为研究对象,对其进行PSP毒素快速累积实验。结果表明,暴露于PSP中的贻贝,其鳃组织中MXR活性明显提高;相同浓度的VRP处理后贻贝鳃组织排出RhoB的速率明显下降,即VRP能够通过抑制P-gp的活性从而降低贻贝鳃组织MXR活性。

图9 维拉帕米(VRP)对紫贻贝鳃组织RhoB排出速率的影响
另外,某些研究显示,当MgATP浓度一定时,低浓度VRP具有激活与P-gp偶联的ATPase活性的作用,使得P-gp供能充足,转运活性增强;高浓度VRP则有抑制ATPase活性的能力,使得P-gp转运活性降低[38-40]。对于不同物种,VRP对其ATPase的激活或抑制作用的阈值有所不同。AI-Shawi等[39]分别对人和中国仓鼠的10 mmol·L-1MgATP均以130 μmol·L-1VRP处理,发现VRP能激活人类P-gp-ATPase活性,而抑制仓鼠P-gp-ATPase活性。本实验中相同浓度的VRP对栉孔扇贝和紫贻贝的作用不同,可能是种属差异所引起的,不同浓度VRP对栉孔扇贝的P-gp活性的调节作用也还有待进一步研究。
致谢:感谢国家海洋环境监测中心梁玉波研究员提供的网状原角藻藻株;感谢中国科学院海洋研究所李莉老师提供的栉孔扇贝。
(References):
[1] Kurelec B.Inhibition of multixenobiotic resistance mechanism in aquatic organisms:Ecotoxic consequences[J]. Science of the Total Environment,1995,171(1):197-204
[2] Kurelec B.The multixenobiotic resistance mechanism in aquatic organisms[J].Critical Reviews in Toxicology, 1992,22(1):23-43
[3] Kurelec B,Pivcevic B.Evidence for a multixenobiotic resistance mechanism in the musselMytilus galloprovincialis[J].Aquatic Toxicology,1991,19(4):291-302
[4] Cornwall R,Toomey B H,Bard S,et al.Characterization of multixenobiotic/multidrug transport in the gills of the musselMytilus californianusand identification of environmental substrates[J].Aquatic Toxicology,1995,31(4): 277-296
[5] Luedeking A,Van Noorden C J F,Koehler A.Identification and characterization of a multidrug resistance-related protein mRNA in the blue musselMytilus edulis[J].Marine Ecology Progress Series,2005,286(1):167-175
[6] 苗晶晶.苯并芘对栉孔扇贝分子毒理学机制的研究[D].青岛:中国海洋大学,2010
Miao J J.Molecular mechanism behind the toxic effects of benzo(a)pyrene on scallopChlamys farreri[D].Qingdao: The Ocean University of China,2010(in Chinese)
[7] Xiu M,Pan L,Jin Q,et al.Gender differences in detoxification metabolism of polycyclic aromatic hydrocarbon (chrysene)in scallopChlamys farreriduring the reproduction period[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2015,170:50-59
[8] Waldmann P,Pivcevic B,Müller W E G,et al.Increased genotoxicity of acetylaminofluorene by modulators of multixenobiotic resistance mechanism:Studies with the fresh water clamCorbicula fluminea[J].Mutation Research/Genetic Toxicology,1995,342(3):113-123
[9] 李志茹.P-糖蛋白在毛蚶镉代谢中的作用研究[D].青岛:中国海洋大学,2011
Li Z R.Study on the role of P-glycoprotein in the metabolism on cadmium inMeretrix meretrix[J].Qingdao:The Ocean University of China,2011(in Chinese)
[10] Eufemia N,Girshick S,Epel D.Algal products as naturally occurring modulators for the multidrug resistance (MDR)transporter[J].Marine Environmental Research, 2000,50(1):332-333
[11] 刘望鹏.近江牡蛎P-g-p基因的克隆及其在抗腹泻性贝毒中作用的初步研究[D].广州:暨南大学,2010
Liu W P.Cloning of P-glycoprotein gene and its role in DSP toxin resistance inCrassostrea ariakensis[D].Guangzhou:Jinan University,2010(in Chinese)
[12] Svensson S,Särngren A,Förlin L.Mussel blood cells,resistant to the cytotoxic effects of okadaic acid,do not express cell membrane p-glycoprotein activity(multixenobiotic resistance)[J].Aquatic Toxicology,2003,65(1):27-37
[13] 刘仁沿,梁玉波,刘磊,等.液相色谱结合串联质谱方法研究中国沿海贝类中脂溶性藻毒素的种类结构和分布规律[J].生态环境学报,2014,23(8):1320-1326
Liu R Y,Liang Y B,Liu L,et al.The lipophilic phycotoxins profile and distribution in bivalve shellfish of Chinese coasts by high performance liquid chromatography coupled with mass spectrometry[J].Ecology and Environmental Science,2014,23(8):1320-1326(in Chinese)
[14] Paz B,Blanco J,Franco J M.Yessotoxins production during the culture ofProtoceratium reticulatumstrains isolated from Galician Rias Baixas(NW Spain)[J].Harmful Algae,2013,21-22:13-19
[15] Paz B,Riobo P,Fernandez M L,et al.Production and release of yessotoxins by the dinoflagellatesProtoceratium reticulatumandLingulodinium polyedrumin culture[J]. Toxicon,2004,44:251-258
[16] Rhodes L,McNabb P,de Salas M,et al.Yessotoxin production byGonyaulax spinifera[J].Harmful Algae,2006, 5(2):148-155
[17] 高春蕾,刘仁沿,梁玉波,等.虾夷扇贝毒素yessotoxin (YTXs),中国沿海贝类中首次发现的一组贝类生物毒素[J].海洋学报,2010,32(3):129-137
Gao C L,Liu R Y,Liang Y B,et al.First report of the presence of yessotoxins(YTXs)in shellfish from China’s coastal areas[J].Acta Oceanologica Sinica,2010,32(3): 129-137(in Chinese)
[18] 陈建华,于仁成,孔凡洲,等.北黄海海域虾夷扇贝体内脂溶性藻毒素分析[J].海洋与湖沼,2014,45(4):855-863
Chen J H,Yu R C,Kong F Z,et al.Detection of lipophil-ic phycotoxin inPatinopecten yessoensisin the northern yellow sea[J].Oceanologia et Limnologia Sinica,2014, 45(4):855-863(in Chinese)
[19] Guillard R R L,Hargraves P E.Stichochrysis immobilis is a diatom,not a chrysophyte[J].Phycologia,1993,32(3): 234-236
[20] Ivanina A V,Sokolova I M.Effects of cadmium exposure on expression and activity of P-glycoprotein in eastern oysters,Crassostrea virginicaGmelin[J].Aquatic Toxicology,2008,88(1):19-28
[21] 崔龙波,陆瑶华,刘传林,等.栉孔扇贝(Chlamys farreri)鳃的形态学研究[J].烟台大学学报:自然科学与工程版,1998,11(4):279-284
Cui L B,Lu Y H,Liu C L,et al.Morpological study on the gill ofChlamys farreri[J].Journal of Yantai University:Natural Science and Engineering Edition,1998,11(4): 279-284(in Chinese)
[22] Escobedo-Lozano A Y,Estrada N,Ascencio F,et al.Accumulation,biotransformation,histopathology and paralysisin the pacific calico scallopArgopecten ventricosusby the paralyzing toxins of the DinoflagellateGymnodinium catenatum[J].Marine Drugs,2012,10(5):1044-1065
[23] Estrada N,de Jesús Romero M,Campa-Córdova A,et al. Effects of the toxic dinoflagellate,Gymnodinium catenatumon hydrolyticand antioxidant enzymes,in tissues of the giant lions-paw scallopNodipecten subnodosus[J]. Comparative Biochemistry and Physiology Part C:Toxicology and Pharmacology,2007,146(4):502-510
[24] Estrada N,Carmen R J,Felipe A,et al.Biología y cultivo de los moluscos pectínidos del género nodipecten:1st, Chapter:4[M].México:Limusa,2011:59-98
[25] 崔龙波,周雪莹,陆瑶华,等.栉孔扇贝消化系统的组织学研究[J].烟台大学学报:自然科学与工程版,2001, 14(3):185-200
Cui L B,Zhou X Y,Lu Y H,et al.Histological study on digestive system of the scallopChlamys farreri[J].Journal of Yantai University:Natural Science and Engineering,2001,14(3):185-200(in Chinese)
[26] 权赫梅.镉暴露条件下紫贻贝成体消化盲囊结构的研究[J].解剖科学进展,2004,9(2):125-127
Quan H M.Structure research of adultMytilus edulis’digest blind sac exposed to cadmium[J].Progress of Anatomical Sciences,2004,9(2):125-127(in Chinese)
[27] 苗晶晶,潘鲁青,王静.B[α]P对栉孔扇贝组织显微和超微结构的影响[J].环境科学学报,2007,27(9):1497-1503
Miao J J,Pan L Q,Wang J.Effects of B[α]P on micro and ultrastructure of gill and digestive gland ofChlamys farreri[J].Acta Scientiae Circumstantiae,2007,27(9): 1497-1503(in Chinese)
[28] Buratti S,Franzellitti S,Poletti R,et al.Bioaccumulation of algal toxins and changes in physiological parameters in Mediterranean mussels from the North Adriatic Sea(Italy) [J].Environmental Toxicology,2013,28(8):451-470
[29] Galgani F,Cornwall R,Toomey B H,et al.Interaction of environmental xenobiotics with a multixenobiotic defense mechanism in the bay musselMytilus galloprovincialis from the coast of California[J].Environmental Toxicology Chemistry,1996,15(3):325-331
[30] Kurelec B.Reversion of the multixenobiotic resistance mechanism in gills of a marine musselMytilus galloprovincialisby a model inhibitor and environmental modulators of p170-glycoprotein[J].Aquatic Toxicology,1995, 33(2):93-103
[31] Mayer U,Wagenaar E,Dorobek B,et al.Full blockade of intestinal P-glycoproteinandextensiveinhibitionof blood-brain barrier P-glycoprotein by oral treatment of mice with PSC833[J].Journal of Clinical Investigation, 1997,100(10):2430-2436
[32] Iordanov M S,Pribnow D,Magun J L,et al.Ribotoxic stress response:Activation of the stress-activated protein kinase JNK1 by inhibitors of the peptidyl transferase reaction and by sequence-specific RNA damage to the alphasarcin/ricin loop in the 28S rRNA[J].Molecular and Cellular Biology,1997,17(6):3373-3381
[33] Korsnes M S,Røed S S,Tranulis M A,et al.Yessotoxin triggers ribotoxic stress[J].Toxicology in Vitro,2014,28 (5):975-981
[34] Haimeur A,Conseil G,Deeley R G,et al.The MRP-related and BCRP/ABCG2 multidrug resistance proteins:Biology,substrate specificity and regulation[J].Current Drug Metabolism,2004,5(1):21-53
[35] Kingtong S,Chitramvong Y,Janvilisri T.ATP-binding cassette multidrug transporters in Indian-rock oysterSaccostrea forskaliand their role in the export of an environmental organic pollutant tributyltin[J].Aquatic Toxicology,2007,85(2):124-132
[36] Luckenbach T,Epel D.ABCB-and ABCC-type transporters confer multixenobiotic resistance and form an environment-tissue barrier in bivalve gills[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2008,294(6):R1919-R1929
[37] Whalen K E,Sotka E E,Goldstone J V,et al.The role of multixenobiotic transporters in predatory marine molluscs as counter-defense mechanisms against dietary allelochemicals[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2010,152(3):288-300
[38] Stephane O,Lluis M M,Jean B J,et al.Effects of steroids and verapamil on P-glycoprotein ATPase activity:Progesterone,desoxycorticosterone,corticosterone and verapamil aremutually non-exclusive modulators[J].Biochemical Journal,1996,317:515-522
[39] Al-Shawi M K,Polar M K,Omote H,et al.Transition state analysis of the coupling of drug transport to ATP hydrolysis by p-glycoprotein[J].The Journal of Biological Chemistry,2003,278(52):52629-52640
[40] Omote H,Al-Shawi M K.A novel electron paramagnetic resonance approach to determine the mechanism of drug transport by P-glycoprotein[J].Journal of Biological Chemistry,2002,277(47):45688-45694◆
Transport Activity and Distribution of P-glycoprotein Induced by Yessotoxin in Scallop Chlamys farreri
Zhao Cuiqiong1,2,3,Gao Chunlei1,2,*,Jiang Meijie1,2,Jia Zhihui1,2,Wang Zongxing1,2,Wang Zongling1,2,#
1.The First Institute of Oceanography,State Oceanic Administration,Qingdao 266061,China
2.Laboratory of Marine Ecology and Environmental Science,Qingdao;National Laboratory for Marine Science and Technology,Qingdao 266061,China
3.East China Sea Forecast Center,State Oceanic Administration,Shanghai 200081,China
11 December 2015 accepted 26 January 2016
Many studies have shown that multi-xenobiotic resistance(MXR)mediated by P-glycoprotein(P-gp)in shellfish played an important role in resisting or tolerating xenobiotics in polluted water.However,few research has been conducted whether this mechanism also works on the resistance or tolerance of dietary toxins(eg.yessotoxin, YTX)in shellfish.In this study,Chlamys farreriwas exposed to the YTX toxin-producing strain ofProtoceratium reticulatum.YTX concentrations,P-gp transport activity and P-gp expression were measured and analyzed to study the changes over exposure time in gills and digestive gland ofC.farreri.Consequently,it was discussed about the possible role of P-gp in YTX toxin tolerance in shellfish.The results showed that YTX contents in gills and digestive gland increased continuously with exposure time.Evident toxic effects were observed in the scallop tissues despite no death resulted.After 12 h exposure,H.E.dye assay showed the melanization in the laterofrontal cillia of gill filament,exfoliation of epithelial cells in digestive gland and degradation of digestive ducts.Rhodamine-B (RhoB)excretion experiments confirmed that YTX toxin,with a short exposure period,could significantly enhance the transport activity of P-gp in the scallop.After 12 h exposure,the efflux rates of RhoB in gills and digestive gland were 3.8 and 1.4 times of those in unexposed ones;while later,the P-gp activity had limited increase,and began to decrease after 72 h-exposure.Contrary to the previous research,the inhibitor of P-gp-verapamil(VRP),in the given concentration,didn’t inhibit but enhance the efflux of RhoB.Immunohistochemical analysis revealed increased P-gp expression in the laterofrontal ciliated columnar cells of gills,in the ductal epithelial columnar cells and digestive cells of digestive gland after YTX toxin exposure.Above all,this study suggested that YTX,possibly the substrate of P-gp,can induce the transport activity and expression of P-gp inC.farreri,and P-gp played an important role in the YTX toxin tolerance.In addition,further studies were needed considering the discrepant results of VRP inhibiting the P-gp activity,which was probably due to the different testing organisms used in this study.
yessotoxin;Chlamys farreri;Protoceratium reticulatum;gill;digestive gland;P-glycoprotein;rhodamine B;verapamil
2015-12-11 录用日期:2016-01-26
1673-5897(2016)3-281-13
X171.5
A
10.7524/AJE.1673-5897.20151211001
简介:高春蕾(1974-),女,海洋生物学专业,博士,副研究员,主要研究方向为海洋环境生物学。
王宗灵(1966-),男,海洋生态学专业,博士,研究员,主要从事海洋浮游生物多样性与生态系统功能、赤潮生物学与生态学、生态系统动力学、生物竞争理论等方面的研究工作。
国家自然科学基金(No.41206161);海洋公益性行业科研专项经费项目(No.2013418010);海洋局一所基本科研业务专项资金项目(No.GY0213G28,No.2012T08)
赵翠琼(1991-),女,硕士研究生,研究方向为海洋生物学,E-mail:cqzhao@fio.org.cn;
*通讯作者(Corresponding author),E-mail:gaochunlei@fio.org.cn
#共同通讯作者(Co-corresponding author),E-mail:wangzl@fio.org.cn

