水环境中藻毒素生态风险的物种敏感性分布评价
朱小奕,陈瑾,张建英,*
1.浙江大学环境科学研究所,杭州310058
2.浙江省有机污染过程与控制重点实验室,杭州310058
水环境中藻毒素生态风险的物种敏感性分布评价
朱小奕1,2,陈瑾1,2,张建英1,2,*
1.浙江大学环境科学研究所,杭州310058
2.浙江省有机污染过程与控制重点实验室,杭州310058
藻毒素对人体的健康风险已受普遍关注,然而其对水生态物种敏感性分布的影响尚不明朗。本研究采集已有实验数据,利用种间相关性分析(ICE)模型和物种敏感性分布评估(SSDs)方法,筛选了64个水生生物物种的71组急性毒性数据(EC50),构建水生生物对肝毒素(节球藻毒素、柱孢藻毒素)和神经毒素(类毒素、贝毒素)的SSD方程。在此基础上,计算不同暴露浓度下的潜在影响比例(PAF)以及保护95%物种基础上藻毒素对水生生物的生态风险阈值(HC5),比较不同类别生物对藻毒素的敏感性以及藻毒素对水生生物的生态风险。结果表明:(1)在95%物种保护保证率下,节球藻毒素、柱孢藻毒素、类毒素和贝毒素对全部物种的HC5值分别为74.96、205.39、194.39、0.3 μg·L-1,贝毒素水生态风险最高,柱孢藻毒素最低。(2)柱孢藻毒素、类毒素对无脊椎动物的HC5值分别为122.93、95.19 μg·L-1,低于全部物种的HC5值,无脊椎动物受柱孢藻毒素、类毒素影响较其他物种大。(3)物种潜在影响比例可明确表征敏感性,柱孢藻毒素、类毒素在各浓度暴露情景下对无脊椎动物的PAF值均高于脊椎动物,显示无脊椎动物的敏感性较高。
藻毒素;水生生物;物种敏感性分布;生态阈值
朱小奕,陈瑾,张建英.水环境中藻毒素生态风险的物种敏感性分布评价[J].生态毒理学报,2016,11(3):131-139
Zhu X Y,Chen J,Zhang J Y.Assessing ecological risk of cyanotoxins based on interspecies correlation estimation and species sensitivity distributions[J]. Asian Journal of Ecotoxicology,2016,11(3):131-139(in Chinese)
湖泊藻华爆发遍布全球,其中25%~70%的藻华会产生有毒的二次代谢产物藻毒素。根据毒素对动物的致毒方式,可分为肝毒素和神经毒素等,肝毒素包括微囊藻毒素(microcystins,MCs)、节球藻毒素(nodularins, NODs)和柱孢藻毒素(cylindrospermopsin,CYN),神经毒素包括类毒素(anatoxin-a,antx-a)、贝毒素(saxitoxins, STXs)等[1-2]。1990年至2014年间,中国已有60%的淡水湖泊出现不同程度的富营养化现象,引发严重藻华污染,释放藻毒素以微囊藻毒素为主,浓度可达35.3 μg ·L-1[3],近年柱孢藻毒素、类毒素和贝毒素等污染也日趋严重,如柱孢藻毒素浓度达8.25 μg·L-1[4]。藻毒素不但会引起肝、神经毒性等健康风险,还可导致鱼类的死亡、浮游动物与水生植物生长和繁殖抑制等物种危害[5-6],从而造成水生态物种多样性破坏风险[7-8]。然而,多种藻毒素在生态系统尺度上的风险尚不清楚,其生态风险阈值亟待确定。
物种敏感性分布评估方法(species sensitivity distributions,SSDs)是基于不同物种对某一环境胁迫的敏感度服从一定累积概率分布假设,以统计分布模型来描述不同物种样本对胁迫因素的敏感性差异,实现将单一物种的测试结果外推至生态系统的风险评估方法[9]。该方法被广泛应用于生态风险评价[10-11]和水质基准推导[12-13],目前国内学者也尝试运用SSD方法对农药[14-15]、重金属[16]、多环芳烃[17]、微囊藻毒素[18]等进行生态风险评估。SSD拟合物种数要求不少于5个[19-20],为弥补不同物种,特别是稀缺物种毒性数据缺失对SSD方法结果不确定性的影响,美国EPA提出种间相关性分析(interspecies correlation estimations, ICE)模型。在ICE模型中,假定替代物种和预测物种的毒性值符合最小二乘法线性回归,因此可通过替代物种毒性数据,外推预测物种的毒性效应[21]。ICE模型弥补了SSD评估中毒性数据的断层,已被用于水生无脊椎动物和鱼类的毒性外推研究,如ICE得出硝基芳烃对不同生物毒性数据与其实验数据拟合结果在1%的置信水平上呈显著的线性正相关[22-23];对锌水质基准研究显示基于ICE和实验数据得出的SSD估算HC5值无显著差异[24],表明应用ICE方法预测缺失毒性数据用于水生态风险评估是可行的。
目前,对微囊藻毒素的生态风险研究已从生物个体水平发展到到生态系统水平,但除此之外,水环境中节球藻毒素、柱孢藻毒素、类毒素和贝毒素等的研究仅限于生物个体毒性,尚未报道其在系统尺度上的生态风险。本研究通过挖掘文献中4种藻毒素的急性毒性试验数据,构建ICE-SSD复合模型,评价不同浓度水平藻毒素污染的水生态物种敏感性风险,计算藻毒素对水生生物的风险阈值。拟提供在系统尺度上评价藻毒素污染风险的一个保证率为95%的可靠评价模型,从而为藻毒素污染水体的生态风险管理提供方法和依据。
1 材料与方法(Materials and methods)
1.1 毒性数据获取与物种分组

表1 毒性数据筛选条件Table 1 Criteria for selecting toxicity data
分别利用节球藻毒素、柱孢藻毒素、类毒素与贝毒素的EC50急性毒性数据构建SSD曲线,用以评价其水生态风险,数据来源于Web of Science(http:// www.webofknowledge.com/)收录的相关文献资料,其筛选原则参照欧盟生态风险评估标准“风险评估技术纲领”等[25]:(1)标准毒性试验方法,如经济合作与发展组织(Organization for Economic Cooperation and Development,OECD)或美国材料与试验协会(A-merican Society for Testing and Materials,ASMT)等发布方法;(2)实验条件的设定,如暴露周期、介质等,具体筛选条件见表1[9],本研究中节球藻毒素、柱孢藻毒素和类毒素以淡水分布为主,选取其对淡水生物毒性试验结果,而贝毒素主要来源于海洋藻释放,评价其对海洋生物的急性毒性;(3)急性毒性终点选取,以半数效应浓度EC50表征,其效应包括运动抑制、生长抑制、胚胎发育抑制和致死率等中毒症状;(4)评价物种数不少于5个,且尽量分布于3个以上营养级。为弥补柱孢藻毒素、类毒性、贝毒素适当毒性数据的缺失,本文进一步采用EPA的ICE模型(http:// www.epa.gov/ceampubl/fchain/webice/),通过选取2个具有代表性的物种(大型蚤Daphnia magna,Daphnia pulex)为替代物种外推同类生物急性毒性数据。
根据文献和ICE模型预测,共获得64个水生生物物种的71组急性毒性数据,包含36个甲壳类、17个鱼类、6个昆虫类、2个软体类、2个棘皮类和1个原生动物。节球藻毒素、柱孢藻毒素、类毒素与贝毒素的毒性数据分别含7、24、24和9个物种。同一物种拥有多个毒性数据时,以几何平均值作为该物种的数据点[26]。根据获得物种毒性数据分布,柱孢藻毒素和类毒素在对全部物种进行分析的基础上,进一步细分为脊椎动物和无脊椎动物以比较不同类别生物受到污染物危害的风险大小。全部物种包括脊椎动物和无脊椎动物;脊椎动物包括鱼类和两栖类;无脊椎动物包括甲壳类、昆虫类、软体动物、蠕虫类及其他无脊椎动物。
1.2 SSD拟合
将生物的毒性数据浓度值(或其对数值)对以浓度排列的分位数作图,并对其进行参数拟合得到SSD物种敏感性分布曲线。对比不同参数拟合方法,BurrIII模型分布灵活,可根据参数值的大小转换成ReWeibull和RePareto两种模式,且数据量要求较少(最小数据量为7个),对本研究筛选获得的数据拟合度较好,除贝毒素对全部物种的SSD曲线拟合R2为0.89,其余曲线拟合R2均大于0.93。因此文中采用澳大利亚联邦科学和工业研究组织CSIRO提供的BurrlizO(1.0.14)软件计算BurrIII型分布模式[18],其方程为:

式中:x为污染物浓度值(μg·L-1);b、c、k为函数的3个参数,其中b为尺度参数,c为形状参数,曲线位置则由c、k共同决定。
当k趋于无穷大时,BurrIII分布变化为Re-Weibull分布:

当c趋于无穷大时,变化为RePareto分布:

2 结果(Results)
2.1 水生生物对藻毒素的敏感响应
不同类别生物对节球藻毒素、柱孢藻毒素、类毒素、贝毒素的急性毒性响应值见表2和表3。水生生物对贝毒素、节球藻毒素、柱孢藻毒素、类毒素的对数EC50值分别为1.81、3.11、3.48、3.59 μg·L-1,敏感响应浓度依次升高,显示贝毒素的毒性最大。柱孢藻毒素、类毒素对无脊椎动物的对数EC50值均低于脊椎动物,表明这2种藻毒素对无脊椎动物的毒性更大。

表2 全部物种的毒理数据统计特征(对数变换后)Table 2 Log-transformed toxicity data statistics of all species
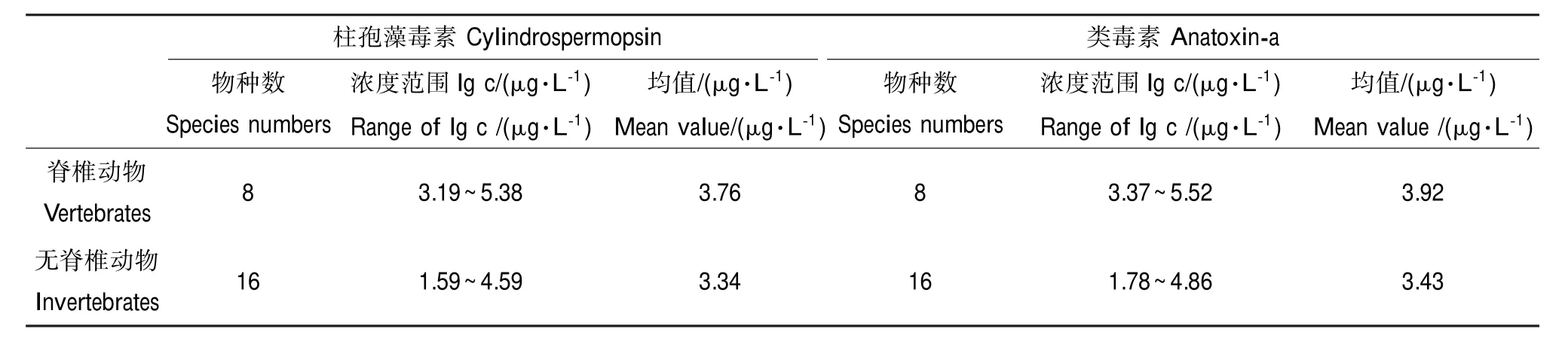
表3 脊椎动物和无脊椎动物的毒理数据统计特征(对数变换后)Table 3 Log-transformed toxicity data statistics of vertebrates and invertebrates

表4 利用BurrlizO计算SSD参数结果Table 4 SSD parameters calculated by BurrlizO
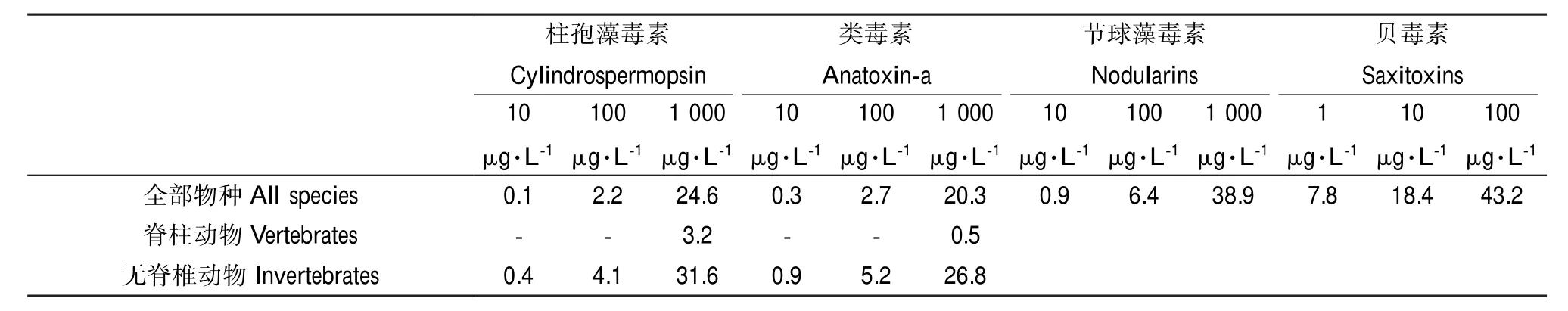
表5 不同暴露浓度下藻毒素的PAF预测值(单位:%)Table 5 Predicted PAF values under different concentrations of cyanotoxins(unit:%)
2.2 藻毒素水生态风险的物种敏感性分布规律
表4是使用BurrlizO软件计算得出的柱孢藻毒素、类毒素与节球藻毒素、贝毒素SSD方程参数结果。其中柱孢藻毒素、类毒素对全部物种和无脊椎物种的敏感性分布曲线符合Burr III分布,对脊椎动物符合ReWeibull分布;节球藻毒素对全部物种适用Burr III分布拟合;贝毒素对全部物种适用Re-Pareto分布拟合。
2.3 不同暴露浓度下藻毒素的PAF值
不同浓度暴露情景下,柱孢藻毒素、类毒素与节球藻毒素、贝毒素对水生生物的PAF预测值见表5。表5显示了由不同浓度值得到的PAF值的大小,反映其对不同物种的损害程度。在1 000 μg·L-1下,柱孢藻毒素和类毒素对全部物种和无脊椎动物的损害比例为20.3%~31.6%,超过了5%的生态风险阈值,对水生态系统造成一定危害;在各浓度暴露情景下,柱孢藻毒素、类毒素对无脊椎动物的PAF值均高于脊椎动物,显示无脊椎动物的敏感性较高。节球藻毒素浓度达到1 000 μg·L-1时,对全部物种的PAF值为38.9%,危害明显。贝毒素对生态系统的影响最为显著,当贝毒素浓度为100 μg·L-1时,对全部物种的PAF值即高达43.2%。
2.4 藻毒素对水生生物的HC5值及生态风险比较
柱孢藻毒素、类毒素与节球藻毒素、贝毒素对不同类别生物的HC5值见表6,与文献[18]中微囊藻毒素急性毒性数据HC5值(19.22 μg·L-1)相比较可得,5种藻毒素对全部物种的HC5值从小到大依次为:贝毒素<微囊藻毒素<节球藻毒素<类毒素<柱孢藻毒素,表现出依次降低的生态风险,贝毒素水生态风险最高,柱孢藻毒素最低。柱孢藻毒素、类毒素对无脊椎动物的HC5值(122.93、95.19 μg·L-1)均低于脊椎动物(1 134.77、1 662.73 μg·L-1),表明无脊椎动物受到损害的风险更高。
HC5值反映低浓度下不同类别生物对藻毒素的耐受性阈值,而通过SSD曲线可以直观比较不同浓度范围内物种对污染物的敏感性差异。对4种藻毒素的毒性数据构建SSD曲线,并与文献[18]中对微囊藻毒素构建的SSD曲线相比较,全部物种对5种藻毒素的SSD曲线如图1所示。贝毒素曲线较陡峭,在低浓度时即对水生生物产生较大的生态风险,并且随着浓度增加,物种敏感性增大的趋势迅速,在浓度高于932.60 μg·L-1时,累计概率即达到100%,生态风险极大。节球藻毒素、柱孢藻毒素和类毒素的SSD曲线斜率差距较小,从曲线整体位置来看,低浓度时从左到右依次为:节球藻毒素、类毒素、柱孢藻毒素,生态风险依次降低,与比较HC5值得到的结果一致;而随着浓度的升高,柱孢藻毒素对水生生物的生态风险逐渐大于类毒素。微囊藻毒素的SSD曲线较缓,在低浓度时,生物敏感性高于节球藻毒素、柱孢藻毒素和类毒素,但随着浓度增加,敏感性增大的趋势较缓慢,在高浓度时,微囊藻毒素对水生生物的生态风险逐渐低于节球藻毒素、柱孢藻毒素和类毒素。

图1 全部物种对5种藻毒素的物种敏感性分布(SSD)曲线图
不同类别生物(I脊柱动物,II无脊椎动物)对微囊藻毒素、柱孢藻毒素和类毒素的SSD曲线如图2,其中,微囊藻毒素的SSD曲线借鉴于文献[18]。图I中,脊椎动物对柱孢藻毒素和类毒素的敏感性差异不显著,柱孢藻毒素对脊椎动物的生态风险略大于类毒素;脊椎动物对微囊藻毒素的SSD曲线位于最左侧,表明微囊藻毒素对脊椎动物的生态风险大于柱孢藻毒素和类毒素。从图II中可见,无脊椎动物对柱孢藻毒素和类毒素的敏感性差异同样不显著,依然是柱孢藻毒素的生态风险略大;无脊椎动物对微囊藻毒素的SSD曲线变化较缓,在低浓度时,无脊椎动物对微囊藻毒素的敏感性高于柱孢藻毒素和类毒素,但随着浓度的增加,敏感性逐渐低于柱孢藻毒素和类毒素。
对比脊椎动物、无脊椎动物对不同藻毒素(柱孢藻毒素,类毒素)的SSD曲线(图3)可看出,柱孢藻毒素与类毒素的情况相似,在低浓度时,无脊椎动物与脊椎动物的敏感性差异较显著,无脊椎动物的敏感性高于脊椎动物;随着浓度增大,脊椎动物的敏感性增大趋势更迅速,因此在到达高浓度时,无脊椎动物与脊椎动物的敏感性差异较小。

表6 藻毒素对水生生物的HC5值(单位:μg·L-1)Table 6 HC5values of cyanotoxins to aquatic organisms(unit:μg·L-1)
2.5 自然水体中藻毒素生态风险评估
运用本文拟合的SSD曲线对我国典型水体藻毒素污染水平进行生态风险评估[4,27],其物种损害比例见表7。在广东省东莞市水濂山水库和河北省秦皇岛市洋河水库,分别检测到柱孢藻毒素浓度和类毒素浓度为8.25 μg·L-1、0.29 μg·L-1,均低于本研究HC5值,对全部物种的影响比例为0.1%和0.01%,显示水生态风险不显著。节球藻毒素和贝毒素在水体中的浓度水平较低,但在我国东海和南海海域的贝类中毒素的检出率分别为14%和30%[28],表明水生动物以藻类为食亦可造成藻毒素体内富集和产生毒害效应,进而威胁水生态安全。
3 讨论(Discussion)

图2 脊柱动物(I)、无脊椎动物(II)对微囊藻毒素、柱孢藻毒素和类毒素的SSD曲线比较

图3 脊椎动物、无脊椎动物对柱孢藻毒素(I)、类毒素(II)的SSD曲线比较

表7 国内水体柱孢藻毒素和类毒素对淡水生物的PAF预测值(单位:%)Table 7 Predicted PAF values of cylindrospermopsin and anatoxin-a to freshwater species in studied waters(unit:%)
通过对4种藻毒素水生态风险的评价,可见不同藻毒素的水生态风险差异显著,同为神经毒素的类毒素与贝毒素对全部物种的HC5值相差近650倍,可归因于其致毒分子机制的差异。研究表明,类毒素主要与乙酰胆碱存在烟碱受体的竞争性结合作用,在对虹鳟(Oncorhynchus mykiss)鱼苗的暴露实验中,鱼体肌肉组织的乙酰胆碱酯酶(AChE)活性随着类毒素剂量的增加而显著增强[29];而麻痹性贝类毒素(paralytic shellfish toxins,PSTs)之一的贝毒素则通过阻止神经细胞钠离子通道抑制神经冲动的正常动作电位传输,从而引起神经肌肉的麻痹,被认为是最有效的和快速的神经毒素之一[30]。此外,同种藻毒素对不同种类生物毒性影响亦差异显著,无脊椎动物对柱孢藻毒素与类毒素暴露的敏感性均明显高于脊椎动物。可能与其对藻毒素降解机制的差异有关,谷胱甘肽转移酶(glutathione s-transferase,GST)通过催化内源性谷胱甘肽(glutathione,GSH)与毒素结合而起到降毒作用,是生物体毒素降解的重要指标之一。10 μg·L-1柱孢藻毒素对罗非鱼(Oreochromis niloticus)暴露7 d,鱼体内GST酶活性增强,诱导率约为35%[31];而648.6 ng·L-1柱孢藻毒素对大型蚤(Daphnia magna)暴露24 h,蚤体内GST酶活性即被诱导,诱导率达25.14%[32]。显示无脊椎动物大型蚤(Daphnia magna)在低浓度藻毒素暴露下短时间内即产生应急毒性响应,敏感性更高。
物种敏感性分布是一种基于单物种测试的外推方法,它把可能发生的风险依靠统计模型以概率的方式表达出来。影响SSD评估不确定性的因素包括毒性数据的选择和统计模型的选择[33]。目前的研究结果表明数据的选择比统计模型的选择对HC5值影响更大[9]。SSD方法对毒理数据的选择暂没有统一规定,经济合作与发展组织(OECD)推荐的最小数据量为5个,美国环保署(US EPA)建议至少涉及3个营养级8个分类群。本研究中柱孢藻毒素和类毒素的毒理数据量足够覆盖3个营养级,而节球藻毒素和贝毒素的毒理数据量不足3个营养级,但超过OECD推荐的5个数据点限值。此外,物种敏感性分布假定有限的生物物种是从整个生态系统中随机取样的,故认为评估有限物种的损害概率是适合整个生态系统的。但在实际应用中,物种样本的数据是根据数据的有效性来采用的,而不是随机样本,因此在很大程度上增加了不确定性。因此针对毒理数据缺乏带来的风险评估不确定性,需进一步开展水生受试生物的毒理学实验,丰富毒理学研究数据,提高采用SSD方法评估的准确性与可靠性。
综上所述,藻毒素因致毒机制等差异可对水生生物造成不同程度毒性影响,有必要对多种藻毒素进行水生态风险评估,以获得其生态安全浓度阈值。本研究基于不同营养级水生生物对肝毒性和神经毒性藻毒素的急性毒性数据运用SSD概率统计分布方法评估4种藻毒素风险,指出其生态风险阈值HC5为0.3~205.39 μg·L-1不等,尤以神经毒素贝毒素的水生态风险最高,为藻毒素污染的水生态风险管理提供依据。但在SSD模型评估中,毒性数据缺失及不同地区敏感物种组成的差异性,导致风险评估不确定性增加,有必要开展进一步的毒理学实验或野外研究,获得多营养级更多分类群的毒理数据,进一步修正本文的相关研究结果。
(References):
[1] 谢平.微囊藻毒素对人类健康影响相关研究的回顾[J].湖泊科学,2009,21(5):603-613
Xie P.A review on the studies related to the effects of microcystins on human health[J].Journal of Lake Sciences, 2009,21(5):603-613(in Chinese)
[2] Merel S,Walker D,Chicana R,et al.State of knowledge and concerns on cyanobacterial blooms and cyanotoxins [J].Environment International,2013,59:303-327
[3] Otten T G,Xu H,Qin B,et al.Spatiotemporal patterns and ecophysiology of toxigenic microcystis blooms in Lake Taihu,China:Implications for water quality management[J].Environmental Science&Technology,2012, 46(6):3480-3488
[4] Lei L,Peng L,Huang X H,et al.Occurrence and dominance ofCylindrospermopsis raciborskiiand dissolved cylindrospermopsin in urban reservoirs used for drinking water supply,South China[J].Environmental Monitoring and Assessment,2014,186(5):3079-3090
[5] Ferrao-Filho A S,Kozlowsky-Suzuki B.Cyanotoxins: Bioaccumulation and effects on aquatic animals[J].Marine Drugs,2011,9(12):2729-2772
[6] Saqrane S,Ghazali I E,Ouahid Y,et al.Phytotoxic effects of cyanobacteria extract on the aquatic plantLemna gibba: Microcystin accumulation,detoxicationandoxidative stress induction[J].Aquatic Toxicology,2007,83(4):284-294
[7] Bittencourt-Oliveira M C,Hereman T C,Cordeiro-Araujo M K,et al.Phytotoxicity associated to microcystins:A review[J].Brazilian Journal of Biology,2014,74(4):753-760
[8] Landsberg J H.The effects of harmful algal blooms on aquatic organisms[J].Reviews in Fisheries Science,2002, 10(2):113-390
[9] Wheeled J R,Grist E P M,Leung K M Y,et al.Speciessensitivity distributions:Data and model choice[J].Marine Pollution Bulletin,2002,45:192-202
[10] Raimondo S,Vivian D N,Delos C,et al.Protectiveness of species sensitivity distribution hazard concentration for acute toxicity used in endangered species risk assessment [J].Environmental Toxicology and Chemistry,2008,27 (12):2599-2607
[11] Garner K L,Suh S,Lenihan H S,et al.Species sensitivity distributions for engineered nanomaterials[J].Environmental Science&Technology,2015,49(9):5753-5759
[12] Australian and New Zealand Environment and Conservation Council and Agriculture and Resource Management Council of Australia and New Zealand.Australian and New Zealand Guidelines for Fresh and Marine Water Quality[R].Canberra:ANZECC and ARMCANZ,2000
[13] National Institute for Public Health and the Environment. Guidance for the Derivation of Environmental Risk Limits within the Framework of‘International and National Environmental Quality Standards for Substances in the Netherlands’(INS)[R].BA Bilthoven,Netherlands:RIVM, 2007
[14] 王印,王军军,秦宁,等.应用物种敏感性分布评估DDT和林丹对淡水生物的生态风险[J].环境科学学报,2009,29(11):2407-2414
Wang Y,Wang J J,Qin N,et al.Assessing ecological risks of DDT and lindane to fresh water organisms by species sensitivity distributions[J].Acta Scientiae Circumstantiae,2009,29(11):2407-2414(in Chinese)
[15] 徐瑞祥,陈亚华.应用物种敏感性分布评估有机磷农药对淡水生物的急性生态风险[J].湖泊科学,2012,24 (6):811-821 Xu R X,Chen Y H.Assessing acute ecological risks of organophosphorus pesticides to freshwater organisms by species sensitivity distributions[J].Journal of Lake Sciences,2012,24(6):811-821(in Chinese)
[16] 孔祥臻,何伟,秦宁,等.应用物种敏感性分布评估重金属对淡水生物的急性生态风险[J].中国环境科学, 2011,31(9):1555-1562
Kong X Z,He W,Qin N,et al.Assessing acute ecological risks of heavy metals to freshwater organisms by species sensitivity distributions[J].China Environmental Science, 2011,31(9):1555-1562(in Chinese)
[17] 蒋丹烈,胡霞林,尹大强.应用物种敏感性分布法对太湖沉积物中多环芳烃的生态风险分析[J].生态毒理学报,2011,6(1):60-66
Jiang D L,Hu X L,Yin D Q.Ecological risk assessment on polycyclic aromatic hydrocarbons of sediment in Taihu Lake using species sensitivity distributions[J].Asian Journal of Ecotoxicology,2011,6(1):60-66(in Chinese)
[18] 陈瑾,刘奕梅,张建英.基于物种敏感性分布的微囊藻毒素与氮污染水体生态风险评估[J].应用生态学报, 2014,25(4):1171-1180
Chen J,Liu Y M,Zhang J Y.Aquatic ecological risk assessment of microcystins and nitrogen pollution based on species sensitivity distribution[J].Chinese Journal of Applied Ecology,2014,25(4):1171-1180(in Chinese)
[19] Vanstraalen N M,Denneman C A J.Ecotoxicological evaluation of soil quality criteria[J].Ecotoxicology and Environmental Safety,1989,18(3):241-251
[20] Australian and New Zealand Environment and Conservation Council and Agriculture and Resource Management Council of Australia and New Zealand.Australian and New Zealand Guidelines for Fresh and Marine Water Quality[R].Canberra:Environment and Conservation Council,Agriculture and Resource Management Council, 2000
[21] Raimondo S,Jackson C R,Barron M G.Web-Based Interspecies Correlation Estimation(Web-ICE)for Acute Toxicity:User Manual Version 3.2[DB].Washington DC: US Environmental Protection Agency,Office of Research and Development,National Health and Environmental Effects Research Laboratory,2013
[22] Raimondo S,Jackson C R,Barron M G.Influence of taxonomic relatedness and chemical mode of action in acute interspecies estimation models for aquatic species[J].Environmental Science&Technology,2010,44(19):7711-7716
[23] 王斌,余刚,黄俊,等.应用ICE和PCA方法评价硝基芳烃的综合毒性[J].环境科学,2007,28(8):1774-1778 Wang B,Yu G,Huang J,et al.Evaluation of integrated toxicity of nitroaromatic compounds by the combination of ICE and PCA[J].Environmental Science,2007,28(8): 1774-1778(in Chinese)
[24] Feng C L,Wu F C,Dyer S D,et al.Derivation of freshwater quality criteria for zinc using interspecies correlation estimation models to protect aquatic life in China[J]. Chemosphere,2013,90(3):1177-1183
[25] European Chemicals Bureau.Technical Guidance for Deriving Environmental Quality Standards.Common Implementation Strategy for the Water Framework Directive (2000/60/EC)[R].Luxembourg:European Chemicals Bureau,European Commission Joint Research Center,European Communities,2011
[26] Hose G C,Van den Brink P J.Confirming the speciessensitivity distribution concept for endosulfan using laboratory,mesocosm,and field data[J].Archives of Environ-mental Contamination and Toxicology,2004,47(4):511-520
[27] Li Z L,Yu J W,Yang M,et al.Cyanobacterial population and harmful metabolites dynamics during a bloom in-Yanghe Reservoir,North China[J].Harmful Algae,2010, 9(5):481-488
[28] 江天久,陈菊芳,邹迎麟,等.中国东海和南海有害赤潮高发区麻痹性贝毒素研究[J].应用生态学报,2003, 14(7):1156-1160
Jiang T J,Chen J F,Zou Y L,et al.Paralytic shellfish toxins in shellfish from the coast of high frequent harmful algae blooms occurrence areas in East China Sea and South China Sea[J].Chinese Journal of Applied Ecology, 2003,14(7):1156-1160(in Chinese)
[29] Osswald J,Carvalho A P,Guimaraes L,et al.Toxic effects of pure anatoxin-a on biomarkers of rainbow trout, Oncorhynchus mykiss[J].Toxicon,2013,70:162-169
[30] Zagatto P A,Buratini S V,Aragao M A,et al.Neurotoxicity of twoCylindrospermopsis raciborskii(cyanobacteria) strains to mice,daphnia,and fish[J].Environmental Toxicology and Chemistry,2012,31(4):857-862
[31] Guzman-Guillen R,Prieto A I,Vasconcelos V M,et al. Cyanobacterium producing cylindrospermopsin cause oxidative stress at environmentally relevant concentrations in sub-chronically exposed tilapia(Oreochromis niloticus) [J].Chemosphere,2013,90(3):1184-1194
[32] Nogueira I C G,Saker M L,Pflugmacher S,et al.Toxicity of the cyanobacteriumCylindrospermopsis radborskii toDaphnia magna[J].Environmental Toxicology,2004, 19(5):453-459
[33] Aldenberg T,Jaworska J S.Uncertainty of the hazardous concentration and fraction affected for normal species sensitivity distributions[J].Ecotoxicology and Environmental Safety,2000,46(1):1-18◆
Assessing Ecological Risk of Cyanotoxins Based on Interspecies Correlation Estimation and Species Sensitivity Distributions
Zhu Xiaoyi1,2,Chen Jin1,2,Zhang Jianying1,2,*
1.Environmental Science Institute,Zhejiang University,Hangzhou 310058,China
2.Zhejiang Provincial Key Laboratory of Organic Pollution Process and Control,Hangzhou 310058,China
15 July 2015 accepted 17 November 2015
The risk of cyanotoxins to human health has been widely concerned.However,their effect on aquatic species sensitivity distribution was not well understood.This study aimed to assess the ecological risks of two typical cyanobacterial hepatotoxins(nodularins,cylindrospermopsin)and two typical cyanobacterial neurotoxins(anatoxin-a,saxitoxins)by employing the interspecies correlation estimation(ICE)and species sensitivity distributions (SSDs)models.SSDs were constructed based on 71 available sets of acute toxicity data covering 64 aquatic organisms exposure to cyanotoxins.The potentially affected fractions(PAF)under various concentrations and the hazardous concentrations for 5%of the species(HC5)were calculated and compared among different aquatic species.Re-sults show that the estimated HC5values for nodularins,cylindrospermopsin,anatoxin-a and saxitoxins were 74.96 μg·L-1,205.39 μg·L-1,194.39 μg·L-1and 0.3 μg·L-1,respectively,suggesting that the hazardous risk of species is assessed at higher and lower level for saxitoxins and cylindrospermopsin.The invertebrates exposure to cylindrospermopsin and anatoxin-a presented lower HC5than that of the all aquatic organisms with 122.93 μg·L-1and 95.19 μg ·L-1,respectively,which indicate that cylindrospermopsin and anatoxin-a cause more damage to invertebrates than other species.The PAF of 10-1000 μg·L-1cylindrospermopsin and anatoxin-a to invertebrates were higher than that of vertebrates,suggesting that invertebrates are more sensitive to cylindrospermopsin and anatoxin-a than vertebrates.
cyanotoxins;aquatic organisms;species sensitivity distributions;ecological threshold
2015-07-15 录用日期:2015-11-17
1673-5897(2016)3-131-09
X171.5
A
10.7524/AJE.1673-5897.20150715005
简介:张建英(1967-),女,环境工程博士,副教授,主要研究方向为水污染生态化学、环境风险控制技术,发表学术论文70余篇。
国家自然科学基金项目(21177106,21477103)
朱小奕(1990-),女,硕士研究生,研究方向为水生态毒理学,E-mail:21414020@zju.edu.cn
*通讯作者(Corresponding author),E-mail:zjy@zju.edu.cn

