通心络对同型半胱氨酸诱导大鼠心肌微血管内皮细胞损伤的干预作用及氧化应激机制研究
位庚,刘红利,李红蓉,马柳一,尹玉洁,姚兵,贾振华
通心络对同型半胱氨酸诱导大鼠心肌微血管内皮细胞损伤的干预作用及氧化应激机制研究
位庚,刘红利,李红蓉,马柳一,尹玉洁,姚兵,贾振华
目的:探讨通心络对同型半胱氨酸诱导大鼠心肌微血管内皮细胞损伤的干预作用及氧化应激机制。
方法:采用植块法原代培养大鼠心肌微血管内皮细胞,倒置显微镜观察细胞形态并通过CD31免疫荧光法对培养的大鼠心肌微血管内皮细胞进行辨别、鉴定。用同型半胱氨酸(Hcy)建立细胞损伤模型,实验分为对照组、同型半胱氨酸组、通心络低浓度组、通心络中浓度组、通心络高浓度组。分别检测各组细胞的存活率、细胞上清液中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量、细胞内活性氧(ROS)水平、内皮素-1(ET-1)和内皮型一氧化氮合酶(eNOS)表达水平的变化。
结果:与对照组相比,同型半胱氨酸组细胞存活率降低 [(74.61±2.88)% vs(100.00±2.07)%],细胞上清液中MDA含量升高[(4.10±0.18)nmol/ml vs(1.92±0.10)nmol/ml],SOD活性降低[(7.55±0.71)U/ml vs(20.77±0.68)U/ml],细胞内ROS水平升高[(38.17±10.28)% vs(19.83±2.97)%],ET-1 mRNA表达上调,eNOS蛋白表达下调;与同型半胱氨酸组相比,通心络各剂量组均能不同程度的改善上述指标变化。
结论:通心络能够改善同型半胱氨酸诱导的大鼠心肌微血管内皮细胞的功能损伤,并通过减轻氧化应激损伤发挥细胞保护作用。
通心络;心肌微血管内皮细胞;同型半胱氨酸;内皮功能;氧化应激
Abstract
Objective: To observe the effect of Tongxinluo (TXL) on homocysteine-induced rat’s cardiac micro vascular endothelial cell(RCMECs) injury and to study the oxidative stress mechanism.
Methods: Primary RCMECs were cultured with tissue explants process, cell morphology was observed by inverted microscope and the cell was identified by CD31 immunofluorescence method. RCMEC injury model was established by Homocysteine (Hcy)induction and the cells were divided into 5 groups: Control group, with normal cells, Hcy group, the cells were treated by Hcy at 10 mmol/L, Low-dose TXL group, Hcy treated cells were cultured with TXL at 100 mg/L, Middle-dose TXL (200 mg/L)group and high-dose TXL (400 mg/L) group. Cell survival rates were detected, supernatant levels of superoxide dismutase (SOD)activity and malondialdehyde (MDA) content were examined, intracellular protein expressions of reactive oxygen species (ROS)and endothelial nitric oxide synthase (eNOS) were detected and mRNA expression of endothelin-1 (ET-1) was measured in different groups respectively.
Results: Compared with Control group, Hcy group showed decreased cell survival rate (74.61 ± 2.88)% vs (100.00 ± 2.07)%, increased supernatant level of MDA (4.10 ± 0.18) nmol/ml vs (1.92 ± 0.10) nmol/ml, reduced SOD activity (7.55 ± 0.71) U/ml vs(20.77 ± 0.68) U/ml, elevated ROS level(38.17 ± 10.28) % vs (19.83 ± 2.97) %, up-regulated mRNA expression of ET-1 and down-regulated protein expression of eNOS. Compared with Hcy group, the above indexes were improved in each TXL group at different levels.
Conclusion: TXL could decrease Hcy induced RCMECs injury, such protection was conducted by reducing the oxidative stress mechanism in cells.
(Chinese Circulation Journal, 2016,31: 908.)
同型半胱氨酸(Homocysteine,Hcy)是诱发动脉粥样硬化的独立危险因素,它可以通过诱导血管壁氧化应激反应而导致内皮细胞功能障碍[1],这可能是Hcy导致动脉粥样硬化的机制之一。中药复方制剂通心络在脉络学说理论指导下对心血管疾病的防治具有调脂、抗氧化、抗炎,改善内皮功能、稳定易损斑块等多种作用,临床疗效明显[2]。我们课题组前期的动物实验证实了通心络可明显改善Hcy诱发的血管内皮细胞功能障碍,可能与其抑制自由基的过量生成有关[3]。为了进一步观察通心络的保护机制,本研究采用Hcy诱导原代培养的大鼠心肌微血管内皮细胞(Rat cardiac microvascular endothelial cells,RCMECs)为损伤模型,观察Hcy对心肌微血管内皮细胞的损伤机制,并探讨通心络对微血管内皮细胞的保护作用和作用机制,以期为动脉粥样硬化的机制研究和临床治疗提供理论依据。
1 材料与方法
实验动物:2周龄SPF级SD雄性大鼠10 只,体重(30±5)g,由北京富豪实验动物养殖中心提供,实验动物许可证号:SCXK(京)2011-0012。大鼠心肌微血管内皮细胞由大鼠心室肌分离提取,连续传4代用于实验。
药物及试剂:通心络药粉由石家庄以岭药业股份有限公司提供;内皮细胞(ECM)培养套装购自美国Sciencell公司;CCK-8细胞增殖-毒性检测测试盒购自日本同仁化学研究所;丙二醛测试盒、超氧化物歧化酶测试盒和活性氧簇测试盒均购自江苏南京建成生物工程研究所;反转录试剂盒、实时定量反转录聚合酶链式反应(RT-PCR)试剂盒购自美国Fermentas公司;CD31抗体、内皮型一氧化氮合酶(eNOS)抗体、DyLight 488标记的羊抗小鼠IgG抗体购自美国Abcame公司;内皮素-1(ET-1)引物购自上海生工生物公司。
主要仪器:PrimoVert倒置显微镜购自德国Zeiss公司; Operetta高通量高内涵细胞分析系统购自美国PerkinELmer公司;FACSAriaⅢ超速流式细胞分选系统购自美国BD公司;ABI 7300实时 PCR 系统购自美国ABI公司;UVP凝胶扫描系统购自美国UVP公司;电转膜仪、半干转膜仪、垂直电泳仪购自美国Bio-Rad公司。
药物配制:称取通心络药粉溶于无血清ECM培养基,超声促溶20 min,6500 g,离心10 min,收集上清液,用0.22 μm微孔滤器过滤除菌,将所得所有沉淀于60℃加热烘干,计算实际溶于无血清ECM培养基药物重量,制备成10 mg/ml通心络贮存液,分装后-20℃贮存备用[4]。
原代大鼠心肌微血管内皮细胞分离、培养:采用植块法分离和培养原代RCMECs,参照文献[5]的方法提取RCMECs,待细胞培养至80 %汇合状态,以0.25%胰蛋白酶消化传代,取第2~4代用于实验。
原代大鼠心肌微血管内皮细胞鉴定:首先倒置显微镜下观察细胞形态,其次CD31作为微血管内皮细胞的标志物,它参与了调节微血管内皮细胞间的连接稳定性和完整性[6],故本实验采用细胞免疫荧光法检测RCMECs胞膜上CD31的表达对细胞进行鉴定。将原代培养的细胞消化后,接种于96孔板中,约1~2 d后细胞生长铺满皿底,弃上清,4%多聚甲醛固定10 min,磷酸缓冲盐溶液(PBS)冲洗3次,0.5% Trition X-100 孵育细胞5 min;磷酸盐缓冲液(PBS)冲洗3次后用封闭液室温封闭细胞30 min;加入1:200稀释的CD31一抗孵育,4 ℃过夜,DyLight 488标记的荧光二抗1:200稀释室温避光孵育1 h,甘油封片后高通量高内涵细胞分析系统检测CD31表达。
细胞分组及处理:(1)对照组:细胞正常培养;(2)同型半胱氨酸组:培养液含10 mmol/L Hcy;(3)通心络低浓度组:通心络预孵育4 h,终溶液Hcy 10 mmol/L加通心络100 mg/L;(4)通心络中浓度组:通心络预孵育4 h,终溶液Hcy 10 mmol/L加通心络200 mg/L;(5)通心络高浓度组:通心络预孵育4 h,终溶液Hcy 10 mmol/L加通心络 400 mg/L。
CCK-8法检测大鼠心肌微血管内皮细胞存活率[7]:取对数生长期的RCMECs以1.0×108/L的细胞浓度接种于96孔培养板中,每组3个复孔,每孔加入100 μl 细胞悬液培养24 h 后用于实验。5组细胞于37℃、5%CO2培养箱中继续孵育24 h,吸弃培养基,加入含有CCK-8的无血清培养基100 μl(CCK-8溶液:无血清培养基=1:10),37℃、5%CO2培养箱中继续孵育1 h, 酶标仪检测450 nm波长处光密度(OD)值。以对照组OD值作为参照,以其他各组OD值与对照组OD值比值进行统计分析。
羟胺法及TBA法检测细胞上清中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量[8]:药物相应处理细胞24 h后收集细胞上清液,羟胺法检测SOD活性,于波长550 nm处,双蒸水调零,酶标仪检测OD值,按说明书上给出的公式计算出SOD活性;TBA法检测MDA含量,于532 nm处,双蒸水调零,酶标仪检测OD值,按说明书上给出的公式计算出MDA含量,实验操作步骤严格按照说明书进行。
流式细胞仪检测细胞中活性氧(ROS)水平:药物相应处理细胞24 h后弃去上清,PBS清洗细胞两次,按照1:10000浓度用无血清ECM培养基稀释DCFH-DA,37℃、5%CO2培养箱中继续孵育30 min,0.25%的胰酶消化2 min,加入培养基终止消化,制成细胞悬液,350 g离心5 min收集细胞,用PBS洗涤细胞2次后,流式细胞仪检测。
RT-PCR检测细胞内皮素-1(ET-1)mRNA的表达:各组细胞相应处理24 h后,Trizol试剂提取总RNA。用紫外分光光度计检测总RNA完整性及纯度,并用M-MLV逆转录酶系统和随机引物逆转录。以β-肌动蛋白(β-actin)作为内参照基因,分别与各组相比,得到目的基因表达的相对定量值(RQ值),将RQ值用于统计分析,引物序列见表1。

表1 引物序列
蛋白免疫印迹(Western blot)法检测细胞eNOS蛋白的表达:各组细胞相应处理24 h后,将细胞充分裂解,超声破碎后蛋白定量,SDS聚丙烯酰胺凝胶电泳,半干转膜后封闭,与eNOS一抗结合,4℃过夜,与二抗结合,化学发光法检测,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,以各目的蛋白灰度值与GAPDH灰度值的比值进行分析。
统计学方法:采用SPSS19.0统计软件进行数据分析,组间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1大鼠心肌微血管内皮细胞的形态及鉴定结果(图1)
植块法分离的RCMECs培养至第2~3天时,可见未融合状态下单个微血管内皮细胞呈梭形、星型或多角形,去除组织块继续培养至第5天时,可见细胞汇合成铺路石样。CD31免疫荧光鉴定结果显示所提取的大鼠心肌微血管内皮细胞纯度大于95%。
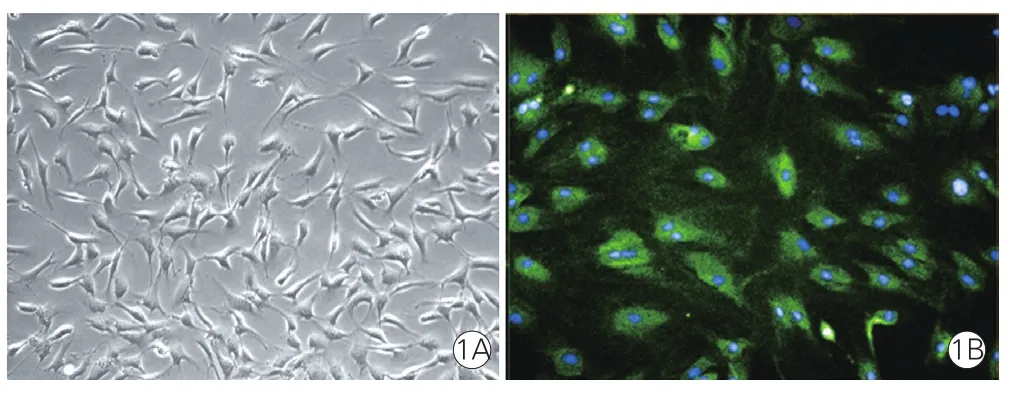
图1 大鼠心肌微血管内皮细胞的形态及鉴定结果(×200)
2.2通心络对同型半胱氨酸损伤大鼠心肌微血管内皮细胞存活率的影响(表2)
与对照组比较,同型半胱氨酸组细胞存活率显著降低(P<0.01);与同型半胱氨酸组比较,通心络高浓度组细胞存活率显著增高(P<0.01)。
2.3通心络对同型半胱氨酸损伤大鼠心肌微血管内皮细胞上清液SOD活性和MDA含量的影响(表2)
与对照组比较,同型半胱氨酸组细胞上清液SOD活性降低(P<0.01),MDA含量升高(P<0.01);与同型半胱氨酸组相比,通心络低浓度组、通心络中浓度组及通心络高浓度组细胞上清液SOD活性升高(P<0.01),通心络中浓度组及通心络高浓度组细胞上清液MDA含量降低(P<0.01);与通心络低浓度组比较,通心络高浓度组细胞上清液SOD活性升高(P<0.05),通心络中浓度组及通心络高浓度组细胞上清液MDA含量降低(P<0.01);与通心络中浓度组比较,通心络高浓度组细胞上清液MDA含量降低(P<0.01)。
2.4通心络对同型半胱氨酸损伤大鼠心肌微血管内皮细胞ROS水平的影响(表2、图2)
流式细胞仪检测细胞内活性氧探针DCFH-DA荧光强度,在以下流式结果图中,X轴代表了相对荧光强度,Y轴代表了细胞数目,所以峰值越靠右,则表明了在相同数目(10 000个)的细胞样本中荧光强度越大,而P2门的位置是固定的,所以P2门中样本的比例越大,则代表荧光强度越高。与对照组比较,同型半胱氨酸组ROS荧光强度升高(P<0.05);与同型半胱氨酸组比较,通心络高浓度组ROS荧光强度降低(P<0.05)。
表2 各组大鼠心肌微血管内皮细胞存活率、细胞上清液超氧化物歧化酶活性、丙二醛含量及细胞内活性氧水平比较(n=3,±s)

表2 各组大鼠心肌微血管内皮细胞存活率、细胞上清液超氧化物歧化酶活性、丙二醛含量及细胞内活性氧水平比较(n=3,±s)
注:与对照组比较*P<0.05,**P<0.01;与同型半胱氨酸组比较△P<0.05,△△P<0.01;与通心络低浓度组比较▲P<0.05,▲▲P<0.01;与通心络中浓度组比较#P<0.01
活性氧(%)对照组 100.00±2.07 20.77±0.68 1.92±0.10 19.83±2.97同型半胱氨酸组 74.61±2.88** 7.55±0.71** 4.10±0.18** 38.17±10.28*通心络低浓度组 82.11±7.84 17.31±1.29△△ 3.90±0.15 33.83±9.41通心络中浓度组 83.10±7.19 19.11±1.30△△ 3.50±0.16△△▲▲ 30.90±9.83通心络高浓度组 90.03±3.59△△ 19.64±0.89△△▲ 2.26±0.13△△▲▲# 22.50±3.66△组别 存活率(%)超氧化物歧化酶(U/ml)丙二醛(nmol/ml)
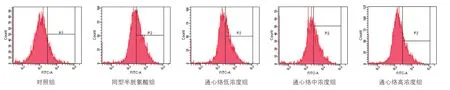
图2 流式细胞仪检测各组大鼠心肌微血管内皮细胞活性氧荧光强度
2.5通心络对同型半胱氨酸损伤大鼠心肌微血管内皮细胞ET-1 mRNA表达的影响(表3)
与对照组比较,同型半胱氨酸组ET-1 mRNA表达升高(P<0.01);与同型半胱氨酸组比较,通心络低浓度组、通心络中浓度组及通心络高浓度组ET-1 mRNA表达降低(P<0.01)。
表3 各组大鼠心肌微血管内皮细胞内皮素-1 mRNA及内皮型一氧化氮合酶蛋白表达比较
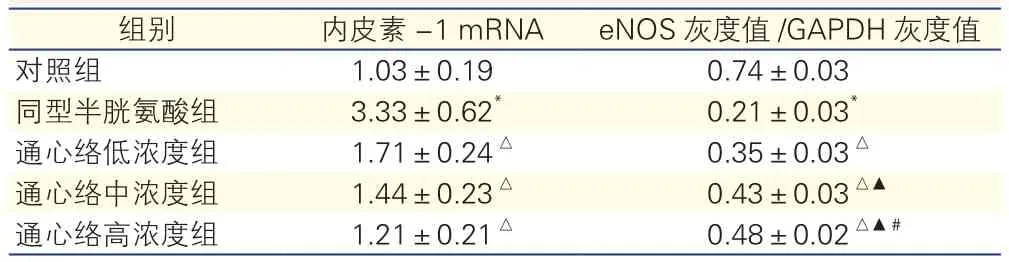
表3 各组大鼠心肌微血管内皮细胞内皮素-1 mRNA及内皮型一氧化氮合酶蛋白表达比较
注:eNOS: 内皮型一氧化氮合酶;GAPDH: 甘油醛-3-磷酸脱氢酶。与对照组比*P<0.01;与同型半胱氨酸组比较△P<0.01;与通心络低浓度组比较▲P<0.01;与通心络中浓度组比较#P<0.05
组别 内皮素-1 mRNA eNOS灰度值/GAPDH灰度值对照组 1.03±0.19 0.74±0.03同型半胱氨酸组 3.33±0.62* 0.21±0.03*通心络低浓度组 1.71±0.24△ 0.35±0.03△通心络中浓度组 1.44±0.23△ 0.43±0.03△▲通心络高浓度组 1.21±0.21△ 0.48±0.02△▲#
2.6通心络对同型半胱氨酸损伤大鼠心肌微血管内皮细胞eNOS蛋白表达的影响(表3、图3)
与对照组比较,同型半胱氨酸组eNOS蛋白表达降低(P<0.01);与同型半胱氨酸组比较,通心络低浓度组、通心络中浓度组及通心络高浓度组eNOS蛋白表达升高(P<0.01);与通心络低浓度组比较,通心络中浓度组及通心络高浓度组eNOS蛋白表达升高(P<0.01);与通心络中浓度组比较,通心络高浓度组eNOS蛋白表达升高(P<0.05)。
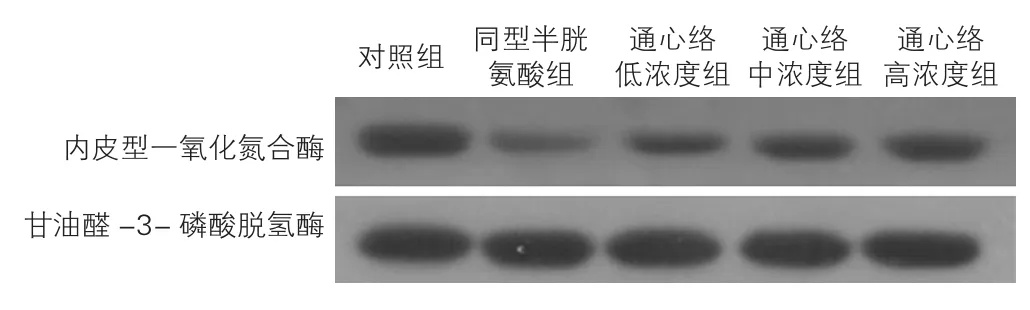
图3 各组大鼠心肌微血管内皮细胞内皮型一氧化氮合酶蛋白表达水平蛋白免疫印迹图
3 讨论
目前的研究认为内皮细胞损伤是导致动脉粥样硬化的始动因素之一,Hcy是动脉粥样硬化形成的独立危险因素,它可以引起血管内皮细胞发生氧化应激,炎症反应,使血管内脂质代谢紊乱,促进血管平滑肌细胞增殖等[9,10]。通心络是在中医络病理论指导下研制而成的中药复方制剂,主要由人参、全蝎、水蛭、土鳖虫、蝉蜕、降香、冰片等中药组成,具有益气、活血、化瘀通络等功效。通心络已广泛用于心脑血管疾病的治疗,大量实验证实其对于微血管具有明显的保护作用,在保护微血管内皮细胞及其功能方面更显示出其独特的优势[11,12]。我们前期的动物实验也证实通心络可以抑制自由基的过量生成改善Hcy诱导的内皮细胞损伤,而且通心络能导致Hcy损伤的人脐静脉内皮细胞的基因表达谱改变,这些基因改变可能参与了细胞凋亡和氧化应激等过程[13]。所以本研究通过Hcy诱导体外培养的RCMECs损伤,用通心络进行药物干预,进一步探讨其保护微血管内皮细胞的作用及氧化应激机制。
一氧化氮(NO)为内皮细胞合成的主要舒血管物质,参与维持血管的正常张力、抑制血小板黏附,防止血栓的形成,发挥积极的心血管保护作用。它的前体是L-精氨酸,由一氧化氮合酶催化合成,NOS有三种类型,内皮细胞中存在的是eNOS。Hcy可抑制eNOS的合成和活性,抑制L-精氨酸的转运,导致eNOS的脱偶联,从而减少NO的生成。ET具有强烈的收缩血管作用,主要由内皮细胞合成和释放,其表达的异常及伴随的内皮功能障碍是血管病理学的一个重要早期事件。生理状态下,内皮细胞分泌的舒血管物质和缩血管物质在局部维持一定的浓度比,互相制约,保持动态平衡。当内皮细胞受到损伤时,其分泌的舒血管因子就会减少,缩血管因子增多,可诱发高血压、AS等疾病。本研究结果显示,经Hcy损伤后,RCMECs的eNOS蛋白表达下调,同时ET-1 mRNA表达上调,ET/NO间的动态平衡被破坏,可引起内皮细胞的舒缩功能发生障碍。通心络各给药组干预后,eNOS蛋白表达上调,ET-1 mRNA表达下调,均以通心络高浓度组改善效果最佳,且呈剂量依赖性,表明通心络能够从基因和蛋白水平有效改善Hcy诱导的内皮细胞功能障碍。
Hcy代谢过程中产生过氧化氢自由基、羟自由基,而诱导氧化应激反应,降低内皮细胞NO释放,减弱内皮依赖性的血管舒张反应[14],所以Hcy可通过其诱导的氧化应激介入AS的病理生理过程,并可以加剧内皮细胞的功能障碍。SOD是清除自由基的主要防御酶,能清除超氧阴离子自由基(O2-·)保护细胞免受损伤[15],其活力的高低间接反应了机体清除氧自由基的能力,而MDA是细胞被自由基攻击,经细胞壁破裂和细胞膜脂降解形成的最终裂解产物,间接反应了机体细胞受自由基攻击的严重程度[16],ROS是氧元素在体内氧化还原反应的产物,其表达量过多导致的氧化应激可直接导致血管内皮细胞的氧化损伤和功能障碍,ROS还作为信号分子放大和叠加损伤作用[17,18],所以三者联合检测可更好的反映氧化应激程度。本研究结果显示,Hcy组细胞上清中MDA含量及ROS水平升高,细胞上清中SOD活性降低,表明Hcy诱导的细胞损伤存在着明显的氧化应激反应。通心络不同浓度干预后,细胞上清中SOD活性和MDA含量及细胞中ROS水平均有不同程度的改善,其中通心络高剂量组改善作用最为明显。
[1] Bellamy MF, McDowell IF, Ramsey MW, et al. Hyperhomocysteinemia after an oral methionine load acutely impairs endothelial function in healthy adults. Circulation, 1998, 98: 1848-1852.
[2] 刘红利, 郎艳松, 王宏涛. 通心络胶囊治疗心血管疾病研究进展.中国新药杂志, 2014, 23: 1769-1772.
[3] 梁俊清, 吴以岭, 徐海波, 等. 同型半胱氨酸对血管内皮功能的影响及通心络超微粉的干预作用. 中国应用生理学杂志, 2008, 24: 66-70.
[4] 李红蓉, 位庚, 孙颖, 等. 通络药物对血管内皮细胞与单核细胞黏附作用的影响. 中国循环杂志, 2016, 31: 480-483.
[5] Nishida M, Carley WW, Gerritsen ME, et al. Isolation and characterization of human and rat cardiac microvascular endothelial cells. Am J Physiol, 1993, 264: H639-652.
[6] Mei H, Campbell JM, Paddock CM, et al. Regulation of endothelial cell barrier function by antibody-driven affinity modulation of platelet endothelial cell adhesion molecule-1 (PECAM-1). J Biol Chem, 2014,289: 20836-20844.
[7] 曹娜, 葛力萁, 程明月, 等. 阿托伐他汀通过 SIRT1/NADPH 氧化酶对抗高糖诱导的人脐静脉内皮细胞的氧化损伤作用. 中国循环杂志, 2014, 29: 1000-1004.
[8] 庞洁, 梁俊清, 王志鑫, 等. 津力达联合通心络对高糖诱导胰岛微血管内皮细胞损伤干预作用及机制研究. 中国药理学通报, 2015,31: 430-435.
[9] 王生兰, 刘辉琦, 曹学锋, 等. 同型半胱氨酸促进大鼠血管平滑肌细胞增殖和表型转化. 中国病理生理杂志, 2010, 26: 1321-1324.
[10] Han S, Wu H, Li W, et al. Protective effects of genistein in homocysteine-induced endothelial cell inflammatory injury. Mol Cell Biochem, 2015, 403: 43-49.
[11] 吴以岭, 袁国强, 游佳华, 等. 通心络超微粉对高脂饮食兔主动脉内皮保护机制的实验研究. 中国病理生理杂志, 2007, 23: 629-633.
[12] Cui H, Li X, Li N, et al. Induction of autophagy by Tongxinluo through the MEK/ERK pathway protects human cardiac microvascular endothelial cells from hypoxia/reoxygenation injury. J Cardiovasc Pharmacol, 2014, 64: 180-190.
[13] 陈燕铭, 吴琳, 刘勇, 等. 通心络对同型半胱氨酸损伤的内皮细胞的基因表达谱的影响. 中国病理生理杂志, 2011, 27: 42-47.
[14] Stanger O, Weger M. Interactions of homocysteine, nitric oxide, folate and radicals in the progressively damaged endothelium. Clin Chem Lab Med, 2003, 41: 1444-1454.
[15] Ye N, Liu S, Lin Y, et al. Protective effects of intraperitoneal injection of TAT-SOD against focal cerebral ischemia/reperfusion injury in rats. Life Sci, 2011, 89: 868-874.
[16] Duryee MJ, Klassen LW, Schaffert CS, et al. Malondialdehydeacetaldehyde adduct is the dominant epitope after MDA modification of proteins in atherosclerosis. Free Radical Bio Med, 2010, 49: 1480-1486.
[17] Case J, Ingram DA, Haneline LS. Oxidative stress impairs endothelial progenitor cell function. Antioxid Redox Sign, 2008, 10: 1895-1907.
[18] Ingram DA, Krier TR, Mead LE, et al. Clonogenic endothelial progenitor cells are sensitive to oxidative stress. Stem Cells, 2007, 25: 297-304.
Effect of Tongxinluo on Homocysteine-induced Rat’s Cardiac Micro Vascular Endothelial Cell Injury and the Oxidative Stress Mechanism
WEI Geng, LIU Hong-li, LI Hong-rong, MA Liu-yi, YIN Yu-jie, YAO Bing, JIA Zhen-hua.
Graduate School of Hebei Medical University, Shijiazhuang (050017), Hebei, China
Corresponding Author: JIA Zhen-hua, Email: jiatcm@163.com
Tongxinluo; Cardiac micro vascular endothelial cells; Homocysteine; Endothelial function; Oxidative stress
2016-04-05 )
(编辑:许菁)
国家重点基础研究发展计划(973计划)(2012CB518606)
050017 河北省石家庄市,河北医科大学 研究生学院
位庚 主治医师 博士 主要从事心血管疾病的研究 Email:weigengtcm@163.com 通讯作者:贾振华 Email:jiatcm@163.com
R54
A
1000-3614(2016)09-0908-05 doi:10.3969/j.issn.1000-3614.2016.09.019

