复合成骨诱导剂对骨髓基质干细胞成骨分化的影响
甘升远,夏德林,肖 鸣,邵学垒,吴双江,张 磊
复合成骨诱导剂对骨髓基质干细胞成骨分化的影响
甘升远,夏德林,肖 鸣,邵学垒,吴双江,张 磊
(西南医科大学附属口腔医院口腔颌面外科四川 泸州646000)
目的:探讨复合成骨诱导剂对骨髓基质干细胞(Bone Marrow Stromal Stem Cells, BMSCs)成骨分化的影响。方法:选取2月龄SD雄性大鼠2只,处死后冲洗股骨,胫骨骨髓腔获得骨髓组织,采用贴壁培养法纯化大鼠BMSCs,并进行原代和传代培养。取第三代BMSCs,将细胞分A~G 7个组,A组为对照组:在不含任何诱导剂的培养基内培养;B组为常规诱导组:在仅含有诱导剂(10.0mmol/β-甘油酸钠,10-8mol/L地塞米松,50mg/L抗坏血酸)的培养基内培养;C,D,E,F,G组为复合诱导组,在含有复合诱导剂(常规诱导剂+阿仑膦酸钠)的培养基内培养,其中阿仑膦酸钠的浓度分别是10-6mol/L、10-7mol/L、10-8mol/L、10-9mol/L、10-10mol/L。观察细胞贴壁生长增殖及形态变化,western-blot法检测骨形态发生蛋白(BMP-2)的表达。结果:观察发现各组细胞贴壁生长良好,呈长梭形,细胞均存活,E组细胞体积变得肥大,长出多个胞浆突起呈多角形,细胞周围可见云雾状分泌物。A组中细胞呈长梭形增殖,形态未见明显变化,分泌物最少。各周各组western检测发现BMP-2表达量顺序均如下:10-8mol/L 组>10-7mol/L组>10-9mol/L组>10-6mol/L组>10-10mol/L组>常规诱导组>空白对照组。结论:阿仑膦酸钠在低浓度(10-8mol/L)时对骨髓基质干细胞成骨分化具有促进作用。
阿仑膦酸钠;骨髓基质干细胞;大鼠;成骨分化;
随着组织工程骨的发展为修复骨组织缺损提供了新方法,多因素诱导骨组织的发生,而基因强化的组织工程程序复杂,实施困难,因此需寻找复合成骨诱导剂诱导骨组织的发生。双膦酸盐可以降低骨组织吸收,形成并维持骨质的结构和矿化程度,调节骨更新[1]。阿仑膦酸钠属于第三代含氮二膦酸盐,是目前治疗骨质疏松症的常用药物之一,其主要机制是抑制破骨细胞的骨吸收功能[2]。骨髓基质干细胞是存在于骨髓基质中的一种非造血干细胞,易于扩增且具有多潜能分化能力。骨髓基质干细胞是最先且最早的骨组织工程种子细胞。骨形态发生蛋白(bone morphogenetic proteins, BMP)是BMSCs分泌的糖蛋白,可以促进骨的生长。目前BMP蛋白种类较多,其中比较具有代表性的是BMP-2,在BMSCs成骨分化的过程中能够自分泌BMP-2,因此本实验评估BMSCs的成骨分化是利用westernblot检测BMP-2的表达来实现的。阿仑膦酸钠对骨髓基质干细胞成骨分化是否具有作用尚不清楚。本实验通过不同浓度阿仑膦酸钠与传统成骨诱导剂共同作用骨髓基质干细胞,观察并探讨其对骨髓基质干细胞成骨分化的影响。
1 材料和方法
1.1实验动物及主要实验试剂和仪器:2月龄雄性SD大鼠2 只,体重100 g(由西南医科大学实验动物中心提供);FBS胎牛血清,L-DMEM低糖培养基(eHylone公司,美国);0.25% 胰蛋白酶,地塞米松,维生素C,β-甘油磷酸钠(Sigma 公司,美国);阿仑膦酸钠(杭州默沙东制药有限公司);青霉素-链霉素溶液、Hank’s液(碧云天生物科技有限公司); Na2HPO3·12H2O、 NaH2PO3·2H2O(上海国药);倒置相差显微镜XSJ-D型(日本OLYMPUS光学仪器有限公司);蛋白电泳仪(创博环球生物科技有限公司);流式细胞仪(美国贝克曼公司)。
1.2BMSCs的采集、分离、培养和鉴定:取2月龄雄性SD大鼠2只,体重100g经脱颈处死后,予以75%酒精浸泡消毒10min;无菌操作下分离大鼠股骨、胫骨,去除双侧干骺端,以含有肝素的DMEM 5ml充分冲洗髓腔3次,冲洗液1 000r/min离心10min。取膜状的有核细胞层(BMSCs层即包含在该层中)接种于培养瓶(含DMEM培养液,10%入胎牛血清)中培养,换液去除悬浮细胞。14d后贴壁细胞达约80%融合,即得到原代培养细胞。以0.25%胰蛋白酶消化,传代培养,每2d换液一次并在倒置相差显微镜下观察BMSCs形态生长变化。取活力旺盛的细胞,制备细胞悬液,调整细胞浓度为1×107/L。取细胞悬液2 000r/min离心10min,弃上清,分别加入抗CD44、CD45,混匀后室温孵育30min,经PBS洗涤离心2次后,加入FITC标记的二抗避光反应15min,流式细胞仪检测细胞CD44、CD45的表达情况[3-4]。
1.3不同浓度阿伦膦酸钠的成骨诱导:取融合至80%第3代大鼠BMSCs,以0.25%胰蛋白酶消化离心后重悬,调整细胞密度至2×105/ml,接种于3块 96孔板中,选取其中91孔分为七组(A~G)接种培养,接种细胞混悬液100μl。待细胞贴壁后向B、C、D、E、F、G组加入常规诱导剂,含有浓度为10-8mol/L地塞米松, 10mmol/L,β-甘油酸钠,50mg/L抗坏血酸;A组不加入任何诱导剂,再往C、D、E、F、G组中加入不同浓度阿仑膦酸钠溶液,从C-G组中分别为10-6mol/L、10-7mol/L、10-8mol/L、10-9mol/L、10-10mol/L。将3个96孔板分别标记为1,2,3板。1板培养7d,2板培养14d,3板培养21d。培养期间每2d换液一次。
1.4western-blot检测BMP-2的表达:将每组细胞收集,加入PBS溶液清洗,加入细胞裂解液裂解细胞,离心提取上清液蛋白。每个样品槽内加入5×SDS上样缓冲液及等体积蛋白样品,然后接通电源进行电泳。通过电转印法将凝胶转移至硝酸纤维素膜上。将转印后的膜脱色置于一抗液面上室温下孵育2h,再次脱色后将膜置于SuperSignal化学发光试剂中进行化学发光反应1h。使用Phoretix 1D软件进行灰度值分析。
1.5统计学分析:采用SPSS 17.0软件计算实验数据,实验所有参数均以x¯±s表示。采用t检验,以P<0.05表示差异有显著性意义。
2 结果
2.1BMSCs培养结果:原代培养的细胞在48~72h后,细胞贴壁,胞体圆形或多边形。培养4d后,细胞体积增大,胞体呈梭形,伴长突起,胞核大,扁圆形(图1)。在7d左右,细胞相互融合,成片生长。细胞达80%贴壁融合时胰酶消化传代。传代后细胞形态更均匀,呈长梭形(图2)。流式细胞仪检测结果显示,培养的细胞CD44表达阳性,而CD45表达呈阴性(图3、4),表示培养的细胞是BMSCs。
2.2BMP-2的表达:使用Phoretix 1D软件进行灰度值分析各组组中BMP-2均有表达,在第7天时各组BMP-2出现表达量出现明显差异(图5);第14天表达量差异较第7天更加明显(图6);第21天时表达差异达到最高(图7)。各周各组western检测发现BMP-2表达量顺序均如下:10-8mol/L组>10-7mol/L组>10-9mol/L组>10-6mol/L组>10-10mol/L组>常规诱导组>空白对照组。常规诱导剂与其他浓度阿仑膦酸钠共同作用时BMP-2表达量均不及10-8mol/L组。B组单一使用常规诱导剂其BMP-2表达量较C、D、E、F、G组最低。实验组与对照相比,其表达存在明显差异(P<0.05),具有统计学意义。用Phoretix 1D软件读取各条带灰度值,比值及标准差如表1所示。

图1 原代骨髓基质干细胞(倒置相差显微镜下拍摄,×200)

图2 第3代骨髓基质干细胞(倒置相差显微镜下拍摄,×200)

图3 CD44表达结果

图4 CD45表达结果

图5 第7天Western-blot图

图7 第21天Western-blot图
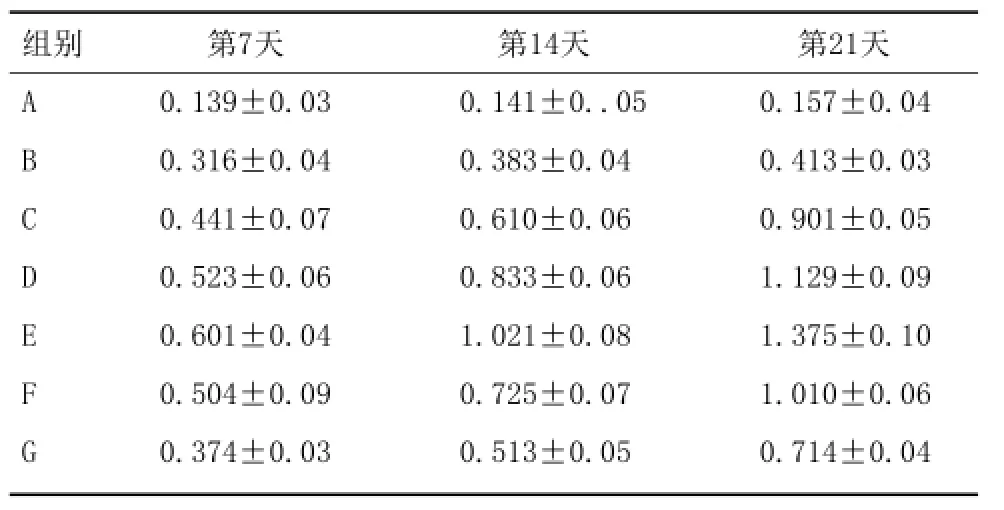
表1 各组第7、14、21天Western-blot检测BMP-2的蛋白表达
3 讨论
BMSCs是骨髓基质中的多能干细胞,经体外诱导培养可以成骨,成纤维,成软骨,成脂肪,成肌肉等细胞方向分化[5]。骨髓基质干细胞中加入成骨诱导剂可以明显诱导其成骨分化[6]。诱导BMSCs向成骨细胞转化需要特定的外界环境,经典成骨诱导剂(地塞米松,甘油酸钠,维生素C)作用温和,成本较低,能增强碱性磷酸酶活性,诱导细胞产生骨钙素,从而诱导BMSCs向成骨细胞向分化。由于经典的成骨诱导剂诱导效率较低不能满足临床构建大块组织工程骨的需要[7-8]。如何提高BMSCs成骨分化的能力,满足构建大块骨组织工程骨解决临床治疗所需,是目前骨组织工程研究的难点之一。
双膦酸盐作为治疗骨质疏松的首选药物,减少骨吸收改建治疗骨质疏松症。阿仑膦酸钠第三代双膦酸盐典型代表,能抑制破骨细胞生长,促进使其发生程序性细胞凋亡,同时还能促进成骨细胞的增殖和成熟,从而抑制骨的吸收,维持骨质密度。如Mathov阿仑膦酸盐诱导了大鼠颅盖骨源性成骨细胞的增殖[9]促进人松质骨成骨细胞数的增加,增强碱性磷酸酶(alkaline phosphataseALP)活性及BMP-2、I型胶原和骨钙素的表达。Fu LJ等研究表明阿仑膦酸钠不仅可诱导BMSCs成骨向分化还抑制BMSCs的成脂向分化[10]。董群伟等[11]研究不同浓度阿仑膦酸钠对BMSCs成骨向分化能力的影响,发现10-8mol/L阿仑膦酸钠组增殖速度(0.366±0.012)明显大于对照组(0.184±0.031)。因此,一定浓度的阿仑膦酸钠可作为一种成骨诱导剂来促进BMSCs向成骨细胞分化。
本实验将不同浓度的阿仑膦酸钠与成骨诱导剂(10-8mol/L地塞米松,10.0mmol/β-甘油酸钠,50mg/L维生素C)混合后加入培养基共同培养BMSCs,与单一的经典诱导剂进行比较,并观察阿仑膦酸钠诱导BMSCs成骨分化的作用。采用贴壁法结合密度梯度离心法分离培养BMSCs,经检测细胞CD44、CD45的表达,成功分离纯化传代BMSCs,同时不影响细胞的干细胞特性。实验结果显示:第7天时成骨诱导培养所有组中BMP-2均有不同程度的表达,在第14天表达量的差异明显;21d时差异达到最高。10-8mol/LALN+常规诱导剂共同作用于BMSCs时BMP-2的表达水平最高。其他浓度ALN+常规诱导剂组表达明显减弱,但是混合后对BMSCs的诱导作用也明显高于空白对照组的诱导作用。无任何诱导剂组,其表达剂量最低。表明阿仑膦酸钠和常规骨诱导剂能促进BMSCs向成骨细胞转化,提高转化效率,且阿仑膦酸钠在10-8mol/L浓度的时与常规诱导剂诱导BMSCs成骨转化作用最强。
综上所述,本实验研究表明复合骨诱导剂能促进BMSCs向成骨细胞的转化,提高转化效率。通过改良种子细胞为构建大块骨组织功提供一种新的方法。
[1]Fermtfi G,Fabi A,Carlini P,et al. Zoledronic acid-induced circulating level modifications of angiogenic fact,metalloproteises and proinflammatory cytokines in metastatic breast cancer patients[J]. Oncology,2005,69(1):35-43.
[2]Allen MR. The effects of bisphosphonates on jaw bone remodeling,tissue properties,and extraction healing[J].Odontology,2011,99(1): 8-17.
[3]夏德林,刘道华,贾娟,等.兔骨髓基质干细胞体外分离培养及生物学特性研究[J].中国美容医学,2011,20(8):1251-1254.
[4]夏德林,黄铭柯,付光新,等.Triton X-100对脂质体介导的BMP-2基因转染大鼠BMSCs的作用[J].中国修复重建外科杂志,2015,29(1):69-73.
[5]Saito F,Nakatani T,Iwase M,et al. Administration of cul-tured autologous bone marrow stromal cells into cereb-rospinal fluid in spinal injury patients: a pilot study[J].Restor Neurol Neurosci,2012,30(2): 127-136.
[6]Muschler GF,Raut VP.The Design and Use of Animal Models for Translational Research in Bone Tissue Engineering and Regenerative Medicine[J].Tissue Engineering Part B Rev,2010,16(1):123-145.
[7]王艳双.大鼠骨髓基质干细胞分离培养及向成骨、成脂诱导分化的研究[J].北华大学学报(自然科学版),2015,16(6):748-752.
[8]魏强强,殷嫦嫦,殷明,等.GDF-5联合地塞米松诱导大鼠BMSCs向类髓核样细胞分化[J].基础医学与临床,2014,34(8):1037-1043.
[9]Mathov I,Plotkin LI,Sgarlata CL,et al.Extracellular signal-regulated kinases and calcium channels are involved in the proliferative effect of bisphosphonates on osteoblastic cells in vitro[J].J Bone Miner Res,2001,16(11):2050-2056.
[10]Fu LJ,Tang TT,Miao YY.Stimulation of osteogenic differentiation and inhibition of adipogenic differentiation in bone marrow stromalcells by alendronate via ERK and JNK activation[J]. Bone,2008,43(1) :40-47.
[11]董群伟,孙奋勇,洪曼杰,等.阿仑膦酸钠对体外培养的间充质干细胞成骨能力的影响[J].广东医学,2006,4(27): 462-464.
编辑/张惠娟
编辑部版权页声明
本刊已许可中国学术期刊(光盘版)电子杂志社在中国知网及其系列数据库产品中以数字化方式复制、汇编、发行、信息网络传播本刊全文。该社著作权使用费与本刊稿酬一并支付。作者向本刊提交文章发表的行为即视为同意我社上述声明。
本刊编辑部
Experimental study on composite osteogenic inducer promoted rat bone marrow stromal cells to differentiate into osteoblast in vitro
GAN Sheng-yuan, XIA De-lin, XIAO Ming, SHAO Xue-lei,WU Shuang-jiang, ZHANG Lei
(Department of Oral and Maxillofacial Surgery, Affiliated Stomatological Hospital, Southwest Medical University, Luzhou 646000, Sichuan,China)
ObjectiveTo investigate the effect of compound osteogenic inducer on ost-eogenic differentiation of bone marrow stromal cells.MethodsThe BMSCs were isolated by gradient centrifugation with adherent culture from Sprague Dawley rats of two months old. The third generation of bone marrow stromal stem cells with 1×108/L concentration was divided into seven groups with A to G. The group A was blank group, which cultured in L-DMEM with 10% FBS. The group B was Conventional induction group, which cultured in L-DMEM with 10-8mol/L dexamethasone, 10.0 mmol/l β- glycerin, sodium and 50mg / L ascorbic acid. The group C to G was Compound induced group which cultured the cultured in the same concentration osteoblast-induced fluid the same as group B. Then the group C to G was separately added with 10-6mol/L,10-7mol/L,10-8mol/L,10-9mol/L,10-10mol/ L ALN. Changes of proliferation and morphology of cells were observed under inverted microscope. The expression of the BMP-2 was tested by western-blot. The test was used for statistical analysis.ResultsThe cells of every group were survived and live well. The cells become hypertrophy, multi angle, and the high secretory activity in the E group than other groups. The number of cells in the A group change at least, the lowest secreti-on obviously. The order of the result of the expression of BMP-2 was 10-8mol/L group>10-7mol/L group>10-9mol/L group>10-6mol/L group>10-10mol/L group>Conventional induction group>blank group.ConclusionAllen alendronate at low concentration (10-8mol/L) can promote osteogenic differentiation on bone marrow stromal cells.
alendronate; bone marrow stromal cells;rat; osteogenetic differentiation
Q813.1
A
1008-6455(2016)09-0074-04
2016-05-27
2016-08-29
夏德林,男,四川泸州人,西南医科大学附属口腔医院颌面外科主任,硕士研究生导师,教授,主要从事颅颌面畸形整复与重建,颌面部肿瘤治疗;E-mail:xiadeln@163.com
甘升远,男,四川省宜宾市人,西南医科大学口腔颌面外科在读硕士;E-mail:414737415@qq.com

