注射用磷酸肌酸钠和氯化钾注射液与不同输液配伍的稳定性研究
高声传,沈 丽,何一闻,刘美彤
注射用磷酸肌酸钠和氯化钾注射液与不同输液配伍的稳定性研究
高声传*,沈丽,何一闻,刘美彤
目的为注射用磷酸肌酸钠和氯化钾注射液联合用药选择合适的溶媒,考察其稳定性,为临床用药提供科学依据。方法0.9%氯化钠注射液、5%葡萄糖、10%葡萄糖和葡萄糖氯化钠注射液作为对照组,测定溶液的pH值和不溶性微粒数,采用高效液相色谱法测定溶液中磷酸肌酸钠的含量。参照临床常用剂量,注射用磷酸肌酸钠和氯化钾注射液溶于0.9%氯化钠注射液、5%葡萄糖、10%葡萄糖和葡萄糖氯化钠注射液为实验组,分别于0、0.5、1、2、4、8 h观察溶液的澄明度,按《中国药典》2010版附录ⅨC光阻法测定≥10 μm和≥25 μm的不溶性微粒数和pH值。结果0.9%氯化钠注射液、5%葡萄糖、10%葡萄糖和葡萄糖氯化钠注射液符合《中国药典》2010版规定。加入到0.9%氯化钠注射液和葡萄糖氯化钠注射液后澄明度合格,磷酸肌酸钠的含量、pH值和不溶性微粒符合规定。在5%葡萄糖注射液和10%葡萄糖注射液中澄明度符合要求,pH值偏高,微粒数超出规定范围。结论注射用磷酸肌酸钠和氯化钾注射液联合使用可选用0.9%氯化钠注射液和葡萄糖氯化钠注射液为溶媒。
注射用磷酸肌酸钠;氯化钾注射液;配伍;稳定性
0 引言
磷酸肌酸是参与细胞能量代谢的重要物质之一,是人体内源性活性物质,在肌肉收缩的能量代谢中发挥重要作用[1],它是心肌和骨骼肌的化学能量储备,用于ATP的再合成。临床广泛用于心脏缺血情况下的代谢异常或减轻患者心脏手术造成的心肌损伤,以及心力衰竭、心肌梗死和心绞痛等疾病的治疗[2-4]。氯化钾注射液属于调节水、盐、电解质平衡及酸碱平衡类药物,主要用于治疗各种原因引起的低血钾症状。有研究表明,磷酸肌酸作为有效的心肌保护液成分,在重症瓣膜手术前与心肌极化液(10%葡萄糖注射液,氯化钾注射液,胰岛素)联合使用时,能显著增强其心肌保护作用[5],临床上经常将注射用磷酸肌酸钠和氯化钾注射液溶于同一输液中联合应用。在临床应用过程中,输液反应时有发生[6]。为了探讨输液反应发生的原因,本研究对注射用磷酸肌酸钠和氯化钾在不同溶媒中的稳定性进行考察,以探索输液反应发生的原因及与注射用磷酸肌酸钠和氯化钾注射液最合适的配伍溶媒,为临床安全合理地应用提供科学依据。
1 仪器与材料
1.1材料注射用磷酸肌酸钠(海口奇力制药股份有限公司,规格:1.0 g,批号:20150101);氯化钾注射液(杭州民生药业有限公司,规格:10 mL∶1 g,批号:1410183);10%葡萄糖注射液(上海百特医疗用品有限公司华仁药业股份有限公司,规格:500 mL∶50 g,批号:S1411039);0.9%氯化钠注射液(上海百特医疗用品有限公司华仁药业股份有限公司,规格:250 mL∶2.25 g,批号:S1412026);5%葡萄糖注射液(上海百特医疗用品有限公司华仁药业股份有限公司,规格:250 mL∶12.5 g,批号:S1411035);10%葡萄糖注射液(上海百特医疗用品有限公司华仁药业股份有限公司,规格:250 mL∶25 g,批号:S1411088);葡萄糖氯化钠注射液(上海百特医疗用品有限公司华仁药业股份有限公司,规格:500 mL葡萄糖25 g与氯化钠4.5 g,批号:S1501010);灭菌注射用水(石家庄四药有限公司,规格:500 mL,批号:1501093203);25 μm乳胶微粒粒度标准物质(北京海岸鸿蒙标准物质技术有限公司,样品批号:20122506);10 μm乳胶微粒粒度标准物质(北京海岸鸿蒙标准物质技术有限公司,样品批号:20131002)。磷酸肌酸钠标准品(中国食品药品检定研究院,批号:100875-200901);四丁基氢氧化铵(天津希思思生物科技有限公司,批号:T-21511);一次性使用溶药注射器(山东新华安得医疗用品有限公司,规格:16×32测孔20 mL,批号:150407)。
1.2仪器Waters 717高效液相色谱仪,2996检测器,600型输液泵,KQ3200型超声波清洗器(昆山市超声仪器有限公司);Sartorius PB-10 pH计(上海摩速科学器材有限公司);GWJ-4微粒测定仪(天津天大);YB-Ⅱ型澄明度监测仪(天津富兰斯电子科贸有限公司)。
2 实验方法
2.1实验用注射液的制备按照临床用药的剂量,注射用磷酸肌酸钠2.0 g[7],由经过培训的专业技术人员在局部百级的洁净环境中进行液体配制。用一次性使用溶药注射器抽取相应溶媒适量注入西林瓶内,必要时可轻轻摇动助溶,全部溶解混匀后,用同一注射器抽出药液,注入输液袋内,轻轻摇匀,分别注入250 mL生理盐水、250 mL 5%葡萄糖、250 mL 10%葡萄糖、250 mL葡萄糖氯化钠中,抽取氯化钾注射液7.5 mL,分别注入上述溶媒中,贴好标签备用。对照溶液的制备:用溶药针抽取注射用磷酸肌酸钠2.0 g,用注射用灭菌用水溶解后,贴好标签备用。
2.2微粒测定按《中国药典》2010版附录ⅨC不溶性微粒检查法的光阻法[8],取检测专用杯,用待测样液冲洗检测杯壁、搅拌转子2~3次;取待测样50 mL注入检测杯内,置检测室内,静置10 s左右脱气,进行测定。
2.3磷酸肌酸钠含量测定:
2.3.1色谱条件色谱柱:Hypersil Gold aQ(250 mm×4.8 mm,5 μm);灵敏度:0.01 AUFS;柱温:室温;检测波长:215 nm;流速:1.0 mL/min;进样量:20 μL;流动相:0.2%磷酸盐缓冲液(pH 3.00),含0.5%四丁基氢氧化铵。用外标法计算样品的百分含量。
2.3.2标准曲线绘制精密称取磷酸肌酸钠80 mg至50 mL容量瓶,用灭菌注射用水定容,制成1.6 mg/mL的对照品溶液;再将该溶液移出5 mL至10 mL容量瓶,定容,稀释成0.8 mg/mL的对照品溶液;同样方法分别稀释上一步所得的对照品溶液,制成浓度分别为0.4、0.2、0.1 mg/mL的对照品溶液。按“2.1”项下方法测定,得到峰面积(y)与浓度(x)的回归方程:y=10 351 034.879 0 x+264 825.375 0(R2=0.999 6),表明磷酸肌酸钠在0.1~1.6 mg/mL线性范围内浓度与峰面积呈良好的线性关系。
2.3.3精密度实验分别用4种输液精密配制磷酸肌酸钠溶液1.6、0.8、0.1 mg/mL高、中、低3种浓度,分别于1 d和5 d内进样5次,测得日内、日间RSD(%)值,结果见表1。
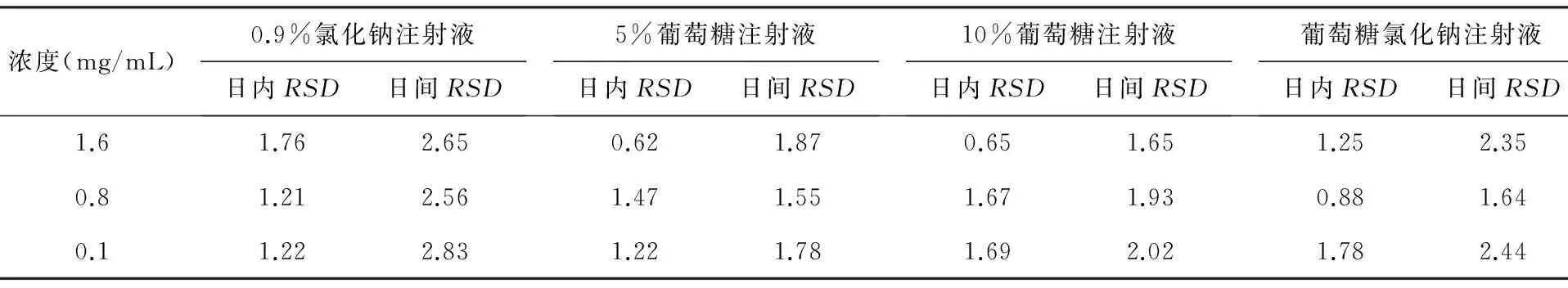
表1 精密度实验结果(n=5)
2.3.4回收率实验分别用4种输液精密配制磷酸肌酸钠溶液1.6、0.8、0.1 mg/mL高、中、低3种浓度,各配5份,按含量测定方法测定磷酸肌酸钠的含量。实验结果表明,在0.9%氯化钠注射液中
的回收率分别为101.13%±0.38%、99.22%±0.52%、98.70%±1.88%,在5%葡萄糖注射液中的回收率分别为101.62%±0.74%、98.50%±0.47%、98.44%±1.12%,在10%葡萄糖注射液中的回收率分别为99.25%±1.28%、98.23%±0.87%、97.65%±1.52%,在葡萄糖氯化钠注射液中的回收率分别为98.62%±1.56%、99.37%±0.84%、98.26%±1.27%。
2.3.5含量测定模拟临床用药浓度,精密称取200 mg磷酸肌酸钠4份,用上述4种输液溶解,分别置于25 mL量瓶中,抽取氯化钾注射液0.75 mL,分别注入上述溶媒中,分别用4种输液稀释至刻度,得浓度为8 mg/mL的临床常用浓度,分别于0、0.5、1、2、4、8 h再将该溶液移出1 mL至10 mL容量瓶,定容,稀释成0.8 mg/mL的供试溶液,进样20 μL测定。将峰面积代入回归方程,计算各时间点的样品溶液中药物的含量。
2.4pH值测定将上述配好的溶液抽取30 mL,置于空白烧杯中,贴好标签,分别于0、0.5、1、2、4、8 h用pH计测定pH值,并记录结果。
2.5澄明度检测按照不同的放置时间,在澄明度监测仪观察溶液的澄明度。
2.6结果判定2010版药典规定:标示量为100 mL或100 mL以上的静脉用注射液,除另有规定外,每1 mL中含10 μm以上的微粒不得过25粒,含25 μm以上的微粒不得过3粒[8]。含量测定,pH值和溶液的澄明度应符合规定。
3 实验结果
3.1实验分组实验分为对照组和实验组,对照组为0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液和葡萄糖氯化钠注射液,实验组为注射用磷酸肌酸钠和氯化钾注射液溶解于上述溶媒后的溶液,以确定注射用磷酸肌酸钠和氯化钾注射液在不同溶媒中澄明度、pH值和不溶性微粒的变化。对照组溶液测定结果见表2。
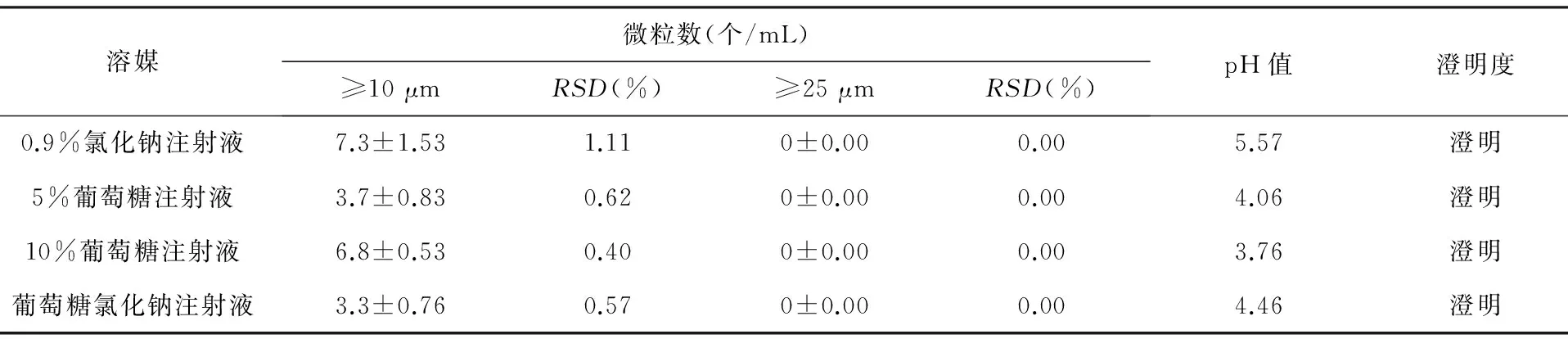
表2 对照组溶液测定结果(n=3)
由表2可以看出,对照组中0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液和葡萄糖氯化钠注射液的微粒数、pH值和澄明度均符合《中国药典》2010版规定。即所有对照组溶液检验合格。
3.2磷酸肌酸钠对照品及供试品溶液色谱图在“2.3.1”项色谱条件下,磷酸肌酸钠在0.9%氯化钠注射液中保留时间为10.35 min,在5%葡萄糖注射液中的保留时间为10.47 min,在10%葡萄糖注射液中的保留时间为10.46 min,在葡萄糖氯化钠注射液中的保留时间为10.32 min。如图1所示。磷酸肌酸钠在4种输液中比较稳定,其中在10%葡萄糖注射液中含量略有变化。
3.3注射用磷酸肌酸钠和氯化钾注射液加入到0.9%氯化钠注射液250 mL中后,不同时间点溶液的变化情况见表3。
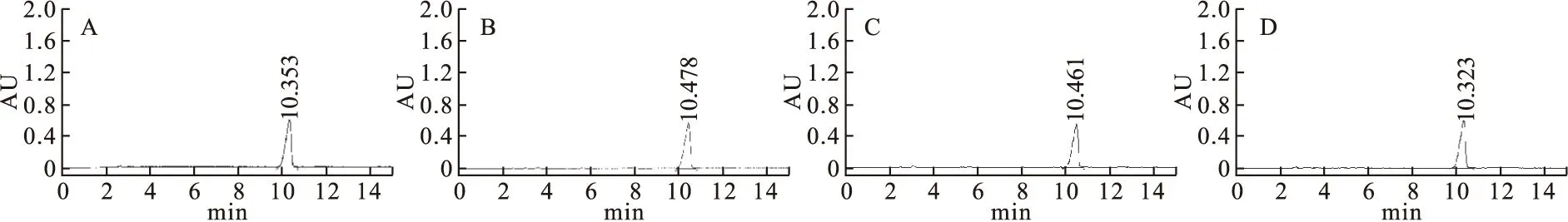
图1 磷酸肌酸钠溶液色谱图

时间(h)微粒数(个/mL)≥10μmRSD(%)≥25μmRSD(%)含量(%)pH值澄明度024.3±1.330.970.0±0.00.00100.007.43澄明0.523.4±3.672.660.0±0.00.0098.747.40澄明120.0±8.146.260.0±0.00.0098.237.34澄明223.9±2.141.550.0±0.00.0098.657.25澄明423.3±0.950.710.1±0.230.1798.147.19澄明813.1±1.010.710.0±0.00.0098.407.22澄明平均值21.3±2.870.01±0.03
由表3可以看出,注射用磷酸肌酸钠和氯化钾注射液加入到0.9%氯化钠注射液后,磷酸肌酸钠含量变化不大。pH值在7.19~7.43之间,≥10 μm的微粒数为21.3,8 h时微粒数最少,≥25 μm的微粒数为0.01,溶液澄明,符合《中国药典》2010版的规定。
3.4注射用磷酸肌酸钠和氯化钾注射液加入到5%葡萄糖注射液250 mL中后,不同时间点溶液的变化情况见表4。
由表4可以看出,注射用磷酸肌酸钠和氯化钾注射液加入到5%葡萄糖注射液中后,磷酸肌酸钠含量变化不大。pH值升高,在6.98~7.10之间,≥10 μm的微粒数在0 h为17.3,随着时间延长,微粒数显著增加,超过了《中国药典》2010版的规定,8 h时微粒数最少为6.5。≥25 μm的微粒数为0.2,溶液澄明,符合《中国药典》2010版的规定。
3.5注射用磷酸肌酸钠和氯化钾注射液加入到10%葡萄糖注射液250 mL中后,不同时间点溶液的变化情况见表5。
由表5可以看出,注射用磷酸肌酸钠和氯化钾注射液加入到10%葡萄糖注射液中后,磷酸肌酸钠含量变化不大。pH值升高,在6.68~6.80之间,≥10 μm的微粒数基本合格,1 h时微粒数41.3,超过了《中国药典》2010版的规定,其他时间点符合规定,平均值为17.1。≥25 μm的微粒数为0.1,溶液澄明,符合《中国药典》2010版的规定。
3.6注射用磷酸肌酸钠和氯化钾注射液加入到葡萄糖氯化钠注射液250 mL中后,不同时间点溶液的变化情况见表6。
由表6可以看出,注射用磷酸肌酸钠和氯化钾注射液加入到葡萄糖氯化钠注射液中后,磷酸肌酸钠含量变化不大。pH值升高,在6.98~7.19之间,≥10 μm的微粒数合格,0.5~2 h之间微粒数最少,符合《中国药典》2010版的规定,其他时间点符合规定,平均值为17.1。≥25 μm的微粒数为0,溶液澄明,符合《中国药典》2010版的规定。

表4 注射用磷酸肌酸钠和氯化钾注射液在5%葡萄糖注射液中不同时间的变化(n=3)
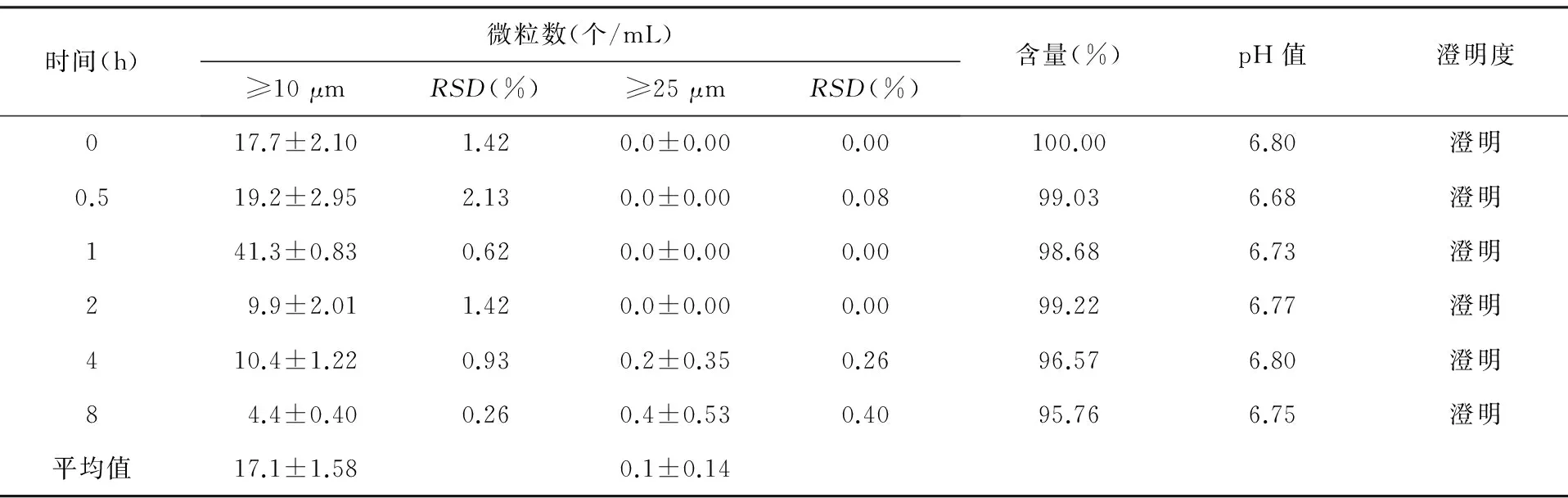
表5 注射用磷酸肌酸钠和氯化钾注射液在10%葡萄糖注射液中不同时间的变化(n=3)

表6 注射用磷酸肌酸钠和氯化钾注射液在葡萄糖氯化钠注射液中不同时间的变化(n=3)
实验所用空白溶媒均符合《中国药典》2010版的规定。注射用磷酸肌酸钠和氯化钾注射液加入到0.9%氯化钠注射液和葡萄糖氯化钠注射液后澄明度合格,磷酸肌酸钠含量变化不大,pH值和不溶性微粒符合规定。在5%葡萄糖注射液和10%葡萄糖注射液中澄明度符合要求,磷酸肌酸钠含量略有变化,pH值偏高,微粒数不符合中国药典2010版规定,因此,不建议注射用磷酸肌酸钠和氯化钾注射液使用5%葡萄糖注射液和10%葡萄糖注射液作为溶媒。
4 讨论
4.1注射用磷酸肌酸钠和氯化钾注射液与含电解质的溶媒相容性注射用磷酸肌酸钠的主要成分为磷酸肌酸二钠盐四水合物,含有酸基和Na+[9],氯化钾为Cl-和K+,同物质微粒间的Van der Waals力相互吸引,而介质的存在能减弱吸引作用,介质与微粒性质越接近,微粒间的相互吸引就越弱[10]。因此,注射用磷酸肌酸钠和氯化钾注射液与含电解质的溶媒相容性较好,在0.9%氯化钠注射液和葡萄糖氯化钠两种溶媒中比较稳定,产生的不溶性微粒少,而在5%葡萄糖注射液和10%葡萄糖注射液这两种溶媒中不稳定,微粒较多,超过《中国药典》2010版附录ⅨC不溶性微粒数的规定。
4.2不溶性微粒的聚集由于微粒的Brown运动,粒子的移动,会使某个时间点测得的微粒数值有所波动,也会使同一时间点测得的3组数据具有差异。放置的时间过长,微粒聚集,导致微粒数量的较大改变,甚至可能出现倍增现象[11]。
4.3pH值的影响注射用磷酸肌酸钠和氯化钾注射液加入到5%葡萄糖注射液和10%葡萄糖注射液中后,溶液的pH值升高,葡萄糖的物理化学性质改变,不溶性微粒增多,值得临床注意,磷酸肌酸钠含量略有变化[12]。
4.4注意事项注射用磷酸肌酸钠说明书中未限定溶媒种类,氯化钾注射液一般加入到5%葡萄糖注射液中,二药合用,建议选用0.9%氯化钠注射液和葡萄糖氯化钠注射液作为溶媒,同时减慢输液速度。
[1]郭超,王晶哲,姜晶.磷酸肌酸钠药学研究浅析[J].中国医药科学,2014,4(17):139-141.
[2]连立,黄婵娟,韩华成,等.磷酸肌酸钠对心血管疾病的临床疗效[J].药物与临床,2012,19(2):48-49.
[3]Chen GH,Guo JH,Xuan H,et al.Role of creatine phosphate as a myoprotective agent during coronary artery bypass graft in elderly patients[J].Coron Artery Dis,2013,24(1):48-53.
[4]Deng KW,Shi XB,Zhao YX,et al.The effect of exogenous creatine phosphate on myocardial injury after percutaneous coronary intervention[J].Angiology,2015,66(2):163-168.
[5]石开虎,龚文辉,张飞,等.重症瓣膜病手术前应用含磷酸肌酸心肌极化液的作用[J].中国基层医药,2011,18(18):2451-2452.
[6]何燕,周继春,徐晓月.注射用磷酸肌酸钠的安全性评价[J].中国医院药学杂志,2011,31(22):1871-1874.
[7]陈丽,何燕青.磷酸肌酸钠治疗慢性肺源性心脏病合并心力衰竭60例疗效观察[J].现代诊断与治疗,2013,24(8):1777-1778.
[8]国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010:附录71.
[9]米成根,唐雪梅,刘俊强,等.磷酸肌酸钠的合成[J].中国医药工业杂志,2013,44(8):741-743.
[10]李三鸣.物理化学[M].第7版.北京:人民卫生出版社,2011:336-337.
[11]汤韧,张宜,傅立波,等.注射剂配伍后不同粒径不溶性微粒的倍增现象[J].中国医院药学杂志,1999,19(11):663-666.
[12]张宁,范青,范广俊,等.磷酸肌酸钠在不同输液中的稳定性[J].中国药师,2007,10(1):78-80.
Research on the stability of creatine phosphate sodium for injection and potassium chloride injection combined with different transfusions
GAO Sheng-chuan*,SHEN Li,HE Yi-wen,LIU Mei-tong
(Department of Pharmaceutics,General Hospital of Shenyang Military Region,Shenyang 110016,China)
ObjectiveTo explore the stability of creatine phosphate sodium for injection and potassium chloride injection combined with different transfusions and to provide an evidence for clinical application.MethodsThe 0.9% sodium chloride injection,5% glucose injection,10% glucose injection and glucose chloride sodium injection were control group,the pH value and the particles number of the solution were detected,and the content of sodium phosphocreatine was determined by HPLC method.According to the commonly-used clinical dosage,the creatine phosphate sodium for injection and potassium chloride injection combined with 0.9% sodium chloride injection,5% glucose injection,10% glucose injection and glucose chloride sodium injection were experimental group.The compatibility solution clarity was detected at 0,0.5,1,2,4,8 h,and the particles number which was ≥10 μm and ≥25 μm and the pH value were detected by light blockage method specified in China Pharmacopedia (2010 edition ⅨC).ResultsThe 0.9% sodium chloride injection,5% glucose injection,10% glucose injection and glucose chloride sodium injection conformed to the 2010 edition of Chinese Pharmacopoedia standards.When combining the creatine phosphate sodium for injection and potassium chloride injection with 0.9% sodium chloride injection and glucose chloride sodium injection,the clarity had no obvious change,the content of sodium phosphocreatine and pH value remained stable.The number of particles conformed to the 2010 edition of Chinese Pharmacopoedia standards.In the 5% glucose injection and 10% glucose injection,the clarity had no obvious change,the pH value increased.The number of particles was beyond the requirements of Chinese Pharmacopoedia standards.ConclusionThe 0.9% sodium chloride injection and glucose sodium chloride injection can be used as the solvent of creatine phosphate sodium for injection and potassium chloride injection.
Creatine phosphate sodium for injection;Potassium chloride injection;Compatibility;Stability
2016-01-11
沈阳军区总医院药剂科,沈阳 110016
10.14053/j.cnki.ppcr.201609028

