腹腔注射西地那非对噪声性聋豚鼠听功能的保护作用及其机制
梁媛,张淑君,马桂琴,尹桂茹,陆鸿略,刘春丽
(承德医学院附属医院, 河北承德 067000)
腹腔注射西地那非对噪声性聋豚鼠听功能的保护作用及其机制
梁媛,张淑君,马桂琴,尹桂茹,陆鸿略,刘春丽
(承德医学院附属医院, 河北承德 067000)
目的探讨5-磷酸二酯酶(PDE5)抑制剂对噪声性聋豚鼠听功能的保护作用及其机制。方法 将豚鼠按随机数字表法分为对照组、噪声暴露组和治疗组,每组15只。治疗组及噪声暴露组豚鼠在白噪声暴露1周后分别腹腔注射西地那非10 mg/(kg·d)及生理盐水4 mL/(kg·d),连续给药4周。分别测试噪声暴露前1天、噪声暴露后1、2及4周Ⅰ波潜伏期和听性脑干反应(ABR)阈值,并通过扫描电镜观察噪声暴露后4周豚鼠耳蜗毛细胞的形态变化。 结果 与对照组比较,噪声暴露组和治疗组豚鼠体质量在噪声暴露后,给药1、2、4周后均降低(P均<0.05);噪声暴露组比治疗组给药1、2、4周后体质量降低,两组比较,P均<0.05。治疗组豚鼠噪声暴露后,给药1、2、4周后较噪声暴露前其Ⅰ波潜伏期及ABR阈值均呈下降趋势,噪声暴露组豚鼠给药1周后较噪声暴露前和噪声暴露后呈升高趋势,但在给药2、4周后较给药1周后呈明显下降趋势;与对照组比较,噪声暴露组及治疗组在噪声暴露后的各时间ABR阈值升高,Ⅰ波潜伏期延长(P均<0.05);给药后各时间,治疗组与噪声暴露组比较,P均<0.05。扫描电镜显示,噪声暴露组豚鼠耳蜗内、外毛细胞均出现听毛紊乱、融合及缺失;而治疗组耳蜗病变较轻,听毛仅有轻微倒伏、融合现象。结论 腹腔注射PDE5抑制剂西地那非能够减轻噪声性聋豚鼠的听功能损害,可能与其降低ABR阈值,缩短噪声引起的Ⅰ波潜伏期有关。
噪声性耳聋;5-磷酸二酯酶抑制剂;耳蜗;毛细胞;听功能;豚鼠
噪声性耳聋(NHIL)是由噪声引起的一种感音神经性聋,噪声污染已被认为是世界七大公害之首。虽然许多扩血管药物因其能提高内耳血流量和改善血管痉挛而被用于噪声性听力损伤的治疗[1],但迄今尚无理想的治疗方法。5-磷酸二酯酶(PDE5)抑制剂通过增强NO/环磷酸鸟苷(cGMP)途径,升高cGMP水平,从而起到扩张血管平滑肌的作用。在临床上,它被广泛应用于治疗阴茎勃起功能障碍,同时,人们还研究并探讨了其对心血管系统、肺功能、呼吸系统、视觉、镇痛方面的影响,但在听觉损伤方面尚无系统的报道。临床诊疗中发现多位勃起功能障碍患者服用PDE5抑制剂后原下降之听力有所改善。Jaumann等[2]首次在耳蜗中发现PDE5蛋白高表达,并与环磷酸鸟苷依赖性蛋白激酶1(Prkg1)编码基因部分共定位。这为PDE5抑制剂在听觉损伤治疗方面提供了潜在可能。2014年11月~2015年5月,本实验拟在对噪声暴露1周后的豚鼠腹腔内注射一定剂量的西地那非,通过观察豚鼠致聋后ABR及潜伏期的变化,探讨PDE5抑制剂是否能减轻噪声对豚鼠耳蜗听功能的损害。
1 材料与方法
1.1材料 耳廓反射灵敏的健康杂色雄性豚鼠45只(承德医学院实验动物中心提供),体质量250~305 g。主要试剂和仪器:枸橼酸西地那非(美国辉瑞,批号:C070652),Keyponit型4通道听觉脑干诱发电位仪(Dantec,丹麦),扫描电子显微镜(S-3500N SEM,日立,日本),解剖显微镜(Mnler 显微镜,德国)。
1.2动物分组及处理按随机数字表法将豚鼠分为正常对照组、噪声暴露组和治疗组,每组15只。各组豚鼠在经戊巴比妥钠(40 mg/kg)腹腔麻醉及无菌条件下于颅顶部双侧皮层听区硬膜外手术埋植不锈钢丝慢性电极(记录电极),牙科水泥固定,稳定1周后进行实验。噪声暴露组和治疗组豚鼠暴露于噪声1周。将豚鼠置于自制小笼(20 cm×20 cm×20 cm)内,每笼1只,放入暴露舱(26 m3);由信号发生器产生20~2 000 Hz的白噪声,经GY型400 W扩音器放大,并由扬声器组向暴露舱播放;暴露时用B&K 2107型频率分析仪连续监测,暴露声压级(A计权)为110 dB,动物暴露范围内声场不均匀度为±1 dB。豚鼠每日暴露1次,每次2 h,连续暴露1周。对照组豚鼠安静环境中饲养,未给予噪声暴露。豚鼠噪声暴露结束后即开始给药,噪声暴露组腹腔注射生理盐水(4 mL/kg,每日1次),治疗组豚鼠腹腔注射西地那非10 mg/kg(将西地那非用生理盐水稀释,4 mL/kg,1次/d),连续给药4周。
1.3Ⅰ波潜伏期及听性脑干反应(ABR)测试动物保持清醒状态,半限制于测试笼中,置于隔声电屏蔽室内。分别于噪声暴露前1 d,药物干预后第1、2、4周进行Ⅰ波潜伏期及ABR测试。对照组在相同时间点测试。记录电极置于颅顶部,参考电极和接地电极分别置于同侧和对侧乳突部。滤波带通30~3 000 Hz,叠加1 024次,扫描时间15 ms。采用0.1 ms方波脉冲刺激声,频率20 Hz,记录Ⅰ波潜伏期,即80 dB HL下ABR Ⅰ波出现时的时间,并以Ⅲ波刚刚出现时的刺激强度作为ABR阈值。
1.4耳蜗螺旋器细胞的超微结构观察从3组中任意选取5只豚鼠,取其耳蜗作为扫描电镜观察对象。豚鼠完成最后给药及ABR测试后(噪声暴露后4周)断头处死,取出其中的颞骨,在解剖显微镜下打开听泡,蜗尖钻孔及镫骨脱位,2.5%戊二醛前固定,在0.1 mol/L磷酸盐缓冲液中漂洗3次,每次10 min,1%锇酸固定1 h,再经磷酸盐缓冲液漂洗、乙醇梯度脱水和干燥,金属镀膜,在扫描电镜下观察耳蜗螺旋器细胞的超微结构变化。

2 结果
2.13组豚鼠不同时间点的体质量比较实验过程中,豚鼠无死亡,未发现中耳感染、行走不稳等迹象。给药后均未出现明显的药物不良反应。3组不同时间点的体质量比较见表1。
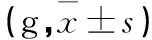
表1 3组不同时间点体质量比较
注:与对照组比较,aP<0.05;与噪声暴露组比较,bP<0.05。
2.23组不同时间点Ⅰ波潜伏期比较 见表2。
2.33组不同时间点ABR阈值比较见表3。

表2 3组不同时间点Ⅰ波潜伏期比较
注:与噪声暴露前比较,aP<0.05;与噪声暴露后比较,bP<0.05;与噪声暴露组比较,cP<0.05;与对照组比较,dP<0.05。
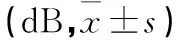
表3 3组不同时间点ABR阈值比较
注:与噪声暴露前比较,aP<0.05;与噪声暴露后比较,bP<0.05;与噪声暴露组比较,cP<0.05;与对照组比较,dP<0.05。
2.43组耳蜗毛细胞形态的改变 对照组豚鼠耳蜗内、外毛细胞形态正常,排列整齐,界限清楚。噪声暴露组内毛细胞损伤较轻,3排外毛细胞损伤明显,主要表现为听毛紊乱、融合及缺失。治疗组耳蜗损伤相对较轻,内、外毛细胞形态结构基本正常,与对照组相比差异不大,外毛细胞听毛仅有轻微倾倒融合现象。
3 讨论
噪声是危害人类身体健康的社会公害,其对听觉器官损害是多方面的,主要包括耳蜗和中枢听觉系统两个方面。噪声性听力损伤是一类常见的感音神经性听力下降,其发病机制目前主要有如下学说:机械学说、血管学说、钙离子紊乱学说、NO/cGMP学说等[3]。
研究表明,NO/cGMP途径存在于内耳中并参与耳蜗的各项功能活动,它对耳蜗生理功能具有调节作用,特别是在内环境稳定、听觉传导及改善微循环方面。环绕耳蜗血管纹毛细血管的内皮细胞是平滑肌样细胞,通过它的收缩功能来调节毛细血管的渗透性和血管直径。研究发现,外源性NO可松弛处于收缩状态的内皮细胞,因为内皮细胞中存在cGMP的靶酶-Prkg,故推测NO通过cGMP发挥作用。所以NO/cGMP通路可能是调节耳蜗血供的主要途径[4]。
耳蜗传入神经主要接受由内毛细胞传递的信息。当内毛细胞向突触间隙释放的神经递质-谷氨酸与突触后膜上的谷氨酸受体结合后,产生的突触后电位使胞膜去极化,从而形成神经冲动。在这个过程中可能有NO/cGMP通路的参与。已经发现,NO/cGMP通路能够调节听觉通路脑干部分神经递质的释放,其中NO被认为是调节谷氨酸受体活性的负反馈调节物。这一负反馈调节过程的意义在于可以减弱谷氨酸神经毒性作用对神经的损害。
近年研究表明,哺乳动物的支持细胞是潜在的神经递质、神经调质和神经体液因子的靶细胞,豚鼠柱状细胞的游离Ca2+浓度变化是由嘌呤和NO-cGMP-蛋白激酶G通路调节的[5]。听觉灵敏度是受支持细胞的位移来调控,在高强度噪声暴露时,支持细胞可保护耳蜗功能[6];且认为支持细胞间、支持细胞与外毛细胞间的缝隙连接对细胞生理的协调和小离子的交换具有重要意义[6]。耳蜗中的缝隙连接蛋白主要为Cx26和Cx30,存在于耳蜗内的支持细胞和连接组织细胞中,cGMP、三磷酸肌醇、ATP和cAMP等阴离子参与细胞间信号传递、营养、能量代谢是通过连接蛋白G26实现的[7]。从而推测NO-cGMP通路通过调节支持细胞的功能状态,进而影响基底膜及盖膜的紧张度,间接影响外毛细胞的功能。
本研究发现,随着病程的延长,噪声暴露组于给药1周后Ⅰ波潜伏期达2.31 ms,虽然于给药第2周后有所降低,但仍明显高于对照组。而治疗组豚鼠Ⅰ波潜伏期延长的程度明显低于噪声暴露组,在给药4周后,其Ⅰ波潜伏期也明显短于噪声暴露组。两组与对照组比较差异均有统计学意义。推测病变部位可能在耳蜗底回。因为短声引起的听性脑干反应首先来自耳蜗底回,短声是一种宽频带噪声,含有低频成分,当耳蜗底回受损害时,Ⅰ波主要是由短声的低频刺激顶回毛细胞所引出,由于行波延迟,致使Ⅰ波潜伏期延长。这与耳蜗铺片中底回特别是钩端的毛细胞损失严重相一致。同时,发现豚鼠经稳态白噪声连续暴露后,普遍有ABR阈值上移,在给药2周后,噪声暴露组平均阈值仍然高达50 dB以上,可以认为该组动物已有永久性阈移。但治疗组豚鼠,其ABR阈移的幅度明显低于噪声暴露组,在给药4周后,其ABR阈值已基本接近噪声暴露前水平,该组动物所形成的阈移属于暂时性阈移。
PDE5抑制剂因其能增强NO/cGMP途径,升高cGMP水平,已经在性功能障碍、心血管系统、肺动脉、呼吸系统、视觉、镇痛等方面取得肯定疗效,但对听觉损伤的保护作用尚无系统报道。西地那非为一种选择性PDE5抑制剂,能够增加eNO的释放,改善内皮细胞功能[8]。有研究发现,耳蜗毛细胞中存在PDE5-cGMP-Prkg1-PARP(ADP聚合酶)信号肽[2]。PARP1是广泛表达的DNA缺口末端的传感元件,并以NAD+为底物,催化ADP多聚核糖到受体蛋白,经DNA断裂并激活PARP,这有利于转录、复制和DNA碱基切除修复[9]。但是,NO的毒副作用又与DNA损伤、PARP过度活化及伴随的因NAD+或ATP耗尽引起的细胞坏死有关[10]。因为PARP可能直接激活cGMP[11],所以PDE5抑制剂能在增加cGMP信号肽的保护作用同时,而不提高高浓度NO的潜在破坏效应。因此推测PDE5抑制剂缩短Ⅰ波潜伏期可能是通过PDE5-cGMP-Prkg1途径调节的。
总之,腹腔内注射一定剂量的PDE5抑制剂西地那非,可以降低噪声性聋引起的ABR阈值升高,缩短噪声引起的Ⅰ波潜伏期延长。由此推论出PDE5抑制剂对噪声所致听功能损伤有一定的逆转作用。
[1] 孙建军,刁明芳.急性听力损失的诊断与治疗[J].中华耳鼻咽喉头颈外科杂志,2007,42(11):877-880.
[2] Jaumann M, Dettling J, Gubelt M, et al. cGMP-Prkg1 signaling and Pde5 inhibition shelter cochlear hair cells and hearing function[J]. Nat Med, 2012,18(2):252-258.
[3] 赖丹,黎万荣,李兴启.一氧化氮对过氧化氢所致听力损失的保护作用[J].生理学报,2004,56(2):237-242.
[4] Matsunobu T, Schacht J. Nitric oxide/cyclic GMP pathway attenuates ATP-evoked intracellular calcium increase in supporting cells of the guinea pig cochlea[J]. J Comp Neurol, 2000,423(3):452-461.
[5] Chung JW, Schacht J. ATP and nitric oxide modulate intracellular calcium in isolated pillar cells of the guinea pig cochlea[J]. J Assoc Res Otolaryngol, 2001,2(4):399-407.
[6] Flock A, Flock B, Fridberger A, et al. Supporting cells contribute to control of hearing sensitivity[J]. J Neurosci, 1999,19(11):4498-4507.
[7] 张璞,林曦,曲雁.Connexin 蛋白与耳聋[J].中华耳科学杂志,2013,11(1):156-159.
[8] Wayman C, Hornby S, Burden A, et al. Sildenafil increases erection hardness by improved penile oxygenation in the anaesthetized dog [J]. J Sex Med, 2006,3(Suppl 3):226.
张淑君(E-mail:liangyuan12388@126.com)
10.3969/j.issn.1002-266X.2016.29.010
R764.43
A
1002-266X(2016)29-0031-03
2015-07-14)

