齐墩果酸联合二甲亚砜对粪肠球菌的抑制作用
吴悠,胡焱,王瑶
(1西南医科大学口颌面修复重建和再生实验室,四川泸州 646000;2 西南医科大学附属口腔医院)
齐墩果酸联合二甲亚砜对粪肠球菌的抑制作用
吴悠1,胡焱1,王瑶2
(1西南医科大学口颌面修复重建和再生实验室,四川泸州 646000;2 西南医科大学附属口腔医院)
目的探讨齐墩果酸与二甲亚砜联合对粪肠球菌的抑制作用,以及在粪肠球菌感染根管模型中的抑菌效果。方法 分别测定二甲亚砜、齐墩果酸的最小抑菌浓度值(MIC),采用微量棋盘液体稀释法测定联合时对粪肠球菌的抑菌效果,计算抑菌浓度分数指数(FICI)。建立离体牙粪肠球菌感染根管模型,随机分为3组,分别用1 mg/mL齐墩果酸+50%二甲亚砜(A组)、2%洗必泰(B组)、去离子水(C组)根管内封药,封药前及封药1 h、24 h、7 d分别取样进行细菌培养计数,并进行统计学分析。结果 二甲亚砜对粪肠球菌的MIC为20%,齐墩果酸对粪肠球菌的MIC为100 μg/mL。齐墩果酸联合二甲亚砜FICI为0.512 5。3组处理后比处理前细菌数量均有减少,A、B组差异均具有统计学意义(P均<0.05);A组所需作用时间较B组稍长,1 h两者菌落数比较差异有统计学意义(P<0.05),24 h、7 d均能完全抑制根管内粪肠球菌生长,比较差异无统计学意义(P均>0.05)。结论 齐墩果酸与二甲亚砜联合对体外粪肠球菌的抗菌作用表现为相加作用,二者联合应用可有效抑制根管内粪肠球菌生长。
粪肠球菌;齐墩果酸;二甲亚砜
粪肠球菌是再感染根管、患有难治性根尖周炎根管中最常检测到的细菌[1]。目前常用的根管消毒药物对于抑制根管内粪肠球菌生长的有效性、安全性尚不能达到较为理想的效果。齐墩果酸(OA)是女贞子的主要有效成分,别名土当归酸。其大部分以游离酸或糖苷的形式存在,为齐墩果烷型五环三萜类化合物,分子式为C30H48O3。作为一种天然药物,其毒性很低,具有多种生物活性,包括抗菌、抗病毒、抗炎、抗氧化、护肝等。研究[2~5]发现,OA能够抑制多种口腔病原菌的生长,其中包括粪肠球菌,有成为理想的根管消毒药物的可能性。二甲亚砜(DMSO)作为一种有机溶剂,能够增强药物的渗透性,对生物膜的渗透作用好,且其本身也具有抗菌作用,是研究OA常用的赋形剂。但是,DMSO联合OA对粪肠球菌的联合药敏效果尚未得到证实。因此,本研究将OA溶于DMSO,采用倍比稀释法、微量棋盘稀释法、菌落计数法研究两种药物联合抑制浮游态粪肠球菌的效果,以弥补以往研究的不足;并进一步研究其能否抑制离体牙感染根管内粪肠球菌生长,探讨其用于治疗粪肠球菌感染根管的可能性。
1 材料与方法
1.1材料粪肠球菌标准菌株ATCC 29212(四川大学华西口腔医学中心实验室);脑心浸液(BHI)液体培养基(杭州百思生物技术责任有限公司);OA分析纯(绵阳东方源生物科技有限公司);2%醋酸氯己定(上海麦克林生化科技有限公司);DMSO分析纯(北京索莱宝科技有限公司);API 20strep链球菌试剂盒(梅里埃,法国);96孔板(Costar,美国);电子分析天平(Sartorius,德国);麦氏比浊仪(Biomerieux SA,法国);高压蒸汽灭菌消毒器(松下健康医疗器械株式会社,日本);JB-2型恒温磁力搅拌器(上海雷磁仪器厂);YQX-Ⅱ厌氧培养箱(上海跃进医疗器械有限公司)。
1.2菌株的复苏活化从冻存管中取出粪肠球菌接种于有适量灭菌BHI液体培养基的无菌试管,置于37 ℃的厌氧培养箱(80% N2,10% H2,10% CO2)内复苏培养24 h。经两次传代后,细菌进入茁壮期。比浊仪调整菌液浓度至1.5×108CFU/mL,1∶100生理盐水稀释至1.5×106CFU/mL。
1.3DMSO和OA的最小抑菌浓度(MIC)测定采用试管液体倍比稀释法测定DMSO对粪肠球菌的MIC值。最终1~7号试管中DMSO浓度分别为80%、60%、40%、20%、10%、5%、2.5%。8号试管为阴性对照,不含DMSO,仅加入菌液+BHI液体培养基。9号试管为空白对照,仅含BHI液体培养基。取菌悬液100 μL即刻接种于1~8号试管中,置于37 ℃厌氧条件下孵育培养48 h。实验重复3次。培养结束后肉眼观察判定结果,从无菌生长的各管中找出最低药物浓度的试管,该管的药物浓度即为MIC。采用平板琼脂稀释法测定OA对粪肠球菌的MIC值。药物稀释的方法同液体倍比稀释法。将OA分析纯加入低浓度的DMSO(5%)做系列倍比稀释后,1~6号平皿中OA终浓度分别为250、200、150、100、50、10 μg/mL。7、8号平皿为阴性对照,7号不含OA,仅加入5% DMSO、菌液的BHI琼脂培养基共30 mL。8号平皿为仅加入菌液的BHI琼脂培养基30 mL。菌悬液于琼脂平皿表面划线接种,倒置培养于37 ℃厌氧箱内48 h。实验重复3次。培养结束后肉眼观察判定结果,菌落生长被完全抑制的最低药物浓度即为OA对待测菌的MIC(μg/mL)。单一菌落生长可忽略不计。
1.4抑菌浓度分数指数(FICI)的测算 采用微量棋盘稀释法。无菌96孔板中OA从横排加入,DMSO从纵排加入。OA的终浓度分别为200、150、100、50、10、5、2.5、1.25 μg/mL,DMSO的终浓度分别为30%、25%、20%、15%、10%、5%。将OA粉末充分溶解于DMSO后,以BHI液体培养基定容,各浓度梯度药液摇匀备用。OA和DMSO按照浓度由高到低分别加入1~8竖列和A~F横行,各孔均加入药液100 μL。加入预备好的菌液100 μL。第9列为阴性对照,A~F行每孔均加入BHI液体培养基100 μL和菌液100 μL。将96孔板置于37 ℃厌氧培养箱中培养48 h后,观察结果。实验重复3次。联合用药效果评价:根据联合药敏管与单独药敏管的抑菌情况计算FICI。FICI=甲药联合时MIC/甲药单独时MIC+乙药联合时MIC/乙药单独时MIC。当FICI≤0.5时为协同作用,0.5
1.5离体牙样本制备收集2015年1~5月西南医科大学附属口腔医院口腔颌面外科门诊因正畸需要或牙周病而拔除的新鲜单根管恒牙共计45颗,要求根尖孔均发育完全,无近髓龋坏或充填体,未做过牙髓治疗,无根裂等缺陷。自釉牙骨质界下使用慢速切锯在流水冷却下截除牙冠部分,根管标准化长度为10 mm,Mtwo镍钛锉预备至30#,17%乙二胺四乙酸浸泡根管2 min,超声振荡,最后5.25%NaClO浸泡根管2 min,超声振荡。3M流体树脂封闭根尖孔。将牙根浸泡于盛有无菌BHI液体培养基1 mL的Eppendoff管中,在121 ℃、1.5 MPa高温高压条件下灭菌15 min,随机选取5个标本用以检测灭菌效果。
1.6感染根管模型的建立取菌悬液100 μL,注入各根管内后将标本放入含BHI液体培养基1 mL的无菌EP管中,在30 min内接种完毕。将所有样本放入厌氧培养箱内37 ℃厌氧培养,隔日更新BHI培养基至21 d。第21天时,用API 20strep试剂盒对根管内细菌进行细菌菌种鉴定,鉴定结果为粪肠球菌且无其他杂菌污染,证明粪肠球菌感染根管模型建立成功。
1.7分组处理、菌落计数将根管内粪肠球菌感染模型随机分为A、B、C组,每组15个样本。分别用注射方法将1 mg/mL OA+50% DMSO、醋酸氯己定液、去离子水注满各根管内,直至液体溢出为止。上述操作均在无菌条件下进行。MD-Temp暂封后,将3组标本置于厌氧培养箱中培养,分别于1 h、24 h、7 d时,取各组样本各5个,无菌蒸馏水5 mL冲洗根管2次。封药前、后均进行取样:用消毒好的25#纸尖插入根管内停留1 min,吸出根管内液体,立即放入盛有无菌生理盐水1 mL的Eppendorf管中,振荡1 min,平板菌落计数法进行菌落计数,计数菌落形成单位(CFU/mL)。

2 结果
2.1DMSO和OA的MIC值DMSO对粪肠球菌的MIC值为20%,OA对粪肠球菌的MIC值为100 μg/mL。
2.2DMSO和OA联合用药效果微量棋盘稀释法中,DMSO的MIC为10%,OA为1.25 μg/mL。OA与DMSO联合时,FICI=10%/20%+1.25 μg/mL/100 μg/mL=0.512 5>0.5,OA与DMSO联合对粪肠球菌的联合药敏表现为相加作用。
2.3不同时间处理前后3组感染根管内细菌量变化见表1、2、3。
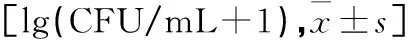
表1 1 h时处理前后3组感染根管内细菌量变化
注:差值=处理前根管内菌落计数-处理后根管内菌落计数;与本组处理前比较,*P<0.05;与C组比较,#P<0.05;与B组比较,@<0.05。
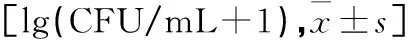
表2 24 h时处理前、后3组感染根管内细菌量变化
注:差值=处理前根管内菌落计数-处理后根管内菌落计数;与本组处理前比较,*P<0.05;与C组比较,#P<0.05;与B组比较,@<0.05。
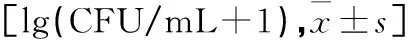
表3 7 d时处理前后3组感染根管内细菌量变化
注:差值=处理前根管内菌落计数-处理后根管内菌落计数;与本组处理前比较,*P<0.05;与C组比较,#P<0.05。
3 讨论
目前用于根管消毒的药物主要包括氢氧化钙、氯已定等。氢氧化钙是根管消毒常用和首选药物,被国内外众多学者所接受。氢氧化钙可通过解离出大量羟基离子发挥其抗菌作用,但对于感染根管中的粪肠球菌缺乏足够的抗菌能力[6]。此外,氢氧化钙还具有一定的不良反应[7]。氯已定对多数细菌均具有抑菌效果,对于感染根管中的粪肠球菌的抗菌作用明显[8];但氯己定对根尖周的组织修复也有一定的负面影响[9]。氯己定能够影响蛋白质合成,降低细胞增殖、细胞迁移和长期生存能力,对巨噬细胞、成纤维细胞、上皮细胞和成骨细胞均有一定毒性。甲醛甲酚、樟脑酚也曾用于根管消毒,但因其均具有一定的细胞毒性、刺激性和半抗原性,且其细胞毒性不可逆[10],并不适合作为根管消毒药物,已逐渐被淘汰。由此,亟需寻找一种更加安全,且能够更加有效地抑制根管内粪肠球菌生长的药物,以期提高根管治疗、再治疗的成功率。
OA作为一种纯天然药物,能够从1 620多种植物分离出来[11]。在我国,OA主要用于减轻急慢性肝炎患者肝脏的损伤,是临床上治疗急性黄疸型肝炎和慢性病毒性肝炎较为理想的药物。随着其药理作用研究的不断深入,OA在口腔疾病治疗方面应用也逐步发现。研究[3]发现,OA的环糊精包和物可增强抗口腔病原菌的作用。Gnoatto等[4]发现,通过给龋齿模型大鼠喂饲含OA-β-环糊精饮食,可明显降低龋齿的得分数。Cai等[2]认为OA能抑制突变链球菌的葡萄糖基转移酶作用,减少黏性葡聚糖形成,从而抑制牙菌斑形成,有预防龋齿作用。这些研究证明OA可抑制口腔病原菌活性,达到抗菌效果。Scalon 等[5]从三萜烯酸及其衍生物的构效关系分析,通过在OA不同碳原子位点上增加羟基、羧基基团产生多种衍生物,溶于10% DMSO后测定其对多种口腔病原菌(包括粪肠球菌、变异链球菌、牙龈卟啉菌、粘性放线菌等)的MIC值,证明了三萜酸结构上C-3位点上的羟基和C-17位点上的羧基是OA针对口腔病原体具有抗菌活性的重要基团。因此,本研究选择OA作为潜在的理想根管消毒药物。
以往关于OA的抑菌实验均未考虑DMSO对OA抑菌作用的影响,只是单纯地将DMSO作为OA的赋形剂,将OA直接溶于DMSO后,测定OA的抑菌作用[5,12]。本实验首次分别研究了DMSO和OA的抑菌效果及联合应用的抑菌效果。药敏研究证明:①DMSO对粪肠球菌具有抑菌性(MIC=20%),这与以往研究结果一致[13];②OA对粪肠球菌的MIC值为100 μg/mL,证明OA对粪肠球菌具有明显的抑菌效果; ③DMSO作为OA的赋形剂,与其协同作用时两种药物浓度均有下降,联合药敏表现为相加作用(FICI=0.5125>0.5),这证明DMSO可以作为OA的赋形剂,增加其在根管内的渗透作用,有效抑制根管内粪肠球菌生长。在测定OA的MIC值时,加入了5%的DMSO助溶,因其抗菌能力小,本实验测定DMSO的MIC值为20%,均证明低浓度的DMSO对粪肠球菌不具有足够的抑菌作用。有临床实验[14]证实,50%的DMSO和2.5%的双氯芬酸联合可明显减轻根尖周炎疼痛、减少根管渗出,且患者对其耐受性良好,无一例出现不良反应。近年美国已批准将45.5%的DMSO作为双氯芬酸的赋形剂,治疗膝部骨关节炎[15]。选择OA浓度时主要考虑能有效抑菌且溶于DMSO未达饱和的较高浓度。因此进一步实验考虑用50%的DMSO与1 mg/mL的OA联用。但二者联合的最佳浓度还需更加严格的实验证实。
粪肠球菌感染根管模型研究结果表明,A组在处理1 h后,根管内粪肠球菌数量有明显减少,处理24 h、7d后根管内无存活的粪肠球菌。与B组相比,A组对粪肠球菌抑菌作用所需时间稍长,处理1 h后根管内细菌量略多,但处理24 h、7 d后两组根管内均无粪肠球菌存活。与C组相比,A、B组处理1 h后细菌数量均明显减少,这说明两组药物处理1 h后均能有效抑制根管内粪肠球菌生长。但若作为根管消毒药物,1 mg/mL OA联合50% DMSO不仅能够满足临床需要,且相对于2%醋酸氯己定更加安全。
综上所述,OA联合DMSO对体外粪肠球菌有相加的抑菌作用,其对根管内粪肠球菌的抑菌效果明显,24 h后与2%醋酸氯己定效果一样,可作为再治疗根管、难治性根尖周炎根管的消毒药物。但其抗菌机制尚不完全明确,值得进一步研究。
[1] Ferrari PH, Gai S, Bombana AC, et al. Effect of endodontic procedures on enterococci, enteric bacteria and yeasts in primary endodontic infections[J]. Int Endod J, 2005,38(6):372-380.
[2] Cai L, Wu CD. Compounds from Syzygium aromaticum possessing growth inhibitory activity against oral pathogens[J]. J Nat Prod, 1996,59(10):987-990.
[3] Kozai K, Suzuki J, Okada M, et al. Effect of oleanolic acid-cyclodextrin inclusion compounds on dental caries by in vitro experiment and rat-caries model[J]. Microbios, 1999,97(388):179-188.
[4] Gnoatto SC, Dalla VL, Lencina CL, et al. Synthesis and preliminary evaluation of new ursolic and oleanolic acids derivatives as antileishmanial agents[J]. J Enzyme Inhib Med Chem, 2008,23(5):604-610.
[5] Scalon Cunha LC, Andradee Silva ML, Cardoso Furtado NA, et al. Antibacterial activity of triterpene acids and semi-synthetic derivatives against oral pathogens [J]. Z Naturforsch C, 2007,62(9-10):668-672.
[6] Kim D, Kim E. Antimicrobial effect of calcium hydroxide as an intracanal medicament in root canal treatment: a literature review-Part Ⅰ. in vitro studies[J]. Restor Dent Endod, 2014,39(4):241-252.
[7] Leonardo RT, Consolaro A, Carlos IZ, et al. Evaluation of cell culture cytotoxicity of five root canal sealers[J]. J Endod, 2000,26(6):328-330.
[8] Zerella JA, Fouad AF, Spångberg LS. Effectiveness of a calcium hydroxide and chlorhexidine digluconate mixture as disinfectant during retreatment of failed endodontic cases[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2005,100(6):756-761.
[9] Tsourounakis I, Palaiologou-Gallis AA, Stoute D, et al. Effect of essential oil and chlorhexidine mouthwashes on gingival fibroblast survival and migration[J]. J Periodontol, 2013,84(8):1211-1220.
[10] 王晓丽,宋萌,娄佳宁,等.根管消毒药物体外细胞毒性和细胞回复能力的研究[J].上海口腔医学,2007,16(5):512-519.
[11] Fukushima EO, Seki H, Ohyama K, et al. CYP716A subfamily members are multifunctional oxidases in triterpenoid biosynthesis[J]. Plant Cell Physiol, 2011,52(12):2050-2061.
[12] 曾范利,于录,葛发,等.MABA法与二倍稀释法测定OA体外抗结核菌活性[J].动物医学进展,2010,31(7):22-25.
[13] 章建益,吴佩玲,张维新,等.氢氧化钙与DMSO对粪肠球菌联合抗菌作用的实验观察[J].牙体牙髓牙周病学杂志,2006,16(4):208-212.
[14] 王昆润.二甲亚砜和双氯芬酸并用治疗根尖周炎[J].国外医学:口腔医分册,1999,26(6):365.
[15] Marren K. Dimethyl sulfoxide: an effective penetration enhancer for topical administration of NSAIDs[J]. Phys Sportsmed, 2011,39(3):75-82.
Inhibiting effect of combination of oleanolic acid and dimethyl sulfoxide on enterococcus faecalis
WUYou1,HUYan,WANGYao
(1OrofacialReconstructionandRegenerationLaboratory,SouthwestMedicalUniversity,Luzhou646000,China)
Objective To investigate the inhibiting effect of oleanolic acid (OA) and dimethyl sulfoxide (DMSO) on enterococcus faecalis (E. faecalis) in drug sensitive test, and its antibacterial effect in E.faecalis infected root canals. Methods Measuring the minimal inhibitory concentrations (MICs) of OA and DMSO respectively. The microdilution checkerboard technique was applied to evaluate the antibacterial effect of OA combined with DMSO and calculate the fractional inhibitory concentration index (FICI). E.faecalis infected root canal models in extracted single-canal permanent teeth were established. Samples were randomly divided into three groups: group A which was treated with 1 mg/ml OA+50% DMSO for intracranial medication, group B with 2% chlorhexidine (CHX), and group C with deionized water (DIW). Before intracranial medication or after treatment 1 h, 24 h and 7 d, the bacteria counting was recorded and the statistical analysis was conducted.ResultsThe MIC of DMSO against E. faecalis was 20%, the MIC of OA against E. faecalis was 100 μg/ml. The FICI of DMSO and OA against E. faecalis 0.5125. Statistical analysis found that the amount of bacteria in three groups after treatment was reduced, the decrement of groups A and B showed statistical difference (allP<0.05). Group A needed a little longer action time than that of group B and significant difference was found in the amount of bacteria within 1 h (P<0.05), however, no viable E.faecalis was detected when the treatment time maintained for 24 h or 7 d in both groups (allP>0.05). ConclusionDMSO combined with OA have additive antibacterial effect against E. faecalis, and the combined application can effectively inhibit the bacteria growth in root canal.
enterococcus faecalis; oleanolic acid; dimethyl sulfoxide
四川省教育厅项目(15ZA0170/2015-00035);四川省科技厅/泸州市科技局泸州医学院联合项目(LZ-LY-53/2014tsx-013)。
吴悠 (1989-),女,硕士,主要研究方向为牙体牙髓病学。E-mail:954365825@qq.com
简介:王瑶(1977-),女,副教授,博士,主要研究方向为牙体牙髓病学。E-mail:438730587@qq.com
10.3969/j.issn.1002-266X.2016.29.006
R378.1
A
1002-266X(2016)29-0017-04
2016-04-10)

