苦酸通调方对自发性糖尿病大鼠腹部脂肪组织中NF-κB和IKKβ mRNA表达的影响*
米 佳,朴春丽,陈 曦,朱浩宇
(1.长春中医药大学附属医院内分泌科,吉林 长春 130021; 2.长春中医药大学附属医院儿科,吉林 长春 130021)
·实验研究·
苦酸通调方对自发性糖尿病大鼠腹部脂肪组织中NF-κB和IKKβ mRNA表达的影响*
米佳1,朴春丽1,陈曦1,朱浩宇2
(1.长春中医药大学附属医院内分泌科,吉林 长春 130021; 2.长春中医药大学附属医院儿科,吉林 长春 130021)
目的:观察苦酸通调方对自发性糖尿病大鼠腹部脂肪组织中NF-κB及IKKβ mRNA表达的影响。方法:将高脂饲料喂养的30只雄性SPF级ZDF大鼠随机分为模型对照组、苦酸通调组、吡格列酮组3组,普通饲料喂养的雄性SPF级ZL大鼠为正常对照组,每组10只。苦酸通调组根据大鼠体质量以3.29 g /(kg·d)混悬液灌胃,吡格列酮组以1.07 μg/(g·d)灌胃,正常对照组和模型对照组给予等体积蒸馏水灌胃,1 d 1次,连续12周。采用RT-PCR法检测各组大鼠腹部脂肪组织中NF-κB、IKKβmRNA的表达水平。结果:模型对照组、吡格列酮组、苦酸通调组大鼠腹腔脂肪组织中NF-κB、IKKβ mRNA的表达高于正常对照组,差别有统计学意义(P<0.01)。与模型对照组对比,苦酸通调组和吡格列酮组NF-κB、IKKβ mRNA的表达均降低,差别有统计学意义(P<0.01,P<0.05)。与吡格列酮组对比,苦酸通调NF-κB、IKKβ mRNA的表达均降低,差别有统计学意义(P<0.05)。结论:苦酸通调方在一定程度上能抑制糖尿病大鼠腹部脂肪组织中NF-κB、IKKβ mRNA表达,这可能是苦酸通调方抑制炎症信号通路的传导而发挥其改善胰岛素抵抗治疗糖尿病的机制之一。
苦酸通调方;NF-κB;IKKβ;动物;ZDF大鼠
糖尿病是一种由多种原因引起的糖、脂肪、蛋白质代谢紊乱综合征[1]。近年来,我国糖尿病人数日益增多,而成人糖尿病人数已超过9200万,并且糖尿病前期患者约有1.48亿[2]。根据预测,到2025年糖尿病患病率将达到5.4%[3]。随着生活方式的改变、生活水平的提高,糖尿病以其较高的发病率成为严重影响人类健康的疾病之一。胰岛素抵抗及胰岛功能受损是2型糖尿病的两个基本环节[4]。因此,深入研究能够改善胰岛素抵抗和胰岛功能受损的药物,对于防治糖尿病及其并发症具有重要意义。苦酸通调方以四气五味药性理论设立,以苦味药为主,与酸味药相配合,由《温病条辨》所记载的连梅汤加大黄、干姜而成。本研究旨在结合中医古今文献,在前期研究[5]的基础上,进一步探讨苦酸通调方对自发性糖尿病大鼠腹腔脂肪组织中NF-κB、IKKβ mRNA的影响,探讨本方治疗2型糖尿病的作用机制,为糖尿病的中医治疗提供新的思路和方法。
1 材料与方法
1.1动物
清洁级9周龄雄性ZDF (Zucker diabetic fatty rat)大鼠42只(体质量244~291 g)和同周龄雄性ZL(Zucker lean)大鼠10只(体质量183~220 g),购于北京维通利华实验动物技术有限公司,动物许可证:SCXK(京)2012-0001。ZDF大鼠在普通饲料喂养1周后予高脂饲料Purina #5008(粗脂肪6.5%、粗蛋白23.5%)喂养,ZL大鼠予普通饲料#1022(粗蛋白≥18.0%、粗脂肪≥4.0%、粗纤维≤5.0%、水分≤8.0%)喂养,饲料购于北京华阜康生物科技股份有限公司,合格证号:SCXK(京)2009-0008。实验前均予普通饲料适应性喂养1周,所有动物自由获取食物和水。
1.2药品
苦酸通调方由黄连、乌梅、大黄、干姜4味中药组成,由长春中医药大学附属医院颗粒药房提供;吡格列酮,江苏恒瑞医药股份有限公司产品,批号:国药准字H20040631。
1.3模型的建立
将42只ZDF大鼠和10只ZL大鼠分笼饲养,每笼2只。明暗周期为12/12 h,自由摄食、饮水。各组予普通饲料适应性喂养1周后,ZL组继续给予普通饲料喂养,ZDF组给予高脂饲料喂养。至12周时,共成糖尿病模型ZDF大鼠30只。
判断造模成功标准:大鼠定期行糖耐量实验,禁食不禁水15 h,剪尾取血微量血糖仪测空腹血糖后,予300 g/L葡萄糖溶液按2 g/kg灌胃[6]。糖负荷后分别在0.5,1,1.5和2 h剪尾取血,用血糖仪测量血糖。当血糖峰值高于16.7 mmol/L和糖负荷后2 h 高于11.1mmol/L时,可诊断为糖尿病。如具备上述任意1条时,为糖耐量减低。取诊断为糖尿病或者糖耐量减低的大鼠为实验对象。
1.4动物分组与给药
将造模成功的30只ZDF大鼠随机分为模型对照组、苦酸通调组和吡格列酮组3组,每组10只;10只ZL大鼠为正常对照组。苦酸通调组根据大鼠体质量以3.29 g /(kg·d)混悬液灌胃,吡格列酮组以1.07 μg/(g·d)灌胃,正常对照组和模型对照组给予等体积蒸馏水灌胃,1 d 1次,连续12周。用药治疗期间正常对照组大鼠饲以普通饲料,其他组饲以高脂饲料,自由进食、饮水,每周称量体质量以调整灌胃剂量。
1.5检测指标
采用RT-PCR法检测各组大鼠腹部脂肪组织中NF-κB、IKKβ mRNA的表达水平。于治疗第12周末灌胃结束后,禁食、不禁水12 h,乙醚麻醉大鼠,打开腹腔,快速提取腹腔脂肪组织,分装后迅速放入液氨罐,移至-80 ℃冰箱里冻存待用。
1.5.1大鼠腹腔脂肪组织总RNA的提取
采用Trizol法。①分别取超低温冻结的正常对照组、模型对照组、苦酸通调组、吡格列酮组的脂肪组织约100 mg,放于匀浆器后加1mL的Trizol 试剂,研磨至组织完全破碎后,室温放置5 min,使样品充分裂解。②将匀浆分别转入1.5 mL的EP管中,加入200 μL氯仿,剧烈振荡15 s,室温放置5 min后,4 ℃离心机设置12 000 r/min,离心10 min。③从离心机中取出EP管,吸取上层清液,缓慢转移到新的1.5 mL的EP管中。④缓慢向上清液中加入0.5 mL的异丙醇混匀,室温放置10 min。⑤在12 000 r/min、4 ℃离心机中离心10 min后,弃去上清液,沿EP管管壁缓慢加入750 mL/L的乙醇1 mL,将离心管震荡摇匀,在冰上静置10 min后放入7 500 r/min、4 ℃离心机中离心5 min,弃上清液。上述过程重复2次。⑥室温干燥10 min,加入10 μL的DEPC水混合均匀,将RNA完全溶解。
1.5.2RNA纯度的测定
用紫外分光光度计测定260 nm、280 nm的紫外吸收值,重复3次。如各组结果A260/A280在1.8~2.0之间,说明提取的RNA纯度较高。
1.5.3RNA反转录反应
取0.2 mL EP管,分别顺次加入表1内试剂,完成RT反应液的配置。将上述试剂混匀静置10 min,上PCR仪反应(45 ℃水浴40 min,95 ℃水浴5 min,5 ℃水浴5 min),灭活逆转录酶后,存放于-20 ℃冰箱中备用。

表1 RT反应液的配置
1.5.4RT-PCR反应
引物序列 参见表2。 GAPDH反应条件:95 ℃预变性5 min,95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,进行35个循环,72 ℃充分延伸5 min,4 ℃保存。NF-KB反应条件:95 ℃预变性5 min,95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,进行38个循环,72 ℃充分延伸5 min,4 ℃保存。IKKβ反应条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,进行40个循环,72 ℃充分延伸 5 min,4 ℃保存。
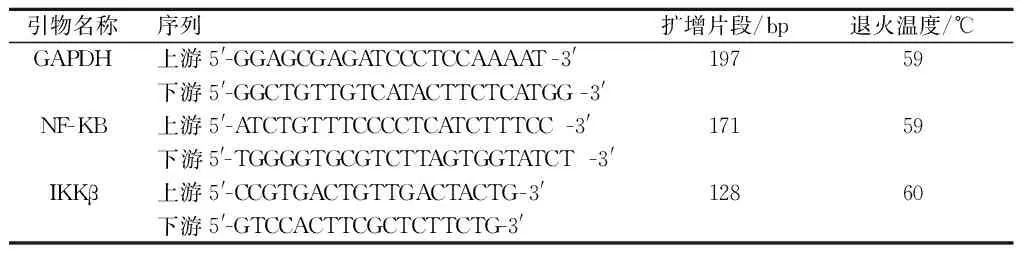
表2 引物序列名称
1.5.5PCR产物的检测和分析
将终产物在质量分数10 g/L琼脂糖凝胶进行电泳20~30 min,紫外灯下拍照,利用凝胶成像系统对每个样品PCR产物扩增的特异性片段进行灰度扫描,并以GAPDH密度作为参考定量标准,进行相关基因相对表达量的计算。
1.6统计学方法

2 结 果
模型对照组、吡格列酮组、苦酸通调组大鼠腹腔脂肪组织中NF-κB、IKKβ mRNA的表达高于正常对照组,差别有统计学意义(P<0.01)。与模型对照组对比,苦酸通调组和吡格列酮组NF-κB、IKKβ mRNA的表达均降低,差别有统计学意义(P<0.01或P<0.05)。与吡格列酮组对比,苦酸通调NF-κB、IKKβ mRNA的表达均降低,差别有统计学意义(P<0.05)。结果表明:苦酸通调方和吡格列酮均有降低糖尿病大鼠腹腔脂肪组织NF-κB、IKKβ基因表达的作用,且苦酸通调方优于吡格列酮。见表3、图1。

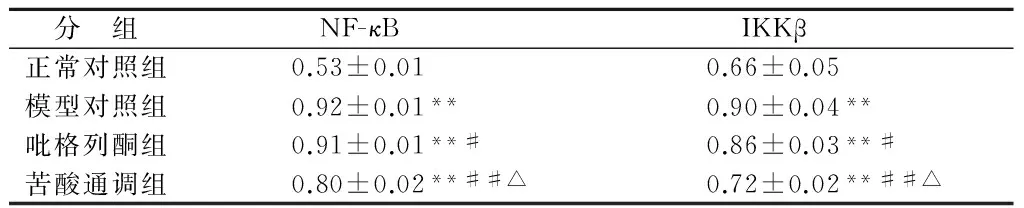
分 组NF-κBIKKβ正常对照组0.53±0.010.66±0.05模型对照组0.92±0.01**0.90±0.04**吡格列酮组0.91±0.01**#0.86±0.03**#苦酸通调组0.80±0.02**##△0.72±0.02**##△
注:与正常对照组对比,**P<0.01;与模型对照组对比,#P<0.05,##P<0.01;与吡格列酮组对比,△P<0.05。
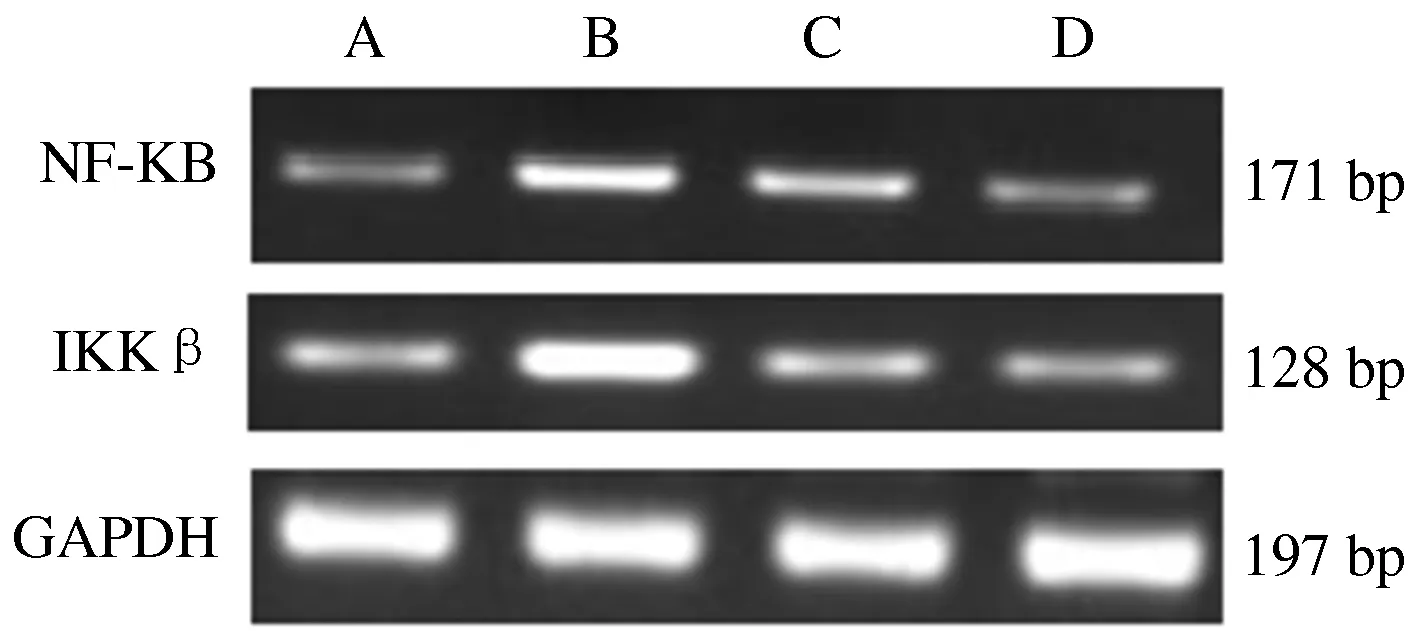
A.正常对照组;B.模型对照组;
3 讨 论
糖尿病属中医学“消渴”范畴。古人对消渴的病机一直遵循“阴虚燥热”的传统观点,认为阴虚为本、燥热为标;但随着生活方式的改变、生存压力的增加,医家对消渴的病因病机有了新的认识:饮食不节使脾胃功能受损,运化失常,气机壅滞,郁而生热;情志不遂,气机郁滞,郁而化火。可见,消渴的产生与郁、热关系较为密切。随着病程的进展,日久热耗气伤阴,气阴两伤,久则阴阳两虚。课题组所在的团队经十余年的临床和动物实验研究[5,7]证实,六郁和络滞并存是导致肥胖2型糖尿病的核心病机。六郁是指以肥甘滋腻之品滞脾碍胃(食郁)为先导而形成的气郁、血郁、热郁、痰郁、湿郁的病理状态;膏、浊、痰、脂、瘀、毒化生,郁滞络脉。络滞是由六郁交互作用而形成络脉郁滞的病理状态。苦酸通调法是对苦酸制甜、辛开苦降、活血通络、解毒通络单一治法学说的高度概括,主要针对肥胖2型糖尿病的核心病机“六郁和络滞”。苦酸通调方按照君臣佐使的组方原则进行药物配伍,以六郁和络滞的病机理论为基础,治疗以清热泻火、养阴生津、解毒通络为原则,以苦酸通调为治疗大法。既往临床研究发现[8],苦酸通调方对肥胖2型糖尿病胰岛素抵抗患者有较好的改善作用。核因子κB(NF-κB)是细胞中的重要的转录调节因子,存在于多种细胞中,通过刺激肿瘤坏死因子等的活化,诱导多种基因的表达,参与炎症反应[9]。王晓晨等[10]指出,NF-κB通过复杂的分子调节参与机体的炎症反应,并产生一定的生理变化,通常以p50-p655异二聚体的形式与其抑制性蛋白结合。NF-κB信号通路中有IKKβ、IKBα、NF-κB3个关键因子[11]。有研究报道,IKKβ是胰岛素抵抗发生的关键[12]。在胰岛素抵抗状态下,IKKβ抑制剂可阻断NF-κB的激活。
本研究结果显示:模型对照组大鼠腹部脂肪组织中NF-κB、IKKβ mRNA表达量较正常对照组增高,苦酸通调方可在一定程度上能抑制糖尿病大鼠此两指标的表达。这可能是苦酸通调方抑制炎症信号通路的传导而发挥其改善胰岛素抵抗治疗糖尿病的机制之一。
[1]陈艳芬,王春怡,李卫民,等.黄芪葛根汤对糖尿病心肌病大鼠氧化应激和NF-KB表达的影响[J].中成药,2012,34(8):1428-1432.
[2]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013版)[J].中国糖尿病杂志,2014,22(8):2.
[3]Shaw JE,Sicree RA,Zimmet PZ.Global estimates of the prevalence of diabetes for 2010 and 2030[J].Diabetes Res Clin Pract,2010,87(1):4-14.
[4]Lanuza-Masdeu J,Arévalo mI,Vila C,et al.In vivo JNK activation in pancreatic β-cells leads to glucose intolerance caused by insulin resistance in pancreas[J].Diabetes,2013,62(7):2308-2317.
[5]王淑俊,朴春丽,刘禹辛.苦酸通调I号方治疗肥胖型2型糖尿病40例临床观察[J].中华实用中西医杂志,2009,22(4):221-222.
[6]Pick A,Clark J,Kubstrup C,et al.Role of apoptosis in failure of beta-cell mass compensation for insulin resistance and beta-cell defects in the maleZucker diabetic fatty rat [J].Diabetes,1998,47(3):358-364.
[7]朴春丽,邓悦,米佳.苦酸通调法抑制糖尿病脂肪组织炎症机制的理论探讨[J].中华实用中西医杂志,2009,22(3):146-148.
[8]朴春丽,陈曦,米佳.苦酸通调法治疗糖尿病前期的临床研究[J].中外健康文摘,2012,9(44):128.
[9]王杏,王超,邢邯英,等.通心络胶囊对糖尿病小鼠视网膜IKKβ/IKBα/NF-kB通路的作用[J].眼科新进展,2014,34(11):1005-1008.
[10]王晓晨,吉爱国.NF-kB信号通路与炎症反应[J].生理科学进展,2014,45(1):68-71.
[11]Chen C,Moreno R,Samikannu B,et al.Improved intraportal islet transplantation outcome by systemic IKK-beta inhibition: NF-κB activity in pancreaticislets depends on oxygen availability[J].Am J Transplant,2011,11(2):215-224.
[12]Chen F.Is NF- kappaB a culprit in type 2 diabetes?[J].Biochern Biophys Res Common,2005,332(1):1-3.
(编辑陶珠)
1001-6910(2016)02-0063-04
R587.1
B
10.3969/j.issn.1001-6910.2016.02.31
吉林省自然科学基金项目(201115169)
2015-06-30;修回:2015-11-30

