鼻咽癌p-IRE1蛋白表达与放射治疗预后的关系
王 欢,乔 俏,解海涛,勾宏图,李 光
(中国医科大学附属第一医院放疗科,沈阳110001)
鼻咽癌p-IRE1蛋白表达与放射治疗预后的关系
王欢,乔俏,解海涛,勾宏图,李光
(中国医科大学附属第一医院放疗科,沈阳110001)
目的探讨磷酸化需肌醇酶1(p-IRE1)蛋白在鼻咽癌组织中的表达及其与放射治疗预后的相关性。方法选取2010年1月至2011年12月在我院首次行根治性调强放射治疗的鼻咽癌患者53例,免疫组化SP法检测鼻咽癌组织中p-IRE1蛋白表达水平,观察鼻咽癌患者放射治疗后生存期,分析p-IRE1蛋白表达水平与鼻咽癌患者临床病理特征、预后的关系。结果53例鼻咽癌组织中p-IRE1阳性表达36例(67.9%),高表达14例(26.4%);p-IRE1蛋白表达水平与淋巴分期相关(P=0.033);多因素分析显示p-IRE1蛋白表达水平(P=0.026)、是否联合化疗(P=0.020)是鼻咽癌放射治疗的独立预后因素,p-IRE1高表达鼻咽癌患者放射治疗后死亡风险是低表达组的2.979倍。结论p-IRE1蛋白可成为预测鼻咽癌放射治疗预后的新指标。
鼻咽癌;磷酸化需肌醇酶1蛋白;放射治疗;预后
放射治疗(以下简称放疗)是鼻咽癌首选的治疗手段。近年来随着调强放疗技术在临床上广泛应用,鼻咽癌的5年生存率有了明显提高[1],但仍有20%左右的鼻咽癌因局部复发或远处转移导致治疗失败[2]。探讨鼻咽癌放疗预后影响因素,准确预测放疗疗效,对实现鼻咽癌精准治疗及提高放疗疗效有极大帮助。需肌醇酶1(inositol requiring enzyme 1,IRE1)是未折叠/错误折叠蛋白的感受器[3]。文献[4-6]报道IRE1在人多种肿瘤细胞中存在过表达,且与肿瘤的发生发展及预后有关。目前国内、外还未见IRE1在鼻咽癌组织中表达情况及其与放疗预后相关关系的报道。本研究通过检测磷酸化IRE1(phosphorylated IRE1,p-IRE1)在鼻咽癌组织中的表达水平,探讨其与鼻咽癌放疗预后的相关关系,为鼻咽癌放疗预后提供预测指标。
1 材料与方法
1.1临床资料
2010年1月至2011年12月于本院接受根治性调强放疗的鼻咽癌患者53例,均为初治病例。其中男41例,女12例;年龄13~74岁,中位年龄52岁;病理分型非角化癌42例,角化型鳞癌11例;采用UICC(第7版)进行临床分期:Ⅰ期1例,Ⅱ期9例,Ⅲ期20例,Ⅳa-b期23例。
1.2免疫组织化学染色及结果判定
所有病理标本均行HE染色证实鼻咽癌诊断,采用SP免疫组化法检测鼻咽癌病理活检组织中p-IRE1表达情况。计数单位视野阳性细胞占总细胞的百分数,辅以计算机图像分析仪分析结果。染色强度及染色细胞数判定标准[7]:染色强度分为4级,0级,无染色;1级,浅黄色;2级,黄色;3级,棕黄或棕褐色。随机观察高倍镜(×200)下5个视野的染色细胞数,每个视野计数200个细胞,计算每张切片上阳性细胞表达的百分数并取平均值,将阳性细胞所占比例分为5级:≤1%,0分;>1%~25%,1分;>25%~50%,2分;>50%~75%,3分;>75%,4分。染色强度和染色细胞数分级后相乘,应用ROC曲线截点值来区分高低表达组(低表达组≤5分,高表达组>5分)。
1.3放疗方法
53例患者均采用调强放疗。患者仰卧位,头颈肩固定架及热塑面膜将其固定。行头顶至胸锁关节下缘范围3 mm层厚螺旋CT增强扫描,将图像传输到ADAC Pinnacle 9.0放疗计划系统中。由2名医生根据CT/MRI融合图像勾画靶区:大体肿瘤区(gross tumor volume,GTV)包括鼻咽原发肿瘤、咽后转移淋巴结和所有的颈部转移淋巴结;临床靶区(clinical target volume,CTV)分为高危区(CTV1)和预防照射区(CTV2),CTV1指原发肿瘤周围极有可能受侵的邻近区域或极有可能转移的区域,包括整个鼻咽、咽后淋巴结区域、斜坡、颅底、咽旁间隙、翼腭窝、蝶窦、鼻腔和上颌窦后1/3,CTV2包括没有转移淋巴结的颈部淋巴引流区;计划靶区(planning target volume,PTV)在CTV基础上外放3 mm。靶区的处方剂量:PGTV=70.0/33 f,PTV1=60.0 Gy/33 f,PTV2=50.4 Gy/28 f,每周5次,要求至少95%的PTV满足上述靶区的处方剂量,PTV接受>110%处方剂量的体积应<20%,PTV接受<93%处方剂量的体积应<3%,PTV外的任何地方不能出现>110%处方剂量。
53例患者中,14例患者采用单纯放疗,5例采用序贯放化疗,34例患者采用2个周期的同期放化疗。序贯或同期化疗方案为PF或DP。
1.4统计学分析
患者生存时间起始点为放疗开始日期,终点为患者出现死亡、失访或随访截止时间。放疗后随访方法为每3~6个月门诊随访1次。采用SPSS 19.0软件对实验数据进行分析和处理。计数资料比较采用χ2检验,生存率采用Kaplan-Meier法,不同变量的生存差异采用log-rank检验,多因素预后分析采用COX模型。P<0.05为差异有统计学意义。
2 结果
2.1p-IRE1在鼻咽癌组织中表达情况
p-IRE1阳性表达定位于细胞核,呈淡黄色至棕褐色染色,弥漫或局灶性分布于鼻咽癌组织中,见图1。53例鼻咽癌组织中p-IRE1阳性表达36例,阳性表达率67.9%;p-IRE1高表达14例,低表达患者39例,见表1。
2.2p-IRE1表达水平与鼻咽癌放疗预后的关系
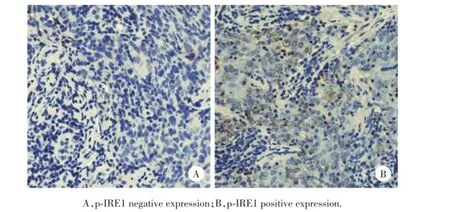
图1 p-IRE1在鼻咽癌中染色情况×400Fig.1 p-IRE1 sta in ing in nasopharyngeal carcinom a×400
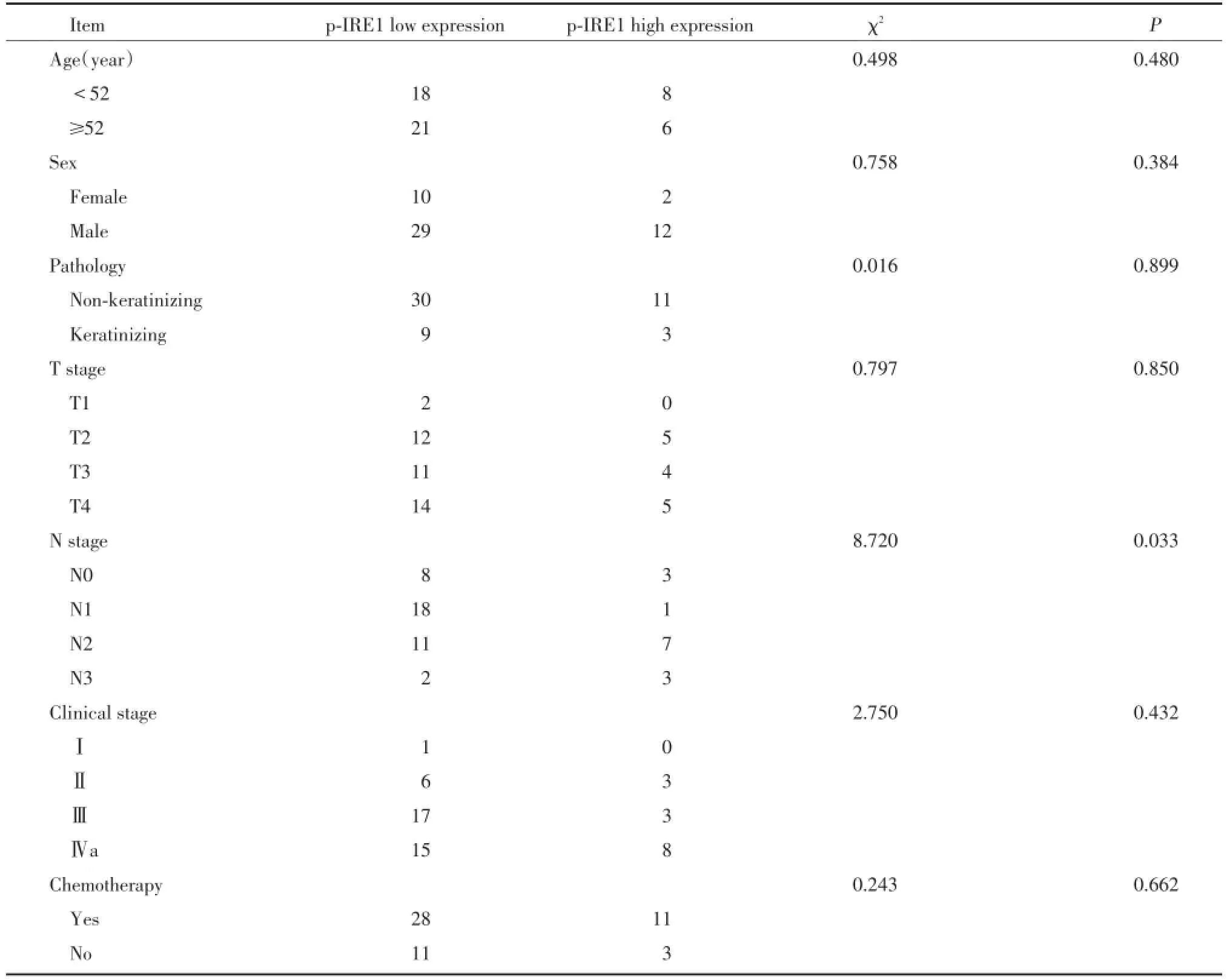
表1 p-IRE1表达水平与临床特征之间的关系Tab.1 Re lationship between p-IRE1 expression and c linical factors
53例鼻咽癌患者放疗后随访截止时间为2015年12月30日,随访5~71个月,中位随访时间52个月。其中30例鼻咽癌患者随访满5年,生存36例,死亡15例,失访2例,失访率3.8%,删失百分比71.7%。全组鼻咽癌患者放疗后1年生存率为94.0%,95%CI为(0.881 2,0.998 8);3年生存率为77.0%,95%CI为(0.652 4,0.887 6);5年总生存率为71.0%,95%CI为(0.592 4,0.827 6)。其中p-IRE1高表达组平均生存时间为(43.690±6.188)个月,中位生存时间为52个月;p-IRE1低表达组平均生存时间为(64.925±3.326)个月。生存曲线见图2。
采用log rank检验对53例鼻咽癌患者放疗预后进行分析发现:p-IRE1低表达、咽旁间隙未受侵犯、临床分期为Ⅰ~Ⅱ及同期化疗患者的生存时间明显增加。单因素分析显示p-IRE1表达水平、咽旁间隙侵犯、临床分期、是否同期化疗是鼻咽癌患者放疗预后的相关因素;而年龄、性别、病理类型、T分期、N分期则与鼻咽癌放疗预后无关,见表2。
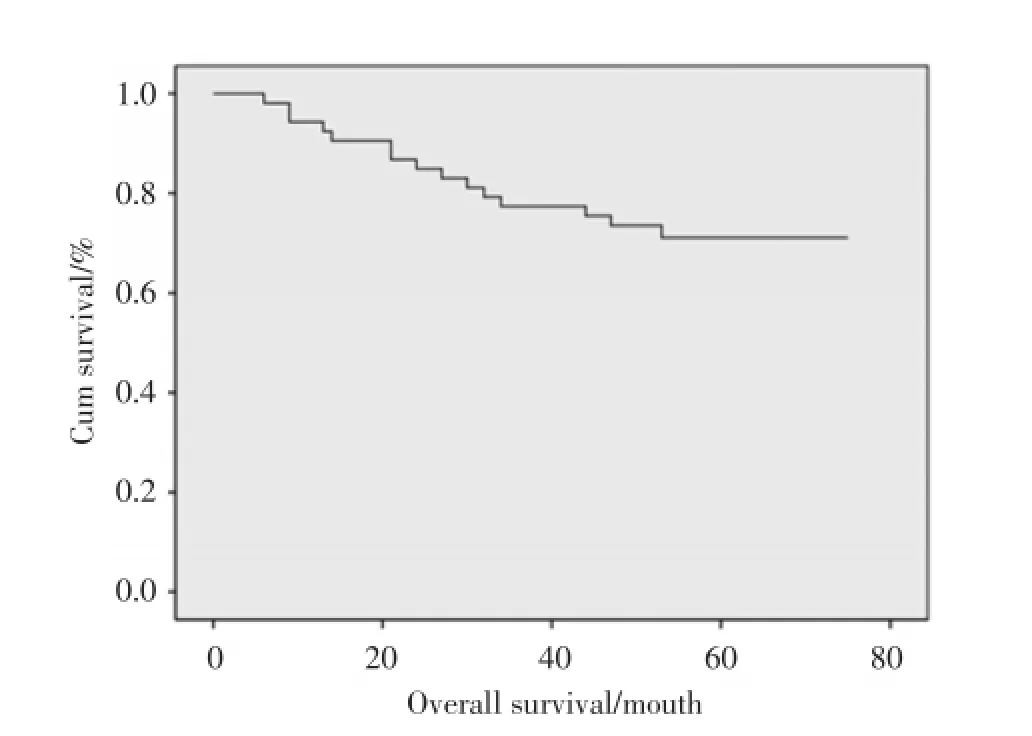
图2 鼻咽癌患者放疗后生存曲线Fig.2 Overall survival curves of the nasopharyngeal carcinoma patients

表2 鼻咽癌放疗预后的单因素分析Tab.2 Univariate analysis of nasopharyngeal carcinoma prognosis with radiotherapy
将单因素预后相关因素纳入COX模型中进行多因素分析发现:p-IRE1表达情况和是否同期化疗是鼻咽癌放疗的独立预后因素。p-IRE1高表达鼻咽癌患者放疗后死亡风险是低表达者的2.979倍,未做同期化疗的鼻咽癌患者放疗后死亡风险是同期化疗的3.131倍,见表3,图3、4。

表3 鼻咽癌放疗预后的多因素分析Tab.3 Multivariate analysis of nasopharyngeal carcinoma prognosis with radiotherapy
3 讨论
我国是鼻咽癌发病率较高的国家之一。因鼻咽癌对放射线相对敏感,且鼻咽癌发生部位隐蔽,与周围重要器官相邻,易直接侵犯或淋巴转移,因此鼻咽癌治疗采取以放疗为主的综合治疗模式。随着放疗技术的不断发展,特别是调强放疗技术的应用,使鼻咽癌5年生存率明显提高。但仍有20%的鼻咽癌患者因局部复发、颈淋巴结和远处转移导致治疗失败。寻找鼻咽癌放疗的预后指标,对实现个体化精准治疗,提高鼻咽癌治愈率有极大帮助。
内质网是真核生物细胞质中重要的细胞器,其功能是保持蛋白动态平衡和蛋白内稳态。当细胞在炎症等生理及肿瘤等病理因素影响下,内质网环境发生改变,导致未折叠或错误折叠蛋白增多,此时细胞会启动一种自我保护机制——内质网应激(endoplasmic reticulum stress,ERS),并激活未折叠蛋白反应(unfolded protein response,UPR)[8]。UPR通过被称为内质网感受器的PERK、IRE1及ATF6 3种膜蛋白介导的信号通路[9],调节肿瘤的发生、发展[10]。
IRE1是一种定位于内质网膜的Ⅰ型跨膜蛋白,属于丝氨酸/苏氨酸蛋白激酶(Ser/Thr protein kinase)家族成员之一。IRE1能够感受错误折叠/未折叠蛋白的内质网管腔蓄积水平,引发相应激酶结构的改变,再作用于自身完成磷酸化过程,变为p-IRE1引起下游生物学效应[3]。IRE1可激活凋亡信号调节激酶ASK1及其下游靶基因氨基末端激酶JNK和核转录因子NF-kB,调节细胞凋亡、细胞迁移等反应[11]。与正常组织相比,IRE1被证实在人骨恶性肿瘤[4]、子宫颈癌[5]、乳腺癌[6]中存在过表达。本研究发现鼻咽癌组织中p-IRE1阳性表达率67.9%;p-IRE1高表达率26.4%(14/53),低表达率73.6%(39/53)。据文献[5]报道IRE1在不同临床分期的子宫颈癌中表达有所差异,但在本研究中未发现p-IRE1表达水平与鼻咽癌临床分期有相关关系,仅与N分期有关,提示p-IRE1表达水平可能与鼻咽癌咽旁或颈淋巴结转移有关。

图3 p-IRE1不同表达组的生存曲线Fig.3 Survival curves of p-IRE1 different exp ression groups

图4 单纯放疗和联合化疗的生存曲线Fig.4 Su rviva l curves of com bined chemo the rapy and rad iotherapy alone
AUF等[12]通过抑制小鼠体内IRE1信号传导,导致IRE1表达下降后,小鼠脑胶质瘤新生血管及血流灌注减少、生长速率下降,荷瘤小鼠生存时间明显延长。本研究发现p-IRE1表达水平是鼻咽癌放疗的独立预后因素,p-IRE1表达水平与鼻咽癌放疗预后呈负相关关系,p-IRE1高表达者放疗后的死亡风险是低表达者的2.979倍。
DROGAT等[13]发现缺氧诱导因子1信号通路的活化和UPR均可导致IRE1被激活,活化的IRE1可以上调血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达。VEGF间接促进肿瘤内血管生成,肿瘤新形成血管的结构与血流动力学异常,血管同时收缩和舒张,造成肿瘤组织乏氧。乏氧严重影响了肿瘤细胞的放射敏感性,也会导致肿瘤放疗疗效下降。此外UPR还通过IRE1-XBP1通路,可以提高肿瘤细胞对周围有害环境(包括放射线)的适应能力[14-15],导致肿瘤细胞对放射线产生抗拒。
同期放化疗是目前治疗局部晚期实体瘤常用的综合治疗模式。其优点在于多种化疗药物可以增加乏氧肿瘤细胞的放射敏感性,且有利于抑制放疗后DNA损伤的修复,提高对肿瘤细胞的杀伤力,还有助于消灭远处的亚临床转移灶。本研究发现同期放化疗是影响鼻咽癌放疗预后的独立预后因素,单纯放疗或序贯放化疗的鼻咽癌患者放疗后死亡风险是同期放化疗的3.131倍。临床分期仍是公认的影响鼻咽癌放疗预后的重要因素,但在本研究中临床分期并不是鼻咽癌放疗预后的独立影响因素,可能与本研究样本量小有关。
已有研究表明IRE1可作为人骨肿瘤[4]、乳腺癌[6]等恶性肿瘤的治疗靶点。本研究表明IRE1是鼻咽癌放疗的独立预后因素,有可能成为评价鼻咽癌放疗预后的新指标,为鼻咽癌个体化精准治疗方案的制定提供依据。
[1]潘建基,WT NG,宗井凤,等.基于IMRT时代的第八版AJCC/ UICC鼻咽癌临床分期建议[J].中华放射肿瘤学杂志,2016,25(3):197-206.
[2]PETERSSON F.Nasopharyngeal carcinoma:a review[J].Semin Diagn Pathol,2015,32(1):54-73.DOI:10.1053/j.semdp.2015.02. 021.
[3]ALI MM,BAGRATUNI T,DAVENPORT EL,et al.Structure of the Ire1 autophosphorylation complex and implications for the unfolded protein response[J].EMBO,2011,30(5):894-905.DOI:10.1038/ emboj.2011.18.
[4]李翔柱.IRE1α上调人骨肿瘤细胞XBP1启动子转录活性的研究[J].医学分子生物学杂志,2012,9(3):171-177.DOI:10.3870/j. issn.1672-8009.2012.03.004.
[5]聂萌.内质网应激反应通路小分子抑制剂协同抗癌药物对宫颈癌细胞的抑制作用[J].基础医学与临床,2014,34(5):638-643.
[6]MING J.A novel chemical,STF-083010,reverses tamoxifen-related drug resistance in breast cancer by inhibiting IRE1/XBP1[J].Oncotarget,2015,6(38):40692-40703.DOI:10.18632/oncotarget.5827.
[7]VAN DER WATT PJ,ZEMANAY W,GOVENDER D,et al.Elevated expression of the nuclear export protein,Crm1(exportin 1),associates with human oesophageal squamous cell carcinoma[J].Oncol Rep,2014,32(2):730-738.DOI:10.3892/or.2014.3231.
[8]DUFEY E,SEPÚLVEDA D,ROJAS-RIVERA D,et al.Cellular mechanisms of endoplasmic reticulum stress signaling in healthand disease.1.An overview[J].Am J Physiol Cell Physiol,2014,307(7):C582-C594.DOI:10.1152/ajpcell.00258.2014.
[9]ZHAO L,ACKERMAN SL.Endoplasmic reticulum stress in health and disease[J].Curr Opin Cell Biol,2006,18(4):444-452.DOI:10.1016/j.ceb.2006.06.005.
[10]MOENNER M,PLUQUET O,BOUCHECAREILH M,et al.Integrated endoplasmic reticulum stress responses in cancer[J].Cancer Res,2007,67(22):10631-10634.DOI:10.1158/0008-5472. CAN-07-1705.
[11]GHOSH R,WANG L,WANG ES,et al.Allosteric inhibition of the IRE1α RNase preserves cell viability and function during endoplasmic reticulum stress[J].Cell,2014,158(3):534-548.DOI:10.1016/j.cell.2014.07.002.
[12]AUF G,JABOUILLE A,GUERIT S,et al.Inositol-requiring enzyme 1alpha is a key regulator of angiogenesis and invasion in malignant glioma[J].Proc Natl Acad Sci USA,2010,107(35):15553-15558.DOI:10.1073/pnas.0914072107.
[13]DROGAT B,AUQUSTE P,NQUYEN DT,et al.IRE1 signaling is essential for ischemia-induced vascular endothelial growth factor-a expression and contributes to angiogenesis and tumor growth in vivo[J].Cancer Res,2007,67(14):6700-6707.DOI:10.1158/ 0008-5472.CAN-06-3235.
[14]HIRAMATSU N,CHIANG WC,KURT TD,et al.Multiple mechanisms of unfolded protein response-induced cell death[J].Am J Pathol,2015,185(7):1800-1808.DOI:10.1016/j.ajpath.2015.03. 009.
[15]CROFT A,TAY KH,BOYD SC,et al.Oncogenic activation of MEK/ERK primes melanoma cells for adaptation to endoplasmic reticulum stress[J].J Invest Dermatol,2014,134(2):488-497. DOI:10.1038/jid.2013.325.
(编辑武玉欣)
Expression and Prognostic Significance of p-IRE1 in Patients with Nasopharyngeal Carcinoma after Radiotherapy
WANG Huan,QIAO Qiao,XIE Haitao,GOU Hongtu,LI Guang
(Department of Radiation Oncology,The First Hospital,China Medical University,Shenyang 110001,China)
Objective To investigate the expression of phosphorylated inositol requiring enzyme 1(p-IRE1)protein in nasopharyngeal carcinoma(NPC),and explore the relationship between the expression of p-IRE1 and radiotherapy prognosis.M ethods A total of 53 cases of NPC who received radical intensity-modulated radiation therapy in our hospital from January 2010 to December 2011 were retrospectively analyzed.P-IRE1 protein expression in cancer tissue was detected by immunohistochemistry.The survival time of patients with NPC after radiotherapy were recorded. The correlation between p-IRE1 expression with clinical pathological data and radiation prognosis in NPC was analyzed.Results Among the 53 patients,36 cases(67.9%)were positive for p-IRE1 staining,and 14 cases(26.4%)were highly expressed.P-IRE1 protein expression was correlated with N stage(P=0.033);Multivariable Cox analysis revealed that p-IRE1 protein expression(P=0.026)and chemotherapy(P=0.020)were independent prognostic factors of radiotherapy.The death risk in patients after radiotherapy in high expression group is 2.979 times higher than low expression group.Conclusion P-IRE1 protein could be a new prognostic indicator of NPC.
nasopharyngeal carcinoma;phosphorylated inositol requiring enzyme 1;radiotherapy;prognosis
R739.62
A
0258-4646(2016)10-0926-06
10.12007/j.issn.0258-4646.2016.10.015
王欢(1990-),女,硕士研究生.
李光,E-mail:13804058616@163.com
2016-04-28
网络出版时间:
网络出版地址

