尿素醇解法合成碳酸乙烯酯
吴雪梅,丁同梅,赫崇衡,田恒水
(华东理工大学化工学院,上海 200237)
尿素醇解法合成碳酸乙烯酯
吴雪梅,丁同梅,赫崇衡,田恒水
(华东理工大学化工学院,上海 200237)
在干燥碱式碳酸锌催化剂的作用下,以尿素和乙二醇(EG)为原料合成碳酸乙烯酯(EC)。重点考察了催化剂用量、原料配比、反应温度、反应时间对反应结果的影响。并通过GC-MS、FTIR和XRD分析,初步探索了反应机理以及碱式碳酸锌的作用机理。结果表明:当催化剂用量为尿素质量的6%,原料配比n(EG)∶n(尿素)=1∶1,反应温度160℃,反应时间3h,反应压力为0.01MPa时,碳酸乙烯酯收率达到91.64%。尿素和乙二醇合成碳酸乙烯酯的反应中,尿素首先分解生成异氰酸,异氰酸再与乙二醇反应生成中间产物 2-羟乙基氨基甲酸酯(2-HEC),最后 2-羟乙基氨基甲酸酯脱氨环化生成碳酸乙烯酯。所用碱式碳酸锌催化剂中存在Zn4CO3(OH)6·H2O和ZnO两种晶相,且以ZnO为主活性组分,两种晶相的协同作用提高了反应收率。
碳酸乙烯酯;催化剂;尿素;合成;醇解法;碱式碳酸锌
碳酸乙烯酯是一种重要的有机合成中间体和性能优良的高沸点清洁溶剂[1],广泛用于高分子、医药、石油化工、纺织及电化学等领域[2-3]。环氧乙烷和二氧化碳合成法是目前工业上的主要生产方法,具有固定温室气体二氧化碳、工艺流程短等优点;但催化剂的选取和后续分离是影响反应的难点所在[4]。尿素醇解法,以尿素和乙二醇为原料合成碳酸乙烯酯,尿素廉价易得,对乙二醇的纯度要求不高,进而有效利用低品质乙二醇;非均相催化剂易于后续分离;副产物氨气可用来生产氨水或其他化学品。
SU 等[5]首次采用尿素和乙二醇在含锡催化剂存在下制备EC。LI等[6-7]发现ZnO对尿素醇解法合成碳酸亚烃酯具有高催化活性。ZHAO等[8]利用ZnO-Fe2O3作催化剂,常压条件下EC收率为66.1%。BHADAURIA等[9]利用ZnO-Cr2O3作催化剂,减压条件下EC收率达到85.75%。ZHOU等[10]采用Zn-Pb混合碳酸盐催化尿素醇解合成碳酸丙烯酯(PC),发现PbCO3和Zn5(CO3)2(OH)6的协同作用明显提高了催化剂活性,PC收率达到96.3%,并且弱碱性更有利于这种协同作用的提高。两种晶相协同作用提高 PC收率的报道在多篇文献中可见[11-12]。WU等[13]发现整体搅拌反应器比浆料反应器更适合于 PC的合成反应,采用ZnO-Cr2O3作催化剂,PC收率达到 97.8%。AN等[14]在固定床反应器中使用ZnO-Al2O3催化剂,PC收率可达到87.4%。本工作通过以干燥后的碱式碳酸锌为催化剂,采用尿素醇解法以尿素和乙二醇为原料合成 EC,重点对合成工艺条件进行优化,旨在提高产品收率,并初步探索反应机理。
1 实验部分
1.1 催化剂活性评价及表征
催化剂在烘箱中100℃下干燥12h。在150mL三口烧瓶中,加入一定量尿素、乙二醇和催化剂碱式碳酸锌,在压力0.01MPa下搅拌并逐渐升温至某一温度,加热反应一定时间。反应结束后冷却至室温分离出催化剂,得产物碳酸乙烯酯。
催化剂的晶相结构采用Bruker D8 FOCUS X射线衍射仪分析,射线源采用Cu-K射线,扫描范围2θ=10~80°,扫描速率2°/min,工作电压40KV,工作电流100mA。
1.2 产物分析
采用安捷伦6890对产物进行定量分析,FFAP毛细管柱,FID检测,初始柱温100℃保持2min,以10℃/min升到250℃,保持5min,进样器温度260℃,检测器温度 270℃。采用安捷伦气相色谱-质谱联用仪6890A-5973N进行定性分析,电子轰击源70eV。
FTIR仪器型号Nicolet5700,分辨率为2cm-1,扫描次数为32次,扫描范围400~4000cm-1。
2 结果与讨论
2.1 催化剂用量对反应的影响
反应温度 150℃、反应时间 3h、n(EG)/n(尿素) =1.5,考察催化剂用量对EC收率的影响,如图1。可以看出,随着催化剂用量的增加,EC收率先增加后减小,当催化剂的用量达到尿素质量的6%时,EC收率最大为80.38%。当催化剂用量低于6%时,催化剂活性中心少,导致EC收率较低;当催化剂的用量大于 6%时,活性中心过多,会导致尿素分解加剧。因此,适宜的催化剂用量为尿素质量的6%。
2.2 原料配比对反应的影响
反应温度150℃、反应时间3h、催化剂用量6%,考察原料配比对 EC收率的影响,如图 2。由图2可见,当n(EG)/n(尿素)小于1时,随着原料配比的增大,EC收率快速增加。当n(EG)/n(尿素)为1时,EC收率达到最大值86.8%,再继续增加原料配比,EC收率几乎呈直线下降。当n(EG)/n(尿素)值较小时,尿素在反应体系中溶解性较差,尿素不能与乙二醇充分接触而分解,从而导致EC收率较低;当n(EG)/n(尿素)较大时,尿素与活性中心的接触难度增加,从而导致收率下降。因此n(EG)∶n(尿素)较适宜的比为1∶1。
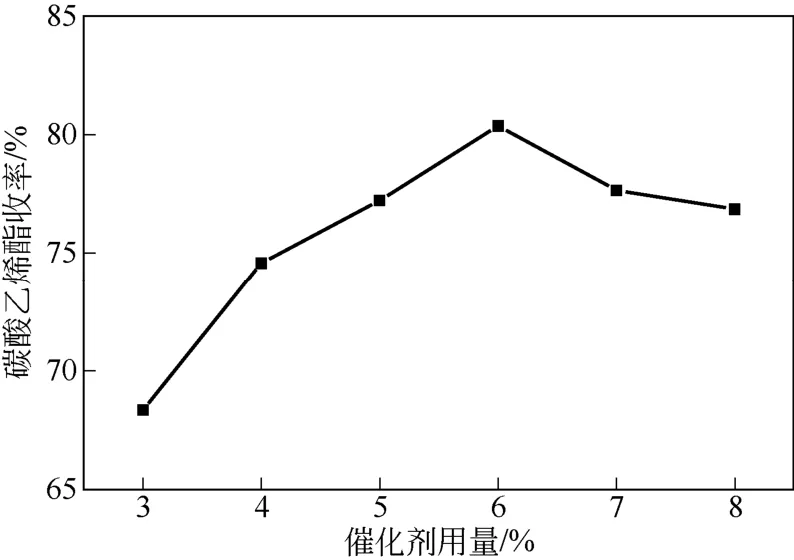
图1 催化剂用量对实验的影响

图2 原料配比对实验的影响
2.3 反应温度对实验的影响
反应时间 3h、催化剂用量 6%、n(EG)/n(尿素)=1,考察反应温度对EC收率的影响,如图3。由图3可知,随着温度的升高,EC收率先增大后减小,当温度达到 160℃时,EC收率达到最大值91.64%。从热力学角度分析,由于反应是吸热反应[15],提高温度有利于反应的正向进行;从动力学角度分析提高温度有利于反应速率的加快,缩短到达平衡的时间。所以当温度低于 160℃时,收率随着温度的增加快速增加。当反应温度超过160℃后,温度过高尿素分解加剧[16]导致收率下降。所以,最适宜的反应温度为160℃。
2.4 反应时间对实验的影响
反应温度160℃、催化剂用量6%、n(EG)/n(尿素)=1条件下,考察反应时间对EC收率的影响,如图4。由图4可知,当反应时间低于3h时,随着反应时间增加EC收率急速增大,当反应时间为3h时,EC收率达到最大值91.64%,继续增加反应时间EC的收率减小。当反应时间低于3h时,反应时间过短导致反应不充分,当反应时间超过3h时反应收率的下降可能是因为碳酸乙烯酯发生分解反应。因此最适宜的反应时间是3h。
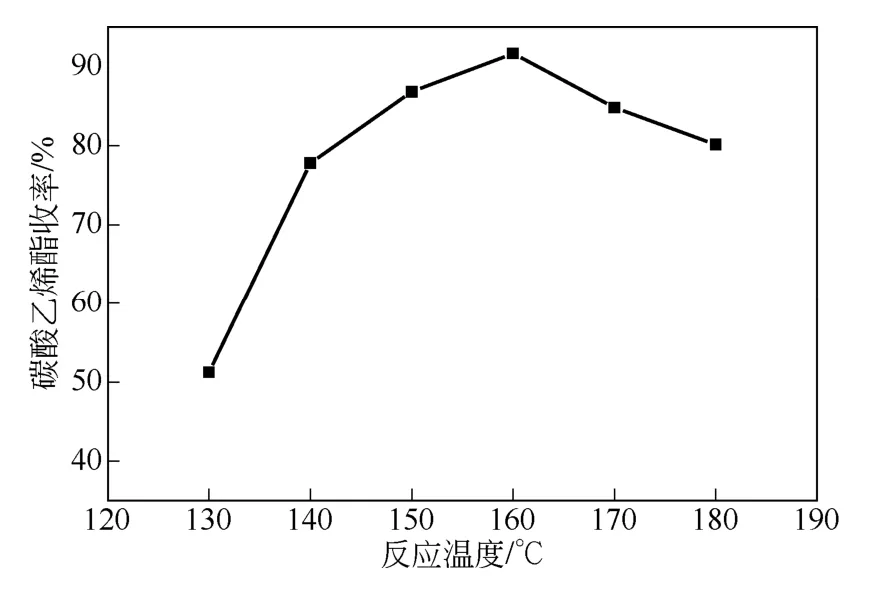
图3 反应温度对实验的影响

图4 反应时间对实验的影响
3 反应机理
3.1 GC-MS分析
通过空白试验,结合GC-MS分析发现产物中有EG、2-HEC以及EC,说明该反应在没有催化剂存在下也会发生。进一步在以上确定的最优条件下反应,对产物进行GC-MS分析,包括EC、EG、及少量的2-HEC和副产物2-唑烷酮。2-唑烷酮可能的生成方式如式(1)。

对比没有催化剂存在的情况下,副产物可能是在 2-HEC脱氨环化生成 EC的反应达到平衡后生成的[14]。
3.2 产物FTIR分析
对加入碱式碳酸锌催化剂反应体系的中间态进行红外分析,并对比空白试验的红外光谱,结果如图5。在3600cm-1左右的红外吸收对应OH的伸缩振动,在3300~3400cm-1的吸收峰对应 NH2的伸缩振动,1700cm-1是羰基伸缩振动,1620cm-1是NH2弯曲振动[17],因此可以确定中间产物2-HEC的生成。加入催化剂碱式碳酸锌后,在2220cm-1处出现了异氰酸物种O=C=N不对称伸缩振动[7,18]。文献研究表明尿素在合成缩二脲以及和有机胺、一元醇的反应中,尿素首先分解为异氰酸,再由异氰酸参与反应[19-20]。
结合GC-MS分析,推断反应机理为:尿素快速分解为异氰酸和氨气,异氰酸再和乙二醇反应生成中间产物2-HEC,2-HEC环化脱氨生成碳酸乙烯酯,如式(2)所示。
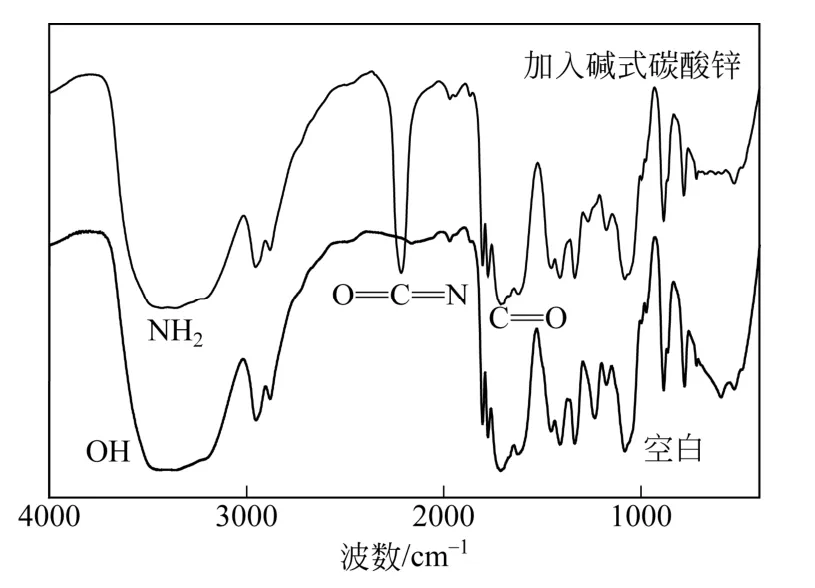
图5 尿素与碱式碳酸锌作用红外光谱
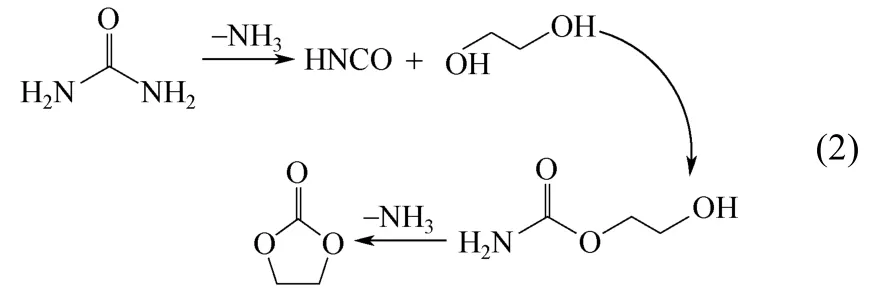
3.3 催化剂XRD表征
对干燥后的催化剂碱式碳酸锌进行XRD表征,结果如图6。
碱式碳酸锌主要有两种形式Zn5(CO3)2(OH)6和Zn4CO3(OH)6·H2O[21]。通过XRD分析,本实验所采用碱式碳酸锌其主要形式是 Zn4CO3(OH)6·H2O(JCPDS11-287)。由图6可以发现碱式碳酸锌中存在ZnO(JCPDS36-1451)晶相,且以ZnO晶相为主,说明存在协同作用。为了验证这一协同作用,相同反应条件下以ZnO为催化剂进行反应,碳酸乙烯酯收率为76.06%,因此可推测ZnO是主活性组分,Zn4CO3(OH)6·H2O和ZnO的协同作用提高了实验收率。而Zn4CO3(OH)6·H2O具有一定碱性,使这种协同作用比较明显[10-11]。

图6 碱式碳酸锌XRD图谱
4 结 论
(1)采用碱式碳酸锌催化尿素和乙二醇生成碳酸乙烯酯的最佳反应条件是:催化剂用量为尿素质量的6%,原料配比n(EG)/n(尿素)=1,反应温度为160℃,反应时间为 3h,反应压力为 0.01MPa,碳酸乙烯酯收率达到91.64%。
(2)尿素和乙二醇反应生成碳酸乙烯酯的反应机理是尿素快速分解为异氰酸和氨气,异氰酸再和乙二醇分两步反应生成目标产物碳酸乙烯酯。
(3)结合XRD发现碱式碳酸锌催化剂中存在Zn4CO3(OH)6·H2O和ZnO两种晶相,ZnO为主活性组分,两种晶相的协同作用提高了EC的收率。
[1] MATYJASZEWSKI K,JASIECZEK C B,NAKAGAWA Y,et al.Polymerization of n-butyl acrylate by atom transfer radical polymerization.Remarkable effect of ethylene carbonate and other solvents[J].Macromolecules,1998,31(5):1535-1541.
[2] 杨超.碳酸乙烯酯合成及其应用的研究[D].西安:西北大学,2010:1,36-38.
[3] 肖远胜,张雪峥,张书笈,等.酯交换法同时合成碳酸二甲酯及乙二醇[J].精细石油化工,2000(2):1-3.
[4] 黄焕生,杨波,黄科林,等.碳酸乙烯酯合成的研究进展[J].化工技术与开发,2007,36(11):15-19,37.
[5] SU W Y,SPERANZA G P.A process for preparing alkylene carbonates:EP 0443758A1[P].1991-08-28.
[6] LI Q B,ZHANG W Y,ZHAO N,et al.Synthesis of cyclic carbonate from urea and diols over metal oxides[J].Catalysis Today,2006,115:111-116.
[7] LI Q B,ZHAO N,WEI W.Catalytic performance of metal oxides for the synthesis of propylene carbonate from urea and 1,2-propanediol[J].Journal of Molecular Catalysis A:Chemical,2007,270:44-49.
[8] ZHAO X Q,AN H L,WANG S F,et al.Synthesis of ethylene carbonate from urea and ethylene glycol over zinc/iron oxide catalyst[J].Journal of Chemical Technology and Biotechnology,2008,83(83):750-755.
[9] BHADAURIA S,SAXENA S,PRASAD R,et al.Synthesis of ethylene carbonate from cyclocondensation of ethylene glycol and urea over ZnO·Cr2O3catalyst system controlled by co-precipitation method[J].European Journal of Chemistry,2012,3(2):235-240.
[10] ZHOU J C,WU D F,ZHANG B R,et al.Synthesis of propylene carbonate from urea and 1,2-propylene glycol over metal carbonates[J].Chemical Industry and Chemical Engineering Quarterly,2011,17(3):323-331.
[11] ZHANG T T,ZHANG B S,LI L,et al.Zn-Mg mixed oxide as high-efficiency catalyst for the synthesis of propylene carbonate by urea alcoholysis[J].Catalysis Communications,2015,66:38-41.
[12] DU Z P,CHEN F S,LIN Z K,et al.Effect of MgO on the catalytic performance of MgTiO3in urea alcoholysis to propylene carbonate[J].Chemical Engineering Journal,2014,278:79-84.
[13] WU D F,GUO Y L,GENG S,et al.Synthesis of propylene carbonate from urea and 1,2-propylene glycol in a monolithic stirrer reactor[J].Industrial & Engineering Chemistry Research,2013,52(3):1216-1223.
[14] AN H L,MA Y H,ZHAO X Q,et al.Preparation of Zn-Al oxide catalyst and its catalytic performance in propylene carbonate synthesis from urea and propylene glycol on a fixed-bed reactor[J].Catalysis Today,2016,264:136-143.
[15] 张瑾.尿素合成碳酸乙烯酯工艺的研究[D].天津:天津大学,2008:31-34.
[16] 张勇,郑超,陈文利,等.氧化锌对尿素热分解过程的催化作用[J].辽宁化工,2009,38(5):289-291.
[17] SHARMA P,DWIVEDI R,DIXIT R,et al.DFT-assisted mechanism evolution of the carbonylation of ethylene glycol to ethylene carbonate by urea over Zn(NCO)2·2NH3catalyst[J].Industrial & Engineering Chemistry Research,2013,52(32):10977-10987.
[18] 李奇飚,彭伟才,郭启文,等.ZnO催化尿素和丙二醇合成碳酸丙烯酯的反应研究[J].燃料化学学报,2007,35(4):447-451.
[19] 胡宏纹.有机化学(下册)[M].第2版.北京:高等教育出版社,1990:504.
[20] SCHABER P M,COLSON J,HIGGINS S,et al.Thermal decomposition (pyrolysis) of urea in an open reaction vessel[J].Thermochimica Acta,2004,424(1-2):131-142.
[21] 时文中,张昕,朱国才,等.制备纳米氧化锌前驱体碱式碳酸锌的热解动力学[J].无机盐工业,2004,36(6):19-22.
Synthesis of ethylene carbonate by urea alcoholysis
WU Xuemei,DING Tongmei,HE Chongheng,TIAN Hengshui
(College of Chemical Engineering,East China University of Science and Technology,Shanghai 200237,China)
The synthesis of ethylene carbonate from urea and ethylene glycol as raw materials over basic zinc carbonate. The influence of reaction conditions such as the amount of catalyst,raw material ratio,reaction temperature and reaction time on the reaction was discussed in detail. And the mechanism of reaction and the effect of basic zinc carbonate were preliminarily explored by using GC-MS,FTIR and XRD. The results showed that the yield of EC could reach 91.64% under the optimum reaction conditions: the catalyst concentration 6% (based on the mass of urea),n(EG)∶n(urea) = 1∶1,the reaction time 3h,and the reaction temperature 160℃,and 0.01MPa of pressure. In this reaction,urea decomposed to isocyanic acid in the first step. Then,isocyanic acid reacted with ethylene glycol to produce the intermediate product 2-hydroxyethyl carbamate (2-HEC). 2-HEC deaminized and cyclized to produce EC. Two crystal phases of Zn4CO3(OH)6·H2O and ZnO exist in the catalyst,in which ZnO acted as the main active component. The synergistic effect of the two crystal phases improved the yield of EC.
ethylene carbonate;catalyst;urea;synthesis;urea alcoholysis;basic zinc carbonate
TQ 203.2
A
1000-6613(2016)10-3263-04
10.16085/j.issn.1000-6613.2016.10.034
2016-03-04;修改稿日期:2016-05-05。
吴雪梅(1990—),女,硕士研究生。联系人:田恒水,教授,博士生导师。E-mail hstian@ecust.edu.cn。

