葡萄皮渣多酚提取及其对五种食源性致病菌的抑制作用
聂相珍,申丽媛
(扬州大学 旅游烹饪学院,江苏 扬州 225127)
葡萄皮渣多酚提取及其对五种食源性致病菌的抑制作用
聂相珍,申丽媛
(扬州大学 旅游烹饪学院,江苏 扬州 225127)
以葡萄皮渣为原料,采用乙醇溶液对葡萄皮渣中的多酚类物质进行浸提,用Folin-Ciocalteu法测定多酚含量,通过单因素及正交试验得出浸提的最佳工艺条件为:乙醇体积分数45%,浸提温度48℃,浸提时间8 h,料液比1∶15(g∶mL),多酚得率为:16.48 mg/g。采用滤纸片法进行葡萄皮渣多酚的抑菌试验,发现其对金黄色葡萄球菌(Staphylococcus aureus)、志贺氏菌(Shigella)、单增李斯特菌(Listeria monocytogenes)、沙门氏菌(Salmonella)、大肠杆菌(Escherichia coli)都有一定的抑菌作用,其中对金黄色葡萄球菌和沙门氏菌的抑制效果最好。
葡萄皮渣;多酚;乙醇浸提;抑菌活性
葡萄皮渣中富含酚类物质,如没食子酸、原花青素、儿茶素、鞣酸及白藜芦醇等[1-4]。近年来,很多研究证实了这些酚类物质具有多种生物活性,如延缓衰老、抗癌、抗氧化、抑制微生物生长、抗病毒等[5-10]。我国葡萄产量位居世界水果产量的前列[11],大部分酿酒葡萄皮渣用于生产饲料和肥料,有的酿酒厂则将葡萄皮渣直接丢弃,造成资源浪费,并且也给环境带来沉重的压力[12-13]。而法国、西班牙、意大利等葡萄酒大国其大部分葡萄酒渣都已被应用到食品、医学等领域,具有一定的市场规模,70%以上的酿酒葡萄废弃物都得到了很好地利用[11]。研究和解决葡萄废弃物的利用问题,不仅可产生很高的经济价值和社会价值[14],而且有利于葡萄酒产业的发展。
目前,葡萄皮渣中多酚类物质的提取方法主要有溶剂提取法[15]、(主要包括浸渍法、煎煮法、渗漉法、回流提取法)、超声波辅助提取法[16-17]、微波辅助提取法[18]、生物酶水解提取法[19]、超临界流体萃取法[20]、大孔吸附树脂纯化法[21]等。其中,溶剂提取法由于对操作设备要求简单、产品得率较高、低成本等原因成为目前应用最为广泛的方法;因此,本实验采用溶剂提取法中的乙醇浸提法从酿酒剩余的赤霞珠葡萄皮渣中提取多酚物质,优化提取工艺,并探究其对金黄色葡萄球菌(Staphylococcus aureus)、志贺氏菌(Shigella)、单增李斯特菌(Listeria monocytogenes)、沙门氏菌(Salmonella)、大肠杆菌(Escherichia coli)的抑制作用,以期为新型食品防腐剂的开发提供一定的参考。
1 材料与方法
1.1材料与试剂
赤霞珠葡萄皮渣:市售。
志贺氏菌、沙门氏菌、单增李斯特菌、大肠杆菌、金黄色葡萄球菌:实验室保存。
无水乙醇(分析纯):北京化工厂;福林酚(Folin-Ciocalteu)、没食子酸(分析纯):北京索莱宝科技有限公司。
1.1.2培养基
牛肉膏蛋白胨培养基:牛肉膏5.0 g/L,蛋白胨10.0 g/L,NaCl 5 g/L,蒸馏水1 000 mL,pH 7.2~7.4。
1.2仪器与设备
BS2443电子分析天平:北京赛多利斯仪器系统有限公司;HH-8数显恒温水浴锅:常州国华电器有限公司;85-2A数显恒温磁力搅拌器:上海玺袁科学仪器有限公司;FZ102微型植物粉碎机:上海书培实验设备有限公司;722G可见分光光度计:上海精密科学仪器有限公司;PYX-DHS-50×60-BS-Ⅱ隔水式电热恒温培养箱:上海跃进医疗器械厂。
1.3方法
1.3.1乙醇浸提法提取葡萄皮渣中的多酚类物质
原料预处理:将酿酒下脚料赤霞珠葡萄皮渣,经分离、阴干后,将葡萄皮渣放入50℃的烘箱中干燥2 h,烘干后,粉碎得到葡萄皮渣干粉,备用。
单因素试验:称取一定量的葡萄皮渣粉末置于锥形瓶中,按一定的料液比加入适当体积分数的乙醇溶液,封口,在适当温度下水浴浸提一段时间。分别考察料液比(1∶7、1∶9、1∶11、1∶13、1∶15、1∶17(g∶mL))、乙醇体积分数(30%、40%、50%、60%、70%)、浸提温度(30℃、35℃、40℃、45℃、50℃)和浸提时间(3 h、5 h、7 h、9 h、11 h)对葡萄皮渣中多酚得率的影响。
1.3.2正交试验
在单因素试验结果的基础上,以葡萄皮渣中多酚物质得率(Y)为评价指标,对乙醇体积分数(A)、浸提温度(B)、浸提时间(C)和料液比(D)进行优化正交试验,确定最佳的提取条件。正交试验因素与水平见表1。

表1 葡萄皮渣多酚提取工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction process optimization of grape pomace polyphenols
1.3.3Folin-Ciocalteu法测定多酚含量
没食子酸标准曲线的绘制:准确称10 mg没食子酸于烧杯中,制成0.1g/L的标准溶液。准确移取100μL、200 μL、400 μL、600 μL、800 μL没食子酸标准溶液于10 mL的棕色容量瓶中,用双蒸水补充至2.0mL。然后再加入福林酚试剂1.0 mL和质量分数为26.7%的Na2CO3饱和溶液4.0 mL,充分混匀,再加入蒸馏水定容至10 mL。在室温条件下静置2 h,在波长760 nm处测定吸光度值(A),最后以没食子酸的质量浓度(x)为横坐标,吸光度值(y)为纵坐标制作没食子酸标准曲线。
葡萄皮渣多酚含量的测定:浸提液经过旋转蒸发浓缩后,用蒸馏水定容至50mL,准确移取50 μL浸提液于10 mL棕色容量瓶中,采用上述福林酚法测定吸光度值,根据没食子酸标准回归方程计算多酚含量及多酚得率。
1.3.4抑菌试验
菌种的活化:将5种致病菌(金黄色葡萄球菌、大肠杆菌、志贺氏菌、单增李斯特菌、沙门氏菌)分别接种至牛肉膏蛋白胨斜面培养基中,37℃恒温培养24 h。
菌悬液的制备:在活化后的斜面培养基中注入1 mL无菌水,将斜面生长的细菌菌落刮下,振荡摇匀,小心挑取一环接入到装有9 mL无菌生理盐水的试管中,振荡、摇匀,制成菌悬液待用。
抑菌试验:采用无菌操作将灭过菌的培养基倾注于培养皿中,每个培养皿装15~20 mL(培养皿中培养基厚度约3~5 mm),待培养基凝固,用移液枪移取1 mL金黄色葡萄球菌的菌悬液于培养皿中,涂布均匀,静置,菌液被充分吸收后,向4 mm灭菌滤纸圆片上注入20 μL配制好的3 mg/mL的葡萄皮渣多酚溶液,立即将滤纸片贴在培养基表面。按照十字形对称贴4张滤纸圆片,其中3个是注入3 mg/mL的葡萄皮渣多酚溶液,另外的1个是注入20 μL无菌生理盐水(对照),37℃培养24 h后,取出观察抑菌圈大小,记录结果。按照同样的操作,分别在滤纸圆片上注入5 mg/mL、8 mg/mL、10 mg/mL、12 mg/mL的不同质量浓度葡萄皮渣多酚溶液,考察其抑菌效果。大肠杆菌、志贺氏菌、单增李斯特菌、沙门氏菌重复同样操作步骤。
2 结果与分析
2.1标准曲线的绘制
横坐标为没食子酸的质量浓度(x),纵坐标为波长760 nm处的吸光度值(y),绘制没食子酸标准曲线,结果如图1所示。

图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
由图1可知,没食子酸标准曲线回归方程为:y=0.110 33x+ 0.014 26,相关系数R2=0.999 040,在1~8 mg/L质量浓度范围内,没食子酸与吸光度值呈良好的线性关系。
2.2单因素试验结果
2.2.1料液比对葡萄皮渣多酚得率的影响
由图2可知,随着料液比的逐渐增大,葡萄皮渣中多酚得率整体呈上升的趋势。当料液比<1∶15(g∶mL)时,多酚得率增加速度快,提取液体积较小时,葡萄皮渣可能与乙醇溶液接触不充分,导致提取不完全;当料液比到达1∶15(g∶mL)后继续增大料液比,多酚得率增加缓慢。因此,选择料液比为1∶15(g∶mL)进行正交试验。
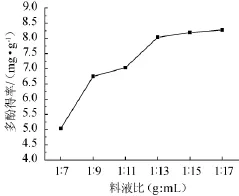
图2 料液比对葡萄皮渣多酚得率的影响Fig.2 Effect of solid-liquid ratio on the yield of polyphenols in grape pomace
2.2.2乙醇体积分数对葡萄皮渣多酚得率的影响
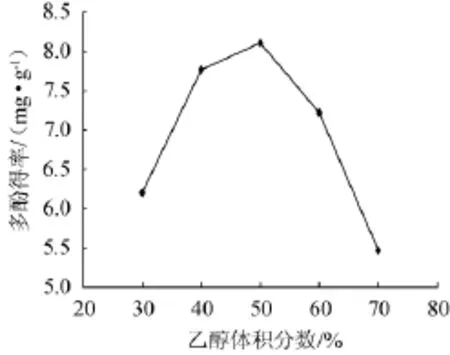
图3 乙醇体积分数对葡萄皮渣多酚得率的影响Fig.3 Effect of ethanol concentration on the yield of polyphenols in grape pomace
由图3可知,随着乙醇体积分数的逐渐增大,葡萄皮渣中多酚类物质的得率呈先上升后下降的趋势。当乙醇体积分数为50%时,葡萄皮渣中多酚类物质的得率达到最大;继续增大乙醇体积分数,葡萄皮渣中多酚得率则开始下降。原因可能为多酚类物质的分子结构中存在着酚羟基、羟基等,在植物体内通常与其他物质通过氢键连接,而乙醇可以破坏这些氢键,当乙醇体积分数较低时,水的含量相对较大,从而会浸出许多水溶性杂质,多酚类物质得率便较低。随着乙醇体积分数增大,多酚类物质得率也增加;而当乙醇体积分数过高时,可能会使多酚类物质在乙醇溶液中的溶解性降低,反而不利于多酚类物质溶解,导致得率降低。因此,选择乙醇体积分数为50%进行正交试验。
2.2.3浸提温度对葡萄皮渣中多酚得率的影响

图4 浸提温度对葡萄皮渣多酚得率的影响Fig.4 Effect of extraction temperature on the yield of polyphenols in grape pomace
由图4可知,随着浸提温度的升高,葡萄皮中多酚类物质的得率先呈上升趋势,当浸提温度为45℃时,多酚得率达到最高;当浸提温度继续提高时,葡萄皮中多酚类物质的得率则呈下降趋势。通常情况下,随着温度的升高,分子运动速率会加快,多酚类物质从葡萄细胞中溶到乙醇溶液中的速度就会加快,得率也会逐渐增大。但是当温度增大到一定程度时,多酚类物质可能被破坏,致使多酚类物质的得率下降。因此,选择浸提温度为45℃进行正交试验。
2.2.4浸提时间对葡萄皮渣多酚得率的影响

图5 浸提时间对葡萄皮渣多酚得率的影响Fig.5 Effect of extraction time on the yield of polyphenols in grape pomace
由图5可知,随着浸提时间的增加,葡萄皮渣中多酚类物质得率先呈上升趋势,当浸提时间为7 h时,多酚得率达到最大。随着浸提时间的继续增大,葡萄皮渣中多酚类物质得率逐渐下降。一般情况下,浸提时间越长,溶解于乙醇溶液中的多酚类物质会越多,得率会越大。但是当浸提时间达到一定值时,多酚类物质已大体溶于溶剂乙醇溶液中,长时间加热可能会使多酚类物质缩合,进而导致多酚得率下降。因此,选择浸提时间7 h进行正交试验。
2.3正交试验结果
根据单因素试验结果,设计正交试验因素水平表,采用L9(34)正交试验设计,正交试验结果与分析见表2,方差分析见表3。
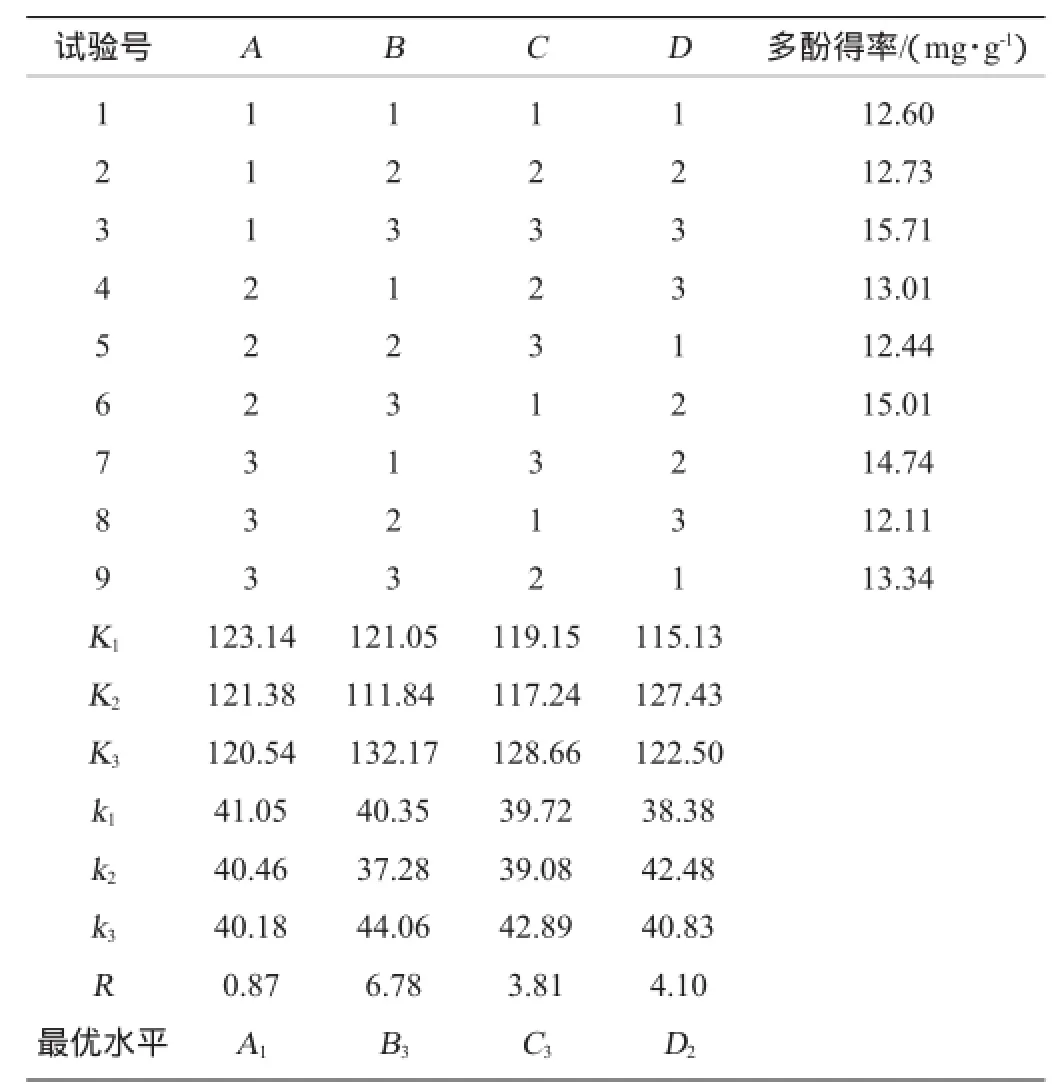
表2 葡萄皮渣中多酚提取工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for extraction process optimization of grape pomace polyphenols

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表2极差R值可知,采用乙醇法提取葡萄皮渣中多酚类物质时,各因素对葡萄皮渣多酚得率影响的大小顺序是:B>D>C>A,即浸提温度>料液比>浸提时间>乙醇体积分数,最优提取方案为A1B3C3D2,即乙醇体积分数45%,浸提温度48℃,浸提时间8 h,料液比1∶15(g∶mL)。
由表3方差分析结果表明,乙醇体积分数、浸提温度、浸提时间和料液比4个因素的F值均远高于6.23,对多酚得率均有极显著影响。而从表中4个因素的F值大小可以看出,FB>FD>FC>FA,即各因素对葡萄皮渣多酚类物质得率影响的主次顺序是浸提温度>料液比>浸提时间>乙醇体积分数,方差分析结果与极差分析得出的结果一致。
2.4验证试验结果
正交试验理论结果的最优方案为A1B3C3D2,而表2中最优方案为A1B3C3D3。对两种方案通过3次平行试验进行验证。在A1B3C3D3条件下葡萄皮渣多酚得率为15.71 mg/g,而验证试验中,在A1B3C3D2条件下葡萄皮渣多酚得率为16.48 mg/g,因此确定提取的最佳工艺为A1B3C3D2,即乙醇体积分数45%,浸提温度48℃,浸提时间8 h,料液比为1∶15(g∶mL)。
2.5葡萄皮渣多酚物质对供试菌的抑菌效果
按照试验方法,分别测定了不同质量浓度的葡萄皮渣多酚提取物对5种供试菌的抑菌圈大小,考察葡萄皮渣多酚类物质对5种供试菌的抑制效果,试验结果见表4。
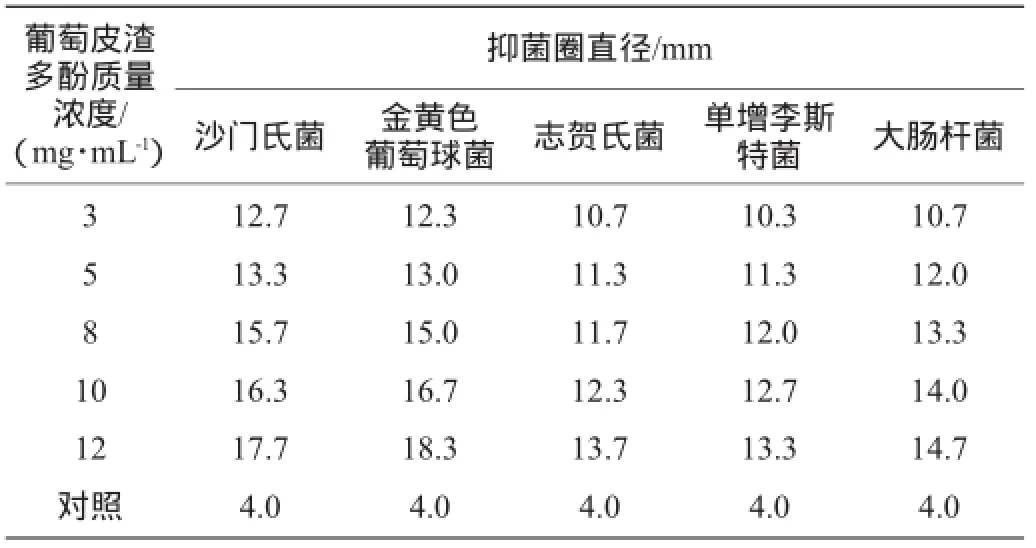
表4 不同质量浓度的葡萄皮渣多酚提取物对供试菌的抑菌效果Table 4 Inhibitory effect of different polyphenol extracts concentrations on tested bacteria
抑菌圈直径越大,说明抑菌效果越明显[22]。由表4可知,葡萄皮渣中多酚提取物质量浓度越大,抑菌圈直径越大,当葡萄皮渣多酚提取物质量浓度为12 mg/mL时,对沙门氏菌、金黄色葡萄球菌、志贺氏菌、单增李斯特菌和大肠杆菌的抑菌圈直径分别为17.7mm、18.3mm、13.7mm、13.3mm、14.7 mm。与空白对照相比,葡萄皮渣中多酚提取物对5种致病菌具有明显的抑菌效果,其中对金黄色葡萄球菌和沙门氏菌的抑制效果最好,其次是大肠杆菌。
3 结论
本实验采用乙醇浸提法提取葡萄皮渣中多酚类物质,利用单因素和正交试验对提取工艺进行了优化,并对葡萄皮渣多酚提取物的抑菌效果进行了研究。结果表明,葡萄皮渣多酚的最佳提取工艺为:乙醇体积分数为45%,浸提温度为48℃,浸提时间为8 h,料液比为1∶15(g∶mL)。在此条件下,多酚得率为16.48 mg/g。抑菌效果结果表明,葡萄皮渣中的多酚提取物对金黄色葡萄球菌、志贺氏菌、单增李斯特菌、沙门氏菌和大肠杆菌都表现了明显的抑菌作用,并且随着多酚物质质量浓度的增大抑制作用增强,其中对金黄色葡萄球菌和沙门氏菌的抑制效果最好。为葡萄皮渣多酚提取物作为新型天然食品防腐剂的开发和综合利用提供理论基础。
[1]高学峰,杨继红,王华.葡萄及葡萄酒生产过程中副产物的综合利用研究进展[J].食品科学,2015,36(7):298-304.
[2]令博.葡萄皮渣膳食纤维的改性及其生理功能和应用研究[D].重庆:西南大学,2012.
[3]党艳艳,郭禹熙,曹文静,等.葡萄籽多酚类物质的盐析萃取[J].化工学报,2014,65(8):3048-3053.
[4]张昂.葡萄冬剪枝条抗氧化特性及活性酚类成分的研究[D].杨凌:西北农林科技大学,2013.
[5]贾荣.山葡萄籽多酚提取物及抗氧化活性的研究[D].长春:吉林大学,2010.
[6]李焱,刘仲华.葡萄多酚提取及抗氧化研究进展[J].农产品加工·学刊,2013(2):52-55.
[7]吕昕泽,吴秀祯,张卫.葡萄多酚对心肌保护作用研究进展[J].药物评价研究,2012(1):46-52.
[8]朱美蓉,房玉林.葡萄多酚研究进展及其开发利用[J].中国酿造,2015,34(12):1-4.
[9]李黔柱.以没食子酸为先导合成1,2,4-三唑衍生物及抗菌和抗病毒活性研究[D].贵阳:贵州大学,2009.
[10]王华,刘霞,杨继红,等.葡萄籽原花青素抗癌活性及其机制研究进展[J].安徽大学学报:自然科学版,2012,36(4):101-108.
[11]闫瑜.中国葡萄酒产业国际竞争力分析[D].青岛:中国海洋大学,2011.
[12]米雪.酿酒葡萄的综合开发利用价值[D].杨凌:西北农林科技大学,2009.
[13]吕庆峰.近现代中国葡萄酒产业发展研究[D].杨凌:西北农林科技大学,2013.
[14]李鹏.农业废弃物循环利用的绩效评价及产业发展机制研究[D].武汉:华中农业大学,2014.
[15]LAFKA T,SINANOGLOU V,LAZOS E S.On the extraction and antioxidant activity of phenolic compounds from winery wastes[J].Food Chem,2007,104(3):206-1214.
[16]令博,王捷,吴洪斌.等.葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J].食品科学,2011,32(18):24-29.
[17]DENG Q,PENNER M H,ZHAO Y.Chemical composition of dietary fiber and polyphenols of five different varieties of wine grape pomace skins[J].Food Res Int,2011,44(9):2712-2720.
[18]李凤英.葡萄皮籽多酚物质的提取技术研究[D].北京:中国农业大学,2004.
[19]CHAMORRO S,VIVEROS A,ALVAREZ I,et al.Changes in polyphenol and polysaccharide content of grape seed extract and grape pomace after enzymatic treatment[J].Food Chem,2012,33(2):308-314.
[20]PINELO M,RUIZ-RODRÍGUEZ A,SINEIRO J,et al.Supercritical fluid and solid-liquid extraction of phenolic antioxidants from grape pomace:a comparative study[J].Eur Food Res Tech,2007,226(1):199-205.
[21]郭雄飞,倪慧,卿德刚,等.葡萄籽中多酚类物质的提取和纯化工艺[J].西北农业学报,2009(4):41-44.
[22]黄和,林晓霞,邝高波,等.番石榴多酚成分分析及抑菌活性研究[J].热带作物学报,2014,35(12):2482-2487.
Extraction of polyphenols in grape pomace and their inhibition on five kinds of food-borne pathogenic bacteria
NIE Xiangzhen,SHEN Liyuan
(School of Tourism and Culinary Science,Yangzhou University,Yangzhou 225127,China)
With the grape pomace as raw material,the polyphenols in grape pomace were extracted by ethanol method,and the polyphenols content was determined by Folin-Ciocalteu method.Through single factor and orthogonal experiments,the optimum process conditions were ethanol 45%,extraction temperature 48℃,extraction time 8 h and solid-liquid ratio 1∶15(g∶ml).Under the conditions,the polyphenols yield was 16.48 mg/g.The antibacterial activity of grape pomace polyphenols was researched by filtering paper method.Results showed that the polyphenols had a certain inhibitory effect onStaphylococcus aureus,Shigella,Listeria monocytogenes,SalmonellaandEscherichia coli,and the inhibitory effect of the polyphenols onS.aureusandSalmonellawas the optimal.
grape pomace;polyphenols;ethanol extraction;antimicrobial activity
TS262.6
0254-5071(2016)09-0101-05doi:10.11882/j.issn.0254-5071.2016.09.023
2016-05-23
江苏省高校自然科学研究计划项目(No.05KJB150148)
聂相珍(1991-),女,硕士研究生,研究方向为食物成分与人体健康的研究。

