基于立方体纳米氧化亚铜修饰的安培型葡萄糖生物传感器的制备及性能研究
马真真 余会成 吴朝阳 吴燕 肖福兵

摘要:将合成的立方体纳米氧化亚铜用于修饰玻碳电极,在其上固定葡萄糖氧化酶,构建了高灵敏的安培型葡萄糖生物传感器。采用X射线衍射(XRD)、扫描电镜(SEM)对合成的立方体纳米氧化亚铜及其修饰电极进行了表征。结果表明,合成的纳米氧化亚铜为均匀的立方体形状。采用循环伏安法 (CV)、交流阻抗谱 (EIS)、差分脉冲伏安法 (DPV) 及计时电流法 (CA)考察了修饰电极的电化学行为。在含0.1 mmol/L葡萄糖的磷酸盐缓冲溶液(pH 7.4)中研究了立方体纳米氧化亚铜修饰电极的循环伏安(CV)响应,实验结果表明,此修饰电极对葡萄糖显示出良好的电催化性能。DPV响应电流与葡萄糖的浓度在5.0×10mol/L(S/N=3)。CA实验结果表明,尿酸、抗坏血酸、D果糖对传感器不产生干扰。本传感器具有较好的重现性和稳定性,可用于实际样品中葡萄糖的检测。
关键词 :立方体纳米氧化亚铜; 葡萄糖氧化酶; 葡萄糖; 电催化; 生物传感器
1 引 言
葡萄糖浓度的准确检测在临床医学、生物学、环境科学、食品分析等领域极为重要[1]。目前,测定葡萄糖浓度的方法主要有分光光度法[2]、荧光检测法[3]、高效液相色谱法[4]及毛细管电泳法[5]等,这些方法大多数灵敏度低或耗时长、成本较高。电化学传感器具有灵敏度高、响应时间短、线性范围宽、成本低并且可在线检测等优点,因此电化学葡萄糖生物传感器已经成为研究热点之一[6]。
目前,电化学葡萄糖传感器多采用葡萄糖氧化酶 (GOx)修饰电极[7]。直接将GOx涂滴在电极表面上,GOx很容易丧失活性,电子传递也较慢;采用壳聚糖或Nafion等成膜,通过戊二醛交联,可将GOx固定在电极表面膜上,但固定的GOx在电极上的电子传递受到明显抑制,因此所构建的电化学传感器的灵敏度较低。
纳米材料具有较大比表面积、良好的电子传递能力[8],铂、金、银、碳纳米管、石墨烯等纳米材料已被广泛用于修饰GOx传感电极表面,以提高检测葡萄糖的灵敏度[9~11]。纳米材料的电催化性能不但取决于材料尺寸及元素组成,还取决于材料的形貌,高表面能的晶面常比低表面能的晶体表现出更高的电催化活性[12~15]。纳米氧化亚铜作为新型的p 型氧化物半导体材料, 具有活性的电子空穴对, 表现出良好的电催化活性[16]。Li等[17]制备了正八面体纳米氧化亚铜与碳纳米量子点复合物修饰的非酶性葡萄糖传感器;Khan等[18]发现飞镖状纳米氧化亚铜可在葡萄糖的检测中表现出良好的电催化效果。
为了提高电化学方法检测葡萄糖的灵敏度,本研究合成了立方体纳米氧化亚铜,构建了基于立方体纳米氧化亚铜修饰电极的安培型葡萄糖生物传感器,采用循环伏安法(CV)、交流阻抗 (EIS)技术、差分脉冲伏安法 (DPV)及计时电流法 (CA)对修饰电极的电化学行为进行了研究,考察了其对葡萄糖的分析性能。
2 实验部分
2.1 仪器与试剂
CHI660E型电化学工作站(上海辰华仪器有限公司);PHS3C型pH计(上海雷磁仪器厂);Ultima Ⅳ型X射线衍射仪(日本理学株式会社);SUPRA 40/40VP场发射扫描电镜(德国卡尔蔡司公司)。
葡萄糖氧化酶 (Glucose oxidase, GOx, E. C1. 1. 3. 4, 234, 900 units/g)、 尿酸 (UA, 純度 99%)、L抗坏血酸 (AA, 纯度 99%)、D果糖 (Fru, ≥99.0% (HPLC))、牛血清白蛋白 (冻干粉, Protease, essentially free, ≥98%)、二茂铁 (98%)、葡萄糖 (≥99.5% (GC))均购自Sigma 公司;CuCl2 (纯度99%)、NaOH (纯度99.9%)、丙酮 (纯度99.7%)及无水乙醇 (纯度99.7%)均购自天津科密欧化学试剂厂。除非特殊说明,所有试剂均为分析纯。实验用水为超纯水 (18.3 MΩ cm)。
2.2 实验方法
2.2.1 立方体纳米氧化亚铜的合成 立方体纳米氧化亚铜的合成参考文献\[19\]并稍作改进。将1.0 mL 0.1 mol/L CuCl2溶液及1.0 mL 0.5 mol/L NaOH溶液加入到50 mL超纯水中,持续搅拌,出现蓝色的Cu(OH)2沉淀后再搅拌5 min。然后加入1.0 mL 0.1 mol/L抗坏血酸溶液,沉淀由蓝色变成黄色,最后又变成砖红色。反应30 min后,10000 r/min离心5 min,并用超纯水洗涤沉淀3次,沉淀最后保存在乙醇溶液中。
2.2.2 修饰电极的制备 将玻碳电极(GCE, Φ=2 mm)表面依次用0.3和0.05 μm的Al2O3粉末抛光成镜面,然后依次用超纯水、稀HNO3(1∶1, V/V)、乙醇、超纯水各超声清洗5 min。
将5 mL 立方体纳米氧化亚铜 (8.0 mg/mL)悬浊液分散在 5 mL 5% Nafion溶液中,然后取8 μL溶液均匀滴涂在电极表面,置于红外灯下,挥发干溶剂后,滴涂6 μL 1.25% (V/V)戊二醛,然后滴涂8 μL 含有10 mg/L葡萄糖氧化酶、8. 0 mg/L 牛血清白蛋白及5.0 mg/L二茂铁 (电子媒介体)的混合溶液,在室温下放置晾干8 h, 用磷酸盐缓冲溶液 (PBS)洗去多余的反应物,干燥后即得葡萄糖氧化酶立方体纳米氧化亚铜修饰电极 (GOx/Cu2O/GCE)。 无纳米氧化亚铜修饰的葡萄糖氧化酶电极 (GOx/GCE)的制备除了不加立方体纳米氧化亚铜外,其余步骤同上。
2.2.3 电化学测试 采用三电极体系:修饰GCE电极为工作电极,甘汞电极为参比电极,铂丝为对电极为。在含有不同浓度葡萄糖的0.1 mol/L Na2HPO4KH2PO4缓冲溶液 (PBS,pH 7. 4)中进行CV, DPV及CA测试。
3 结果与讨论
3.1 材料及修饰电极的表征
采用抗坏血酸还原法制备的纳米氧化亚铜的X射线衍射(XRD)图谱、扫描电镜(SEM)图及其修饰电极的SEM图如图1所示。由图1a可见,XRD谱中所有的衍射峰都与氧化亚铜立方晶系的标准图谱相对应 (JCPDS 5667,晶胞参数a=0.4269 nm), 且具有较高的衍射强度,峰形尖锐,表明产物结晶性较好;合成的材料无杂质峰, 表明产物晶型单一,晶体纯度高。由图1b可见,制备的纳米氧化亚铜呈立方体形状,分散性良好,大小均匀,粒径约为80 nm。从图1c可见,纳米氧化亚铜在玻碳电极表面分布均匀,有利于电极表面上进行的电催化反应。
3.2 立方体纳米氧化亚铜修饰电极的电化学表征
葡萄糖氧化酶 (GOx)催化氧化溶液中的葡萄糖生成葡萄糖酸内酯及H2O2,H2O2 的生成量与溶液中葡萄糖的含量相关,电子媒介体二茂铁能够与电极表面上GOx的氧化还原中心进行有效的传输电子,使反应不断进行,因此可通过检测酶催化反应释放的H2O2间接检测溶液中葡萄糖的浓度[20]。
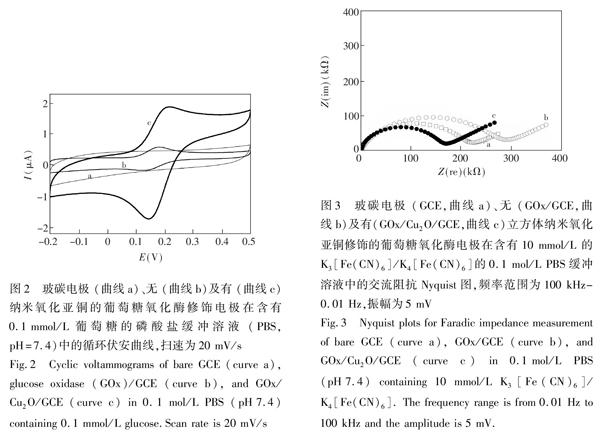
玻碳电极 (GCE,曲线a)、无(GOx/GCE,曲线b)及有 (GOx/Cu2O/GCE,曲线c)纳米氧化亚铜的葡萄糖氧化酶修饰电极在含有0.1 mmol/L葡萄糖的PBS缓冲溶液中的循环伏安图如图2所示,玻碳电极 (曲线a)未出现氧化还原峰;GOx/GCE电极的循环伏安曲线上出现了一对氧化还原峰,为H2O2的氧化还原峰,但峰电流较小。这是因为GOx包埋固定在电极表面膜上,其电子传递受到抑制;而GOx/Cu2O/GCE电极的循环伏安曲线出现一对明显的氧化还原峰,且峰电流与GOx/GCE相比显著增大,说明纳米氧化亚铜对葡萄糖氧化具有显著的电催化作用。
采用K3\[Fe(CN)6\]/K4\[Fe(CN)6\]作为电子探针测定制备的葡萄糖氧化酶纳米氧化亚铜修饰玻碳电极上的交流阻抗谱。交流阻抗Nyquist图中高频区的半圆的直径对应于电极表面的电荷转移电阻(Rct),半圆直径越小,电荷转移电阻越小,电子在电极表面上的电子转移越容易[21]。
玻碳电极 (GCE,曲线a)、无立方体纳米氧化亚铜(GOx/GCE,曲线b)及有立方体纳米氧化亚铜(GOx/Cu2O/GCE,曲线c)的葡萄糖氧化酶修饰电极在含有10 mmol/L K3\[Fe(CN)6\]/K4\[Fe(CN)6\]的0.1 mol/L PBS缓冲溶液中的交流阻抗Nyquist图如图3所示,无纳米氧化亚铜的葡萄糖氧化酶修饰电极的半圆的直径最大(曲线b),这是由于葡萄糖氧化酶固定在电极表面膜上,包埋固定的GOx阻碍了探针在电极上的电子传递。当采用立方体纳米氧化亚铜修饰电极后,半圆的直径显著变小,说明立方
体纳米氧化亚铜可以有效地加速电子在电极表面上的传递。玻碳电极及各修饰电极的交流阻抗谱的结果与循环伏安的研究结果一致。
3.4 传感器选择性和稳定性
采用计时电流法,考察了不同干扰物对本传感器的干扰情况。在搅拌的条件下,连续添加0.1 mmol/L的尿酸 (UA)、抗坏血酸 (AA)、D果糖 (Fru)及目标物葡萄糖 (Glu),实验结果如图5所示。以上干扰物引起的干扰电流较小,可以忽略不計,表明GOx/Cu2O/GCE的选择性良好。
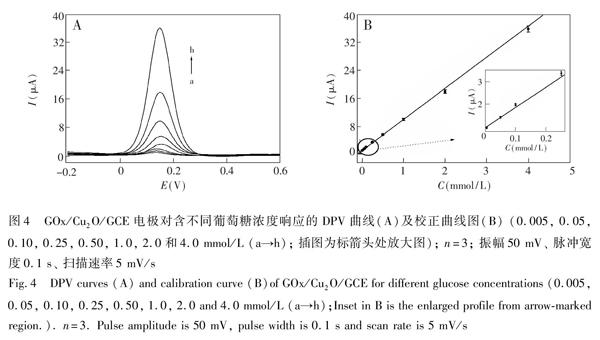
采用差分脉冲伏安法对0.1 mmol/L葡萄糖溶液(0.1 mol/L PBS,pH 7.4)进行测试,5 次平行测定的峰电流相对标准偏差为2.9%,表明检测的重现性良好。制备了5 支相同的修饰电极,测得葡萄糖峰电流的相对标准偏差为3.6%,表明此电极具有良好的制备重现性。将电极于室温下放置2个月后,其响应电流下降3.9%,表明此电极具有良好的稳定性。
3.5 实际样品分析
采用GOx/Cu2O/GCE对糖尿病人的尿液中的葡萄糖含量进行测定。取5 mL尿液,加入5 mL 0.2 mol/L PBS (pH 7.4)缓冲溶液, 采用GOx/Cu2O/GCE及1816拜安康血糖分析仪(德国拜耳公司)对样品分别进行测定,4个尿样的检测结果见表1。
两种方法的测定结果一致,表明所构建的传感器可用
[DZ(20,24]于实际样品分析。
4 结 论
采用抗坏血酸还原法制备了立方体纳米氧化亚铜,用于修饰玻碳电极,在葡萄糖的测定中呈现出显著的电催化作用。构建的基于葡萄糖氧化酶立方体纳米氧化亚铜修饰电极的电化学传感器具有线性范围宽、灵敏度高、检出限低、选择性及稳定性好等优点,可用于实际样品中葡萄糖的分析检测。
References
1 Mathew M, Sandhyarani N. Electrochim. Acta, 2013, 108: 274-280
2 Zhang W, Ma D, Du J. Talanta, 2014, 120: 362-367
3 Gao X, Li X, Wan Q, Li Z, Ma H. Talanta, 2014, 20: 456-461
4 Grembecka M, Lebiedzińska A, Szefer P. Microchem. J., 2014, 117: 77-82
5 Zhao Z, Basilio J, Hanson S, Little R R, Sumner A E, Sacks D B. Clin. Chim. Acta, 2015, 446: 54-60
6 YANG Xiu-Yun,LIANG Feng, ZHANG Wei, MAJEED Saadat,LI Yun-Hui, XU Guo-Bao. Chinese Journal of Applied Chemistry, 2012, 29(12): 1364-1370
杨秀云, 梁 凤, 张 巍, 胡连哲, MAJEED Saadat, 李云辉, 徐国宝. 应用化学, 2012, 29(12): 1364-1370
7 CHEN HuiJuan, ZHU JianJun, YU Meng. Chinese J. Anal. Chem., 2013, 41(8): 1243-1248
陈慧娟, 朱建君, 余 萌. 分析化学, 2013, 41(8): 1243-1248
8 YU HuiCheng, HUANG XueYi, WEI YiChun, LEI FuHou, TAN XueCai, WU HaiYing. Chinese J. Anal. Chem., 2014, 42(11): 1661-1666
余会成, 黄学艺, 韦贻春, 雷福厚, 谭学才, 吴海鹰. 分析化学, 2014, 42(11): 1661-1666
9 HU YaoJuan, DU WenJi, CHEN ChangYun. Chinese J. Anal. Chem., 2014, 42(9): 1240-1244
胡耀娟, 杜文姬, 陈昌云. 分析化学, 2014, 42(9): 1240-1244
10 Qiu C, Wang X, Liu X, Hou S, Ma H. Electrochim. Acta, 2012, 67: 140-146
11 He B, Hong L, Lu J, Hu J, Yang Y, Yuan J, Niu L. Electrochim. Acta, 2013, 91: 353-360
12 Tian N, Zhou Z Y, Yu N F, Wang L Y, Sun S G. J. Am. Chem. Soc., 2010, 132: 7580-7581
13 Chen J, Lim B, Lee E P, Xia Y. Nano Today, 2009, 4: 81-95
14 Sneed B T, Young A P, Jalalpoor D, Golden M C, Mao S, Jiang Y, Wang Y, Tsung C K. ACS Nano, 2014, 8: 7239-7250
15 Bandarenka A S, Koper M T M. J. Catal., 2013, 308: 11-24
16 Wang K, Dong X, Zhao C, Qian X, Xu Y. Electrochim. Acta, 2015, 152: 433-442
17 Li Y, Zhong Y, Zhang Y, Weng W, Li S. Sens. Actuators B, 2015, 206: 735-743
18 Khan R, Ahmad R, Rai P, Jang L W, Yun J H, Yu Y T, Hahn Y B, Lee I H. Sens. Actuators B, 2014, 203: 471-476
19 Wang Z H, Wang H, Wang L L, Pan L. Cryst. Res. Technol., 2009, 44(6): 624-628
20 FU Ping, YUAN Ruo, CHAI YaQin, YIN Bing, CAO ShuRui, CHEN ShiHong, LI WanYang. Acta Chim. Sinica, 2008, 66(15): 1796-1802
付 萍, 袁 若, 柴雅琴, 殷 冰, 曹淑瑞, 陳时洪, 李宛洋. 化学学报, 2008, 66(15): 1796-1802
21 Yu H C, Huang X Y, Lei F H, Tan X C, Wei Y C, Li H. Electrochim. Acta, 2014, 141: 45-50
22 Khan A Y, Noronha S B, Bandyopadhyaya R. Biochem. Eng. J., 2014, 91: 78-85
23 Piao Y, Han D J, Seo T S. Sens. Actuators B, 2014, 194: 454-459
Abstract A highly sensitive amperometric glucose biosensor was fabricated by using the synthesized nanocube copper oxide (Cu2O). The synthesized nanoCu2O and the modified electrode were characterized using Xray diffraction (XRD), scanning electron microscopy (SEM). The results showed that the obtained samples were nanocube Cu2O. The electrochemical properties of the modified electrode were investigated by cyclic voltammetry (CV), differential pulse voltammetry (DPV), electrochemical impedance spectroscopy (EIS), and chronoamperometry (CA). The CV behavior of nanocube Cu2O modified sensor was examined in 0.1 mol/L PBS (pH 7.4) containing 0.1 mmol/L glucose. The experimental results showed the prepared sensor presented remarkably enhanced electrocatalytic activity towards glucose detection. Linear responses of the sensor to glucose were observed for gulcose concentrations ranging from 5.0×10mol/L (S/N=3). The CA results showed that the interference from potential interfering species such as uric acid, ascorbic acid, and D fructose could be ignored. In addition, the developed sensor exhibited good repeatability and stability, and was successfully applied to the determination of glucose in real urea samples from diabetics.
Keywords Nanocube copper oxide; Glucose oxidase; Glucose; Electrocatalysis; Biosensor

