春剑花梗离体培养研究
李灿 王永清


摘要[目的]研究一种或多种适合春剑(Cymbidum longibracteatum)愈伤组织诱导的方法,并试图找到有效控制褐化的措施。[方法]以春剑花梗为外植体进行离体培养,通过正交设计研究不同基本培养基及激素配比对花梗培养时褐化、生长和愈伤组织发生的影響;同时研究不同防褐化处理对花梗切段褐化率的影响。[结果]不同基本培养基及激素配比对花梗培养的影响显著,不同处理方式对花梗褐化控制效果显著。花梗切段愈伤组织诱导的最佳配方为B5+2,4D 2.0 mg/L+TDZ 0.6 mg/L +GA30.5 mg/L,诱导率为7.32%。当花芽长度为2.0 cm时,花梗褐化率较低;当花梗切割厚度为8.0 mm时,花梗褐化率较低;PVP、VC、CA、8HQS对花梗切段褐化均有显著的抑制作用,其中以8HQS效果最好。[结论]建立了春剑花梗离体培养技术体系,为春剑快速繁殖和遗传育种奠定基础。
关键词春剑;花梗;离体培养;愈伤组织诱导;褐化
中图分类号S604+.3文献标识码A文章编号0517-6611(2016)04-178-05
Study on in vitro Culture of Peduncle in Cymbidium longibracteatum
LI Can, WANG Yongqing* (College of Landscape Architecture, Sichuan Agricultural University, Chengdu, Sichuan 611130)
Abstract[Objective] The aim was to find the best way of callus induction for Cymbidium longibracteatum and the effective measures for browning control. [Method] C. longibracteatum peduncle was used as explants for in vitro culture. The effects of different basic medium and hormones on browning, growth and callus induction were studied through orthogonal design, as well as effects of different browning control treatments on browning in peduncle cutting culture.[Result] Different basic culture mediums and hormone combinations had significant effects on peduncle culture, different treatments had significant controlling effects on browning. The best medium for callus induction from peduncle was B5 +2,4D 2.0 mg/L +TDZ 0.6 mg/L +GA3 0.5 mg/L, resulting in 7.32% of callus induction.When the length of flower bud was 2 cm, the peduncle had low browning rate; peduncle explants of 8 mm thickness had the lowest rate of browning; PVP, VC, Citric acid and 8HQS had significant effects on browning control, but 8HQS displayed best results. [Conclusion] The in vitro culture technology system of Cymbidium longibracteatum peduncle is established, which will lay a foundation for rapid propagation and genetic breeding.
Key wordsCymbidium longibracteatum; Peduncle; in vitro culture; Callus induction; Browning
兰花(Cymbidium ssp.)属于兰科兰花属植物,是我国的传统名花,包括春兰、建兰、蕙兰、墨兰、寒兰等,其中春剑(C.longibracteatum)名品较多,为春兰的变种,稀少而珍贵,而常规的分株繁殖很难满足爱好者的需求。兰花新繁殖技术的探索始于20世纪初,20世纪70年代后,国兰的组织培养在我国兴起。目前已陆续建立了建兰、春兰、蕙兰、墨兰、寒兰等组织培养快速繁殖无性系[1-9]。然而国兰离体培养中褐化问题较严重,对外植体的诱导和继代培养造成巨大障碍。控制褐化的常用措施有取材时间、外植体成熟度[11]、母株或外植体预处理[12]、低温处理[13]、切口封闭[5]、吸附剂和抗氧化剂[14]、热激处理[15]、暗培养[16] ,均可在一定程度上减轻褐化影响。目前国兰组织培养常用种子、茎尖、侧芽作为外植体建立再生体系,少数兰花用花器官、根状茎作为外植体。通过种子萌发的无菌苗在遗传物质方面较难保持母株的优良性状;茎尖和侧芽的取材对母株伤害较大,在名品兰花上较难应用。花芽作为春剑较容易取得的材料,如果能从花梗建立再生体系,将对春剑的快速繁殖和遗传育种具有重要意义。笔者以春剑的花梗为外植体,研究了不同处理方法和基本培养基及激素配比对花梗生长和愈伤组织诱导的影响,同时对春剑花梗切段培养过程中出现的褐化问题进行研究,旨在找到一种合适春剑愈伤组织诱导的材料和方法,并试图找到有效控制褐化的措施,以期为春剑快速繁殖和遗传育种奠定基础。
1材料与方法
1.1材料供试材料为四川农业大学园艺系脱毒中心室外种植春剑植株的花芽。
1.2方法
1.2.1外植体准备。选取健壮植株出土饱满的花芽,在加有洗衣粉的洗涤液中浸泡5 min,用软毛刷轻轻刷去表面污垢,流水下清洗后,剥除2~3张苞片,然后转入超净工作台,用滤纸吸干水分,用75%乙醇消毒30 s,无菌水清洗4次,再用0.1%氯化汞消毒6 min,无菌水清洗5次;剥除2~3张苞片,用0.01%氯化汞消毒3 min,无菌水清洗5次。用镊子剥除所有的苞片,用手术刀分割花芽的花梗。
1.2.2不同基本培养基及激素配比对花梗培养的影响。花梗切段培养设计了4因素(基本培养基种类、2,4D浓度、TDZ浓度、GA3浓度)4水平,采用5因素4水平正交设计表(表1)。
1.2.3不同处理对花梗切段褐化的影响。
1.2.3.1不同花芽大小(成熟度)对花梗切段褐化的影响。取出土2.0(处理①)、4.0(处理②)、6.0(处理③)、8.0 cm(处理④)长的花芽,清洗消毒后,切割花梗接种于1/2MS+6BA 0.5 mg/L+NAA 0.5 mg/L培养基中,每瓶接种2个外植体,每个处理接种10瓶,重复3次。
1.2.3.2不同切割厚度对花梗切段褐化的影响。将分离好的花梗进行切割,节段厚度为2.0(处理①)、4.0(处理②)、6.0(处理③)、8.0 cm(处理④),分别接于1/2MS+6BA 0.5 mg/L+NAA 0.5 mg/L培养基中,每瓶接种2个外植体,每个处理接种10瓶,重复3次。
1.2.3.3不同浸泡液对花梗切段褐化的影响。将花梗切段分别浸泡于200 mg/L聚乙烯吡咯烷酮(PVP)(处理①)、200 mg/L 抗坏血酸(VC)(处理②)、200 mg/L柠檬酸(CA)(处理③)、200 mg/L 8羧基哇琳硫酸盐(8HQS)(处理④)、无菌水(处理⑤,CK)中;振荡24 h,分别接于1/2MS+6BA 0.5 mg/L+NAA 0.5 mg/L培养基中,每瓶接种2个外植体,每个处理接种10瓶,重复3次。
1.3培养条件除培养温度试验外,其他材料培养温度为(25±2)℃,空气相对湿度为70%~75%,光照强度为1 500~2 000 lx,光照时间为16 h/d。培养基蔗糖浓度30.0 g/L,琼脂粉7.5 g/L,pH 5.5。
1.4数据统计与分析试验数据采用Excel和DPS版统计分析软件进行数据统计、方差分析及多重比较。
一级褐化率=达到一级褐化标准的外植体数未污染的外植体数×100%
二级褐化率=达到二级褐化标准的外植体数未污染的外植体数×100%
三级褐化率=达到三级褐化标准的外植体数未污染的外植体数×100%
总褐化率=褐化的外植体数未污染的外植体数×100%
转绿百分率=转绿的外植体数未污染的外植体数×100%
生长百分率=生长的外植体数未污染的外植体数×100%
愈伤组织诱导率=产生愈伤组织的外植体数未污染的外植体数×100%
2结果与分析
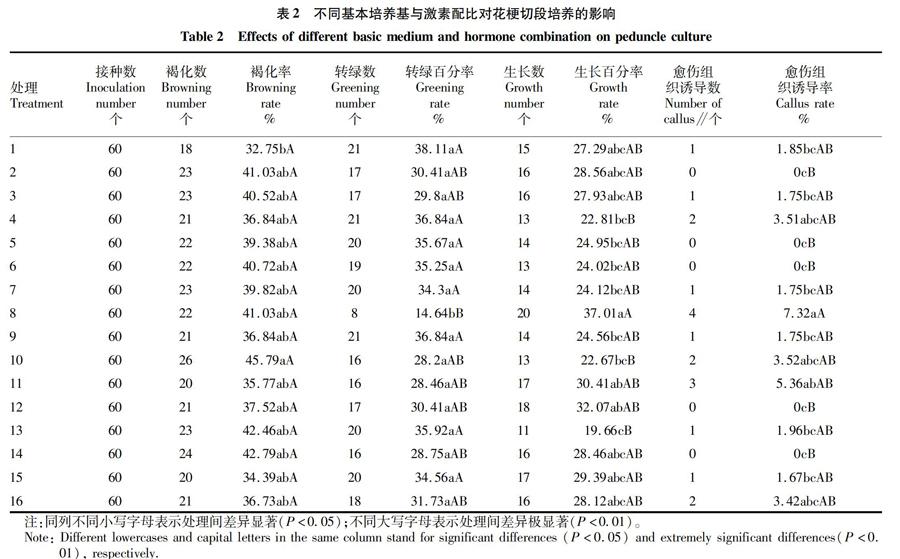
2.1不同基本培养基及激素配比对花梗切段培养的影响由表2可知,不同基本培养基及激素配比对花梗切段培养的影响显著,处理①褐化率最低(32.75%),与其他处理间差异均不显著;花梗转绿百分率最高(38.11%),只与处理⑧差异显著。
生长百分率最高(37.01%)的配方为处理⑧,同时愈伤组织诱导率也最高为7.32%。处理①对花梗切段转绿效果最好,配方为1/2MS+2,4D 0.5 mg/L+TDZ 0.2 mg/L;处理⑧对花梗切段生长和愈伤组织发生的效果最好,配方为B5+2,4D 2.0 mg/L+TDZ 0.6 mg/L+GA3 0.5 mg/L。
方差分析表明,2,4D对花梗切段转绿、生长、愈伤组织诱导的影响达极显著水平。进一步对2,4D、GA3和TDZ进行多重比较,結果表明,2,4D对花梗生长和愈伤发生的影响显著,最适浓度为2.0 mg/L;TDZ对花梗生长的影响显著,最适浓度为0.6 mg/L;GA3对花梗切段转绿的影响显著,最适浓度为0.5 mg/L。
大部分花梗切段能够通过不同激素配比的诱导转绿,长时间培养后花梗表皮增厚,花梗切段逐渐膨大,少数外植体切口处凹凸不平,进一步培养出现少量愈伤组织,但愈伤组织很难继续生长并增殖,在长时间的培养中,愈伤组织会逐步褐化最后死亡(图1)。
2.2不同处理对花梗切段褐化的影响
2.2.1不同花芽大小对花梗切段褐化的影响。由表3可知,不同花芽大小对花梗切段褐化的影响显著。2.0 cm长花芽的花梗一级褐化率最低(15.79%),随着花芽成熟度的增加花梗褐化率随之增加,三级褐化率也随着花芽的增大而增加, 8.0 cm长花芽的花梗褐化率最高(29.38%)。当花芽长为2.0 cm时,花梗总褐化率最低(45.61%),当花芽长为8.0 cm时,花梗总褐化率最高(75.74%)。花梗褐化程度见图2。
2.2.2不同切割厚度对花梗切段褐化的影响。由表4可知,不同切割厚度对花梗一级褐化率、二级褐化率影响显著。随着切割厚度的增加,三级褐化率逐渐减小,2.0 mm处理的花梗三级褐化率最高(78.34%),8.0 mm处理的花梗三级褐化率最低(11.99%),同时总褐化率(58.55%)也最低。不同切割厚度花梗切段生长情况见图3。
2.2.3不同浸泡液对花梗切段褐化的影响。由表5可知,不同浸泡液对花梗切段褐化的影响显著。用8HQS处理的外植体一级褐化率最低(10.53%),三级褐化中,CA处理的褐化率显著高于VC和8HQS处理;4种处理的总褐化率均显著低于对照,其中8HQS处理的总褐化率最低(36.45%)。
3结论与讨论
3.1愈伤组织的发生理论上,中国兰各种离体器官和组织都能诱导形成原球茎,再经分化培养形成植株。该试验花梗切段诱导过程中,培养60 d后,切口处诱导出愈伤组织,诱导率为7.32%,比李子红等[17]、曾宋君等[18]采用花芽的诱导率高。而有些未诱导出愈伤组织的外植体切口处或表皮处呈卵状突起,深绿色,幼嫩,含水丰富,外表光滑,颜色稍浅,或表面有不规则凸凹,生长旺盛,与陈进勇等[19]、项艳等[20]的研究结果相似。
3.2不同基本培养基及激素配比对外植体培养的影响植物外植体的诱导主要受基本培养基和激素配比的影响。不同基本培养基在组织培养中的影响较大,郭翠娥[21]研究表明1/2MS培养基较适合春剑芽及根状茎诱导,也有研究表明B5培养基有利于花蕾的培养。该试验选用1/2MS、B5、花宝、KC作为花梗培养的基本培养基,结果发现4种基本培养基对花梗切段培养的影响均不显著。
在原球茎的诱导阶段,添加生长素如NAA和细胞分裂素对原球茎的诱导有利[22],在一定范围内原球茎诱导率随着6BA浓度的增加而增大,6BA浓度在1.0~10.0 mg/L时均能诱导出原球茎,但以5.0 mg/L诱导效果最好;6BA浓度大于5.0 mg/L时,诱导率下降[23-24],尤其是高浓度6BA会使组织严重褐化。该试验中,NAA浓度对萼片的培养有显著影响,最适浓度为1.5 mg/L;6BA浓度对花蕾的培养有显著影响,最适浓度为1.5 mg/L。
伍成厚等[25]用蝴蝶兰子房切段、花梗切段在2,4D 1.0 mg/L加6BA 0.1 mg/L培养基上诱导出非胚性愈伤组织,愈伤组织白色,疏松。低浓度的2,4D和NAA对花梗诱导原球茎无明显效果,高浓度的2,4D能促进愈伤组织形成,但抑制愈伤组织形成原球茎[26]。该试验中,2,4D对花梗愈伤组织形成具有显著影响,最适浓度为2.0 mg/L。
TDZ诱导植物离体再生的效果显著优于6BA[27]。周南镚等[28]指出在只有NAA的培养基中,其诱导率仅为5.8%。在 NAA、TDZ配合的培养基中皆有较高的诱导率。当TDZ浓度为0.50 mg/L时, 诱导率最高。该试验中,TDZ对花梗的培养具有显著影响,最适浓度为0.6 mg/L。随着TDZ浓度的增加,诱导效果越明显,但当TDZ浓度超过0.6 mg/L后,培养效果开始下降。
GA较少应用在国兰的离体培养中,该研究表明,GA3对花梗切段转绿的影响显著,最适浓度为0.5 mg/L。
3.3不同处理对花梗切段褐化的影响Wang等[29]发现不同植物、同种植物的不同类型在组织培养中发生褐变的频率和程度都存在很大差别,而同种植物在不同生长时期,外植体的褐化程度也有所不同,一般认为褐变随着母株年龄增大和组织木质化程度加强而增加,处于幼龄状态的外植体比处于成熟状态的外植体褐变轻。该试验取2.0、4.0、6.0、8.0 cm长花芽,剥离出花梗进行培养,发现较幼嫩花芽(2.0 cm)的花梗培养时褐化最轻,8.0 cm花芽的花梗褐化最重,与前人的研究结果一致[5]。
外植体的大小和受伤害程度影响组织培养中外植体的褐化。一般认为外植体越小,切面与体积的比率越大,伤害及褐化程度就越大[30-32]。该试验花梗切段培养中, 2.0 mm的花梗切片太薄,切割时破坏的组织较多,外植体容易褐化死亡,褐化率达到89.6%。8.0 mm的切段褐化率较小,但外植体过大不利于营养和激素的吸收运输,影响花梗生长和愈伤组织诱导。
该试验中VC对花梗的褐化有较显著的抑制作用,这与王异星[33]、彭筱娜等[34]、李丽等[35]的研究结果相似。而与张俊琦等[36]的VC在牡丹组织培养中加剧了组织培养物的褐化程度的研究结果不一致。这说明VC对不同外植体材料的防褐化效果不同。PVP的浸泡对花梗切段的褐化有显著的抑制作用,总褐化率比对照低24.75%,与前人的研究结果相同[37-38]。CA对花梗的一级、二级褐化有显著的抑制作用,但对外植体的三级褐化反而有加重作用,但总褐化率比对照低22.22%。研究表明CA可以有效地防止外植體的褐化[39-40]。也有研究表明CA抗褐化效果较差[38,41],反而加剧了褐化。该试验中8QHS对花梗的褐化抑制效果最佳,与汤浩茹等[42]的研究结果相同。4种处理对花梗总褐化率的抑制作用为CA 参考文献 [1] 贾勇炯,曹有龙,王水.彩心建兰花枝茎节离体培养的研究[J].四川大学学报(自然学版),2000,37(1):94-97. [2] 李子红,贾燕.珍品兰花快速繁殖与养护[M].上海:上海科学技术出版社,2006:278-284. [3] 张志胜,欧秀娟.墨兰的组织培养[J].园艺学报,1995,22(3):303-304. [4] 曾宋君,程式君,张京蔚,等.墨兰及其杂种的组织培养与快速繁殖[J].广西植物,1998,18(2):l53-l56. [5] 郭翠娥.春剑花梗离体培养中的褐化研究[D].雅安:四川农业大学,2008. [6] 崔广荣,刘云兵,张俊长.文心兰组织培养的研究[J].园艺学报,2004,31(2):253-255. [7] 陈兴贻.文心兰的组织培养[J].植物生理学通讯,1989(6):49. [8] 彭晓明.文心兰的茎尖及花梗组织培养和快速繁殖[J].园艺学报,2000,27(2):127-129. [9] 陈勇,林开县,王君晖.蝴蝶兰的快速繁殖和规模化栽培技术研究[J].浙江大学学报(理学版),2004,31(1):84-87.
[10] 吴汉珠,王续衍,林泰碧.中国兰茎顶组织培养研究[J].园艺学报,1987,14(3):203-207.
[11] 张素勤.非洲菊离体快速繁殖体系的研究[D].杨凌:西北农林科技大学,2002.
[12] 徐程,詹忠根,张铭,等.中国兰的组织培养[J].植物生理学通讯,2002,38(2):171-174.
[13] 李杰,黄敏仁.兰花生物技术的研究及应用[J].南京林业大学学报(自然科学版),2006,30(2):109-112.
[14]刘用生,李友勇.植物组织培养中活性炭的使用[J].植物生理学通讯,1994,30(3):214-217.
[15] SCONDAHL M M R,MONACO L C,SHARP W R.In vitro methods applied to cofee[M]//Thorpe TA.Plant tissue culotre mehtods and applicaiton in agriculture.New York:Academic Perss,1981:325-348.
[16] 高国讯.植物组织培养中的褐变问题[J].植物生理学通讯,1999,35(6):501-506.
[17] 李子红,贾燕.珍品兰花快速繁殖与养护[M].上海:上海科学技术出版社,2006:278-284.
[18] 曾宋君,程式君,张京蔚,等.墨兰及其杂种的组织培养与快速繁殖[J].广西植物,1998,18(2):153-156.
[19] 陈进勇,程金水,朱莹.几种中国兰种子试管培养根状茎发生的研究[J].北京林业大学学报,1998,20(1):32-35.
[20] 项艳,於凤安,彭镇华.墨兰离体快繁研究[J].林业科学研究,2003,16(4):434-438.
[21] 郭翠娥.春剑花梗离体培养中的褐化研究[D].雅安:四川农业大学,2008.
[22] 段金玉,谢亚红.在无菌条件下激素和种子处理对兰属十种植物种子萌发的影响[J].云南植物研究,1982,4(2):197-201.
[23] 张超,陈立思.文心兰茎尖诱导原球茎的影响因子研究[J].广东农业科学,2008(4):27-31.
[24] 刘福平,洪丽萍,郑明琼.6BA、2,4D诱导蝴蝶兰类原球茎外植体的研究[J].江西农业学报,2007,19(8):69-71.
[25] 伍成厚,叶秀粦,梁承邺.蝴蝶兰愈伤组织诱导研究[J].亚热带植物科学,2004,33(4):29-31.
[26] 李娜.蝴蝶兰的组织培养技术研究[J].江西农业学报,2008,20(9):51-53.
[27] 孙崇波.蕙兰种子无菌萌发及植株再生[J].浙江农业学报,2008,20(4):231-235.
[28] 周南镚,沈生初,黄一青.中国兰组织培养技术[J].安徽农学通报,2006,12(5):158 .
[29] WANG P J,HU C Y.Meristem,shoot tip and bud cultures[M]//EMVANS D A,SHARP W R,AMMIRATOPvetal(eds).Handbook of Plant cell culture (Volum l).New York:Ma cmillan Publiahing Co[J].A Division of Macmillan,Inc, 1983:177-228.
[30] 杨美纯.外部因子对蝴蝶兰叶片原球茎状体发生的影响[J].广西植物,2000,2(1):42-46.
[31] TEIXEIRA D S,JAIME A,YAM T, et al.Establishment of optimumnutrient media for in vitro.propagation of Cymbidium Sw.(Orchidaceae) using protocormlike body segments[J].PropOrnamental Plants,2006,5(3):129-136.
[32] 叶梅.大花蕙兰组织培养的关键性技术研究[D].重庆大学,2004.
[33] 王异星.荔枝细胞培养的初步研究[J].济南大学出版社(自然与医学报),1997,18(5):84-88.
[34] 彭筱娜,易自力,蒋建雄.观赏凤梨组织培养中防止外植体褐化的初步研究[J].湖南农业科学,2007(4):67-69.
[35] 李丽,张湮帆,何康,等.两种红豆杉植物的愈伤组织培养及褐化抑制[J].复旦学报:自然科学版,2006,45(6):701-707.
[36] 张俊琦,罗晓芳.牡丹组织培养中褐化的发生原因与防止方法的研究[J].沈阳农业大学学报,2006,37(5):720-724.
[37] 顾福根.白萼吊钟海棠的组织培养与快速繁殖[J].植物资源与环境学报,2006,15(3):55-59.
[38] 张妙霞.柿树组织培养防止外植体褐变的研究[J].河南农业大学学报,1999,33(1):87-90.
[39] 徐程,詹忠根,张铭,等.中国兰的组织培养[J].植物生理学通讯,2002,38(2):171-174.
[40] 關仕港,刘建昌,崔志新,等.中国蕙兰(金蕙)试管苗生根培养研究[J].佛山科学技术学院学报:自然科学版,2005,23(4):66-68.
[41] 黄浩.红豆杉细胞多酚氧化酶的性质研究初探[J].江西科学,1999,17(3):158-162.
[42] 汤浩茹,王永清,邓群仙.用8羟基喹啉硫酸盐防止梨、苹果外植体褐变[J].果树科学,1998,15(2):112-115.
[43] 刘均利,马明东.华盖木组织培养中褐化控制研究[J].浙江林业科技,2007,27(1):20-23.
[44] 胡彦,赵艳.植物组织培养技术的应用以及在培养过程中存在的问题[J].陕西师范大学学报:自然科学,2004,32(S1):130-134.安徽农业科学,Journal of Anhui Agri. Sci.2016,44(4):204-205

