东北黑蜂椴树蜜中耐高糖酵母菌分离鉴定及透射电子显微镜观察
徐伟,杜娇,杜鹃,徐春华,孟庆生,付大伟,王薇
1(哈尔滨商业大学 食品工程学院,黑龙江 哈尔滨,150076)2(大兴安岭绿源蜂业有限公司,黑龙江 加格达奇,165000)
东北黑蜂椴树蜜中耐高糖酵母菌分离鉴定及透射电子显微镜观察
徐伟1*,杜娇1,杜鹃1,徐春华2,孟庆生2,付大伟1,王薇1
1(哈尔滨商业大学 食品工程学院,黑龙江 哈尔滨,150076)2(大兴安岭绿源蜂业有限公司,黑龙江 加格达奇,165000)
从东北特产椴树蜜中分离1株酵母菌,将初筛得到的酵母菌经过向发酵液中加入不同克数的葡萄糖发酵试验性能测定的比较,筛选出1株适合用于蜂蜜酿造的具有耐受80 g/100 mL葡萄糖的高糖特性的酵母菌YMI-37,采用透射电子显微镜(transmission electron microscope, TEM)观察酵母菌YMI-37在不同葡萄糖浓度下细胞内部结构变化,并对YMI-37进行生理生化特性和分子生物学的鉴定,根据生理生化和26S rDNA基因测序综合分析,初步鉴定为酵母菌属的酿酒酵母(Saccharomycescerevisiae)。
酵母菌;耐高糖;椴树蜜;筛选;鉴定
椴树蜜是一种营养丰富的高热量食品,其主要成分是葡萄糖和果糖,占蜂蜜总糖的85%以上[1],可以不经过消化作用而直接被人体吸收利用,蜂蜜具有润肺止咳、润肠通便、滋补强身、排毒养颜等功效[2-4],是一种天然的滋补品,但由于含糖量高而使饮用人群受限。发酵饮料在国内外非常盛行,具有丰富的营养素,醇厚的香味成分,深得人们喜爱。酵母菌是酿造蜂蜜发酵饮料中主要的微生物,由于蜂蜜原料糖度高,在发酵时会引起酵母菌细胞水分活度和细胞质组成发生显著变化,酵母菌的细胞膜及酶系受到破坏,从而抑制酵母菌的生长和发酵[5],研究酵母菌耐高(糖、盐)渗透压下的遗传特性以及高渗透压下酵母菌的调节机理,具有非常重要的理论意义和应用价值。
高浓度发酵后稀释酿造技术,是目前发酵工业领域一项先进的技术。筛选出耐高糖的酵母菌,应用于蜂蜜发酵饮品生产中,采用高浓度发酵再稀释的方法,可节省能源,降低生产成本。本研究通过从东北黑蜂椴树蜜中分离出6株耐高糖酵母菌株,进行复筛得到1株适合用于蜂蜜酿造的耐高糖特性酵母菌YMI-37,采用透射电子显微镜(transmission electron microscope, TEM)观察耐高糖酵母菌YMI-37在不同葡萄糖浓度下细胞内部结构变化,根据形态学观察、生理生化及26S rDNA基因测序进行了系统的分析鉴定。
1 材料与方法
1.1材料与试剂
蜂蜜为采集于东北的椴树蜜。
酵母浸粉、蛋白胨、琼脂等均为生物试剂,葡萄糖、醋酸钠、硝酸铵、硝酸钾、亚硝酸钠、磷酸二氢钾、硫酸镁等均为分析纯。
1.2仪器及设备
HWS24型电热恒温水浴锅,上海一恒科技有限公司;LRH-70F生化培养箱,上海一恒科技有限公司;LDZX-50XB立式压力蒸汽灭菌器,上海中安医疗器械厂;SW-CJ-1FD型单人单面净化工作台,苏州净化设备有限公司;YS2-H显微镜,NiKon China;BS224S电子天平,赛多利斯科学仪器(北京)有限公司;H-113ATC手持糖度计 ,北京测维光电仪器厂;SBA-40D生物传感分析仪,山东省科学院生物研究所;S-3400扫描电子显微镜,HITACHI公司;ES-2030型冷冻干燥,HITACHI公司;E-1010型离子溅射镀膜仪,HITACHI公司;JEM-2100F透射电镜,HITACHI公司。
1.3方法
1.3.1分离鉴定培养基和培养方法
酵母培养基[6];麦氏培养基;玉米粉培养基;糖类发酵培养基;碳源利用培养基;硝酸盐利用培养基;类淀粉化合物形成测定培养基;尿素分解培养基。
富集培养:将蜂蜜进行稀释,放入28 ℃恒温培养箱内培养。
1.3.2酵母菌初筛
将富集培养后的样品进行梯度稀释,吸取1 mL富集培养液加入9 mL无菌生理盐水中,稀释成10-1,10-2,10-3,10-4,10-5,10-6浓度,分别吸取上述稀释梯度为10-4到10-6的菌液各0.1 mL涂布到已凝固的分离培养基上,用玻璃涂布器涂匀。每个稀释度重复3次,放入到28 ℃恒温培养箱内培养。
在酵母菌培养基平板上挑取菌落特征与酵母菌相似的单个孤立菌落,进一步在酵母菌平板上划线分离,分离后挑取单个孤立的菌落制成水浸片后,观察其细胞形态、大小进行酵母菌的初筛,观察到细胞形态、大小基本一致,则为纯菌。
1.3.3酵母菌复筛
挑取筛选出的纯菌种以5%的量分别接入到含25、30、35、40、45、50、55、60、65、70、75、80 g/100 mL葡萄糖的酵母菌液体培养基里[7-9],放入28 ℃恒温培养箱内培养,通过看试管中杜氏小管里的产气情况和生物传感仪测定的残糖量,判断发酵效果,挑选出耐糖量较高的菌种。
1.3.4菌种的生理生化鉴定
酵母菌特征观察:观察菌落形态,观察细胞形态及测定大小、观察子囊孢子的形成、观察假菌丝的形成、观察掷孢子形成[10-11]。
生理生化的检测:糖类发酵试验、同化碳源试验、同化氮源试验[12-14]、产生淀粉化合物试验、尿酶试验、产酸试验[15-16]。
1.3.5菌种的分子生物学鉴定
筛选的耐高糖菌株,由生工生物工程(上海)有限公司进行 26S rDNA 鉴定[ 17-20]。
1.3.6菌种的TEM观察
筛选的耐高糖菌株,采用TEM观察不同葡萄糖浓度细胞内部结构变化。
2 结果与分析
2.1酵母菌的初筛
从蜂蜜中分离出6株耐高糖酵母菌株,发现菌落形态较单一,大小基本一致,初步确认为单一纯种,编号为YMI-1、YMI-2、YMI-15、YMI-18、YMI-25、YMI-37,将其接种到复筛培养基上进行复筛。
2.2酵母菌的复筛
将培养好的种子液以5%的接种量接入带有杜氏小管的试管中,28 ℃培养96 h,耐糖杜氏小管产气结果见表1,生物传感仪测定的发酵后的残糖量结果见表2。
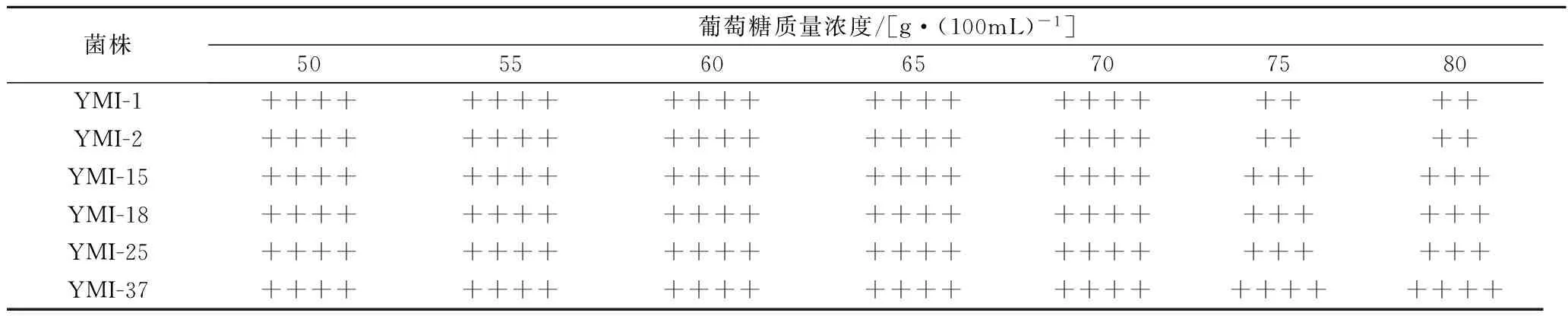
表1 六株酵母菌耐葡萄糖杜氏小管产气结果
注:根据杜氏小管中产气量分为5个等级;“++++”表示杜氏小管中充满气体;“+++”表示杜氏小管中充满3/4气体;“++”表示杜氏小管中充满1/2气体;“+”表示杜氏小管中充满1/4气体;“-”表示杜氏小管中没有气体。
杜氏小管耐高糖发酵过程中,酵母菌利用葡萄糖并将其转化为乙醇和CO2,酵母菌在适宜的葡萄糖浓度下,能充分利用葡萄糖,其生长繁殖旺盛,但在葡萄糖浓度较高的环境下,由于渗透压的作用使其细胞质、细胞膜、细胞内水分活度发生变化,酵母菌利用葡萄糖的能力下降,生长受到抑制,但有些酵母菌高糖环境下会在细胞内积累特定溶质来抵御其胞内水分子外流,使自身达到生长繁殖、发酵。所以通过杜氏小管产气筛选耐糖性能较好的酵母菌。
表1结果为发酵96 h的结果,葡萄糖质量浓度在70 g/100 mL以下时,酵母菌发酵旺盛,YMI-1、YMI-2、YMI-15、YMI-18、YMI-25、YMI-37酵母菌产气充满整个杜氏小管。葡萄糖浓度为75 g/100 mL时,YMI-1、YMI-2酵母菌发酵管内充满1/2的气体,YMI-15、YMI-18、YMI-25酵母菌发酵管内充满3/4的气体,产气量减少,YMI-37酵母菌产气充满整个杜氏小管。当糖浓度为 80 g/100 mL时,YMI-1、YMI-2酵母菌杜氏小管中充满1/2气体,YMI-15、YMI-18、YMI-25酵母菌杜氏小管中充满3/4气体,YMI-37酵母菌在80 g/100 mL糖浓度下仍能起酵,发酵旺盛,产气充满整个杜氏小管。根据耐糖杜氏小管产气结果说明YMI-37酵母菌耐糖性能较好。

表2 6株酵母菌发酵后的残糖量
6株菌都能在含80 g/100 mL的葡萄糖培养基里利用葡萄糖生长,由于发酵培养液起始糖浓度相同, 残留的葡萄糖越少,说明在高糖条件下,用于酵母菌生长和发酵的糖越多,酵母菌的发酵力越强,耐糖性越好,由表2可以看出,YMI-37酵母菌高浓度糖下残留葡萄糖量为42 g/100 mL,相对于其他5株菌残留的葡萄糖量最少,所以选择发酵能力强、耐糖性能好的YMI-37酵母菌。
综合耐糖杜氏小管产气结果和生物传感分析仪筛选出起酵速度快、发酵能力强、耐受糖度为80%的葡糖溶液的酵母菌YMI-37,对其进行生理生化鉴定。
2.3酵母菌鉴定结果
2.3.1YMI-37酵母菌特征观察结果
将培养2 d的酵母菌分别制成水浸片在光学显微镜下观察,如图1b所示;又将酵母菌进行前处理后于扫描电镜下观察,如图1c所示。酵母菌成细胞卵形、腊肠形,大小为(5.7~9.3)μm×(3.7~6.7)μm,出芽生殖。无菌操作下,挑取酵母菌斜面1环进行酵母菌平板划线培养,28 ℃恒温培养1 d后每天观察,如图1 a所示。菌落为奶酪状,表面平滑,反光,乳白色,边缘整齐。在玉米琼脂平板上培养不产生假丝,子囊孢子圆形,无假菌丝。
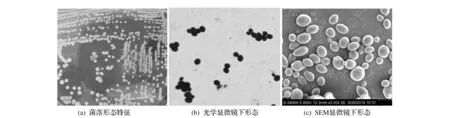
图1 YMI-37酵母菌的菌落与菌体形态 Fig.1 Morphology and colony of strain YMI-37
2.3.2生理生化鉴定结果
将培养好的种子液分别接入糖发酵管中、碳源发酵管中、氮源、产酸、类淀粉、脲酶试管中,28 ℃培养48 h,观察实验现象(表3)。
由表3可知,YMI-37酵母菌能够发酵麦芽糖、蔗糖、乳糖、葡萄糖、海藻糖、棉籽糖,不发酵纤维二糖、半乳糖、松三糖、蜜二糖、阿拉伯糖、菊糖、可溶性淀粉;碳源同化麦芽糖、半乳糖、海藻糖、葡萄糖、蔗糖、木糖、棉籽糖,不能同化阿拉伯糖、纤维二糖、、蜜二糖、肌醇、山梨糖、核糖、乳糖、赤藓糖醇、山梨醇、甘露糖、松三糖、鼠李糖、可溶性淀粉;氮源同化硫酸铵、硝酸钾、亚硝酸钠。
由表4可知YMI-37酵母菌不产生类淀粉;不产酸;脲酶试验为阴性;根据上述生理生化实验结果,对照酵母菌的特征与鉴定手册,初步确定该菌株为酵母菌属的酿酒酵母(Saccharomycescerevisiae)。
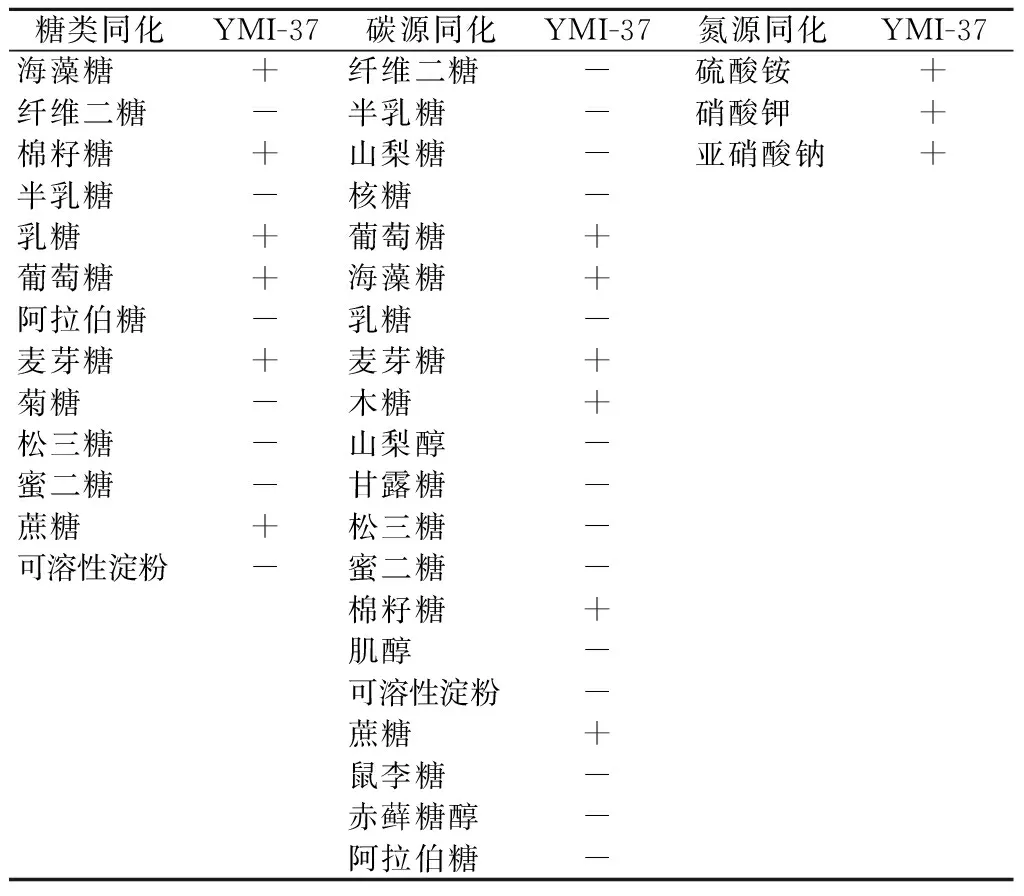
表3 生理生化试验结果
注:“+”表示能同化;-”表示不能同化。
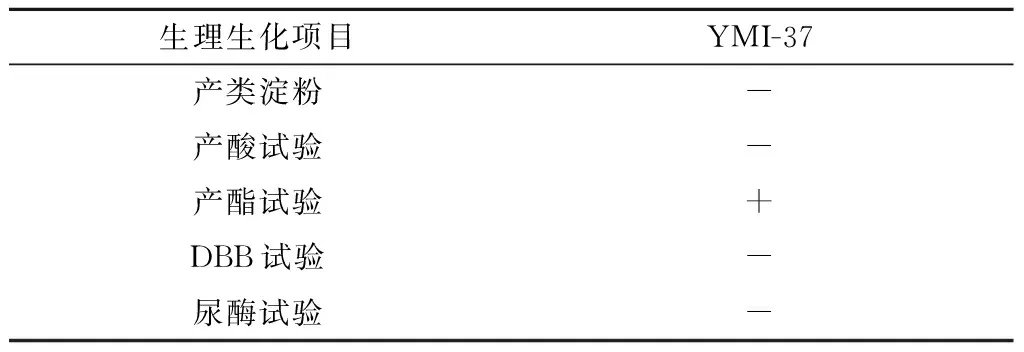
表4 YMI-37酵母菌其他同化结果
注:“+”表示阳性;“-”表示阴性。
2.3.3分子生物学鉴定结果
2.3.3.1DNA的提取和PCR扩增
以NL1和NL4为引物,通过酵母菌的特异性PCR反应扩增,然后对所扩增出的酵母菌的PCR产物,用1%琼脂糖凝胶电泳检测如图2所示,扩增产生了单一的DNA片段条带,以Marker对比显示跑出的条带在500~750 bp之间,扩增的产物无明显的非特异的扩增现象,表明已经扩增出目的基因,结果见图2。
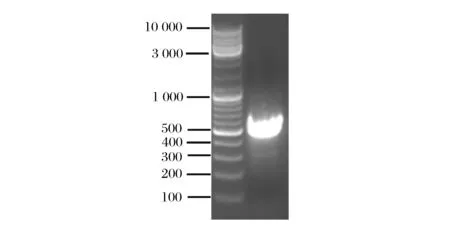
图2 YMI-37 26S rDNA D1/D2 基因扩增电泳图Fig.2 YMI-37 26S rDNA D1/D2 gene amplification electrophoresis pattern
2.3.3.226S rDNA序列相似性
采用双向测序的方法,对YMI-37酵母菌的26S rDNA D1/D2区域的序列进行测定,用Sequencher软件拼接测得的DNA 序列,通过BLAST在GenBank核酸序列数据库中进行同源序列搜索及相关信息检索,结果见表5。结果表明,YMI-37酵母菌与GenBank数据库中已知酵母的一些模式菌株Saccharomycescerevisiae具有100%的相似性。
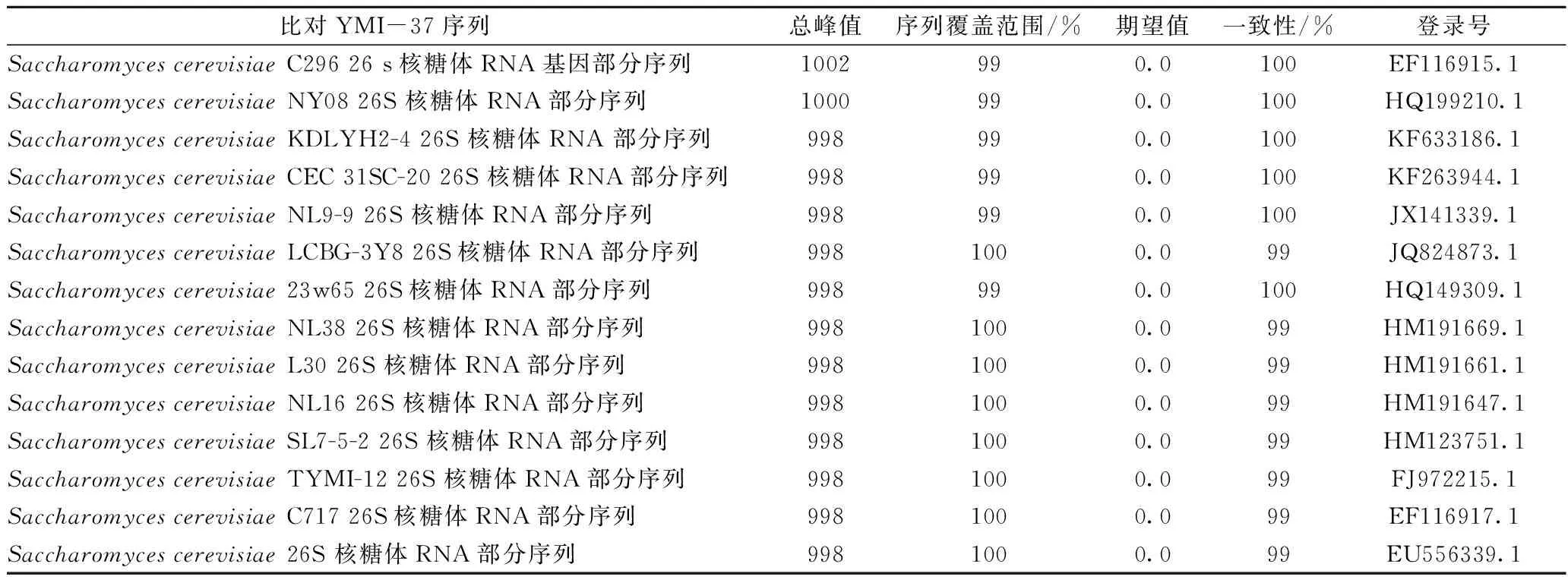
表5 分离菌株26S rDNA序列相似性分析
2.3.3.3系统发育分析结果
为了研究YMI-37酵母菌与已知的模式菌株种属之间的亲缘关系和YMI-37酵母菌在系统发育的地位,采用校正后的YMI-37酵母菌的26S rDNA D1/D2 区域序列,保留YMI-37酵母菌可靠的 581 bp 序列,对YMI-37酵母菌进行系统发育分析,在GenBank核酸序列数据库中进行YMI-37酵母菌已知酵母菌相应序列的相似程度的比较。根据搜索结果,分别得到12个种模式菌株26S rDNA Dl/D2区域序列,将分离菌与12个种模式菌株使用ClustalX 1.83排序[21]后使用MEGA three 3.1计算序列相似性,通过Neighbor-Joining 分析方法,制作系统发育树[ 22],并进行了1 000次bootstrap的统计学检验,见图3。
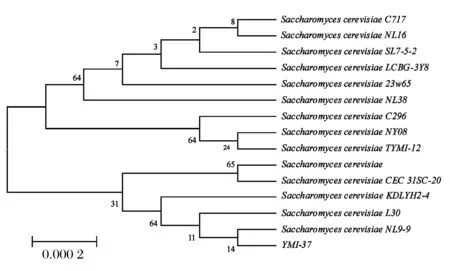
图3 YMI-37酵母菌和相关酵母模式菌株系统发育树Fig.3 YMI-37 yeast and related yeast strains of yeast phylogenetic tree
由图3可知,菌株YMI-37与模式菌株SaccharomycescerevisiaeNL9-9聚为一枝同源性最近支持率为100%,结合两者D1/D2序列一致性为100%,YMI-37判断为酿酒酵母Saccharomycescerevisiae。
2.4耐高糖YMI-37酵母菌的TEM观察结果
不同糖浓度环境下,酵母菌的生命活动与渗透压的变化有着密切的关系。当糖浓度高时细胞内部渗透压小于外部环境,细胞内的细胞质、 细胞膜等会发生变化。为了研究YMI-37酵母菌在高糖度下细胞内的变化,用透射电镜观察了酵母菌分别在含18、40、80 g/100 mL葡萄糖浓度的YPD培养基中细胞的变化,以不耐高糖的酵母菌在葡萄糖浓度为10 g/100 mL的YPD培养基中细胞的变化作对照,结果见图4。
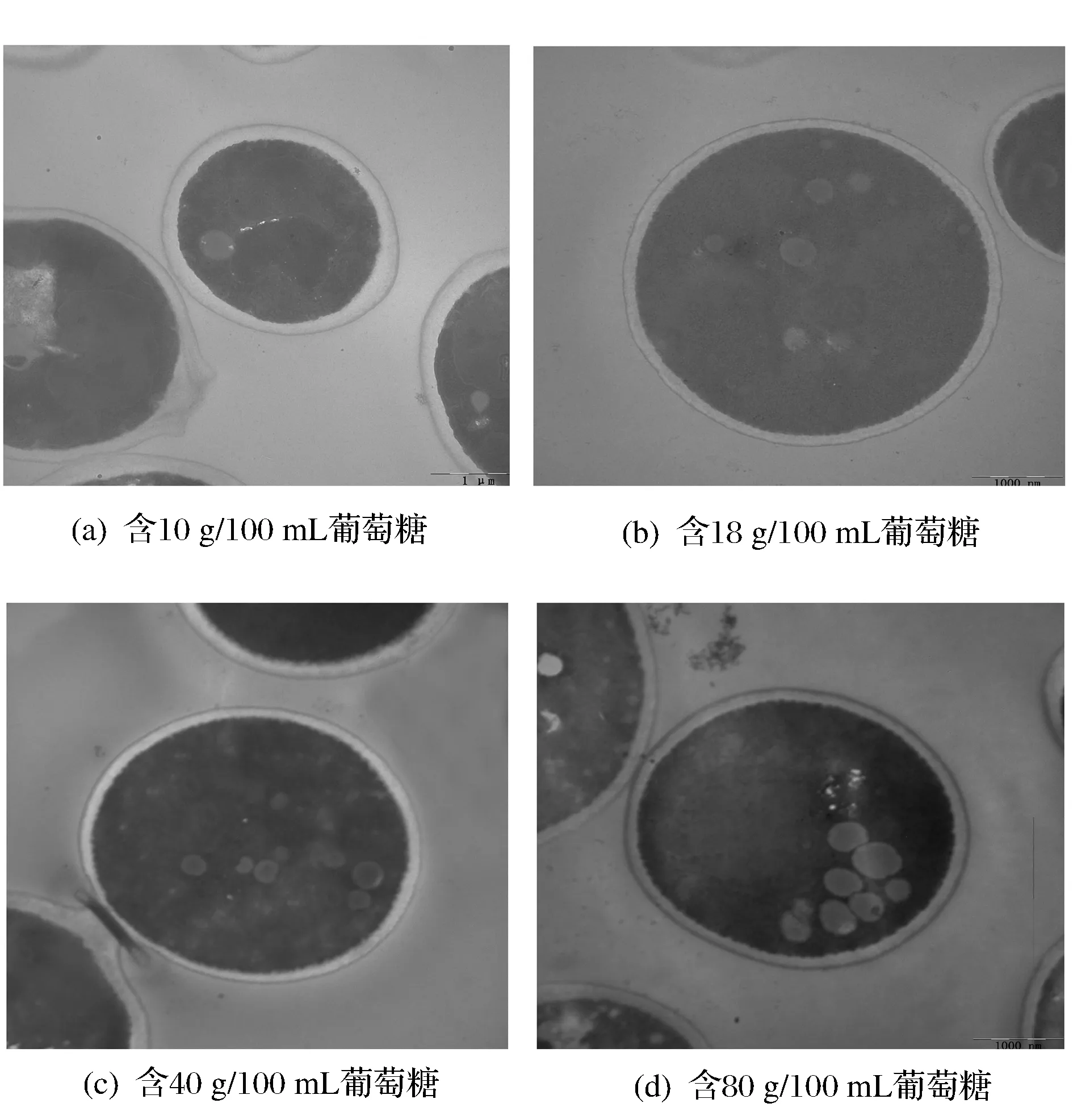
图4 YMI-37酵母菌在不同糖浓度下的TME的观察结果Fig.4 YMI-37 yeast in different concentration of sugar TME of observations
由图4可以看出,当培养基中葡萄糖的浓度为18 g/100 mL时,细胞质与细胞膜结合紧密,细胞内含有少量的液泡,当葡萄糖的浓度为40 g/100 mL时,细胞膜与细胞质之间出现锯齿状,细胞质与细胞膜结合紧密,细胞质的浓度变深,液泡的数量变多;当葡萄糖的浓度为80 /100 mL时,细胞膜与细胞质之间出现锯齿状,细胞质与细胞膜结合紧密,细胞质浓度变深,液泡变大,而不耐高糖的酵母菌,在葡萄糖的浓度为10 g/100 mL时,细胞内含有极少量的液泡,细胞质与细胞膜结合紧密,细胞壁厚表面圆滑无锯齿状。
综上可知,YMI-37酵母菌随着糖浓度的增加,细胞外部的渗透压变大,细胞质的浓度变深,细胞内的液泡变大,细胞膜与细胞质结合紧密,细胞大小基本一致,说明YMI-37酵母菌对高渗应激反应存在的生理性防御反应,YMI-37酵母细胞具有适应不同糖度渗透压环境的能力,当糖度渗透压环境高时,细胞质浓度深,可以推测某些与调渗有关的物质可能增加,会在细胞内部积累一些特殊溶质使细胞内外的渗透压保持平衡[23]。它们可以使细胞内的渗透压增加,保持细胞膜内外的渗透压平衡,来调节外界的渗透压,保证细胞能在高糖环境条件下生长繁殖。同时从TEM图片结果可知,细胞内液泡也有调节渗透压的功能,糖浓度高细胞内的液泡变大,使菌体内外渗透压达到平衡,以保证细胞能在高糖环境条件下生长繁殖[24]。同时在不同浓度下酵母菌的大小基本一致,说明YMI-37酵母菌没有在高糖度渗透压下,使细胞失水体积变小,失去细胞的完整性。由此可知YMI-37酵母菌对高糖环境有调节的能力,适合在高糖度下生长繁殖。
3 结 论
从蜂蜜中经过初筛、复筛,筛选出1株耐高糖酵母,可以在含80 g/100 mL 的葡萄糖培养基里生长,跟据细胞形态、菌落形态观察、生理生化试验、26S rDNA基因测序和TEM观察综合分析,初步确定该菌株为酵母菌属的酿酒酵母Saccharomycescerevisiae。
[1]杨玉华.椴树和椴树蜂蜜[J].中国蜂业, 2013(19):1-2.
[2]毛文岭.蜂胶和蜂蜜的成分研究[D].郑州:河南大学,2011.
[3]黄根树,张庆华.红枣蜂蜜保健酒的酿造工艺研究[J].中国酿造,2014,33(5):161-164.
[4]曹炜,尉亚辉.蜂产品保健原理与加工技术[M].北京:化学工业出版社,2002:198-204.
[5]王亚军,姚善泾,吴天星.渗透剂对酿酒酵母细胞增殖、形态和存活力的影响[J].化工学报,2004,55(7):1 150-1 154.
[6]祖若夫,胡宝龙,周德庆.微生物学实验教程[M].上海:复旦大学出版社,1993:35-36.
[7]赵硕.耐高渗(高糖)酵母菌株的选育[D].合肥:安徽农业大学,2010.
[8]田景芝.蜂蜜酒酵母菌株的筛选及发酵工艺的研究[J].食品科学,2010,31(4):23-24.
[9]胡海霞.蜂蜜高渗酵母菌分离及大蒜汁对其抑制作用研究[D].西安:陕西师范大学,2009.
[10]赵红梅,刘景武,张伟.耐高渗酵母的分离、筛选及鉴定[J].食品研究与开发,2006,27(6):34-37.
[11]彭涛.蜂蜜发酵饮料的开发研究[D].无锡:江南大学,2009.
[12]胡瑞卿.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991: 6.
[13]Barnett JA,Payne RW,Yarrow D. Yeasts:Characteristics and Identification(Third Edition)[M]. Netherlands:Springer Netherlands,2001.
[14]胡开辉.微生物学实验[M].北京:中国林业出版社,2004:8.
[15]王小红,徐康,赵山等.孝感凤窝酒曲中酵母菌的分离及特性研究[J].现代食品科技,2008,24(2):134-137.
[16]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002,8.
[17]李金霞,刘光全,程池.酿酒酵母26S rDNA D1/D2区域序列分析及其系统发育研究[J].酿酒,2007,34(1):67-69.
[18]吴阳.赛里木酸奶中酵母菌筛选鉴定及发酵特性研究[D].南京:南京农业大学,2012.
[19]KURTZMAN C P,ROBNETT C J.Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S) riboso-mal DNA partial sequences[J].Antonie van Leeuwenhoek,1998,73(4):331-371.
[20]FELL J W,BOEKHOUT T,FONSECA A,et al.Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(3):1 351-1 371.
[21]THOMPSON J D,HIGGINS D G, GIBSON T J. Improving the sensitivity of progressive multiple sequence alignment through-sequence weighting, position-specific gap penalties and weight matrixchoice [J].Nucleic Acid Res, 1994, 22 (22):4 673- 4680.
[22]SAITOUN,NEIM.The neighbor-joining method:a new method for reconstructing phylogenetic tree[J].Mol BioEvol,1987,4(4):406-425.
[23]Adriana G A, Fornando L, Wilhelm H. Cu, Zn-superoxide dismutase ofSaccharomycescerevisiaeis required for resistance to hyperosmosis [J]. Febs Lett,2003,539:68-72.
[24]余秉琦,诸葛健.酵母细胞对高渗环境的适应与胞内甘油的积累[J].中国生物工程杂志,2003,23(2):25-28.
2(Lvyuan Bee Limited Corporation of Daxinganling, Jagedaqi 165000, China)
Isolation and screening of high sugar-tolerant yeast in the Northeast black bee linden honey and TEM observation
XU Wei1*,DU Jiao1,DU Juan1,XU Chun-hua2,MENG Qing-sheng2,Fu Da-wei1,WANG Wei1
1(School of Food Engineering, Harbin University of Commerce, Harbin 150076, China)
A yeast strain was isolated from Northeast of China specialty linden honey. The resulting yeast strain was fermented with broth containing different grams of glucose and then the different performance was compared. One strain with resistance to 80 g/100mL of glucose was suitable for use in the brewing of honey and named as yeast YMI-37. TEM was used to observe the internal structure changes of yeast YMI-37 cells at different glucose concentrations. The physiological, biochemical and molecular biological characteristics of YMI-37 were identified. Based on the comprehensive analysis of the physiological and biochemical features and 26S rDNA gene sequencing, the strain was preliminarily identified asSaccharomycescerevisiaeof yeast genera.
yeast; high sugar-tolerance;linden honey;screening;appraisal
10.13995/j.cnki.11-1802/ts.201608009
博士,教授(本文通讯作者,E-mail:xuw@hrbcu.edu.cn)。
黑龙江省应用技术研究与开发项目(GC13B205)
2016-01-04,改回日期:2016-03-18
——2017年渗透压相关高考真题赏析

