响应面法对罗汉果花总黄酮超声波提取工艺的优化
张卓睿 孙广仁 段秀岩 姜贵全


摘要:以罗汉果(Siraitia grosvenorii)花为原料,采用超声波技术从罗汉果花中提取总黄酮,并利用响应面法设计优化了工艺参数。通过对乙醇体积分数、液料比、超声波功率、超声时间等因素进行试验分析,考查了各提取参数对罗汉果花中总黄酮提取率的影响,并在单因素试验的基础上进行响应面试验设计,确定了罗汉果花中总黄酮的最佳提取工艺条件,即乙醇体积分数为67.55%,超声时间43.62 min,超声波功率208.48 W,液料比15∶1 (mL∶g),此条件下总黄酮提取率可達到6.537%。
关键词:罗汉果(Siraitia grosvenorii)花;超声波;总黄酮;响应面
中图分类号:TS209;S567.23+9 文献标识码:A 文章编号:0439-8114(2016)06-1518-05
DOI:10.14088/j.cnki.issn0439-8114.2016.06.039
罗汉果花来源于葫芦科植物罗汉果(Siraitia grosvenorii)的干燥雄花,有清热解毒、化痰止咳、养声润肺的功效,常用于治疗口臭、口腔炎、咽炎、扁桃体炎、色斑、肝斑、暗疮等疾病[1]。罗汉果花虽然在民间是一种常见的花草茶,但对于其功效成分的深入研究,直到近几年才开始逐渐展开。研究人员发现,罗汉果花中的精油具有抗菌活性,尤其是对枯草芽孢杆菌有很强的抑制作用[2]。另外,罗汉果花中还含大量的黄酮类化合物,经分析主要为山奈酚[3]。黄酮类化合物是一大类天然多酚化合物,其以游离态或糖苷形式广泛存在于植物中,结构复杂多样,能防治心脑血管疾病和呼吸系统疾病,具有抗炎抑菌、降血糖、抗氧化、抗辐射、抗癌、抗肿瘤以及增强免疫能力等生理活性[4,5]。黄酮的提取方法主要有超临界萃取、热回流提取、酶提取、微波辅助提取和超声波辅助提取等[6,7]。其中超声波辅助提取是利用超声波产生的“空穴作用”破碎植物细胞,使提取液不断振荡,有利于黄酮类化合物的溶出和扩散,大大提高了植物有效成分的提取率,该方法操作简单,无需加热,对黄酮的活性破坏少,且提取率高,是现在应用非常广泛的一种黄酮提取法。因此本研究采用超声波辅助提取罗汉果花中总黄酮,并应用响应面分析法优化试验结果得出最佳提取条件,以期为罗汉果花的开发应用提供理论依据。
1 材料与方法
1.1 主要材料与试剂
罗汉果花,2013年7月购于广西桂林永福县,烘箱中55 ℃烘4 h,粉碎机粉碎后置于试剂瓶中,室温贮藏于干燥器中备用。无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠等试剂(均为分析纯)购于南京化学试剂有限公司;芦丁(生化试剂)购于美国Sigma公司。
1.2 主要仪器与设备
TU1810紫外可见分光光度计,北京普析通用仪器有限公司;LG10-2.4A高速离心机,北京医用离心机厂;WK-1000A高速药物粉碎机,青州市精诚机械有限公司;JY92-2D超声波细胞粉碎机,宁波新芝生物科技股份有限公司;DHG-9140A电热恒温鼓风干燥箱,上海一恒科技有限公司;FA2004A电子天平,上海精天电子仪器有限公司;RE-85Z旋转薄膜蒸发器,上海青浦泸西仪器厂;QUANTA200环境扫描电子显微镜,荷兰FEI公司。
1.3 方法
1.3.1 标准曲线的绘制[8] 精密称取干燥至恒重的芦丁标准品20.0 mg置于100 mL容量瓶中,加60%乙醇适量,置水浴锅中微热使之溶解,放冷后用60%乙醇定容至刻度,摇匀,得质量浓度为0.200 mg/mL的标准溶液。量取芦丁标准溶液0、1.0、2.0、3.0、4.0、5.0 mL于6只10 mL比色管中,各加30%乙醇溶液至5 mL,加入5% NaNO2溶液0.3 mL,摇匀,静置6 min,再各加入10%Al(NO3)3溶液0.3 mL,摇匀,静置6 min,加1 mol/L的NaOH溶液4 mL,然后分别加水定容至10 mL,摇匀,放置15 min。以空白试剂为参比液,在510 nm下测定吸光度。以吸光度为纵坐标,标准溶液质量浓度(mg/mL)为横坐标绘制标准曲线,用最小二乘法进行回归,得吸光度A与总黄酮浓度x(mg/mL)的线性方程为:A=11.675x+0.033 5,R2=0.997 8,表明总黄酮浓度在0.02~0.1 mg/mL范围内与吸光度呈线性关系。
1.3.2 罗汉果花中总黄酮的提取 准确称取2.0 g罗汉果花粉置于150 mL锥形瓶中,按设定液料比加入某体积分数的乙醇溶液,在一定功率条件下超声波破碎提取一段时间,提取液以8 000 r/min离心分离10 min,上清液于100 mL容量瓶中定容。
1.3.3 样品中总黄酮含量的测定 取1 mL定容后的提取液,按“1.3.1”的方法测定样品的吸光度A,利用标准曲线回归方程得出样品溶液中总黄酮的质量浓度,再计算出样品中总黄酮的提取率。计算公式为:
总黄酮提取率(以芦丁计)=■×100%
式中,D为样品溶液稀释倍数;C为样品溶液中总黄酮浓度,mg/mL;V1为测定时比色管中溶液体积,mL;V2为样品溶液总体积,mL;m为样品质量,mg。
1.3.4 单因素试验 以总黄酮提取率为检测指标,分别考察提取方法、乙醇体积分数、超声波功率、液料比(mL∶g,下同)、超声时间5个因素对总黄酮提取率的影响。
1.3.5 Box-Behnken试验设计 在单因素试验的基础上,选取液料比、乙醇体积分数、超声时间和超声波功率为试验因素,利用Design-expert软件进行Box-Behnken试验设计[9],优化罗汉果花中总黄酮的提取工艺。
1.4 数据统计方法
所有试验均做3次平行,取平均值,利用Excel程序或Design-expert软件对结果进行分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取方法对罗汉果花中总黄酮提取率的影响 分别考察了回流提取法、酶提取法、超声波提取法3种方法对罗汉果花中总黄酮提取率的影响,并将提取后的物料在室温条件下风干,置于载物台上用离子溅射仪喷金后在扫描电子显微镜下观察其形貌变化,结果见表1和图1。由表1可知,超声波提取法的总黄酮提取率最高,酶提取法次之,而回流提取法的提取率最低。从图1(a)也可以看出,经回流提取后的物料其内部结构完整密实,说明大部分植物细胞未受到破坏,因而细胞内组分亦不能充分浸出,提取率最低;而图1(c)中超声波提取后的物料面变得平滑松散,说明提取过程中物料在超声波的空化作用下,引起体系的宏观湍动和固体颗粒的高速碰撞,传质边界层变薄,植物组织细胞发生了破壁或变形,使得细胞内组分更易浸出,提取率最高。因此选择超声波提取法从罗汉果花中提取总黄酮。
2.1.2 乙醇体积分数对罗汉果花中总黄酮提取率的影响 按液料比10∶1,超声波功率150 W,超声时间30 min,分别考察不同乙醇体积分数对罗汉果花中总黄酮提取率的影响,试验结果如图2(a)所示。黄酮是一大类极性范围很广的化合物,既包括水溶性的,又包括醇溶性的。而不同体积分数的乙醇溶液,极性不同,对目标组分的溶解能力亦不相同。从图2(a)可以看出,随着乙醇体积分数的逐渐增大,罗汉果花中总黄酮的提取率先升高后降低,在乙醇体积分数为70%时,总黄酮的提取率达到最大值。这说明70%乙醇的极性与罗汉果花中黄酮类化合物的极性相似,醇溶性和水溶性的黄酮类物质都能最大程度的溶出,而当乙醇体积分数超过70%时,水溶性黄酮溶出量减少,同时一些脂溶性物质、糖类及黏性物质的大量析出,又会影响醇溶性黄酮的溶出,故总黄酮提取率迅速降低。因此,确定罗汉果花中总黄酮提取较佳的乙醇体积分数为70%。
2.1.3 超声波功率对罗汉果花中总黄酮提取率的影响 用70%乙醇为提取溶剂,按液料比10∶1,超声时间30 min,分别考察不同超声波功率对罗汉果花中总黄酮提取率的影响,试验结果如图2(b)所示。超声波的空化现象可以强化溶质扩散,且对原料具有破碎作用,使得原料组织内的化学成分能与溶剂充分接触,进而提高化学成分的提取效率。由图2(b)可知,当超声波功率小于200 W时,总黄酮提取率随着功率的增加而增大,且在超声波功率为200 W时达到峰值,但200 W以后,由超声波产生的热效应使得一些黄酮发生了氧化,氧化损失超过了提取效应带来的增加,而且功率过高,杂质溶出增加,也会阻碍黄酮类化合物的溶出,从而导致总黄酮提取率随着功率的增加开始下降。因此,确定罗汉果花中总黄酮提取较佳的超声波功率为200 W。
2.1.4 液料比对罗汉果花中总黄酮提取率的影响 用70%乙醇为提取溶剂,按超声波功率200 W,超声时间30 min,分别考察不同液料比对罗汉果花中总黄酮提取率的影响,试验结果如图2(c)所示。随着提取溶剂的增加,原料与溶剂的接触面积增大,而且原料与溶剂间的浓度梯度也会增大,从而有利于黄酮类物质的浸出。由图2(c)可以看出,随着液料比的增加,总黄酮的提取率逐渐增大。当液料比从10∶1升高至15∶1时,总黄酮提取率急剧增加,但当液料比超过15∶1后,提取率的增加趋势趋于缓和,这主要是因为当溶剂量达到一定程度后,溶剂将原料充分包裹,此时再继续增加溶剂量对提高总黄酮提取率已没有显著的影响。因此,从节约溶剂和减少后期浓缩工作量角度考虑,确定溶剂与罗汉果花的比例为15∶1比较适宜。
2.1.5 超声时间对罗汉果花中总黄酮提取率的影响 用70%乙醇为提取溶剂,按液料比15∶1,超声波功率200 W,分别考察不同超声时间对罗汉果花中总黄酮提取率的影响,试验结果如图2(d)所示。由图2(d)可以看出,随着超声时间的延长,黄酮类物质通过超声波的空化效应从罗汉果花中大量溶出,提取率急剧增加,并在40 min时达到最大值,而40 min之后随着超声时间的继续延长,黄酮类物质溶出量开始减少,但超声波空化作用带来的高温热效应却逐渐增强,使得一部分溶出的黄酮类物质氧化分解,造成总黄酮提取率迅速下降。因此,确定罗汉果花中总黄酮提取适宜的超声时间为40 min。
2.2 Box-Behnken试验设计结果
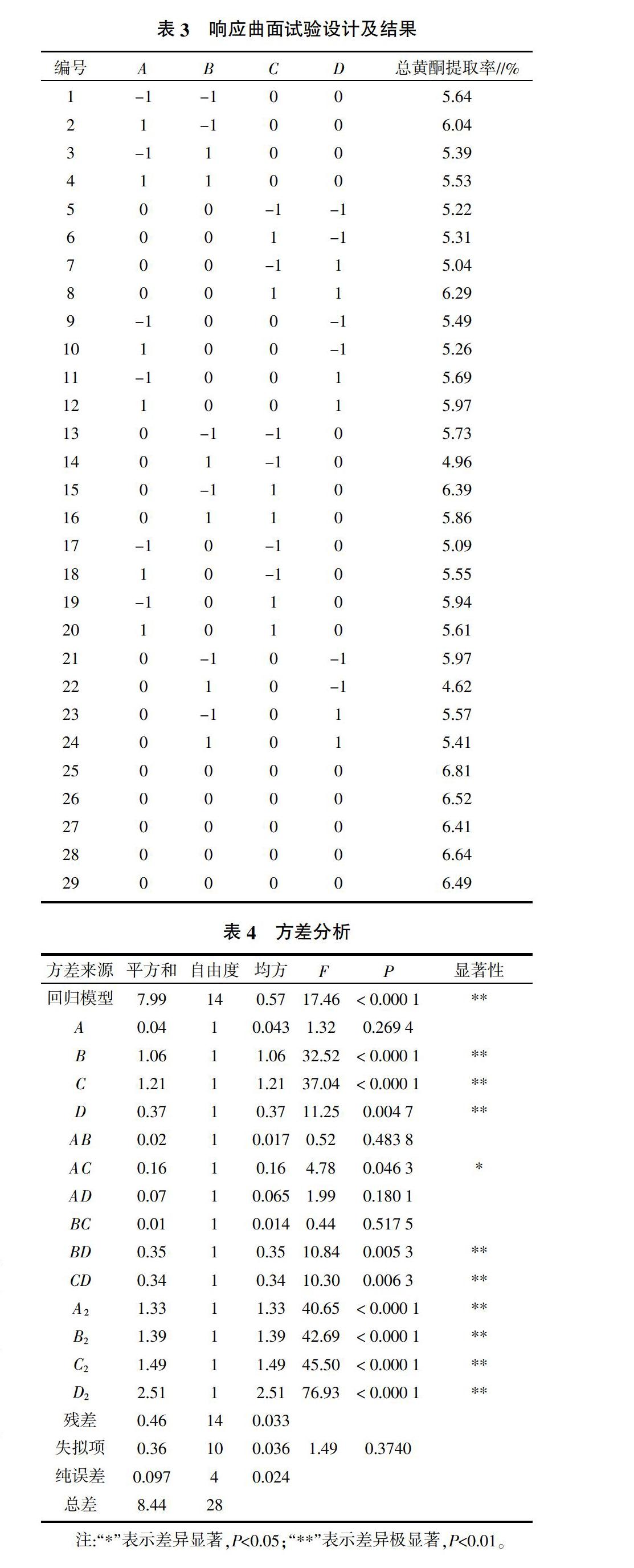
Box-Behnken试验因素与水平见表2,试验设计编排方案及结果见表3。利用Design-Expert 7.0.0软件对表3中的试验数据进行方差分析(表4)。以总黄酮提取率为响应值,各因素经二次回归拟合后,得到罗汉果花中总黄酮提取率(Y)对液料比(A)、乙醇体积分数(B)、超声时间(C)和超声波功率(D)的二次多项回归方程为:
Y=6.57+0.060A-0.30B+0.32C+0.18D-0.065AB-0.20AC+0.13AD+0.060BC+0.30BD+0.29CD-0.45A2-0.46B2-0.48C2-0.62D2,由表4可知,回歸模型检验的P<0.000 1,表明试验所采用的二次模型是极显著的,在统计学上是有意义的,而失拟项检验的P=0.374 0>0.05,表现为不显著,说明方程模拟的比较好;该模型的R2=0.945 8,说明该模型充分拟合试验数据,试验误差小,预测值与实测值之间具有高度相关性。离散系数表示试验的精确度,其值越低,试验结果的可靠性越高[10]。本试验离散系数为3.15%,在可接受范围内,说明试验结果真实可靠。信噪比为14.28,远大于4,说明该模型拟合度和可信度均较高。综上所述,该方程是罗汉果花中总黄酮提取率与提取工艺各参数间合适的数学模型,利用此回归方程可确定罗汉果花中总黄酮的最佳提取工艺。
回归方程中一次项系数绝对值的大小反映了各因素对响应值的影响程度[11]。由回归方程可知,影响罗汉果花中总黄酮提取率的主次因素为:超声时间>乙醇体积分数>超声波功率>液料比,其中提取时间、乙醇体积分数、超声波功率的作用达到极显著,在二次项中,4个因素都表现为极显著,在交互相中,乙醇体积分数与超声波功率的交互作用和超声时间与超声波功率的交互作用表现为极显著水平,其三维响应曲面及等高线见图3和图4。等高线的形状可反映交互效应的强弱,椭圆形表示两因素交互作用强,而圆形则与之相反[12]。由图3、图4可知,乙醇体积分数与超声波功率、超声时间与超声波功率的交互作用对罗汉果花中总黄酮的提取率影响皆显著,且在所选范围内两组图都存在极值点,即响应面的最高点,极值点所对应的条件位于等高线中心点处。
响应面图形是响应值对各试验因子所构成的三维空间的曲面图,从图上可形象地看出各因素交互作用对罗汉果花中总黄酮提取率的影响,若曲线越陡峭,则表明该因素对总黄酮提取率的影响越大[12]。图3表示液料比15∶1,超声时间40 min时,乙醇体积分数和超声波功率对总黄酮提取的影响。从图3可以看出,随着乙醇体积分数和超波声功率的增加,总黄酮提取率先升高后降低,且乙醇体积分数曲面斜率大于超声波功率曲面斜率,说明乙醇体积分数对罗汉果花中总黄酮提取率的影响大于超声波功率;图4表示液料比15∶1,乙醇体积分数70%时,超声时间和超声波功率对总黄酮提取的影响。从图4可以看出,随着超声时间与超声波功率的增加,总黄酮提取率先升高后降低,超声时间和超声波功率的曲面变化都很陡峭,但沿提取时间轴向等高线变化密集,说明提取时间对总黄酮提取率的影响大于超声波功率。
通过响应面得出的最佳提取工艺条件为液料比15∶1,乙醇体积分数67.55%,超声时间43.62 min,超声波功率208.48 W。按此最佳工艺条件进行3次验证试验,得总黄酮平均提取率为6.537%,与回归方程得到的预测值6.683%相差0.146%,实际值与预测基本吻合。
3 结论
采用超声波提取法从罗汉果花中提取总黄酮,通过单因素试验分析,考察了不同因素对罗汉果花中总黄酮提取率的影响,确定总黄酮提取时较适宜的乙醇体积分数为70%,超声波功率为200 W,最适液料比为15∶1,提取时间为40 min;通过Box-Behnken试验设计和分析,确定了罗汉果花中总黄酮超声波提取的最佳工艺条件为:液料比15∶1,乙醇体积分数67.55%,超声时间43.62 min,超声波功率208.48 W,在此条件下,测得罗汉果花中总黄酮的提取率可达到6.537%。
参考文献:
[1] 陈全斌,朱 静,谭洪盛.罗汉果花中黄酮苷元鉴定[J].安徽农业科学,2011,39(2):792-794.
[2] 邓 双,梁志远,张丽丽,等.三种花精油抗菌活性初探[J].贵州师范学院学报,2012,28(12):30-33.
[3] 譚洪盛,马俊飞,陈全斌.罗汉果花中槲皮素和山奈酚含量的测定[J].广西科学,2012,19(1):69-70,73.
[4] BUBOLS G B,VIANNA D R,ALEXANDER M R,et al. The antioxidant activity of coumarins and flavonoids[J]. Mini Reviews in Medicinal Chemistry,2013,13(3):318-334.
[5] SIASOS G, TOUSOULIS D, TSIGKOU V,et al. Flavonoids in atherosclerosis: An overview of their mechanisms of action[J].Current Medicinal Chemistry,2013,20(21):2641-2660.
[6] LU J,ZHOU C,RONG O,et al.Optimization of microwave-assisted extraction of flavonoids from cryptotaenia japonica kassk using response surface methodology[J].Advance Journal of Food Science and Technology,2013,5(3):310-317.
[7] SHAN B,XIE J H,ZHU J H,et al. Ethanol modified supercritical carbon dioxide extraction of flavonoids from Momordica charantia L. and its antioxidant activity[J]. Food and Bioproducts Processing,2012,90(3):579-587.
[8] 姜贵全. 地榆中药用活性成分提取工艺及稳定性研究[D].哈尔滨:东北林业大学,2005.
[9] WEI L Y,WANG J H,ZHENG X D,et al. Studies on the extracting technical conditions of inulin from Jerusalem artichoke tubers[J]. Journal of Food Engineering,2007,79(3):1087-1093.
[10] HE J,ZHEN Q W,QIU N,et al. Medium optimization for the production of a novel bioflocculant from Halomonas sp. V3a'using response surface methodology[J]. Bioresource Technology,2009,100(23):5922-5927.
[11] 吴 晖,赖富饶,胡筱波.响应面分析法优化油菜花粉多糖提取工艺的研究[J].食品与机械,2007,23(5):66-70.
[12] 纪学芳,徐怀德,张淑娟,等.响应面试验优化超声波提取光皮木瓜黄酮和多糖复合物[J].食品科学,2013,34(6):47-51.

