Toll样受体7小分子激动剂偶联流感病毒灭活疫苗的研究
陈婷婷 胡云龙 刘兵 李琴 贾铁留 郭德银 靳广毅
[摘要] 目的 研究Toll样受体7小分子激动剂SZU-101(T7)偶联H1N1流感病毒灭活疫苗对小鼠的免疫原性及安全性评价。 方法 将SZU-101与流感疫苗共价偶联形成SZU-101偶联流感疫苗(Flu-T7);体外评价Flu-T7的对脾脏淋巴细胞免疫诱导活性;体内评价Flu-T7对特异性抗体的诱导效果及特性,将BALB/c小鼠随机分为4组,每组8只,分别为生理盐水组、T7组、单独疫苗(Flu)组、Flu-T7组,采用腹腔注射免疫小鼠,3次免疫后检测血清中Flu特异性IgG及其分型,并考察每组小鼠的生长状况。 结果 体外实验显示Flu-T7组比Flu组刺激产生更多的IL-12、IFN-γ、TNF-α和IL-6细胞因子(P < 0.05),体内实验显示Flu-T7诱导的Flu特异性IgG的血清抗体效价显著增高,同时利用IgG2a/IgG1的比例表明Flu-T7促进小鼠特异性Th1型免疫反应。各组小鼠脾脏指数比较差异无统计学意义(P > 0.05)。 结论 Flu-T7具有良好的有效性及安全性,有望成为新型高效的流感灭活疫苗。
[关键词] Toll样受体7小分子激动剂;流感疫苗;佐剂,免疫反应
[中图分类号] R186 [文献标识码] A [文章编号] 1673-7210(2016)03(c)-0026-05
[Abstract] Objective To evaluate the immunogenicity and safety of Toll-like receptor agonist (SZU-101, T7) conjugated with inactivated H1N1 influenza vaccine in mice. Methods T7 was covalent conjugated with Flu by chemical synthesis (Flu-T7). Then the cellular immune responses were evaluated by determining cytokine levels of IFN-γ, IL-6, IL-12, TNF-α in mouse lymphocyte from splenocytes exposed to vaccines at indicated concentrations and in vivo experiments to evaluate the specific antibody induction effect and characteristics of Flu-T7. BALB/c mice were randomly divided into four groups (n=8) and intraperitonealy immunized normal saline, Flu, Flu-T7 and T7. ELISA assay was employed to test the serum specific IgG level and IgG subclasses after 3 times of immunization. The body weights of the four groups were also observed. Results Chemical conjugation of Flu-T7 significantly increased the release of IFN-γ, IL-12, IL-6 and TNF-α in mouse lymphocytes in vitro (P < 0.05), and significantly increased the IgG antibody titer. Immunization with Flu-T7 elicited a more potent Th1-polarized immune response, represented by higher IgG2a titers. No significant differences were observed in the spleen index of mice in various groups (P > 0.05). Conclusion The new synthetic Toll-like receptor 7 agonist conjugated with inactivated H1N1 influenza vaccines shows high effectiveness and safety, which can be used as a new and promising alternative inactivated H1N1 influenza vaccines.
[Key words] TLR7 agonist; Influenza vaccine; Adjuvant; Immune response
流感病毒引起的急性呼吸系統疾病传播迅速,具有高发病率和高死亡率的特点[1]。根据核蛋白(NP)和基质蛋白 (M1)的不同可分为甲型、乙型和丙型[2]。上个世纪曾经暴发过多次全球性流感大流行,最为严重的一次是发生于1918~1919年的西班牙流感,该流感的流行毒株为最常见的甲型H1N1,至少2千万人死亡[3]。目前,预防流感病毒最有效、最经济的手段是接种流感疫苗[4]。然而,疫苗的有效性受多种因素影响并且每年不同[5]。流感疫苗主要基于表面糖蛋白抗原血凝素(HA)的保守区域[6]。HA的抗原漂移具有高塑性,因此需要开发新的抗原,利用佐剂增强疫苗自身的免疫原性[7]。普通流感疫苗虽然能够激发有效针对病毒的抗体,但是对于免疫系统不完善的幼儿、免疫力低下的人及老年人,长期反复的感染常常导致严重的、不可逆转的呼吸器官损伤,诱发呼吸系统功能衰竭,后果严重。因此,快速清除感染细胞并终止病毒连续复制对于上述感染人群非常重要。CD4+效应T细胞和细胞毒性CD8+T细胞反应杀死细胞内病毒并且在抗流感病毒免疫反应中起到重要作用[6]。因此,Toll样受体(TLRs),一类先天免疫系统识别受体,可以作为一种理想的佐剂。已有文献报道TLRs 7小分子激动剂可以诱导细胞因子的产生和免疫激活反应[8]。
TLRs是一种模式识别受体,它们可以特异性识别微生物的保守分子模式[9]。目前在脊椎动物鉴定出13种TLRs,人体存在10种。TLRs属于穿膜信号蛋白,分别表达在细胞膜上和内涵体膜上。功能上TLRs可以激发固有免疫、连接获得性免疫[10-11]。TLRs 7、8和9表达在内涵体上且均识别核酸类似物,其中TLRs7/8可以被人工合成的小分子激动剂活化,研究显示这些小分子激动剂是有效的疫苗佐剂和抗病毒/抗肿瘤药物[12-13]。但是由于TLRs7/8激动剂小分子的特点,使得它们代谢快速、起效窗口较短,往往造成药效不一致[14]。在新型TLRs7/8激动剂的开发中,发现运用偶联型TLRs7/8形成的蛋白-TLRs7/8复合体疫苗具有突出的免疫诱导效果[14],它们显示长时间局部的免疫诱导效应,可以诱导强有力的特异性体液免疫和细胞免疫反应,且循环细胞因子诱导效果极低,保证偶联疫苗高效的同时具有很好的循环安全性[15]。
本研究利用自主研发的新型TLRs7小分子激动剂SZU-101(T7)与流感病毒偶联形成Flu-T7疫苗,这种新型疫苗可以有效地增强H1N1流感病毒灭活疫苗的免疫诱导效果,并且对小鼠低毒性。因此,SZU-101可以作为H1N1流感病毒灭活疫苗的一种安全有效的佐剂。
1 材料与方法
1.1 实验动物
SPF级Balb/c小鼠,雌性,4~6周,体重13~15 g,体毛整洁、光亮,健康状况良好,购于广东省医学动物实验中心[许可证号:SCXK(粤)2013-0002]。
1.2 主要试剂
H1N1流感病毒灭活疫苗由北京科兴生物制品有限公司惠赠(生产批号:A1-1307-039)。小分子化合物SZU-101(T7)由深圳大学深圳市合成生物学工程实验室(以下简称“本实验室”)合成纯化。Flu-T7由本实验室偶联合成[16]。
1.3 免疫方式
雌性4~6周龄的Balb/c小鼠随机分为4组,每组8只:①生理盐水组;②T7组(1 mg/mL);③Flu组(3 μg);④Flu-T7组(3 μg)。分别于第0、14、28天免疫3次,每次经腹腔注射,0.1 mL/只。量效实验分别在第7、21、35天采集小鼠尾巴静脉血,分离血清,检测抗体效价。
1.4 血清中IgG的检测
用ELISA法检测特异性IgG抗体[17]。首先向96孔酶标板各孔中加入100 μL包被液(含1 μg/mL的Flu),4°C過夜。取出酶标板,弃孔中包被液后,向孔中加入300 μL PBST洗涤3次。血清样品1∶500稀释,室温孵育2 h。碱性磷酸酶标记的IgG、IgG1、IgG2a抗体,100 μL/孔,室温孵育1 h。加入p-NPP底物溶液显色,100 μL/孔,每孔加50 μL 3 mol/L NaOH终止反应,酶标仪测定OD405值。
1.5 细胞因子的检测
利用深圳达科为生物技术有限公司研制的小鼠淋巴细胞分离液,提取小鼠脾脏中的淋巴细胞,1×105个淋巴细胞/孔种在24孔板中,淋巴细胞分别孵育1、5、10 μg/mL的Flu或者Flu-T7,细胞培养箱培养24 h。收集上清,利用ELISA试剂盒(美国eBioscience公司)检测IFN-γ、IL-2、IL-12、TNF-α细胞因子水平。
1.6 统计学方法
采用SPSS 11.0软件对各试验数据进行处理,以P < 0.05为差异有统计学意义。
2 结果
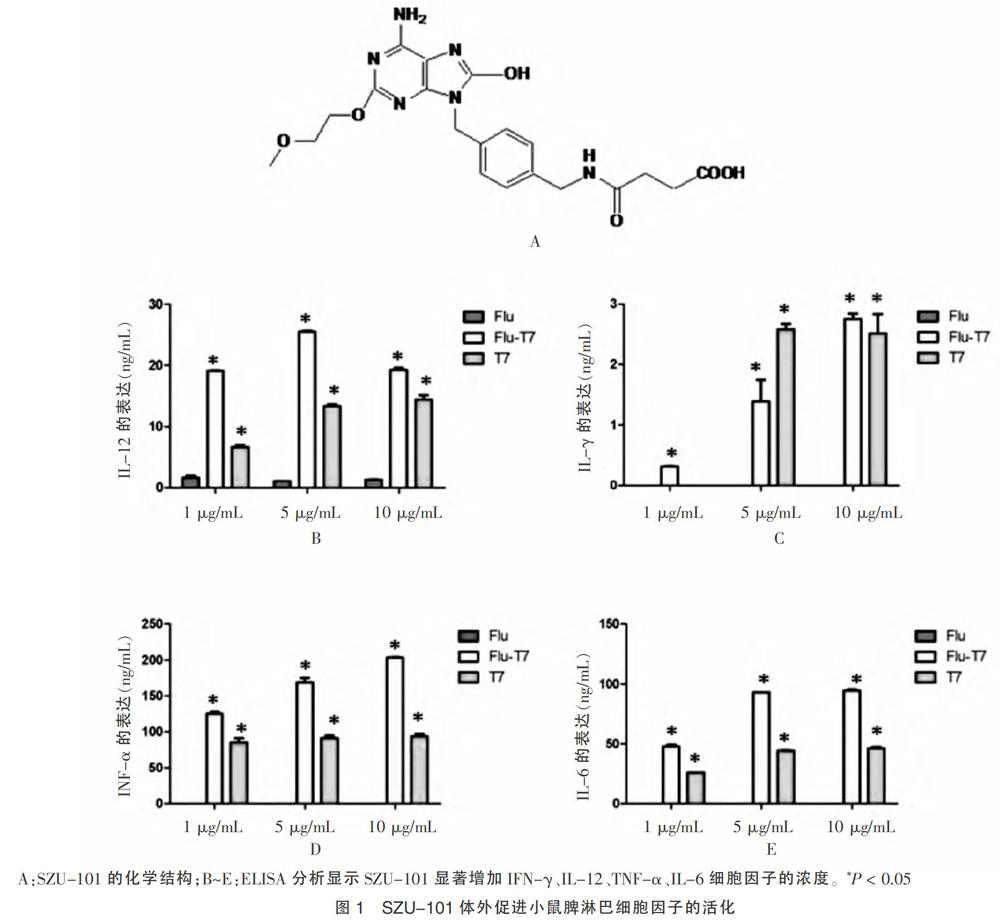
2.1 Flu-T7激活T细胞诱导细胞因子产生
已有研究显示T7诱导细胞因子的产生,增强树突状细胞的成熟以及抗原特异性细胞免疫反应[8]。因此,本研究首先评价T7作为流感疫苗佐剂的体外活性。图1显示T7由本实验室自行合成,并与H1N1流感疫苗化学偶联;然后将小鼠的脾淋巴细胞与不同浓度的Flu或者Flu-T7共同孵育,通过细胞因子的分泌来评价免疫诱导效应。Flu-T7对比于单独Flu组,产生更多的IL-12(图1B)、IFN-γ(图1C)、TNF-α(图1D)、IL-6(图1E)的表达(P < 0.05)。这些结果说明,Flu-T7促进了Th1型和Th2型免疫应答,诱导了细胞免疫和体液免疫相关细胞因子的发生。见图1。
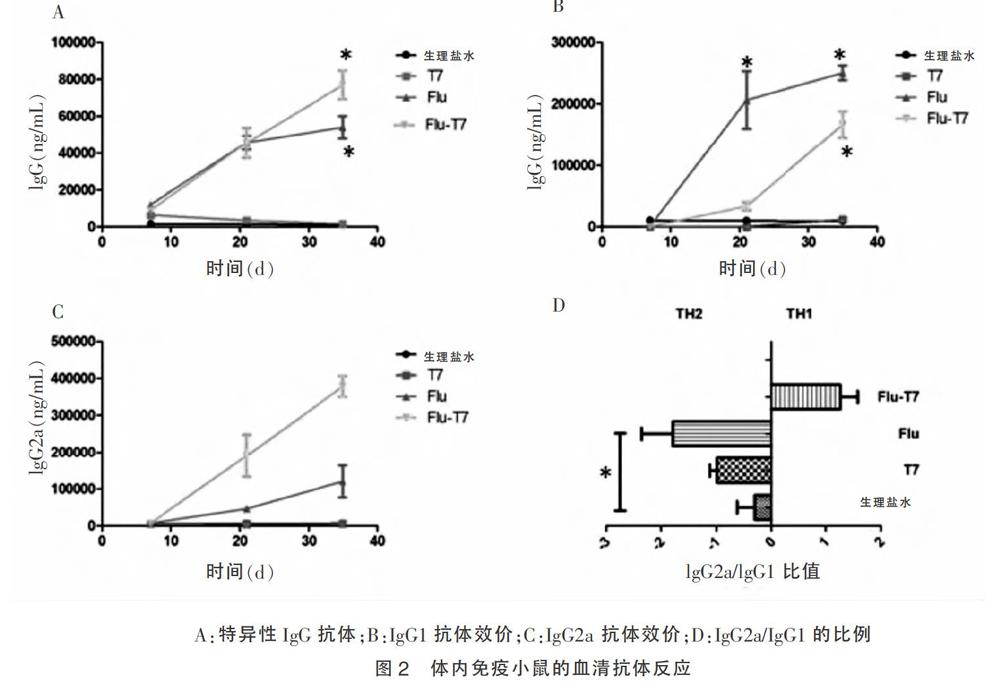
2.2 免疫小鼠的血清抗体反应
为了评价T7作为流感疫苗的佐剂效果,Balb/c分别于第0、14、28天腹腔免疫3 μg的Flu或者3 μg的Flu-T7,并分别于第7、21、35天尾静脉采血。从图2A显示,从第2次免疫开始,Flu-T7的抗体效价高于Flu对照组。IgG根据结果和功能的不同包含不同的亚类,IgG1和IgG2a为最主要的IgG亚类[18],而特异性IgG2a滴度代表Th1型免疫反应的,同时检测了IgG2a/IgG1的比例,结果显示,Flu-T7 主要偏属于Th1型,产生更多的特异性IgG2a型抗体。见图2。
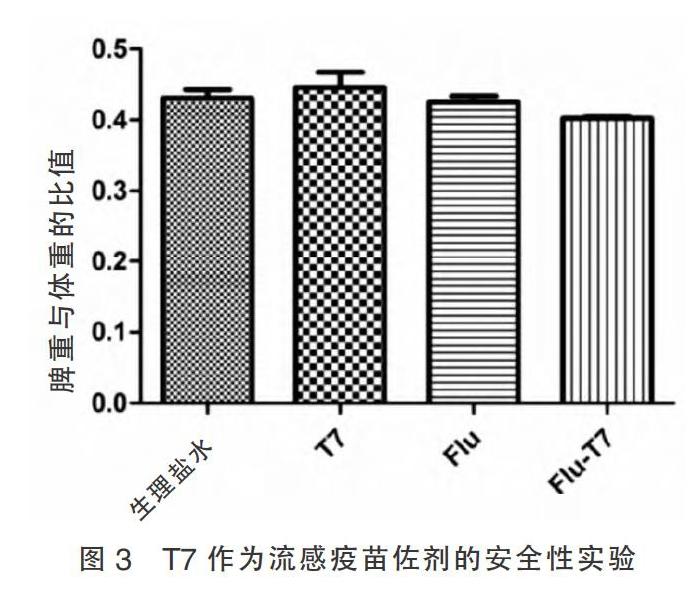
2.3 T7作为流感疫苗佐剂的安全性
免疫后第35天,对各组小鼠的脾脏和体重进行称量,计算各组小鼠脾重与体重的比值。各组小鼠脾重与体重的比值比较差异无统计学意义(P > 0.05),表明以T7为佐剂的疫苗对小鼠机体刺激性较少,对其生长并无显著影响,显示出T7良好的安全性。见图3。
3 讨论
目前防止流感最有效的手段就是接种流感疫苗。但是,当流感大规模暴发时,传统的流感疫苗无法满足在短时间内提供足够多的疫苗给免疫易感人群,抗原血凝素HA的遗传变异常常使流感逃脱免疫反应。因此,佐剂作为一种抗原辅助剂,与疫苗共同使用可以明显提高疫苗的免疫效果。现阶段应用于流感疫苗中较为常见的佐剂有铝盐佐剂、水包油乳剂、病毒颗粒等。新一代的疫苗常常利用小分子Toll样受体和其他天然免疫受体作为佐剂[19]。
TLRs家族是一类进化保守的模式识别受体,可感知病原体的存在并启动机体防御相关基因的表达[20]。越来越多的TLRs被用作佐剂。CD4+和CD8+在流感病毒感染的调控以及长期保护性免疫方面起到了重要的作用[21]。病毒感染主要激活未成熟的CD4细胞,诱导Th1型免疫反应,促进CD8 T细胞的维护和B细胞反应。CD8细胞以接触依赖的方式杀死病毒感染的细胞[22]。TNF-α与IFN-γ协同抗病毒感染[23]。有研究指出SZU-101的活化诱导TNF-α、IFN-γ、IL-12以及Th2型细胞因子IL-6等促炎因子高表达[8]。此次实验结果显示,当T7化学偶联Flu合成为Flu-T7,与单独Flu组比较,可以显著增加TNF-α、IFN-γ、IL-12和IL-6细胞因子的表达水平。并且,越来越多的研究表明,感染流感病毒的老年人Th1型CD4+的反应降低,杀死病毒感染的细胞能力减弱[24]。细胞因子反应在症状形成的早期和决定阶段以及流感病毒感染的宿主防御阶段都起到了重要作用[25]。这些结果都表明,Flu-T7在增强细胞免疫反应、提高清除感染细胞的效率方面显示出更好的疗效,因为Th1型的IFN-γ细胞因子可以增强细胞介导的免疫反应[25]。
IgG是血液和细胞外液中最主要的抗体,调控人体组织的感染。大多数疫苗通过产生血清IgG,对多种病原体介导体液保护[26]。体内实验显示,Flu-T7与Flu单独组比较,诱导多样的免疫反应。Flu-T7不显著降低Flu特异性IgG1水平,同时可以诱导产生更多的Flu特异性IgG2a,IgG2a是Th1型免疫反应的代表型抗体,它具有更高的亲和力和杀伤效果,可以有效地介导机体对病毒的内吞消化[18]。而IgG2a/IgG1比值也显示出Flu-T7诱发的免疫反应偏向于Th1型细胞免疫反应,细胞免疫是机体实现免疫监视、清除胞内感染的关键,该作用提示Flu-T7疫苗存在打破流感病毒免疫耐受的潜力。在副作用评价上,脾脏指数可以作为参考指标,Flu-T7的脾脏指数与对照组比较差异无统计学意义,表示Flu-T7毒副作用较低,可以作为流感疫苗的一种安全佐剂。
病毒抗体只是消除细胞外的病毒,无法清除进入细胞内复制的病毒。所以,只有快速、早期清除感染的细胞才能终止病毒复制。在本研究中,IgG的亚型、脾细胞因子的分泌,表明SZU-101不仅可以增强体液免疫应答,同时增强细胞介导的H1N1流感疫苗的交叉保护性免疫能力。普通的流感无佐剂疫苗加本实验室自行合成的T7所設计的疫苗组合是抗击流感疫苗一种更有效的方法,值得推广。
[参考文献]
[1] Thompson WW,Comanor L,Shay DK. Epidemiology of seasonal influenza:use of surveillance data and statistical models to estimate the burden of disease [J]. Journal of Infectious Diseases,2006,194(Supplement 2):S82-S91.
[2] Horimoto T,Kawaoka Y. Pandemic threat posed by avian influenza A viruses [J]. Clinical Microbiology Reviews,2001, 14(1):129-149.
[3] Hollenbeck JE. Lessons learned from the 1918-1919 influenza pandemic [J]. Indian Journal of Microbiology,2009,49(4):348-351.
[4] Yuen CY,Tarrant M. A comprehensive review of influenza and influenza vaccination during pregnancy [J]. Journal of Perinatal & Neonatal Nursing,2014,28(4):261-270.
[5] Monto AS,Ohmit SE,Petrie JG,et al. Comparative efficacy of inactivated and live attenuated influenza vaccines [J]. New England Journal of Medicine,2009,361(13):1260-1267.
[6] Cox R. Correlates of protection to influenza virus,where do we go from here? [J]. Human Vaccines & Immunotherapeutics,2013,9(2):405-408.
[7] Krammer F,Palese P. Universal influenza virus vaccines:need for clinical trials [J]. Nature Immunology,2014,15(1):3-5.
[8] Zhu J,He S,Du J,et al. Local administration of a novel Toll-like receptor 7 agonist in combination with doxorubicin induces durable tumouricidal effects in a murine model of T cell lymphoma [J]. J Hematol Oncol,2015,8(1):21.
[9] Medzhitov R,Janeway C. Innate immune recognition:mechanisms and pathways [J]. Immunological Reviews,2000,173(1):89-97.
[10] Janssens S,Beyaert R. Role of Toll-like receptors in pathogen recognition [J]. Clinical Microbiology Reviews,2003,16(4):637-646.
[11] Galluzzi L,Vacchelli E,Eggermont A,et al. Trial Watch:Experimental Toll-like receptor agonists for cancer therapy [J]. Oncoimmunology,2012,1(5):699-739.
[12] Akira S,Uematsu S,Takeuchi O. Pathogen recognition and innate immunity [J]. Cell,2006,124(4):783-801.
[13] Czarniecki M. Small molecule modulators of toll-like receptors [J]. Journal of Medicinal Chemistry,2008,51(21):6621-6626.
[14] Wille-Reece U,Wu Cy,Flynn BJ,et al. Immunization with HIV-1 Gag protein conjugated to a TLR7/8 agonist results in the generation of HIV-1 Gag-specific Th1 and CD8+ T cell responses [J]. Journal of Immunology,2005,174(12):7676-7683.
[15] Wu CC,Hayashi T,Takabayashi K,et al. Immunotherapeutic activity of a conjugate of a Toll-like receptor 7 ligand [J]. Proceedings of the National Academy of Sciences,2007, 104(10):3990-3995.
[16] Gao D,Liu Y,Li W,et al. Synthesis and immunoregulatory activities of conjugates of a Toll-like receptor 7 inert ligand [J]. Bioorganic & Medicinal Chemistry Letters,2014, 24(24):5792-5795.
[17] Chan M, Hayashi T,Kuy CS,et al. Synthesis and immunological characterization of toll-like receptor 7 agonistic conjugates [J]. Bioconjugate Chemistry,2009,20(6):1194-1200.
[18] Nimmerjahn F,Ravetch JV. Divergent immunoglobulin g subclass activity through selective Fc receptor binding [J]. Science,2005,310(5753):1510-1512.
[19] Reed SG,Orr MT,Fox CB. Key roles of adjuvants in modern vaccines [J]. Nature Medicine,2013,19(12):1597-1608.
[20] Medzhitov R. Toll-like receptors and innate immunity [J]. Nature Reviews Immunology,2001,1(2):135-145.
[21] Doherty PC,Christensen JP. Accessing complexity:the dynamics of virus-specific T cell responses [J]. Annual Review of Immunology,2000,8(1):561-592.
[22] Brown DM,Román E,Swain SL. CD4 T cell responses to influenza infection [J]. Semin Immunol,2004,16(3):171-177.
[23] Wong GH,Goeddel DV. Tumour necrosis factors α and β inhibit virus replication and synergize with interferons [J]. Nature,1986,323(6091):819-822.
[24] Castle S,Uyemura K,Wong W,et al. Evidence of enhanced type 2 immune response and impaired upregulation of a type 1 response in frail elderly nursing home residents [J]. Mechanisms of ageing and development,1997,94(1):7-16.
[25] Hayden FG,Fritz R,Lobo MC,et al. Local and systemic cytokine responses during experimental human influenza A virus infection. Relation to symptom formation and host defense [J]. Journal of Clinical Investigation,1998,101(3):643.
[26] Thakur A,Pedersen LE,Jungersen G. Immune markers and correlates of protection for vaccine induced immune responses [J]. Vaccine,2012,30(33):4907-4920.
(收稿日期:2015-11-04 本文編辑:赵鲁枫)

