黑皮鸡枞菌水提物和醇提物的主要成分及抗氧化性研究
卢彩会 郭晓萌 牟德华
(河北科技大学生物科学与工程学院,河北石家庄050000)
黑皮鸡枞菌水提物和醇提物的主要成分及抗氧化性研究
卢彩会*郭晓萌牟德华**
(河北科技大学生物科学与工程学院,河北石家庄050000)
近几年来,人们越来越关注食物的抗氧化能力,不仅是因为这些抗氧化物质能够防止食物的腐败变质,更重要的是能够减少自由基对人体免疫的损伤。人体内自由基能够导致各种疾病如心血管疾病、糖尿病、关节炎和癌症。在一些植物原料中存在大量的功能性抗氧化成分,这些抗氧化成分受到了越来越多的关注。
鸡枞菌属又称蚁巢伞属(Term itomyce Heim),属担子菌纲,伞菌科。鸡枞菌不仅含有丰富的氨基酸、维生素和醇类物质及多种生物酶,还含有多酚、多糖、黄酮等多种生物活性成分,这些活性成分常被用在镇痛消炎、提高免疫力、修复损伤器官及调节身体机能等方面。在鸡枞菌的功能性成分研究中,对多糖的抗氧化作用研究最为广泛,粗多糖的提取多采用热水浸提醇沉法。鸡枞菌的醇提物,其主要成分是多酚和黄酮类物质,这两类物质有很强的抗氧化性能,但对其研究报道相对较少。
本文主要通过羟基自由基、DPPH、ABTS清除能力以及铁离子还原力,比较鸡枞菌水提物和醇提物的抗氧化能力大小,并且初步探讨了提取物中活性成分与抗氧化活性的相关性,为鸡枞菌的综合加工利用提供理论依据。
1 材料与方法
1.1材料与仪器
鸡枞菌子实体粉,北京金珠满江生物科技有限公司;没食子酸,天津市大茂化学试剂厂;芦丁,北京化学试剂公司;DPPH、ABTS,上海宝曼生物科技有限公司;硝酸铝、醋酸钾、铁氰化钾、三氯乙酸、氯化铁、双氧水、硫酸亚铁、水杨酸、过硫酸钾,均为分析纯。
756P紫外可见分光光度计,上海光谱仪器有限公司;酶标仪,美国thermo;DELA 320pH计,梅特勒-托利多仪器有限公司。
1.2试验方法
1.2.1样品的制备
水提物的制备:称取鸡枞菌粉10 g,以1∶30的料液比进行混合,60℃浸提1 h,100℃沸水浴提取1.5 h,4 500 r/min离心15 min,分离得到鸡枞菌水提物,定容至250 mL,备用。
醇提物的制备:称取鸡枞菌粉10 g,与体积分数70%乙醇以料液比为1∶25进行混合,90℃提取3次,每次1 h。将提取液进行抽滤得到鸡枞菌醇提物,定容至250 mL,备用。
1.2.2DPPH自由基清除能力的测定
分别吸取1.0 mL、2.0 mL、3.0 mL、5.0 mL、7.0 mL、9.0 mL、11.0 mL样品溶液于试管中,加入2.0 mL 0.2 mmol/L的DPPH溶液,分别用体积分数95%的乙醇定容至15mL,摇匀,室温放置30 min后在517 nm下测定吸光值,记为A1。用相同体积的乙醇代替DPPH,其他操作相同,测定其吸光度,计为A2,用体积分数95%乙醇代替样品溶液,其吸光值记为A0。

1.2.3铁离子还原力测定
吸取2.5 mL磷酸盐缓冲溶液(Na2HPO4与NaH2PO4按37.5∶62.5混合)、2.5 mL铁氰化钾溶液(1%)、再分别加入1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL样品溶液,定容至10 mL,充分混匀。50℃下水浴20 min,加2.5 mL三氯乙酸(10%)混匀,离心,取上清液2.5 mL,加去离子水、氯化铁溶液(0.1%)2.5 mL,反应10 min,700 nm下测定吸光值A1,将样品用同等体积的去离子水代替,其他方法相同,测定吸光度为A0。
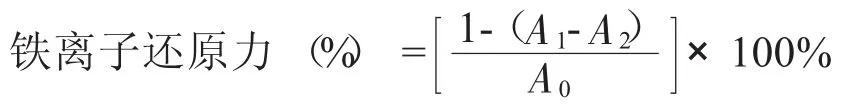
1.2.4·OH清除能力测定
8 mL·OH母体溶液(7.5 mmol/L FeSO4∶7.5 mmol/L H2O2∶7.5 mmol/L水杨酸按1∶2∶1混合)分别加入1.0 mL、2.0 mL、3.0 mL、5.0 mL、7.0 mL、9.0 mL、11.0 mL的样品溶液,用去离子水定容到20 mL,37℃水浴15 min,在530 nm下测定各组的吸光值为A1,将·OH母体溶液用相同体积的去离子水代替,其他方法相同,测定吸光度为A2;将样品溶液用同等体积的去离子水代替,其他操作相同,记为A0。

1.2.5ABTS清除能力
分别取样品溶液0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0mL于小试管中,然后加2 mL ABTS工作液(140 mmol/L K2S2O8与7 mmol/L ABTS按62.5∶1混合),定容至3 mL,混匀,放置6 min,734 nm下测定吸光值为A1;用相同体积的去离子水代替ABTS,测定其吸光度为A2;将样品用相同体积的去离子水代替,其吸光度为A0。

1.2.6多糖含量的测定
采用苯酚硫酸法。
1.2.7多酚含量的测定
采用福林酚法。
1.2.7黄酮含量的测定
按照参考文献中孙琼的方法检测黑皮鸡枞菌中的黄酮含量。吸取1mL样品,分别加入1 mL体积分数70%的乙醇和质量浓度5%0.3 mL的亚硝酸钠溶液,静置6 min,加入0.3 mL质量浓度10%的硝酸铝溶液,静置6 min,加入2 mL质量浓度4%的亚硝酸钠,定容至5 mL,静置15 min,在510 nm下测定其吸光度。
2 结果与分析
2.1水提物和醇提物的成分及含量分析
测定了鸡枞菌的水提物和醇提物中多糖、多酚和黄酮类物质的含量,结果如表1。多糖不溶于乙醇,鸡枞菌醇提物中多糖含量为0.00 mg/g,水提物中多糖含量为23.1 mg/g,比王思芦超声辅助提取的野生鸡枞菌多糖含量略低。黄酮难溶于水,鸡枞菌水提物中黄酮的含量为0.00 mg/g,醇提物黄酮的含量为4.18 mg/g,比缪钱江所测4种食用菌的黄酮含量高,其中平菇的黄酮含量最高为3.16 mg/g。在水提物中多酚含量与醇提物中多酚含量相近,马雅鸽对新鲜鸡枞菌的多酚提取条件进行了优化,得出最优条件下的多酚含量达到了15.00 mg/g,比试验提取的醇提多酚(折合成鲜重)含量要高。

表1 提取物中黄酮、多酚和多糖含量
2.2水提物和醇提物的抗氧化性
由表1可以得出,水提物中多糖、多酚及黄酮的质量浓度分别为0.92 mg/mL、0.25 mg/mL、0.00 mg/mL;醇提物中多糖、多酚及黄酮的质量浓度分别为0.00 mg/mL、0.22 mg/mL、0.17 mg/mL。
2.2.1DPPH自由基清除能力
DPPH是一种稳定的自由基,其醇溶液为紫色,并且在517nm下具有最大吸收。吸光度水平降低的越多,表明样品的抗氧化性越好。鸡枞菌子实体粉水提物和醇提物对DPPH自由基清除能力如图1所示。

图1 水提物和醇提物的DPPH自由基清除能力
由图1可以看出,鸡枞菌粉的水提物和醇提物对DPPH自由基都有一定的清除能力,且随着2种提取物加入量的增加而增加。在加入提取液体积为2 mL时,2种提取物的清除能力有明显的差异,但随着提取液加入量的增加,水提物与醇提物的清除能力的差异在逐渐减少。当水提物添加量为9 mL时,清除能力最高达到了75.04%,而醇提物的最高清除能力为69.51%。
Josiana A.Vaz比较了几种野生菌的抗氧化性,得出L.inversa水提物比醇提物清除DPPH自由基的能力强,Yun-Tao Liu得出了相同结论,而Nick Kalogeropoulos对S.bellinii的DPPH自由基清除能力进行了测定,发现S.bellinii清除DPPH最高达到26.37 mmol TE/100 g。Sandrina A.Heleno检测了2种野生菌的多酚含量,并对它们的抗氧化性能进行了研究发现,多酚含量高的野生菌清除DPPH自由基的EC50值就越低。Suphaphit Boonsong比较了5种食用菌的抗氧化性能,发现清除DPPH自由基的能力与多酚和黄酮的含量成正比。鸡枞菌2种提取物抗氧化性的不同,可能是受到2种提取物中抗氧化成分及含量的影响。
2.2.2还原铁离子能力
样品中的抗氧化成分能将铁氰化钾还原成亚铁氰化钾,亚铁氰化钾再与三价铁离子反应,生成亚铁氰化铁,在700 nm处有吸光度,且吸光度越大,还原能力越强。鸡枞菌子实体粉的醇提物和水提物的还原能力如图2所示。
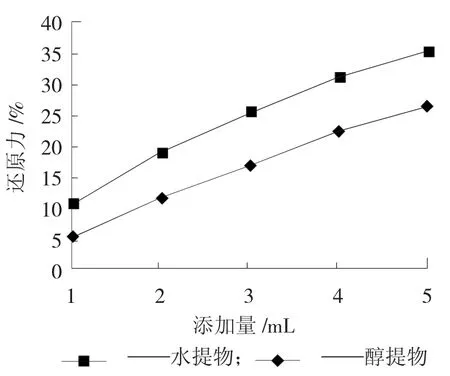
图2 水提物和醇提物的铁离子还原力
由图2可知,鸡枞菌醇提物和水提物对铁离子还原力随着添加量的增加而逐渐上升,但水提物的还原力比醇提物的还原力要高。JIANG Yuji,试验的26株菌水提物的还原力都要高于醇提物,与本试验的结论相同。黄俊丽等人研究表明,松茸、黑牛肝菌和双胞白蘑菇的还原能力与多酚的含量呈正比。Hamzah Rabiat Unekwu研究发现,P. ostreatus的还原能力在8种野生菌中最高,可能是因为其黄酮和多酚含量最高。Ashagrie Z.Woldegiorgis和Filipa S.Reis也得出了相同的结论。由表1可以看出,水提物中多酚含量与醇提物相近,水提物中多糖的质量浓度为0.92 mg/mL,比醇提物中黄酮的质量浓度(1.17 mg/mL)要大很多,因而在加入相同体积的提取物时,多糖的含量就要远高于黄酮的含量,可能是导致水提物的还原能力高于醇提物的原因。
2.2.3羟基自由基清除能力
当体系中含有羟基自由基清除剂时,清除剂能够与水杨酸竞争羟基自由基,使红色络合物减弱。因此通过分光光度计可以测定清除羟基自由的能力。鸡枞菌粉的水提物和醇提物清除羟自由基的能力如图3所示。
由图3可知,鸡枞菌粉的水提物和醇提物对羟基自由基都有较高的清除能力,但水提物的清除能力在加入量为5 mL前明显的高于醇提物,当二者的清除力都达到平衡时,清除力并没有很大的差别。

图3 水提物和醇提物的羟基自由基清除能力
Shu-Yao Tsai对3种食用菌的水提物和醇提物清除羟基自由基能力做了比较,发现水提物的清除能力远高于醇提物。Huizhen Li对平菇的多酚含量和清除羟基自由基的关系做了分析,发现平菇中多酚含量与其清除羟基自由基的能力呈正相关性,Kun Liu也得出了相同的结论。Jun-Hui Wang对黄山栽培的蘑菇的抗氧化性进行了研究,确定这种蘑菇的多糖提取液对羟自由基有很好的清除能力,在多糖质量浓度为5 mg/mL的时候达到了最大值,羟自由基清除率为74.18%,比本研究鸡枞菌粉2种提取物对羟基自由基的清除能力低。
2.2.4ABTS清除能力
ABTS自由基在734 nm下有最大吸收峰,下降程度与样品抗氧化能力呈正相关。ABTS自由基是一种极易被清除的自由基,从图4中也可以反应出来。鸡枞菌粉的2种提取物对ABTS的清除能力都很高,达到了99%左右,而且这2种提取物的的清除能力几乎相同。
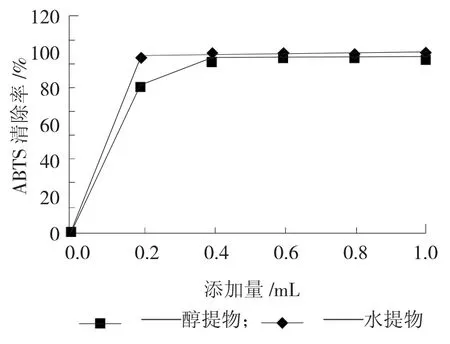
图4 水提物和醇提物的ABTS清除能力
王婷婷对4种食用菌清除ABTS的能力进行了测定,清除能力最高达到了98.66%,且清除率最高的黄皮疣柄牛肝菌的多酚含量也最高。LinaSmolskaite在试验中发现,用甲醇提取的P. schweinitzii和I.hispidus的多酚对ABTS自由基都有很强的清除能力。何晋浙对6种猴头菇的多糖进行ABTS的清除测定,发现每种多糖对ABTS自由基的清除能力都很高,且随着多糖浓度的增高清除能力越强。孙琼对杏鲍菇黄酮抗氧化性进行了研究,发现杏鲍菇具有较强的抗氧化性,并且随着黄酮含量的增加而增加。
3 结论
鸡枞菌粉的水提物中含有一定数量的多酚和多糖类物质,其中多酚含量为6.25 mg/g,多糖含量23.10 mg/g,黄酮含量为0.00 mg/g;醇提物中不含有多糖,多酚含量低于水提物,为5.50 mg/g,黄酮含量为4.18 mg/g;虽然鸡枞菌的水提物和醇提物都具有一定的抗氧化活性,但水提物的抗氧化活性高于醇提物的抗氧化活性,且2种提取物对ABTS自由基的清除能力最高,对铁离子的还原力最低。
鸡枞菌水提物和醇提物的抗氧化性均随着浓度的增加而升高,可能与多糖、多酚以及黄酮类物质含量有关,这种相关性在很多文章中都有报道。Manabendra Pattanayak对鸡枞菌多糖的抗氧化性进行了测定,结果证明,鸡枞菌多糖在很多方面都表显出了较高的抗氧化活性;MajaKozarski对几种野生食用菌多糖的抗氧化性进行了研究,发现试验用的几种食用菌的抗氧化能力均随着多糖浓度的增加而增加。SelimaKhatun和Ka-Chai Siu发现抗氧化性与多酚含量呈线性关系,Sandrina A. Heleno也证明了这一观点。Nevcihan Gursoy对7种羊肚菌的抗氧化性与黄酮含量进行了研究,发现黄酮含量高的羊肚菌的抗氧化能力更好一些。王钦博分别用5种有机溶剂对桑黄的乙醇提取液进行萃取,并用5种萃取相进行抗氧化试验,发现萃取相的抗氧化活性与黄酮的含量成正比。王宏雨对竹荪水提物依次用石油醚、乙酸乙酯和正丁醇进行萃取得到4个萃取相,测定水相主要为多糖物质,不含多酚和黄酮,而乙酸乙酯相则含大量多酚,不含多糖和黄酮,但抗氧化能力却与水相仅差7.06%,说明乙酸乙酯相的物质抗氧化能力要高于水相。鸡枞菌的水提物中多酚和多糖类物质的含量高于醇提物的含量,通过文献分析可能是鸡枞菌水提物的抗氧化活性要高于醇提物的原因,但具体3种抗氧化成分与鸡枞菌抗氧化性的相关性还需要进一步的研究。综上所述,鸡枞菌水提物的抗氧化性要高于醇提物的抗氧化性。
[1]王会,郭立,谢文磊.抗氧化剂抗氧化活性的测定方法(一)[J].食品与发酵工业,2006,32(3):92-98.
[2]SMOLSKAITE L,VENSKUTONIS P R,TALOU T.Comprehensive evaluation of antioxidant and antimicrobial properties of different mushroom species[J].LWT-Food Science and Technology,2015,60(1):462-471.
[3]张玉金.云南鸡枞菌与共生白蚁的系统发育和协同演化关系研究[D].昆明:云南农业大学,2012.
[4]王鹏飞,何隽,周文,等.蚁巢伞属真菌研究进展[J].微生物学通报,2012,39(10):1 487-1 498.
[5]陈晓英.蘑菇酚类物质的提取及其抗氧化活性的研究[D].福州:福建农林大学,2011.
[6]KOSANIC M,RANKOVIC B,RANCIC A,et al. Evaluation of metal concentration and antioxidant,antimicrobial,and anticancer potentials of two edible mushrooms lactariusdeliciosus and macrolepiota procera[J].Journal of Food and Drug Analysis,2016,24(3):1-8.
[7]HELENO S A,BARROS L,SOUSA M J,et al. Tocopherols composition of Portuguese wild mushrooms with antioxidant capacity[J].Food Chemistry,2010,119(4):1 443-1 450.
[8]李小雨,王振宇,王璐.食用菌多糖的抗氧化活性及抗细胞增殖活性研究[J].食品科技,2013(3):179-182.
[9]刘奕琳,王振宇.蓝靛果中花色苷含量的测定及其体外抗氧化性[J].中国林副特产,2011(5):14-17.
[10]孙琼,张直峰,李月梅.响应面法优化超声辅助提取杏鲍菇黄酮类化合物工艺研究[J].食品工业科技,2014(10):264-268.
[11]王思芦,汪开毓,彭艳伶.野生鸡枞菌多糖的提取及其免疫活性分析[J].中国兽医科学,2011,41(12):1 276-1 281.
[12]缪钱江,刘宇,许峰,等.4种食用菌总黄酮生物功能的研究[J].食品科技,2014,39(7):206-209.
[13]马雅鸽,马亚宁,张晓娟.鸡枞菌总多酚提取工艺的优化[J].食品工业,2015,36(6):209-211.
[14]VAZ J A,HELENO S A,MARTINS A,et al.Wild mushrooms clitocybealexandri and lepistainversa:in vitroantioxidant activity and growth inhibition of human tumour cell lines[J].Food and Chemical Toxicology,2010,48(10):2 881-2 884.
[15]LIU Y T,SUN J,LUO Z Y,et al.Chemical composition of five wild edible mushrooms collected from Southwest China and their antihyperglycemic and antioxidant activity[J]. Food and chemical toxicology,2012,50(5):1 238-1 244.
[16]KALOGEROPOULOS N,YANNI A E,KOUTROTSIOS G,et al.Bioactive microconstituents and antioxidant properties of wild edible mushrooms from the island of Lesvos,Greece[J].Food and chemical toxicology,2013,55:378-385.
[17]HELENO S A,BARROS L,MARTINS A,et al.Chemical composition,antioxidant activity and bioaccessibility studies in phenolic extracts of two Hericium wild edible species[J]. LWT-Food Science and Technology,2015,63(1):475-481.
[18]BOONSONGS,KLAYPRADITW,WILAIPUNP. Antioxidantactivitiesofextractsfromfiveedible mushrooms using different extractants[J].Agriculture and Natural Resources,2016.
[19]ZHANG M,CUI S W,CHEUNG P C K,et al.Antitumor polysaccharidesfrommushrooms:areviewontheir isolation process,structural characteristics and antitumor activity[J].Trends in Food Science&Technology,2007,18(1):4-19.
[20]黄俊丽,张慜.松茸、黑牛肝菌、双孢白蘑菇提取物体外抗氧化性试验研究[J].食品与生物技术学报,2011,30(1):342-347.
[21]UNEKWU H R,AUDU J A,MAKUN M H,et al. Phytochemicalscreeningandantioxidantactivityof methanolicextractofselectedwildedibleNigerian mushrooms[J].Asian Pacific Journal of Tropical Disease,2014,4:S153-S157.
[22]WOLDEGIORGIS A Z,ABATE D,HAKI G D,et al. Antioxidant property of edible mushrooms collected from Ethiopia[J].Food chemistry,2014,157:30-36.
[23]REIS F S,MARTINS A,BARROS L,et al.Antioxidant propertiesandphenolicprofileofthemostwidely appreciated cultivated mushrooms:a comparative study between in vivo and in vitro samples[J].Food and Chemical Toxicology,2012,50(5):1 201-1 207.
[24]TSAI S Y,HUANG S J,LO S H,et al.Flavour components and antioxidant properties of several cultivated mushrooms[J].Food Chemistry,2009,113(2):578-584.
[25]LI H,ZHANG Z,LI M,et al.Yield,size,nutritional value,and antioxidant activity of oyster mushrooms grown on perilla stalks[J].Saudi Journal of Biological Sciences,2015,1(10):1-7.
[26]LIU K,WANG J,ZHAO L,et al.Anticancer,antioxidant and antibiotic activities of mushroom Ramaria flava[J].Food and chemical toxicology,2013,58:375-380.
[27]WANG J H,XU J L,ZHANG J C,et al.Physicochemical properties and antioxidant activities of polysaccharide from floral mushroom cultivated in Huangshan Mountain[J]. Carbohydrate polymers,2015,131:240-247.
[28]王婷婷,游金坤,严明,等.4种野生菌多酚的体外抗氧化活性[J].食品与发酵工业,2015,41(9):148-152.[29]SMOLSKAITE L,VENSKUTONIS P R,TALOU T. Comprehensive evaluation of antioxidant and antimicrobial properties of different mushroom species[J].LWT-Food Science and Technology,2015,60(1):462-471.
[30]何晋浙,徐瑶,孙培龙.不同来源猴头菌营养成分及其多糖化学组成和抗氧化活性比较[J].食品与发酵工业,2016,42(1):134-140.
[31]孙琼.杏鲍菇黄酮类化合物提纯及抗氧化活性研究[D].太原:山西师范大学,2015.
[32]PATTANAYAK M,SAMANTA S,MAITY P,et al. HeteroglycanofanediblemushroomTermitomyces clypeatus:structure elucidation and antioxidant properties[J].Carbohydrate research,2015,413:30-36.
[33]KOZARSKI M,KLAUS A,NIKSIC M,et al.Antioxidative activities and chemical characterization of polysaccharide extracts from the widely used mushrooms Ganoderma applanatum,Ganoderma lucidum,Lentinus edodes and Trametes versicolor[J].Journal of food composition and analysis,2012,26(1):144-153.
[34]KHATUN S,ISLAM A,CAKILCIOGLU U,et al. Nutritional qualities and antioxidant activity of three edible oyster mushrooms(Pleurotus spp.)[J].NJAS-Wageningen Journal of Life Sciences,2015,72:1-5.
[35]SIU K C,CHEN X,WU J Y.Constituents actually responsiblefortheantioxidantactivitiesofcrude polysaccharides isolated from mushrooms[J].Journal of Functional Foods,2014,11:548-556.
[36]HELENO S A,FERREIRA R C,ANTONIO A L,et al.Nutritional value,bioactive compounds and antioxidant properties of three edible mushrooms from Poland[J].Food Bioscience,2015,11:48-55.
[37]GURSOY N,SARIKURKCU C,CENGIZ M,et al. Antioxidant activities,metal contents,total phenolics and flavonoids of seven Morchella species[J].Food and Chemical Toxicology,2009,47(9):2 381-2 388.
[38]王钦博.桑黄抗氧化活性成分的筛选及其分离纯化[D].上海:上海师范大学,2011.
[39]王宏雨.食用菌抗氧化活性研究及竹荪抗氧化物质提取工艺优化[D].福州:福建农林大学,2010.
Research of com position and antioxidant activity between water and alcohol extracts ofblack term itom yces album inosus
LUCaihui*GUOXiaomengMOUDehua**
(Biological science and engineering college,Hebei university ofscience and technology,Hebei Shijiazhuang 050000,China)
研究了黑皮鸡枞菌水提物和醇提物中主要抗氧化成分及抗氧化性能。利用分光光度法分别测定2种提取物中多糖、多酚及黄酮类物质的含量,并通过检测2种提取物对DPPH、ABTS、羟基等自由基的清除能力和铁离子还原能力来比较抗氧化性,初步探讨了2种提取物中抗氧化成分与抗氧化能力的关系。试验结果表明,水提物中多糖、多酚、黄酮的含量分别为23.10 mg/g、6.25 mg/g、0.00 mg/g;醇提物中多糖、多酚、黄酮的含量为0.00 mg/g、5.50 mg/g、4.18 mg/g;这2种提取物都具有一定的抗氧化能力,且水提物抗氧化能力高于醇提物。
黑皮鸡枞菌;水提物;醇提物;抗氧化能力
This paper studied the composition,content and antioxidant properties between waterand alcohol extracts of black termitomyces albuminosus.Determined the polysaccharides,polyphenols and flavonoids of two extracts by Spectrophotometer.In addition,measured the antioxidant activity by scavenging the DPPH,hydroxyl radicals,the ABTS,respectively,and compared with the reducing action of two extractsonthe ferric ionanalyzed the correlation between two extracts antioxidant component and antioxidant capacity.The test results show that the water extract of polysaccharides,polyphenols,flavonoids content were 23.10 mg/g,6.25 mg/g and 0.00 mg/g;Alcohol extract content of polysaccharides,polyphenols,flavonoids in 0.00 mg/g,5.50 mg/g and 4.18 mg/g.These two extracts have certain antioxidant ability,and water extraction ofantioxidant capacity than alcohol extract.
black termitornyces;water extracts;alcohol extracts;antioxidant activity
·食品分析·
TS251.6+7
A
1673-6044(2016)03-0035-06
10.3969/j.issn.1673-6044.2016.03.010
*卢彩会,女,1992年出生,河北科技大学食品科学与工程专业在读研究生。
**牟德华,通讯作者,E-mail:dh_mou@163.com.
2016-09-11

