龙胆药材中龙胆多糖的提取工艺研究
宋海燕,梁丽青
(1.吉林农业科技学院实验管理中心,吉林 吉林132101;2.吉林农业科技学院水利与土木工程学院,吉林 吉林 132101)
龙胆药材中龙胆多糖的提取工艺研究
宋海燕1,梁丽青2
(1.吉林农业科技学院实验管理中心,吉林 吉林132101;2.吉林农业科技学院水利与土木工程学院,吉林 吉林 132101)
在单因素试验的基础上,应用响应面法对回流法提取龙胆多糖的工艺条件进行优化。最佳工艺参数为:提取温度为100℃、料液比为1∶27.86 (g∶mL)、提取时间3.70h,药材粒径0.245mm。在此条件下,水溶性龙胆多糖的提取率达到11.08%,与响应面预测值基本吻合。该法操作简便、成本低,为工业龙胆多糖的大量生产提供了一定的理论依据。
龙胆草;多糖;提取;响应面
龙胆草属多年生草本植物,主要分布于黑龙江、吉林、辽宁等地,龙胆草中的有效成分具有清湿热、利肝胆、健胃、杀菌、消炎等作用[1],现代医学中被用作苦味健胃药。
多糖作为龙胆中草药的有效成分之一[2-3],具有抗过敏、降血脂[4]、抗凝血[5]等多种活性,同时具有提高雏鸡等家禽的免疫[6]、抗肿瘤[7]等多种功能,是理想的免疫增强剂。龙胆多糖也是一种具有增效减毒双重作用的天然药物[8],所以对龙胆多糖的提取进行研究具有很强的现实意义。然而目前国内外对龙胆的研究主要集中在苦苷类化合物方面[9],而对其多糖的研究相对较少且不够深入。中药龙胆多糖类物质与其他植物多糖一样有着广阔的生物活性,因此对龙胆多糖的深入研究是非常必要的[10]。本文研究了回流法提取龙胆多糖的工艺条件,为进一步开发利用龙胆药材提供参考。
1 材料与方法
1.1 材料与仪器
龙胆药材(市售),粉碎过筛(0.42mm、0.25mm、0.178mm、0.15mm、0.12mm)。
无水乙醇,苯酚,浓硫酸,葡萄糖(均为分析纯)。
RE-52A型旋转蒸发仪,SHZ-D型循环水式真空泵,DHG-9075A型电热恒温鼓风干燥箱,FA2004型电子天平,RT-08型多功能粉碎机,722型可见分光光度计,电热恒温水浴锅,DF-101S型集热式磁力加热器,80-1型电动离心机。
1.2 实验方法
1.2.1 葡萄糖标准曲线的建立
在文献研究的基础上[11-12],采用苯酚浓硫酸法,精确称量于60℃恒干的葡萄糖1.0g,加入蒸馏水溶解、摇匀、定容到1000mL,配置成0.1mg·mL-1的葡萄糖标准溶液。然后分别精密量取5、10、15、20、25、30、35mL,依次置于7个50mL容量瓶中,加蒸馏水定容摇匀,得到7个不同浓度的葡萄糖标准溶液。分别取上述标准溶液1mL,置于7个10mL的带塞比色管,加入新制的5%苯酚溶液1mL,摇匀,立即加入5mL浓硫酸,充分摇匀,于室温放置30min,另取1mL蒸馏水做空白对照,490nm下用722可见分光光度计测定吸光度。以吸光度A为横坐标,葡萄糖浓度C (μg·mL-1)为纵坐标,绘制标准曲线。
1.2.2 龙胆多糖的提取工艺流程及单因素实验
精确称量烘干的1.0g龙胆药材若干份,放入圆底烧瓶,按照实验设计的条件,加热回流提取。提取完成后,将提取液3000r·min-1离心15min,上清液减压抽滤,收集滤液,瓶底药渣及烧瓶用少量蒸馏水洗涤后,继续抽滤,合并两次滤液,即为龙胆多糖粗提液。将粗提液用旋转蒸发仪进行蒸发,浓缩到一定体积,加入无水乙醇至体积分数占到80%。4℃放置过夜,沉淀,减压抽滤,沉淀用无水乙醇反复洗涤,得龙胆多糖。用适量蒸馏水溶解,配成一定浓度的溶液,分析多糖含量,按照下式计算提取率,并考察提取时间、药材粒径、料液比、提取温度等单因素对龙胆多糖提取率的影响。
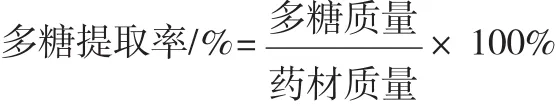
1.2.3 响应面优化实验
在单因素实验结果基础上,根据Box-Behnken中心组合实验设计原理,设计3因素3水平的响应面实验,对提取工艺进行优化。响应面具体因素及水平设计见表1。
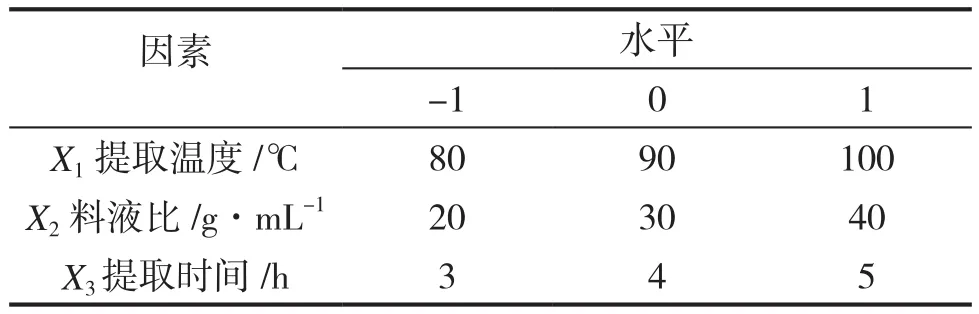
表1 回流提取多糖工艺优化响应面法实验因素水平表Table1 Factors and levels of RSM for polysaccharides extraction technology using heat reflux method
2 实验结果与分析
2.1 葡萄糖标准曲线的建立
实验制备葡萄糖标准曲线,回归曲线和直线方程见图1。
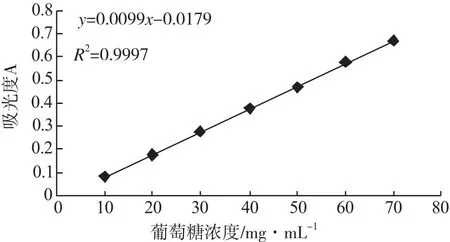
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
回归分析表明,吸光度在10~70mg·mL-1范围内相关系数良好,葡萄糖含量与吸光度值呈良好的线性关系,可用于多糖含量的准确分析。
2.2 回流法提取龙胆多糖的因素实验结果
采用回流法提取龙胆多糖,研究提取时间、药材粒径、料液比、提取温度4个单因素对多糖提取率的影响,实验结果分别见图2、图3、图4、图5。
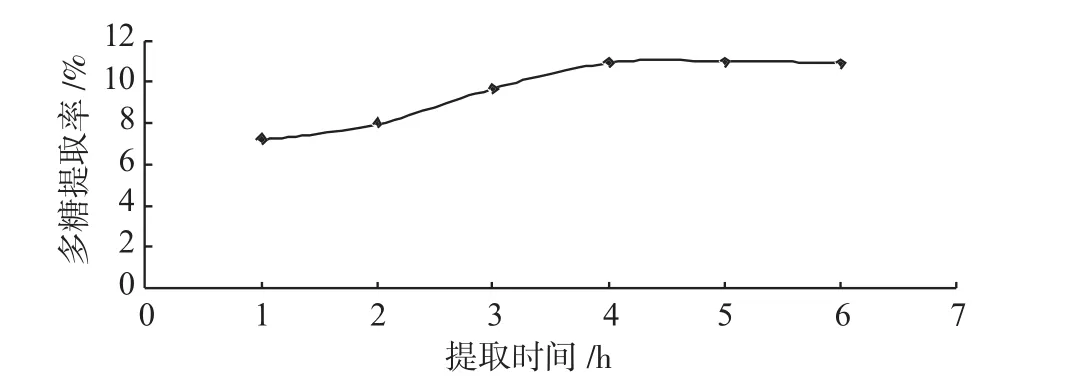
图2 提取时间对多糖提取率的影响Fig.2 Effect of extraction time on extraction rate of polysaccharides

图3 药材粒径对多糖提取率的影响Fig.3 Effect of particle size on extraction rate of polysaccharides
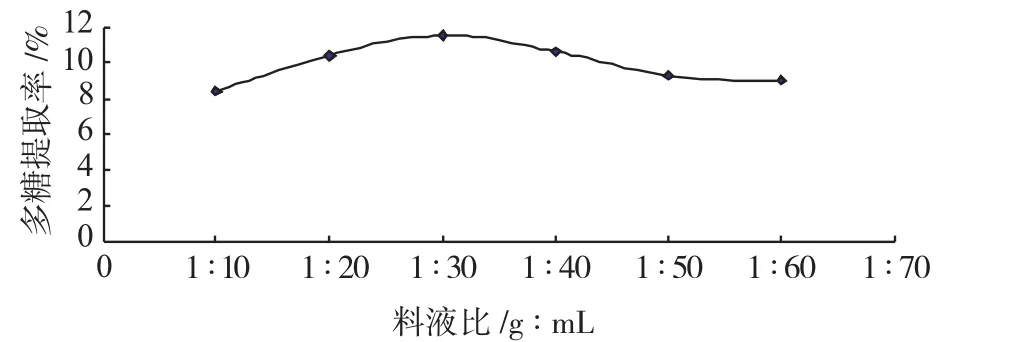
图4 料液比对多糖提取率的影响Fig.4 Effect of solid-liquid ratio on extraction rate of polysaccharides
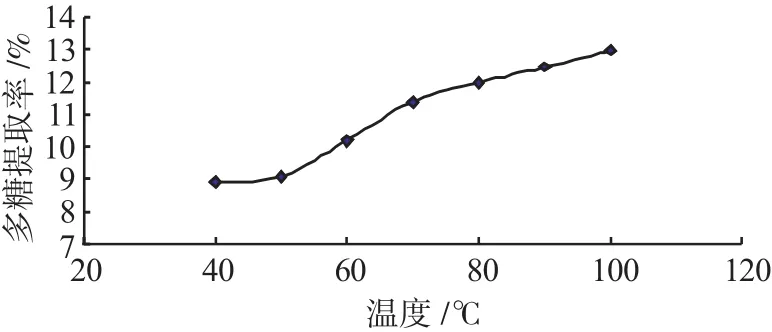
图5 温度对多糖提取率的影响Fig.5 Effect of extraction temperature on extraction rate of polysaccharides
由图2、图3、图4、图5可知,回流法提取龙胆多糖的最佳提取条件为:提取时间4h、粒径为0.25mm、料液比为1∶30、提取温度为100℃。
2.3 响应面优化实验结果
2.3.1 模型的建立及其显著性检验
采用Design-Expert 8.0软件设计响应面试验,实验结果见表2。

表2 回流法提取多糖工艺的响应面优化实验设计及结果Table2 Design and results of RSM for reflux extraction of polysaccharides
利用Design-Expert软件对表2试验数据进行二次多项式逐步回归拟合,得到数学模型:
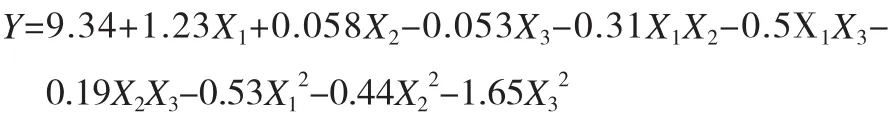
模型的可靠性可由方差分析及相关系数来考察,结果见表3。
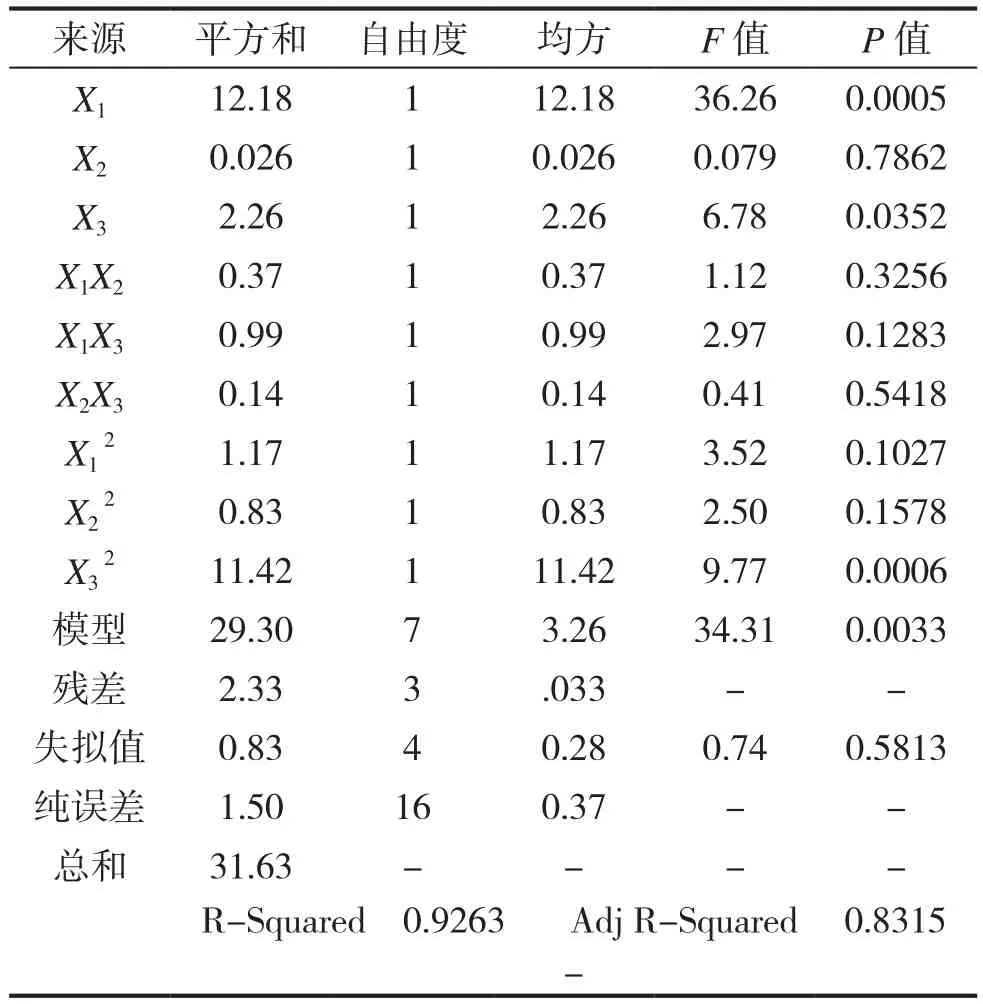
表3 回归方程方差分析Table3 Analysis of variance of regression equations
从表3中可得,模型的F=34.31,P<0.005,证明试验所选用的二次多项模型具有高度的显著性。在总的作用因素中,X1、X3、X项(P<0.05)的影响是显著的,而X2、X3两因素之间的交互作用P>0.05,表明其对多糖提取率的影响不显著。各具体因子对响应值的影响不是简单的线性关系,各因子间的交互作用影响不显著,可忽略。失拟项F=0.74,其校正决定系数,说明该模型能很好地描述试验结果,可以用此模型来分析和预测加热回流法提取龙胆多糖的工艺结果。
2.3.2 提取工艺的响应曲面分析与优化
为了更直观地表现两个因素对多糖提取率的影响,可以令其它两因素水平值为零,即以提取时间、提取温度、料液比3个因素中一个因素取零水平时,另两个因素对多糖提取率的影响进行分析。图6直观地反映了各因素交互作用对响应值的影响。
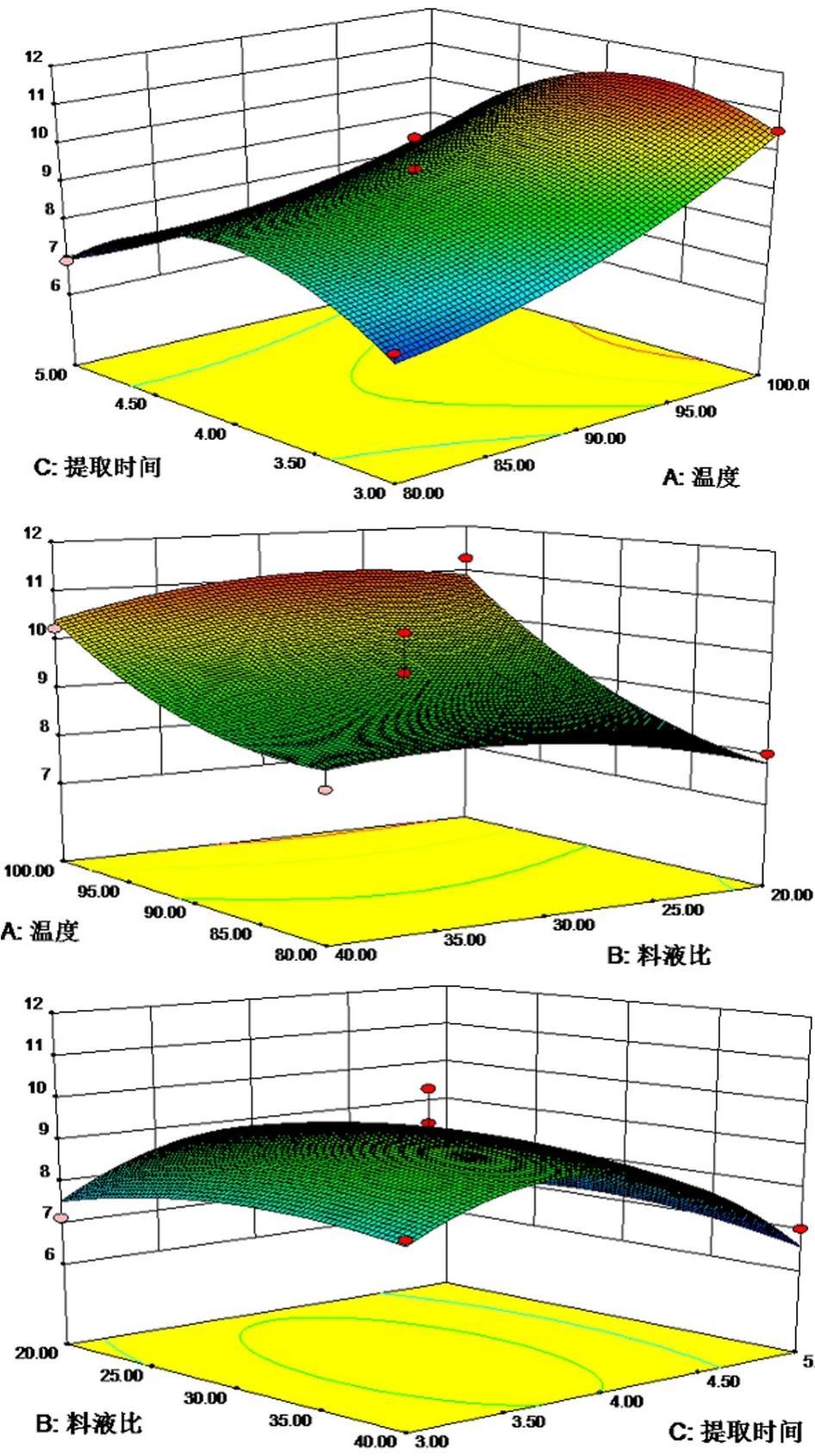
图6 各两因素交互作用对影响龙胆苦苷提取率的响应面图Fig.6 Response surface plots showing the interaction of 2 different parameters on the extraction efficiency of polysaccharides
由图6可知,提取温度对多糖提取率的影响最为显著,表现为曲线较陡,随着提取时间、料液比的增加或减小,响应值变化较大;提取时间、料液比对响应值的影响较小,曲线较为平滑,其数值增加或减少,响应值变化较小。通过对回归方程求一阶偏导,可求得龙胆多糖的最佳提取工艺条件为:提取温度100℃,料液比1∶27.86,提取时间3.70h,龙胆多糖提取率的最大值可达到11.28%。
2.4 多糖提取率的验证结果
准确称取粒径0.25mm的干燥龙胆草样品1.0g,根据“2.3”项响应面优化实验确定的最佳提取工艺,即按照料液比1∶28加入28mL蒸馏水,在100℃下提取3.70h,平行试验3次。龙胆草中龙胆多糖的平均提取率达到11.08%,与响应面预测值基本吻合,表明该方法模型选择合理,试验结果理想,具有一定的实用价值。
3 结论
以龙胆药材为实验原料,采用回流法提取龙胆多糖。考察了料液比、提取时间、药材粒径、提取温度等4个单因素对龙胆多糖提取率的影响。在单因素基础上,根据Box-Behnken设计,采用响应实验,进一步优化了水溶性龙胆多糖的提取工艺条件。最终确定最佳工艺参数为:料液比1∶27.86、提取时间
3.7 h,提取温度100℃,在此工艺下龙胆多糖的提取率达到11.08%。回流提取法操作简便,不需要昂贵的设备,易于工业化中试规模生产。对龙胆多糖提取工艺的系统探索,不仅为工业化龙胆多糖的大量生产提供了数据支撑,而且进一步提高了龙胆药用资源的利用率,具有一定的应用价值。
[1] 宋万志.中国龙胆科药用植物概况[J].中药通报,1986(11):3-7.
[2] 曹斐华,李冲.龙胆属植物化学成分及药理作用的研究进展[J].中国新药杂志,2008,17(1):27-29.
[3] 王晨瑜,刘鑫,王战勇.水溶性龙胆多糖的提取工艺研究[J].北方园艺,2013(10):155-157.
[4] 江蔚新,何文顺,赵玺.龙胆多糖的降血脂作用的研究[J].黑龙江医药,2008,21(4):3133-3135.
[5] 江蔚新,赵玺.龙胆多糖的抗凝血作用的研究[J].黑龙江医药,2008,21(5):3132-3133.
[6] 孟博,王臣,赵蔓,等.龙胆多糖对雏鸡免疫功能的影响[J].中国农村小康科技,2010(4): 57-58.
[7] 江蔚新,江培,张晓燕,等.龙胆多糖的体内抗肿瘤作用研究[J].中成药,2008,30(10):1530-1532.
[8] Li R, Chen W C, Wang W P, et al.Optimization of extraction technology of Astragalus polysaccharides response surface methodology and its effect on CD 40[J].Carbohydrate Polymers, 2009, 78(4): 784-788.
[9] 刘明韬,韩志超,章漳,等.龙胆的化学成分研究[J].沈阳药科大学学报,2005,22(2):103-104.
[10] 张媛,刘健.植物多糖生物活性的研究进展[J].天津药学,2010,22(2):62-64.
[11] 程振玉,宋海燕,杨英杰,等.不同提取方法对北五味子多糖提取率的影响[J].湖北农业科学,2015,54(1):159-165.
[12] 程振玉,宋海燕,杨英杰,等.五味子多糖的提取及纯化工艺[J].贵州农业科学,2014,42(12):204-208.
Extraction Process of Polysaccharide from GentianaScabraBge
SONG Hai-yan1, LIANG Li-qing2
(1.Experimental Managing Center, Jilin Agriculture Science and Technology College, Jilin 132101, China; 2.College of Hydraulic & Civil Engineering, Jilin Agriculture Science and Technology College, Jilin 132101, China)
The heat reflux extraction process of polysaccharides from gentiana scabra bge was studied.Response surface methodology (RSM) was employed to optimize the extraction conditions on the basis of investigating single factors.The optimal technological conditions were as followed: extraction temperature 100℃, solid to liquid ratio 1:27.86, extraction time 3.7h and particle size of 0.25mm.Under these conditions, the extraction rate of water soluble gentian polysaccharide reached 11.08%, which was well close with the predicted values obtained from RSM.The method proposed in this study was easy to operate, low cost and provided certain therical base for the industrial mass scale production of polysaccharides in Gentiana scabra bge.
Gentiana scabra bge; polysaccharide; extraction; response surface methdology
R 284.2
A
1671-9905(2016)09-0028-04
宋海燕(1987-),女,河北省邢台市人,硕士研究生,助理实验师,研究方向为天然产物活性成分的提取及纯化。Tel: 15843289508;E-mail:844503608@qq.com
2016-07-11

