结直肠黏液腺癌病理学异质性及与预后的关系
王满香 陈琼荣
•综述•
结直肠黏液腺癌病理学异质性及与预后的关系
王满香陈琼荣
探讨结直肠黏液腺癌临床病理及分子病理异质性。结合临床病理诊断积累的经验,并复习国内外相关文献,总结结直肠黏液腺癌的临床病理特征、微卫星不稳定性及对预后的影响。结直肠黏液腺癌病理形态特征及微卫星不稳定性状态方面的差异,导致不同的临床生物学行为,对治疗的反应及预后均不相同。结直肠黏液腺癌是一类异质性肿瘤,临床病理和分子病理相结合的精准病理诊断,有利于临床治疗方案的选择和预后分层。
结直肠肿瘤;预后;黏液腺癌;异质性
黏液腺癌(mucinous adenocarcinoma,MAC)是结直肠癌(colorectal cancer,CRC)的少见病理类型,约占结直肠癌的5%~15%[1],以显著的细胞外黏液产生为其特点。目前2010年版WHO消化系统肿瘤分类认为结直肠的黏液腺癌是一种低分化腺癌,不再对其进行组织学分级[2]。但我们临床积累的资料以及文献报道显示黏液腺癌的病理形态特征、临床生物学行为、对治疗的反应以及预后并不完全相同,黏液腺癌其实是一类异质性较大的肿瘤。在个体化医疗日盛的今天,人们开始深入研究黏液腺癌的临床病理特点、临床预后及预测价值、分子生物学及遗传学特征等方面,目前有了一些比较一致的结果,但还有很多方面存在争议。本文拟从黏液腺癌的病理形态特征及微卫星不稳定性方面初步探讨黏液腺癌的异质性及其与预后的关系。
一、黏液腺癌的定义
根据2010版WHO的定义,肿瘤>50%成分为细胞外黏液,黏液内漂浮恶性上皮细胞,形成腺泡、腺管状、条索状或单个散在分布(包括印戒细胞)等,可诊断为黏液腺癌;而肿瘤<50%成分为黏液的不归入黏液腺癌,应诊断为腺癌伴有黏液成分(adenocarcinoma with mucinous component,AMC)[2]。
二、黏液腺癌的临床病理特征与预后
黏液腺癌具有独特的临床病理特征,与普通腺癌相比,患者年龄轻,女性多见,术前CEA水平较高,近端结肠常见,肿瘤体积大,分期晚,多灶复发及腹膜转移率高,高频微卫星不稳定性比率高[3-9]。对于黏液腺癌的预后,存在截然不同的观点。部分研究者认为黏液腺癌是分化差的癌,侵袭性强,预后不良[4,6,10];也有人认为黏液腺癌预后并不比普通腺癌差[11-12]。已有大量的研究对多项临床病理特征进行对比研究,以期探讨其对预后的影响。一项大宗病例分析发现,男性、伴有肠梗阻症状及侵袭性生长模式为黏液腺癌的高复发风险因素;具备其中1项、2项或3项风险因素的黏液腺癌患者,其5年癌症特异性生存率分别为95.6%、52.1%和0.0%[9]。临床上黏液腺癌好发于青壮年,而青壮年患者往往进展快,预后差[13]。这是否意味着年龄是黏液腺癌独立的预后因素呢?Yeo等对2426例结直肠癌患者进行年龄分组,≤40岁为第一组(Group 1,G1),41~50岁为第二组(Group 2,G2),超过50岁为第三组(Group 3,G3),比较各组临床病理特征和预后,发现G1组黏液腺癌发生率较高,分化较差,区域淋巴结转移率及远处转移率高,但5年癌症特异性生存率没有统计学差异[11]。也就是说,年轻组虽然分期更晚,伴有预后不良因素,但其预后并不更糟,所以年龄不是独立的预后因素。还有研究者认为黏液腺癌的发生部位与预后有关系。Razenberg等认为结肠黏液腺癌比普通腺癌死亡风险更低;但直肠黏液腺癌与普通腺癌之间死亡率没有明显差别[14]。Hogan等支持结肠黏液腺癌较普通腺癌具有更好的预后[15]。但是John等的数据却得出不同的结论,他们认为直肠黏液腺癌死亡风险比普通腺癌高,而结肠部位两者没有明显差别[16]。这些矛盾的结论让我们疑惑不已:结直肠黏液腺癌的预后与原发部位有关吗?Gao等通过对两组独立数据进行统计分析后发现:发生于直肠的黏液腺癌是独立的预后不良因素;但结肠不同部位的黏液腺癌预后有差别:发生于右半结肠者具有较好的预后,而左半结肠癌则没有这种优势[17]。一直以来,TNM分期被认为是最重要的预后影响因素。尽管大多数研究支持黏液腺癌分期更晚,预后更差[12,16,18-19],但也有人对此持不同意见。Verhulst等[8]、Kang等[20]的研究认为黏液腺癌虽然分期更晚,但预后并不比普通腺癌差。Jivapaisarnpong等对多项临床病理特征作了调查,发现黏液腺癌预后差可能仅与该组织亚型本身有关,与性别、年龄、部位、TNM分期、术前CEA水平等均无关[21]。而Langner等认为黏液分化(无论范围)并不影响预后,只有肿瘤级别、血管侵犯、神经侵犯、肿瘤出芽等才与预后相关[12]。Zlobec等[22]和Betge等[23]都证实肿瘤出芽具有独立的预后价值。众多的研究既有一致的结果,也有很多的分歧,还需更多深入的研究去发现与解决问题。目前大多数人认同TNM分期、肿瘤侵袭性生长或出芽、血管侵犯、神经侵犯、切缘阳性等具有预后价值,因此,在日常病理诊断工作中,需仔细评估这些因素,给临床提供更有价值的信息。
三、黏液腺癌的形态学分级与预后
WHO分级系统依据腺管形成比例将腺癌分为高分化、中分化、低分化及未分化,仅适用于普通腺癌。对于黏液腺癌,WHO仅指出上皮的成熟水平决定其分化程度,该亚型具有独特的预后意义,不再对其分级[2]。然而黏液腺癌细胞既有高分化的腺泡状、条索状结构,也有分化差的单个细胞或印戒细胞(图1),但目前WHO消化系统肿瘤分类系统既没有给出分化程度的标准,也没有说明与预后的确切关系[2];因此,这种未进一步分级的黏液腺癌的诊断不够精准,也失去了对临床治疗及预后判断的指导价值。
近年来一些学者尝试对结直肠腺癌提出一种新的形态学分级,并认为这种新的分级系统优于WHO分级系统,具有更高的可重复性及独立的预后判断价值[24-30]。这种新的分级系统是通过计数分化细胞簇(poorly differentiated clusters,PDC)为基础的,简称PDC分级。PDC定义为肿瘤浸润灶边缘出现的≥5个缺乏腺管分化的癌细胞团。Ueno和Barresi等给出了详细的分级方法[25,28]。简言之,就是先在低倍镜下观察所有的肿瘤视野,找出PDC最丰富的区域;然后换至20×物镜,计数最丰富区一个视野内PDC的数目:<5个PDC、5~9个PDC、≥10个PDC分别记为1级(Grade 1,G1)、2级(Grade 2,G2)和3级(Grade 3,G3)(图2)。研究表明,与WHO分级相比,PDC分级的优势至少体现在以下几个方面:(1)标准更客观,观察者之间可重复性更高;(2)与肿瘤进展及癌症相关死亡率的相关性更强;(3)对无复发生存率及癌症特异性生存率具有独立的预测价值;(4)与其它临床病理特征相关:侵袭性生长模式、出芽、淋巴管侵犯、隐匿性淋巴结转移等;(5)结合微卫星不稳定性状态进行分级,能更有效地对患者进行预后分层,制定术后个体化治疗方案。甚至有人对内镜活检样本采用此分级系统,发现除了可重复性高之外,纵向对比同一患者活检样本及根治术后样本,PDC分级的前后一致性也较WHO分级高;并且PDC分级可能预测淋巴结受累或pTNM分期情况,另外还可提示手术标本中可能出现的高度侵袭性的组织学特征,如出芽、血管侵犯、神经侵犯、浸润性生长边界等[27]。笔者在日常诊断工作中,亦发现黏液腺癌形态学的异质性较大,预后差别也很明显,PDC分级高的黏液腺癌,容易发生淋巴结转移(未发表的数据)。综上所述,PDC分级系统明显优于传统WHO分级系统,其最大优势,就是适用于所有结直肠癌,包括黏液腺癌,并与预后独立相关,可推荐纳入黏液腺癌的常规分级诊断中。
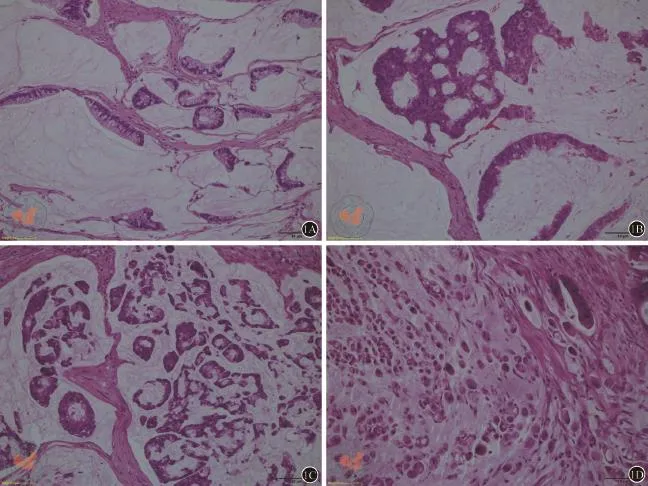
图1 黏液腺癌的不同分化程度(HE染色,×200)。A和B示黏液湖中漂浮的高分化的腺泡状、条索状异型腺体;C显示中分化异型腺体;D示差分化的单个癌细胞或印戒细胞
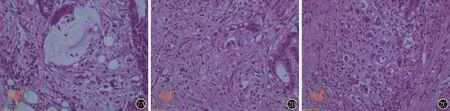
图2 高倍镜下PDC分级(HE染色,×400):A示<5个PDC,为1级(G1);B示5~9个PDC,为2级(G2);C示≥10个PDC,为3级(G3)
四、结合MSI状态和组织学分级判断黏液腺癌的预后
大约15%的散发性结直肠癌和几乎全部的Lynch综合征相关结直肠癌是通过微卫星不稳定性(microsatellite instability,MSI)途径发生的,而MSI是由于DNA错配修复基因(mismatch repair,MMR)突变导致的。常见的MMR基因包括hMSH2,hMSH6,hMLH1,hPMS2这4种。Lynch综合征相关结直肠癌是一种常染色体显性遗传病,约占全部CRC的2%~4%,是由一种或多种MMR基因发生胚系突变导致微卫星不稳定性的发生,除了导致结直肠癌外,还可促发子宫内膜癌、胆管细胞癌等肠外肿瘤[31]。由于MLH1基因启动子发生甲基化使该基因沉默、发生微卫星不稳定性而致的CRC,人们称之为散发性MSI性结直肠癌,约占全部CRC的12%左右[32]。目前国内外病理科通常采用免疫组化检测MMR蛋白表达和/或通过PCR检测微卫星位点偏移情况来筛查这类结直肠癌患者。免疫组化显示MSH2或MLH1及其结合蛋白(分别为MSH6、PMS2)表达缺失,或单独存在MSH6或PMS2缺失,提示存在MMR突变和MSI-H。免疫组化作为一种经济简便的方法可用作初步筛查,如果有缺失,进一步可采用PCR-毛细管电泳法检测微卫星某些位点偏移情况。高频微卫星不稳定(high frequency MSI,MSI-H)的定义为至少2个微卫星位点(≥40%)改变;低频微卫星不稳定(low frequency MSI,MSI-L)是出现1个位点改变或多于1个但在更多位点中<40%发生改变;微卫星稳定(microsatellite stability,MSS)时,没有微卫星位点发生改变[31-32]。研究显示,II期和III期结直肠癌合并MSI-H时,预后相对较好,但接受5-氟尿嘧啶化疗并不获益,而对含伊立替康和奥沙利铂的化疗方案有效[33]。
伴发MSI-H是结直肠癌一种明确的有利预后因素[33-35]。WHO指出黏液腺癌不同于普通腺癌,具有独特的预后意义,多数黏液腺癌伴发MSI-H,为低级别肿瘤,而伴随MSS或MSI-L的黏液腺癌为高级别肿瘤[2]。这种单纯依据MSI状态的分级与临床实际似乎存在一个矛盾:既然黏液腺癌多数为MSI-H,而具有MSI-H的腺癌表现为低度恶性,因此多数黏液腺癌预后应该较好;但临床上多数黏液腺癌预后不良;有什么因素导致这种矛盾现象呢?有研究将组织学分级与MSI状态结合来判断对预后的影响。Rosty等[36]将738例结直肠癌分别按照组织学分级分为低级别组(low grade,LG)和高级别组(high grade,HG),据MSI状态分为MSI-H和MSI-L/MSS。通过比较分析发现,结合组织学分级和MSI状态可将结直肠癌重新分为两组:(1)低级别组,包括组织学低级别者(无论MSI状态)和组织学高级别同时具有MSI-H者;(2)高级别组,为组织学为高级别同时伴有MSI-L/MSS者;仅高级别组总死亡率和癌症特异性死亡率高,而低级别组相应比率较低。因此笔者认为这种新的分级系统可以更好的对患者进行预后分层。虽然WHO并未对黏液腺癌进行组织学分级,但在常规诊断工作中结合癌组织的分化程度,我们可判断其组织学级别,再结合MSI状态,因此,上述分级至少可部分解释我们前面提出的问题;当然,还需要更多的研究去证实这一新的分级系统的科学性和实用性。最近,PDC分级系统的倡导者们对PDC分级系统与MSI的关系进行了探讨[37],发现该PDC分级系统与Rosty等[36]结合组织学分级和MSI状态的分级系统并不矛盾,因为高级别的PDC结直肠癌一般合并MSS而预后不良,因此PDC分级系统加入MSI状态后结果依然不变。当然该研究病例数有限(40例),尚需大宗病例进一步验证。
近年来,随着个体化医疗的发展及精准医疗观点的提出,国内部分大型医院已相继成熟地开展微卫星不稳定性状态的检测[38],通过免疫组化检测错配修复(MMR)蛋白缺失和/或通过PCR-毛细管电泳法检测微卫星位点偏移,并用以指导临床治疗方案的选择及预后判断。分子病理发展的日新月异使多种肿瘤相关基因被相继发现并进入临床,而且为临床医生制定个体化治疗方案、为防癌咨询及潜在高风险患者早期干预治疗提供理论依据。
总之,黏液腺癌具有独特的临床病理特征,经典病理学认为这是一种特定类型的低分化腺癌,不再对其分级[2]。但最近的研究显示黏液腺癌其实是一类异质性肿瘤,其生物学行为的差异迫切需要病理医师结合病理形态学和分子病理学对其进行分级,如Rosty等富有成效的探索,发现结合其病理组织学分级与MSI状态的分级系统可以有效的对患者进行预后分层[36];此外,Barresi等倡导的PDC分级系统也值得我们借鉴[24-30,37],并在临床实践中检验这些理论,以便我们能对黏液腺癌患者给出个体化的精准诊断,并指导临床治疗方案的选择和预后判断。
[1]Sei-ichiro Jimi,Masayuki Hotokezaka,Takuto Ikeda,et al.Clinicopathological features,postoperative survival and prognostic variables for cancer-related survival in patients with mucinous colorectal carcinoma[J].Surg Today,2015,45(3):329-334.
[2]Hamilton SR,Bosman FT,Boffetta P,et al.Carcinoma of the colon and rectum.In:Bosman FT,Carneiro F,Hruban RH,Theise ND,eds.WHO Classification of Tumours of the Digestive System[M].4th Edition.Lyon:IARC Press,2010:134-146.
[3]Viganò L,Russolillo N,Ferrero A,et al.Resection of liver metastases from colorectal mucinous adenocarcinoma:is this a different disease?Results of a case-control study[J].Ann Surg,2014,260(5):878-884.
[4]Park JS,Huh JW,Park YA,et al.Prognostic comparison between mucinous and nonmucinous adenocarcinoma in colorectal cancer[J].Medicine (Baltimore),2015,94(15):e658.
[5]Yoon YS,Kim J,Hong SM,et al.Clinical implications of mucinous components correlated with microsatellite instability in patients with colorectal cancer[J].Colorectal Dis,2015,17(8):O161-167.
[6]Lupinacci RM,Mello ES,Coelho FF,et al.Prognostic implication of mucinous histology in resected colorectal cancer liver metastases[J].Surgery,2014,155(6):1062-1068.
[7]Debunne H,Ceelen W.Mucinous differentiation in colorectal cancer:molecular,histological and clinical aspects[J].Acta Chir Belg,2013,113(6):385-390.
[8]Verhulst J,Ferdinande L,Demetter P,et al.Mucinous subtype as prognostic factor in colorectal cancer:a systematic review and meta-analysis[J].J ClinPathol,2012,65(5):381-388.
[9]Yamaguchi T,Taniguchi H,Fujita S,et al.Clinicopathological characteristics and prognostic factors of advanced colorectal mucinous adenocarcinoma[J].Histopathology,2012,61(2):162-169.
[10]Ooki A,Akagi K,Yatsuoka T,et al.Inverse effect of mucinous component on survival in stage III colorectal cancer[J].J Surg Oncol,2014,110(7):851-857.
[11]Yeo SA,Chew MH,Koh PK,et al.Inverse effect of mucinous component on survival in stage III colorectal cancer[J].Tech Coloproctol,2013,17(6):653-661.
[12]Langner C,Harbaum L,PollheimerMJ,et al.Mucinous differentiation in colorectal cancer--indicator of poor prognosis[J]?Histopathology,2012,60(7):1060-1072.
[13]Nervi M,Gambaccini D,Ambrosini CE,et al.Overall prognosis in younger patients with colorectal carcinoma[J].Minerva Chir,2006,61(5):381-384.
[14]Razenberg LG,van Gestel YR,LemmensVE,et al.The Prognostic Relevance of Histological Subtype in Patients With Peritoneal Metastases From Colorectal Cancer:A Nationwide Population-Based Study[J].Clin Colorectal Cancer,2015,14(4):e13-e19.
[15]Hogan J,Burke JP,Samaha G,et al.Overall survival is improved in mucinous adenocarcinoma of the colon[J].Int J Colorectal Dis,2014,29(5):563-569.
[16]Hyngstrom JR,Hu CY,Xing Y,et al.Clinicopathology and outcomes for mucinous and signet ring colorectal adenocarcinoma:analysis from the National Cancer Data Base[J].Ann SurgOncol,2012,19(9):2814-2821.
[17]Gao P,Song YX,Xu YY,et al.Does the prognosis of colorectal mucinous carcinoma depend upon the primary tumour site? Results from two independent databases[J].Histopathology,2013,63(5):603-615.
[18]Safaee A,Moghimi-Dehkordi B,Fatemi SR et al.Characteristics of colorectal mucinous adenocarcinoma in Iran[J].Asian Pac J Cancer Prev,2010,11(5):1373-1375.
[19]Chen JX,Tang XD,Xiang DB,et al.TNM stages and prognostic features of colorectal mucinous adenocarcinomas:a meta analysis[J].Asian Pac J Cancer Prev,2012,13(7):3427-3430.
[20]Kang H,OʹConnell JB,Maggard MA,et al.A 10-year outcomes evaluation of mucinous and signet-ring cell carcinoma of the colon and rectum[J].Dis Colon Rectum,2005,48(6):1161-1168.
[21]Jivapaisarnpong P,Boonthongtho K.Clinicopathological characteristics of mucinous and non- mucinous adenocarcinoma in the colon andrectum in Rajavithi Hospital,Thailand[J].J Med Assoc Thai,2011,94(Suppl 2):S41-S45.
[22]Zlobec I,Bihl MP,Foerster A,et al.The impact of CpG island methylator phenotype and microsatellite instability on tumour budding in colorectal cancer[J].Histopathology,2012,61(5):777-787.
[23]Betge J,Kornprat P,Pollheimer MJ,et al.Tumor budding is an independent predictor of outcome in AJCC/UICC stage II colorectal cancer[J].Ann SurgOncol,2012,19(12):3706-3712.
[24]Barresi V,ReggianiBonetti L,Ieni A,et al.Histological grading in colorectal cancer:new insights and perspectives[J].HistolHistopathol,2015,30(9):1059-1067.
[25]Ueno H,Kajiwara Y,Shimazaki H,et al.New criteria for histologic grading of colorectal cancer[J].Am J SurgPathol,2012,36(2):193-201.
[26]Ueno H,Hase K,Hashiguchi Y,et al.Site-specific tumor grading system in colorectal cancer:multicenter pathologic review of the value of quantifying poorly differentiated clusters[J].Am J Surg Pathol,2014,38(2):197-204.
[27]Barresi V,Bonetti LR,Ieni A,et al.Histologic grading based on counting poorly differentiated clusters in preoperative biopsy predicts nodal involvement and pTNM stage in colorectal cancer patients[J].Hum Pathol,2014,45(2):268-275.
[28]Barresi V,ReggianiBonetti L,Branca G,et al.Colorectal carcinoma grading by quantifying poorly differentiated cell clusters is more reproducible and provides more robust prognostic information than conventional grading[J].Virchows Arch,2012,461(6):621-628.
[29]Ueno H,Shinto E,Kajiwara Y,et al.Prognostic impact of histological categorisation of epithelial-mesenchymal transition in colorectal cancer [J].Br J Cancer,2014,111(11):2082-2090.
[30]Barresi V,ReggianiBonetti L,Ieni A,et al.Prognostic significance of grading based on the counting of poorly differentiated clusters in colorectal mucinousadenocarcinoma[J].Hum Pathol,2015,46(11):1722-1729.
[31]Moreira L,Balaguer F,Lindor N,et al.Identification of Lynch syndrome among patients with colorectal cancer[J].JAMA,2012,308(15):1555-1565.
[32]Kane MF,Loda M,GaidaGM,et al.Methylation of the hMLH1 promoter correlates with lack of expression of hMLH1 in sporadic colon tumors and mismatch repair-defective human tumor cell lines[J].Cancer Res,1997,57(5):808-811.
[33]Guastadisegni C,Colafranceschi M,Ottini L,et al.Microsatellite instability as a marker of prognosis and response to therapy:a meta-analysis of colorectal cancer survival data[J].Eur J Cancer,2010,46(15):2788-2298.
[34]Benatti P,Gafà R,Barana D,et al.Microsatellite instability and colorectal cancer prognosis[J].Clin Cancer Res,2005,11(23):8332-8340.
[35]Sinicrope FA,Rego RL,Halling KC,et al.Prognostic impact of microsatellite instability and DNA ploidy in human colon carcinoma patients[J].Gastroenterology,2006,131(3):729-737.
[36]Rosty C,Williamson EJ,Clendenning M,et al.Should the grading of colorectal adenocarcinoma include microsatellite instability status[J]? Hum Pathol,2014,45(10):2077-2084.
[37]Barresi V,Bonetti LR.Correlation between microsatellite instabilitystatus and grading assessed by the counting of poorly differentiated clusters in colorectal cancer[J].Hum Pathol,2015,46(7):1063.
[38]秦云,梁莉萍,郑兴征,等.免疫组织化学法检测结直肠癌四种DNA错配修复蛋白表达缺失对判断肿瘤微卫星状态的价值[J].
中华病理学杂志,2015,44(10):704-708.
The heterogenicity of mucinous colorectal adenocarcinoma and its association with prognosis
Wang Manxiang,Chen Qiongrong.Department of Pathology,Hubei Cancer Hospital,Hubei 430079,China
Chen Qiongrong,Email: qiongrongchen@hotmail.com
To discuss the heterogenicity of mucinous colorectal adenocarcinoma in respect of clinicopathological and molecular pathology.Review of the relevant literatures combining with our experience of pathological diagnosis,we summarize the morphological characteristics,the status of microsatellite and the effect on the prognosis of patients with mucinous colorectal adenocarcinoma.There are obvious difference among the morphological characteristics and the status of microsatellite in the patients with mucinous colorectal adenocarcinoma,which cause different clinic biologic behaviors,different response to treatment and so different prognosis.Mucinous colorectal adenocarcinoma is a kind of heterogeneous cancer.The precise diagnosis combining with the morphology and molecular pathology drawed by the pathologists,which is benefit to select the therapeutic regimen and helpful for prognostic stratification for the patients.
Colorectal neoplasms;Prognosis;Mucinous adenocarcinoma;Heterogenicity
2016-06-24)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2016.05.012
湖北省自然科学基金资助项目(No.2013CFC022)
430079武汉,湖北省肿瘤医院病理科
陈琼荣,Email:qiongrongchen@hotmail.com
王满香,陈琼荣.结直肠黏液腺癌病理学异质性及与预后的关系[J/CD].中华结直肠疾病电子杂志,2016,5(5):428-433.

