结直肠癌肝转移的可切除性判断
周鹏扬 王建伟
•青年专家论坛•
结直肠癌肝转移的可切除性判断
周鹏扬王建伟

王建伟教授,浙江大学医学院附属第二医院肿瘤外科主任医师,主要从事结肠癌的外科治疗以及乳腺癌的外科综合治疗。熟练掌握腹腔镜结肠癌根治术,腹腔镜低位直肠癌保肛手术,直肠癌微创局部切除术,乳腺癌保乳根治术。对结直肠癌及肝转移癌的外科治疗和综合治疗有深入的认识。主持参加多项国家自然科学基金、浙江省自然科学基金、浙江省中医药科技计划及浙江省卫生厅等多项科研项目。在《Ann Surg》、《Cancer letters》、《Hepatogastroenterology》、《Updates in Surgery》、《PLoS One》等国内外杂志上发表多篇学术论文。学术兼职:中国抗癌协会大肠癌专业委员会肝转移学组委员、中国医促会结直肠肝转移治疗委员会委员及浙江省抗癌协会大肠癌肝转移治疗协作组成员。担任《浙江临床医学杂志》编委、《临床普外科电子杂志》编委及浙江省自然科学基金评审专家。
结直肠癌最好发的转移部位是肝脏,手术是治愈结直肠癌肝转移并获得长期生存的唯一可能方式。就目前多学科治疗背景下,高效能的化疗方案联合靶向药物以及多种手术方式,如传统二步肝切除联合门静脉栓塞术/门静脉结扎术(portal vein embolization,PVE/portal vein ligation,PVL)及联合肝脏劈离及门静脉结扎的二期肝切除(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)的出现,包括各种消融等局部治疗手段拓展了过去对于肝脏可切除性的定义,而依据新的可切除标准对于可切除性的判断仍存在较大差异,本文将就肝脏可切除性判断展开探讨。
结直肠肿瘤;肿瘤转移;手术切缘
结直肠癌是最常见的恶性肿瘤之一。在西方国家,其发病率位居肿瘤第2位,在我国居恶性肿瘤第3位,全球每年大约140万新发病例,60万死亡病例,其中我国每年新发病人数约40万人,发病数和死亡率已经超过美国[1]。结直肠癌具有显著的肝脏转移特异性,肝脏是结直肠癌最主要的转移部位,20%~40%存在肝转移,根治性切除术后5年内50%发生异时性肝转移,约65%的结直肠癌患者最终死于肝转移[2-3]。肝转移病灶的手术切除仍然是目前来说最有效的治疗手段。在相当长的一段时间里,转移灶的较少个数(通常小于3到4个),转移灶的合适大小(通常直径要小于5 cm)以及一个有效的手术切缘(>1 cm)等等临床病理因素定义了可切除标准[4-6]。在当时的背景下,只有10%~20%的结直肠肝转移(colorectal liver metastasis,CRLMs)的患者可以接受手术治疗[7]。随着高效能的化学治疗手段(联合生物靶向分子治疗等)以及多种极限手术方式的出现,相当一部分在传统的可切除标准下定义为不可切除的患者接受了根治性手术并获得长期生存甚至治愈。可切除标准的转变,强调如何有效切除所有可见病灶的同时保证留有足够大小的预期剩余肝脏(future liver remnant,FLR),而减少了临床病理因素的判断权重。但是,即使是专业的肝脏外科医生依据扩展的可切除标准,对于可切除性的评估仍有较大差异。CELIM[5,8]研究中,7位评估者对1 913次可切除性判断的可切除性一致率仅为64.5%,完全分歧率达到6.8%(即一位评估者认为可切除,其他评估者认为不可切除)。这体现了结直肠癌肝脏转移的外科治疗决策的复杂性和个体性。
一、临床病理因素指导手术
CRLMs患者的临床病理特征包括转移瘤数量,转移瘤直径大小,转移瘤切缘是否足够,是否有肝外转移,肝脏两叶累及程度,化疗应答程度等等。这些因素是外科医师制定手术决策的重要考量。事实上,这些因素关注更多的是肿瘤本身的生物学行为而不是患者通过肝脏手术中的生存获益。在1986年,Ekberg等[4]总结归纳出CRLMs的可切除标准包括:肝转移癌个数<4个,转移瘤局限于肝脏单叶,无肝外转移且肿瘤切缘大于等于10 mm等。这一标准的提出引发了许多争议。依照此可切除标准,真正符合条件并有机会接受手术治疗的患者非常少,只占到全部CRLMs患者的10%~20%。外界的质疑主要有2点,其一是这一项研究的样本量太少,真正符合所有不可切除标准的患者只占很少一部分,其二是这一研究的相关影响因素没有被很好排除,这在当时大部分的研究都是单中心的小样本研究背景下是很常见的。在一项来自Memorial Sloan-Kettering肿瘤中心的包含1 001例(1985至1998年)CRLMs的回顾性多变量分析研究里,Fong等提出了影响预后的7项独立因素:原发病灶淋巴结阳性;从原发病灶到肝转移的无病间隔期小于等于12个月;大于1个肝内病灶;最大的肝脏转移病灶直径大于等于5 cm;癌胚抗原水平>200 ng/ml;肝外转移病灶和阳性切缘。在这之中,阳性切缘以及肝外转移病灶与预后的相关性最大并且应该被视作是肝脏手术的禁忌证。而Fong等将其余的5项因素组成临床评分系统,分数为0分的患者预后要明显优于分数为5分者,5年无病生存期(disease free survival,DFS)60% vs 14%。Ekberg等的手术标准与Fong等提出的手术禁忌与评分标准很大程度上影响了当时肝脏外科医师对CRLMs的手术判断。随着新的治疗手段与治疗理念的更新换代,传统的可切除标准与手术方式受到了挑战。在原先标准下不可切除的CRLMs患者,尝试高效能化疗转化,通过极限手术方式完成肝脏肿瘤切除。经过长期的随访,这部分患者并没有出现预期中极差的生存预后。
二、转移瘤数目
过去的许多研究都强调了转移瘤数目对CRLMs预后的影响。在Ekberg等[4]报道的68例CRLMs病例中,他发现肝脏内寡转移患者的预后要明显优于多发转移者,5年总生存期(overall survival,OS)24% vs 9%,(P<0.05),并且肝内出现孤立的微卫星灶的患者,5年OS为0(P<0.01)。而Fong等[9]的报道也发现了类似结果:肿瘤转移数目为1的患者预后要明显优于转移数目大于1的患者(5年OS 44% vs 28%及中位生存期52个月 vs 36个月,P=0.001)。在CELIM试验中,不可切除的标准的定义是技术上不可切除或者转移瘤数目≥5个。有趣的是,虽然在基于多中心大样本分析研究中,肝内转移灶数目≥5个意味着更差的无病生存期(disease free survival,DFS),Altendorf-Hofmann和Scheele[10]在回顾分析了473例R0切除的患者后指出,在保证阴性切缘的情况下,转移瘤数目1~3与≥4并没有对生存期造成影响。而在回顾分析CELIM试验中同一批患者,在基于新辅助化疗后判定为可切除者比基线判断时可切除者拥有更好的总生存率,从而进一步肯定了转化性化疗的作用。
三、转移瘤直径
转移瘤的直径大小作为CRLMs患者的临床预后相关因素而被纳入临床决策考量。然而,相关研究对这一因素提出了异议。一些研究[6,11-12]明确肯定了肝脏内最大转移瘤的直径大小对OS的影响,而在另一些研究报道中[13-17],最大转移瘤直径大小与总体预后的关联无统计学意义。在技术上,最大转移瘤大小对可切除性评估的影响主要是一方面使得保障阴性手术切缘变得更加困难(与肿瘤毗邻结构及重要器官侵犯有关),而另一方面让完整切除转移瘤的同时保证足够的FLR变得更加困难。在生物学行为上,研究者们[6,9,18]将转移瘤直径>5 cm作为判断预后的独立影响因素,而单独满足>5 cm的这组患者的五年OS仍可以达到31%~40%。高效能的新辅助化疗以及积极的手术方式(如二步肝切除等)的陆续开展,在快速缩小转移瘤的同时,也能够有效的增加FLR。转移瘤大小对生存预后的影响上虽存争议,但因此将转移瘤直径5 cm作为手术可行性的界限,显然会失去大样本可从手术获益的患者。
四、肿瘤切缘
CRLMs的肝脏切缘状态对预测远期预后非常重要。一项在1998年发表在《Annals of Surgery》的包含200多例大肠癌肝转移术后患者的随访研究发现,转移瘤切缘宽度<1 cm的患者预后要明显差于>1 cm者。根据这项结果,Cady等[19]认为,1 cm的最小手术切缘应当被视为判断CRLMs肝脏手术可行性的标准,预期手术切缘<1 cm被视为手术禁忌。之后的许多研究[6,9,20]进一步论证了手术阳性切缘与术后局部复发率升高以及远期生存受损的相关性。在2005年,来自MD Anderson癌症中心的回顾性队列研究[21]报道了557例接受肝脏手术的CRLMs患者的情况。在经过29个月的中位随访期后,1年、3年及5年的实际生存率分别是97%、74%、58%、40%的患者发生了术后复发。术后病理中标本切线上肿瘤残留的定义为阳性切缘,其余为阴性切缘。阴性切缘中切缘宽度分别为1 mm~4 mm,5 mm~9 mm 以及≥1 cm的患者术后总的复发概率相当(P>0.05)。Postriganova等[22]在分析了317例在1998至2012年间经历腹腔镜下肝转移癌切除的CRLMs患者后发现了类似结果:切缘宽度分别为小于1 mm(n=33)、≥1 mm到3 mm(n=31)、≥3 mm到10 mm(n=55)和≥10 mm(n=36)的4组患者,经过31个月的中位随访期后,在不论是的生存期以及肝脏局部复发率上差异均无统计学意义(P=0.316,P=0.349)。镜下肿瘤细胞残留的切缘(R1切除)与较差的总体预后有密不可分的关系。阳性手术切缘往往预示着更差的肿瘤生物学行为以及术后切缘复发,而阴性手术切缘的患者预后与切缘宽度无相关性。Andreou等[23]分析了378例CRLMS肝脏切除的病例(其中R1切除占到了14%)后发现,一方面,阴性切缘(R0切除)的患者的预后要明显好于前者(5年OS 55% vs 26%,P=0.017);另一方面,对化疗应答越差的患者,越能从R0切除中获益。对化疗反应不理想的患者,其5年OS在R0切除者中仍可以获得46%,而R1切除只有0%。相反,对化疗反应良好的患者,R0切除与R1切除的预后相当(3年OS 92% vs 88%,P=0.917)。de Haas等[24]也发现了类似结果:对化疗敏感的CRLMs患者就算R1切除,其OS以及DFS与R0切除患者相比差异并无统计学意义(5年OS 61% vs 57%,P=0.27;5年DFS 29% vs 20%,P=0.20)。当然,>1 cm是最理想的手术切缘宽度,1 cm以内的手术切缘仍然可以获得较好的预后。对化学治疗不敏感的患者应努力设法达成R0切除,而对化学治疗敏感且为了保护重要胆管结构而不得不进行R1切除的情况,不应当视为手术禁忌。
五、肝外转移
结直肠癌的肝脏外转移因其对预后的明显不良影响而成为手术禁忌。发生肝外转移的患者的总生存期明显受损,5年OS只有5%~10%[6,9,25]。在高效能化疗及激进手术干预下,肝外转移是否仍应视为手术绝对禁忌出现争议:Elias等[26]在回顾分析了308例CRLMs手术切除(其中有84例同时切除了肝外转移病灶)的患者后发现,转移瘤总数目(不论是肝内的还是肝外的)相比较转移瘤的位置而言对预后的预测价值更大。相同转移瘤数目的患者,不论其是否存在肝外转移,预后相当。许多学者[27-29]也报道了结直肠癌同时肝肺转移的患者在经过分阶段的手术后获得了与未出现肝外转移患者相当的生存获益。Adam等[30]研究了在1990至2006年间来自法国保罗布鲁斯医院的840例肝切除(22%同时接受肝外转移瘤切除)的CRLMs患者。88%的合并肝外转移的患者出现了复发,而没有肝外转移的患者中只有60%(P=0.004)。虽然合并肝外转移的患者5年OS以及5年DFS都明显低于没有肝外转移者(28% vs 55%,P<0.001;11% vs 25%,P<0.001),选择手术干预的患者预后要明显优于单纯化学治疗者[31](5年OS 28% vs 5%,P<0.05)。2015年欧洲临床肿瘤学会年会新版指南[32]将转移性结直肠癌(metastatic colorectal cancer,mCRC)疾病分为两大类:寡转移性或局限性疾病(oligometastatic disease,OMD)和广泛转移性疾病(metastatic disease,MD)。对于局限性mCRC,以手术为代表的局部治疗手段,包括消融毁损技术(射频消融、微波消融、冷冻消融)、立体定向放疗等的治疗价值越来越得到肯定。CALGB/SWOG 80405临床试验[33]中,经过术前化疗后mCRC中132例(KRAS野生型)手术后达到无疾病残留(no evidence of disease,NED)的患者,OS达到了相当高的64.7个月。新版指南中对于局限性mCRC的治疗目标即是通过手术/局部治疗±全身化疗达到NED。不再受技术层面的手术切缘与生物学行为上的多器官转移的限定,使更多的局限性mCRC获得生存获益。这对于多次复发及合并肝外转移的局限mCRC更有局部治疗的积极的价值。
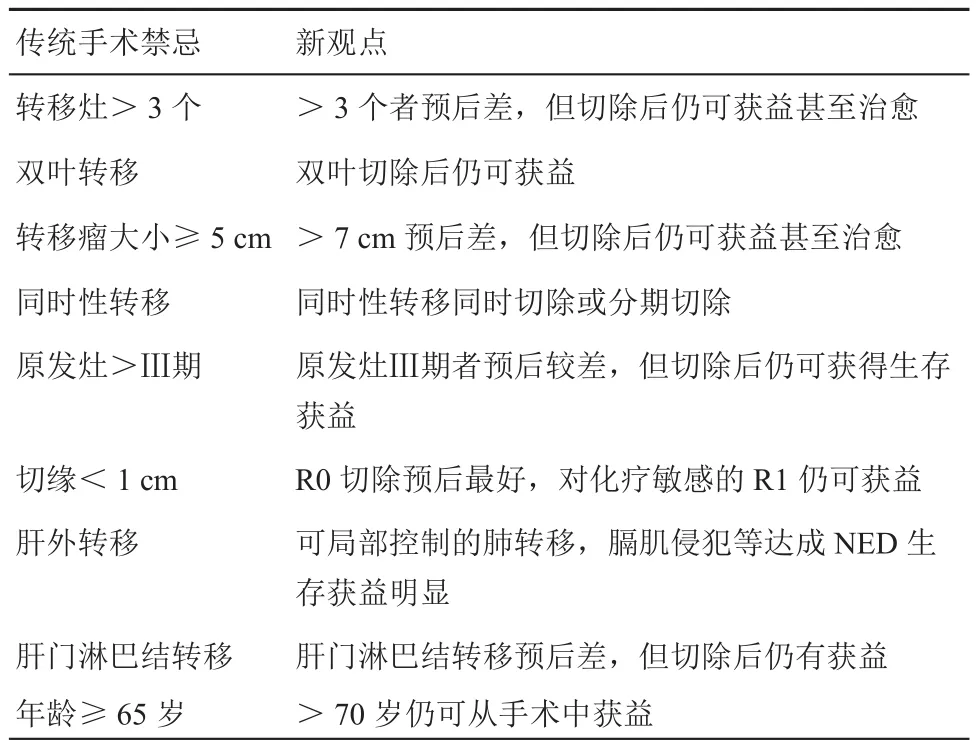
表1 可切除定义的演变
六、扩大可切除标准:手术可行性指导决策
根据某一临床危险因素对总体预后的不良影响而定义手术禁忌的做法存在许多争议(表1)。基于多因素的临床评分系统虽然类别众多,却没有一个理想评分系统能达成专家一致认同。目前看来,可切除标准的基本含义应包括:(1)利用手术联合多种局部治疗手段,转移灶可以被完整切除,达成NED;(2)保留至少2个相邻的功能完整的并拥有足够FLR的肝段(基于肝脏原本的损伤程度,肝脏功能正常者≥25%,化疗性肝损,肝炎及脂肪肝的患者至少30%~60%,肝硬化的患者至少40%~70%)[34-35]。
扩大可切除标准的根本目的在于尽可能多的增加可切除患者的数量。对于原本不可切患者,如何扩大可切除标准,不外乎三点:(1)增加/保持预期剩余肝体积;(2)联合多种辅助治疗手段;(3)缩小肿瘤的大小。
(一)增加/保持预期肝脏体积
一般来说,对于术前肝功能正常的患者,完成肝转移灶切除手术要求的FLR至少要>25%。然而,对于术前肝脏就有合并症(比如肝炎、肝脂肪变性以及肝硬化等)的患者,最小FLR要大的多(30%~40%)。FLR的准确测量,是基于CT以及MRI的扫描结果[34]。肝脏两叶多发转移的患者,往往需要切除右半肝联合肝Ⅳ段(扩大右半肝切除)来保证无肉眼可见肿瘤残留。这一过程,在没有使用任何补充的增加肝脏体积的方法下,需要切除平均来说84%的肝脏[36]。FLR不足的患者甚至有可能发生小肝综合征(small for size syndrome,SFSS),不及时发现处理将面临极高的死亡风险[37]。为了能够满足FLR的要求,增加可切除患者比例,能够快速增加剩余肝脏体积的传统二步肝切除或联合PVE/PVL以及ALPPS术式应运而生。
1.传统二步肝切除联合门静脉栓塞术/门静脉结扎术(PVE/PVL)
肝脏两叶多发转移的CRLMs患者在过去被认为是不可切除的。不仅仅因为其较差的生存预后,还与手术累及过多正常肝脏组织、术后有功能的FLR不足有关。自从2000年Adam等[38]报道了第一例二步肝切除手术以来,这一项技术已经得到广泛认可。早期未合并PVE的二步肝切除往往因术后有功能的FLR不足出现较高的围手术期相关死亡率(9%~15%)[39]。PVE/PVL术的引入,弥补了二次手术间隔期内FLR增长过慢的缺陷,增加了完成两次手术的患者比例同时保证了可接受的围手术期相关死亡率[40]。经典的传统二步肝切除联合PVE术在第一步手术时切除FLR内(大部分是左肝)的转移灶并在之后完成PVE术。在经过3~4周的等待及对FLR增大的评估后,没有明显肿瘤进展的患者将接受第二步手术并完成扩大肝切除术。短期的化疗(2~3个周期)可以在手术间期内应用,以预防FLR内的肿瘤复发及出现新的肝外转移灶。二步肝切除术的出现,使得许多初始不可切除的肝脏两叶多发转移患者获得手术治疗的可能,而能顺利完成该术式的患者,远期预后以及手术期相关风险可与原本可切除患者相当(5年OS 42%~50% vs 35%~58%,围手术期相关死亡率4%~7% vs 3%~6%)[41-43]。然而,选择二步肝切除术式同样面临很多问题:一方面,只有少部分(少于10%)的初始不可切除的患者在经过新辅助化疗后能获得手术机会。同时,患者在接受手术前往往经历高强度化疗,手术风险因肝脏及其他多脏器功能损伤增加。另一方面,对化疗特别敏感的患者可出现肉眼可见肝脏转移灶“消失”从而影响手术切除范围判断等[35,44-45]。在纳入二步肝切除计划中的患者,因为中途肿瘤进展及/或FLR增大不足等而失败的比例可高达三分之一[42]。而且只完成第一步手术的患者,其预后甚至明显差于单纯化疗的患者[46]。
2.联合肝脏劈离及门静脉结扎的二期肝切除(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)
ALPPS被认为是近年来最具突破性的肝脏手术之一,用于治疗因FLR较小而不能耐受肝脏切除的肝癌或肝转移患者。凭借着能够快速增加FLR(通常7~10 d增加80%以上)的特点,ALPPS只需要经历非常短的等待期就可以获得广泛切除肝脏内病灶所需要的FLR,因此在结直肠癌肝脏转移外科领域也受到了广泛关注。自从ALPPS问世以来,其过高的手术相关的死亡率以及术后并发症率一直被一些学者所诟病[47-49]。在一项来自瑞士的回顾性分析研究中,Schadde等[49]分析比较了48例ALPPS及83例传统二步肝切除。ALPPS及传统二步肝切除的二步手术完成率分别是100%和66%,90 d死亡率比较分别是15%以及6%,中位等待期内FLR增长分别77%及34%,日均FLR增长率分别是34.8 cc及2.78 cc,1年内的肿瘤复发率分别是54%及52%。结果表明,在一个高手术死亡率的前提下,ALPPS的确可以快速增大FLR并提升手术成功率。一些学者对ALPPS短期预后影响的担忧,譬如劈离肝脏的操作可能增加全身转移,FLR更快速的增大可能引起更大量生长因子释放从而促进肿瘤细胞的生长等等。就目前而言,传统二步肝切除与ALPPS在短期(1年内)的复发风险并没有统计学差异。近来,在《Annal of Surgery》杂志发表了欧洲的多中心ALPPS Registry Group的注册数据库的结果。共有202例患者,其中141例(70%)患者是CRLMs。患者中位起始FLR是21%,7天后中位FLR为80%。90天的死亡率是9%,严重并发症的发生率为27%。发生严重并发症的高危因素有输血、Ⅰ期手术时间大于300 min、年龄超过60岁和非结直肠癌的肝转移。这是目前比较大的一宗ALPPS手术安全性的分析研究,结果表明老年患者接受ALPPS手术的并发症和死亡率都明显增加,但是CRLMs患者比其他原发肿瘤患者更适宜接受ALPPS手术[48]。虽然目前支持ALPPS应用的循证医学证据级别较低,仍需要大样本前瞻性随机对照研究证实,ALPPS的确提供了扩大可切除标准的可能。
(二)联合多种辅助治疗手段
在近几年内,多种局部消融技术的发展,增加了可切除的CRLMs患者数量。特别在联合消融技术与肝脏切除上,肝切除一方面弥补了消融技术在处理过大转移瘤上的短板,同时又利用了消融技术损伤小,对位置较深的小转移瘤治疗效果较好的特点,进一步扩大了可切除标准。在多种局部消融技术如高能超声消融技术(high-intensity ultrasound ablation),激光热疗(laser thermotherapy)以及90钇粒子植入技术(yttrium-90 seed implants)等等中,目前使用最广泛的是射频消融技术(radiofrequencyablation,RFA)。射频是一种频率达到每秒15万次的高频振动。在高频交流电的作用下,激发组织细胞进行等离子震荡,所产生的热量可使局部温度达到90 ℃以上,由于肿瘤散热差,使肿瘤组织温度高于其邻近正常组织,加上癌细胞对高热敏感,从而快速有效地杀死肿瘤细胞[50]。毗邻甚至部分侵犯重要血管的肝内转移瘤是传统手术切除的一大难点。由于血管内流动的血流可以加快热量的散发,RFA在破坏肿瘤组织的同时可以较安全的保护血管内皮组织免受高热量的损伤。然而,这一特点也可能引起肿瘤组织消融不完全与局部高复发风险的后果。Veltri等[51]分析了262例在1996至2009年间经历RFA治疗的CRLMs患者:总的5年OS在1、2、3和5年时分别是93%,78%、62%和35%;中位生存期在肿瘤直径≤3 cm的亚组中是41个月,而在>3 cm的亚组中是21.7个月(P=0.000 1)。Gillams和Lees[52]及Sorensen等[53]也报道了类似结果,一方面进一步证明了RFA改善了CRLMs患者的生存预后,另一方面也揭示了转移瘤直径大小对射频治疗预后的直接影响。就目前而言,RFA仍不能完全取代肝脏手术治疗,然而其明显较低的围手术期并发症及死亡率以及在不可切除肝转移癌上的应用让其作为肝脏手术的联合治疗方式,增加了可以接受手术治疗的患者数量,也为更灵活的手术方式提供了可能。
(三)缩小肿瘤体积/新辅助化疗
在过去的20年间,针对CRLMs的化疗药物经历了不断的更新换代。从过去以5-FU联合四氢叶酸为主的二联化疗方案,到近几年加入了奥沙利铂或伊立替康的三联甚至四联化疗方案,再到现在各种生物靶向药物的使用,化学治疗对CRLMs的反应率(responsible rate,RR)从最早的20%增长到了现今的50%。高效能的化疗方式的出现,一方面凭借高反应率使得一部分(15%~20%)原本不可切除的患者转移瘤快速退缩从而获得手术治疗的机会,另一方面改善了总体的预后,将总生存期从11~14.7个月延长到了39.4个月[14,54-56]。Adam等[54]分析了单中心的1 439例CRLMs患者,12.5%的初始不可切除患者在高效能化疗的背景下获得了“转化”手术的机会。而在积极的反复肝脏及肝外转移灶的手术切除下,这部分初始不可切除的患者的5年OS可以达到33%,与初始可切除患者的预后相当。虽然高效能化疗可以明显的缩小对化疗敏感患者的转移瘤大小,大量应用细胞毒性及靶向药物的同时,也带来了肝脏功能的损伤。一些研究[57]报道了奥沙利铂的使用会增加肝内血窦梗阻的风险,另一些研究[58-59]报道了伊立替康的使用可能跟肝脂肪变性有关。Zhu等[60]回顾了2000年至2010年间466例CRLMs患者在使用新辅助化疗后的生存获益后发现,手术前化疗≥6个周期,可引起明显的肝脏功能损害,而化疗在2~4个周期的患者,ICG-R15可基本恢复正常。故而术前化疗一定要在6周内完成可切除性评估,达成“转化”手术条件的患者应及时手术。
扩大CRLMs的可切除标准的根本目的在于尽可能多的增加可切除患者的数量。可切除标准的重点在能够达成NED的同时保证可接受的FLR。临床危险因素的确会影响总体预后,然而却并不应该作为手术切除的绝对禁忌。
CRLMs的可切除标准的转变,从临床病理因素指导手术的理念演变到手术可行性指导决策,极大的增加了可切除患者的数量。而随着可切除标准的扩大,承受更广泛的术前化疗,更复杂的肝脏切除手术以及复发-切除-再复发-再切除等积极治疗的患者被纳入到了手术切除的队伍。但是这一部分患者的围手术期死亡率以及OS却并没有比10年前的化疗损伤小、手术更简单、肿瘤生物学行为更好的患者差[61]。可切除标准的转变,强调NED的同时保证留有足够FLR。目前学术界对于NED的概念尚没有清晰的定义。一是判断NED的依据是否包含高水平的病理学无瘤(R0切除)和低水平的临床影像学判断的无瘤,因为局限性转移采用局部消融等手段达到NED目标,是没有外科标本进行病理学评估的。二是NED是否有时间窗的定义限制,例如局部术后出现快速的复发和转移(极短的RFS)显然不能达到局部治疗的NED目标。何种肿瘤学和解剖学特征能够从NED中获益,如何筛选潜在获益群体,这单纯依靠寡转移性或局限性疾病的数目定义是不够的。专业的肝脏外科医生依据扩展的可切除标准,对于可切除性的评估仍有显著差异。一方面,外科决策的主观性包括手术技术可行性判断,综合考量提示早期复发的预后影响因素以及外科医生对待手术风险与生存获益的态度等等在一定程度上造成了可切除判断的分歧。另一方面,肝脏外科医生仍需要加深对可切除性的理解。CELIM研究提示初始不可切除但经过“转化性化疗”获得手术治疗的CRLMs患者有三分之一于术后半年内出现了早期复发。肝转移灶数目超过10个的患者术后DFS显著缩短。对于此类高复发风险的患者,外科治疗是否能够提高生存,以及如何界定此类患者尚没有一个有效的标准。需要在大数据背景下建立并验证一个理想的筛选评分体系。
[1]DeSantis CE,Lin CC,Mariotto AB,et al.Cancer treatment and survivorship statistics,2014[J].CA Cancer J Clin,2014,64(4):252-271.
[2]Mayo SC,Heckman JE,Shore AD,et al.Shifting trends in liver-directed management of patients with colorectal liver metastasis:a population-based analysis[J].Surgery,2011,150(2):204-216.
[3]Andres A,Toso C,Adam R,et al.A survival analysis of the liver-first reversed management of advanced simultaneous colorectal liver metastases:a LiverMetSurvey-based study[J].Ann Surg,2012,256(5):772-778; discussion 778-779.
[4]Ekberg H,Tranberg KG,Andersson R,et al.Determinants of survival in liver resection for colorectal secondaries[J].Br.J.Surg,1986,73(9):727-731.
[5]Folprecht G,Gruenberger T,Bechstein WO,et al.Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab:the CELIM randomised phase 2 trial[J].The lancet oncology,2010,11(1):38-47.
[6]Rees M,Tekkis PP,Welsh FK,et al.Evaluation of long-term survival after hepatic resection for metastatic colorectal cancer:a multifactorial model of 929 patients[J]. Ann Surg,2008,247(1):125-135.
[7]Adam R.Chemotherapy and surgery:new perspectives on the treatment of unresectable liver metastases[J].Annals of Oncology,2003,14(suppl 2):ii13-ii16.
[8]Folprecht G,Gruenberger T,Bechstein W,et al.Survival of patients with initially unresectable colorectal liver metastases treated with FOLFOX/cetuximab or FOLFIRI/cetuximab in a multidisciplinary concept (CELIM study) [J].Annals of Oncology,2014,25(5):1018-1025.
[9]Fong Y,Fortner J,Sun RL,et al.Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer:analysis of 1001 consecutive cases[J].Annals of surgery,1999,230(2):309-318.
[10]Altendorf-Hofmann A,Scheele J.A critical review of the major indicators of prognosis after resection of hepatic metastases from colorectal carcinoma[J].Surg Oncol Clin N Am,2003,12(1):165-192.
[11]Nagashima I,Takada T,Adachi M,et al.Proposal of criteria to select candidates with colorectal liver metastases for hepatic resection:comparison of our scoring system to the positive number of risk factors[J].World Journal of Gastroenterology,2006,12(39):6305-6309.
[12]Yamaguchi T,Mori T,Takahashi K,et al.A new classification system for liver metastases from colorectal cancer in Japanese multicenter analysis[J].Hepato-gastroenterology,2008,55(81):173-178.
[13]Malik HZ,Prasad KR,Halazun KJ,et al.Preoperative prognostic score for predicting survival after hepatic resection for colorectal liver metastases[J].Ann Surg,2007,246(5):806-814.
[14]Minagawa M,Yamamoto J,Kosuge T,et al.Simplified staging system for predicting the prognosis of patients with resectable liver metastasis:development and validation.Archives of Surgery[J].2007,142(3):269-276.
[15]Zakaria S,Donohue JH,Que FG,et al.Hepatic resection for colorectal metastases:value for risk scoring systems[J]? Ann Surg,2007,246(2):183-191.
[16]Tan MCB,Castaldo ET,Gao F,et al.A Prognostic System Applicable to Patients with Resectable Liver Metastasis from Colorectal Carcinoma Staged by Positron Emission Tomography with [18F]Fluoro-2-Deoxy-D-Glucose:Role of Primary Tumor Variables[J].Journal of the American College of Surgeons,2008,206(5):857-868.
[17]Konopke R,Kersting S,Distler M,et al.Prognostic factors and evaluation of a clinical score for predicting survival after resection of colorectal liver metastases[J].Liver Int,2009,29(1):89-102.
[18]Nordlinger B,Guiguet M,Vaillant JC,et al.Surgical resection of colorectal carcinoma metastases to the liver:a prognostic scoring system to improve case selection,based on 1568 patients[J].Cancer,1996,77(7):1254-1262.
[19]Cady B,Jenkins RL,Steele Jr GD,et al.Surgical margin in hepatic resection for colorectal metastasis:a critical and improvable determinant of outcome[J].Annals of surgery,1998,227(4):566-571.
[20]Choti MA,Sitzmann JV,Tiburi MF,et al.Trends in Long-Term Survival Following Liver Resection for Hepatic Colorectal Metastases[J].Annals of Surgery,2002,235(6):759-766.
[21]Pawlik TM,Scoggins CR,Zorzi D,et al.Effect of Surgical Margin Status on Survival and Site of Recurrence After Hepatic Resection for Colorectal Metastases[J].Annals of Surgery,2005,241(5):715-724.
[22]Postriganova N,Kazaryan AM,Røsok BI,et al.Margin status after laparoscopic resection of colorectal liver metastases:does a narrow resection margin have an influence on survival and local recurrence[J]? HPB:The Official Journal of the International HepatoPancreato Biliary Association,2014,16(9):822-829.
[23]Andreou A,Aloia TA,Brouquet A,et al.Margin status remains an important determinant of survival after surgical resection of colorectal liver metastases in the era of modern chemotherapy[J].Ann Surg,2013,257(6):1079-1088.
[24]de Haas RJ,Wicherts DA,Flores E,et al.R1 resection by necessity for colorectal liver metastases:is it still a contraindication to surgery[J]? Ann Surg,2008,248(4):626-637.
[25]Kato T,Yasui K,Hirai T,et al.Therapeutic results for hepatic metastasis of colorectal cancer with special reference to effectiveness of hepatectomy:analysis of prognostic factors for 763 cases recorded at 18 institutions[J].Diseases of the colon and rectum,2003,46(10 Suppl):S22-S31.
[26]Elias D,Liberale G,Vernerey D,et al.Hepatic and extrahepatic colorectal metastases:when resectable,their localization does not matter,but their total number has a prognostic effect[J].Annals of surgical oncology,2005,12(11):900-909.
[27]Lehnert T,Knaebel HP,Dück M,et al.Sequential hepatic and pulmonary resections for metastatic colorectal cancer[J].British Journal of Surgery,1999,86(2):241-243.
[28]Headrick JR,Miller DL,Nagorney DM,et al.Surgical treatment of hepatic and pulmonary metastases from colon cancer[J].The Annals of Thoracic Surgery,2001,71(3):975-980.
[29]Miller G,Biernacki P,Kemeny NE,et al.Outcomes after Resection of Synchronous or Metachronous Hepatic and Pulmonary Colorectal Metastases[J].Journal of the American College of Surgeons,2007,205(2):231-238.
[30]Adam R,de Haas RJ,Wicherts DA,et al.Concomitant extrahepatic disease in patients with colorectal liver metastases:when is there a place for surgery[J]? Annals of surgery,2011,253(2):349-359.
[31]Masi G,Cupini S,Marcucci L,et al.Treatment with 5-Fluorouracil/ Folinic Acid,Oxaliplatin,and Irinotecan Enables Surgical Resection of Metastases in Patients With Initially Unresectable Metastatic Colorectal Cancer[J].Annals of Surgical Oncology,2006,13(1):58-65.
[32]Van Cutsem E,Cervantes A,Nordlinger B,et al.Metastatic colorectal cancer:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Annals of oncology,2014,25(Suppl 3):iii1-iii9.
[33]Venook AP,Blanke CD,Niedzwiecki D,et al.Revisiting the Cancer and Leukemia Group B/Southwest Oncology Group 80405 Trial:a phase III trial of chemotherapy and biologic agents for patients with untreated advanced colorectal adenocarcinoma[J].Clinical colorectal cancer,2007,6(7):536-538.
[34]Ferrero A,Viganò L,Polastri R,et al.Postoperative Liver Dysfunction and Future Remnant Liver:Where Is the Limit[J]?World Journal of Surgery,2007,31(8):1643-1651.
[35]Zorzi D,Laurent A,Pawlik TM,et al.Chemotherapy-associated hepatotoxicity and surgery for colorectal liver metastases[J].Br J Surg,2007,94(3):274-286.
[36]Abdalla EK,Denys A,Chevalier P,et al.Total and segmental liver volume variations:Implications for liver surgery[J].Surgery,2004,135(4):404-410.
[37]Vicente E,Quijano Y,Ielpo B,et al.Is ʺsmall for size syndromeʺ a relatively new complication after the ALPPS procedure[J]? Updates in Surgery,2015,67(3):273-278.
[38]Adam R,Laurent A,Azoulay D,et al.Two-Stage Hepatectomy:A Planned Strategy to Treat Irresectable Liver Tumors[J].Annals of Surgery,2000,232(6):777-785.
[39]Jaeck D,Oussoultzoglou E,Rosso E,et al.A Two-Stage Hepatectomy Procedure Combined With Portal Vein Embolization to Achieve Curative Resection for Initially Unresectable Multiple and Bilobar Colorectal Liver Metastases[J].Annals of Surgery,2004,240(6):1037-1051.
[40]Farges O,Belghiti J,Kianmanesh R,et al.Portal Vein Embolization Before Right Hepatectomy:Prospective Clinical Trial[J].Annals of Surgery,2003,237(2):208-217.
[41]Pamecha V,Nedjat-Shokouhi B,Gurusamy K,et al.Prospective evaluation of two-stage hepatectomy combined with selective portal vein embolisation and systemic chemotherapy for patients with unresectable bilobar colorectal liver metastases[J].Digestive surgery,2008,25(5):387-393.
[42]Wicherts DA,Miller R,de Haas RJ,et al.Long-term results of two-stage hepatectomy for irresectable colorectal cancer liver metastases[J].Ann Surg,2008,248(6):994-1005.
[43]Karoui M,Vigano L,Goyer P,et al.Combined first-stage hepatectomy and colorectal resection in a two-stage hepatectomy strategy for bilobar synchronous liver metastases[J].The British journal of surgery,2010,97(9):1354-1362.
[44]Adam R,Laurent A,Azoulay D,et al.Two-Stage Hepatectomy:A Planned Strategy to Treat Irresectable Liver Tumors[J].ANNALS OF SURGERY,2000,232(6):777-785.
[45]Benoist S,Brouquet A,Penna C,et al.Complete response of colorectal liver metastases after chemotherapy:does it mean cure[J]?J ClinOncol,2006,24(24):3939-3945.
[46]Brouquet A,Abdalla EK,Kopetz S,et al.High Survival Rate After Two-Stage Resection of Advanced Colorectal Liver Metastases:Response-Based Selection and Complete Resection Define Outcome[J].Journal of Clinical Oncology,2011,29(8):1083-1090.
[47]Alvarez FA,Ardiles V,Sanchez Claria R,et al.Associating liver partition and portal vein ligation for staged hepatectomy (ALPPS):tips and tricks[J].J Gastrointest Surg,2013,17(4):814-821.
[48]Schadde E,Ardiles V,Robles-Campos R,et al.Early survival and safety of ALPPS:first report of the International ALPPS Registry[J].Ann Surg,2014,260(5):829-838.
[49]Schadde E,Ardiles V,Slankamenac K,et al.ALPPS offers a better chance of complete resection in patients with primarily unresectable liver tumors compared with conventional-staged hepatectomies:results of a multicenter analysis[J].World J Surg,2014,38(6):1510-1519.
[50]Rhim H,Dodd GD.Radiofrequency thermal ablation of liver tumors[J].Journal of clinical ultrasound:JCU,1999,27(5):221-229.
[51]Veltri A,Guarnieri T,Gazzera C,et al.Long-term outcome of radiofrequency thermal ablation (RFA) of liver metastases from colorectal cancer (CRC):size as the leading prognostic factor for survival[J].La radiologiamedica,2012,117(7):1139-1151.
[52]Gillams A,Lees W.Radiofrequency ablation of colorectal liver metastases[J].Abdominal imaging,2005,30(4):419-426.
[53]Sørensen SM,Mortensen FV,Nielsen DT.Radiofrequency ablation of colorectal liver metastases:long-term survival[J].ActaRadiologica,2007,48(3):253-258.
[54]Adam R,Delvart Vr,Pascal Gr,et al.Rescue Surgery for Unresectable Colorectal Liver Metastases Downstaged by Chemotherapy[J].Ann Surg,2004,240(4):644-657.
[55]Capussotti L,Muratore A,Mulas MM,et al.Neoadjuvant chemotherapy and resection for initially irresectable colorectal liver metastases[J].Br J Surg,2006,93(8):1001-1006.
[56]Kanas GP,Taylor A,Primrose JN,et al.Survival after liver resection in metastatic colorectal cancer:review and meta-analysis of prognostic factors[J].Clin Epidemiol,2012,4(1):283-301.
[57]Rubbia-Brandt L,Audard V,Sartoretti P,et al.Severe hepatic sinusoidal obstruction associated with oxaliplatin-based chemotherapy in patients with metastatic colorectal cancer[J].Annals of Oncology,2004,15(3):460-466.
[58]Fernandez FG,Ritter J,Goodwin JW,et al.Effect of steatohepatitis associated with irinotecan or oxaliplatin pretreatment on resectability of hepatic colorectal metastases[J].Journal of the American College of Surgeons,2005,200(6):845-853.
[59]Pawlik TM,Olino K,Gleisner AL,et al.Preoperative chemotherapy for colorectal liver metastases:impact on hepatic histology and postoperative outcome[J].Journal of Gastrointestinal Surgery,2007,11(7):860-868.
[60]Zhu D,Zhong Y,Wei Y,et al.Effect of Neoadjuvant Chemotherapy in Patients with Resectable Colorectal Liver Metastases[J].PLoS ONE,2014,9(1):e86543.
[61]de Haas RJ,Wicherts DA,Andreani P,et al.Impact of expanding criteria for resectability of colorectal metastases on short-and long-term outcomes after hepatic resection[J].Ann Surg,2011,253(6):1069-1079.
Assessment of resectability of colorectal liver metastasis
Zhou Pengyang,Wang Jianwei.Department of Surgical Oncology,Second Affiliated Hospital,Zhejiang University School of Medicine,Hangzhou 310009,Zhejiang Province,China
Wang Jianwei,Email: Jwewawewa@163.com
Liver is the most common site of metastasis in colorectal cancer.Hepatectomy as the treatment choice for patients seem to offer long-term survival and be the only chance for cure.The advent of aggressive interventions such as two-stage hepatectomy with portal vein embolization/ligation (PVE/ PVL) and associating liver partition and portal vein ligation for staged hepatectomy (ALPPS),high-effective chemotherapy regimen associated with targeted medicine and various ablation treatments has expanded the definition of hepatic resectability.But according to the recent resectability standard,there are still considerable differences in surgical decision making.To further illustrate this issue,we therefore investigate the resectability of colorectal liver metastasis.
Colorectal neoplasms;Neoplasm metastasis;Surgical margin
2016-06-25)
(本文编辑:姜争)
10.3877/cma.j.issn.2095-3224.2016.05.005
国家自然科学基金面上资助项目(No.81272677)
310009杭州,浙江大学医学院附属第二医院肿瘤外科
王建伟,Email:jwewawewa@163.com
周鹏扬,王建伟.结直肠癌肝转移的可切除性判断[J/CD].中华结直肠疾病电子杂志,2016,5(5):390-397.

