莲藕不同部位多糖的理化特征与抗氧化活性研究
李正一,连成杰,孙 杰,闵 婷,2,易 阳,2,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.湖北省生鲜食品工程技术研究中心,湖北武汉 430023)
专题研究专栏
莲藕不同部位多糖的理化特征与抗氧化活性研究
李正一1,连成杰1,孙 杰1,闵 婷1,2,易 阳1,2,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.湖北省生鲜食品工程技术研究中心,湖北武汉 430023)
编者按:广泛存在于动植物中的多糖,不仅作为生物的组织支持和能量来源,还参与生物合成、细胞识别、增殖、转移等多种生理过程。许多天然来源多糖具有良好的免疫调节、抗氧化、降血糖、促进肠道健康等功能活性。特色农产品中多糖的结构特征及其生物活性研究,一直是功能食品研究领域的热点。本期两篇文章分别对莲藕不同部位的多糖和荔枝果肉不同多糖级分的理化性质及其抗氧化活性进行了研究,研究结果可为多糖类功能性食品开发提供参考。
(主持人:张名位研究员)
采用分步醇沉法制备莲藕食用部位、皮和节中多糖(EP60/75/90、PP60/75/90和NP60/ 75/90),分析其基本组成、理化特征及抗氧化活性,明确活性多糖在莲藕中的分布。不同部位多糖的组成存在明显差异,其中由食用部位制备多糖的纯度较低。高效分子排阻色谱分析发现,莲藕不同部位多糖均以1.30~1.63 ku的低分子组分为主,且含有少量的结合蛋白。体外抗氧化活性评价发现:食用部位多糖的抗氧化活性较藕皮多糖和藕节多糖弱,尤其是DPPH自由基清除能力和FRAP总抗氧化能力(p<0.05);藕皮多糖的抗氧化活性均为PP60>PP75>PP90;藕节多糖NP60和NP90的活性相当,其羟自由基清除能力强于NP75(p<0.05),而FRAP总抗氧化能力则较弱(p<0.05)。莲藕抗氧化活性多糖主要分布于皮和节中,其活性强弱可能与结合蛋白含量和分子量的高低有关。
莲藕;多糖;理化特征;抗氧化活性
引用格式:李正一,连成杰,孙杰,等.莲藕不同部位多糖的理化特征与抗氧化活性研究[J].食品科学技术学报,2016,34(4):18-25.
LI Zhengyi,LIAN Chengjie,SUN Jie,et al.Study on physicochemical characteristics and antioxidant activities of polysaccharides from different parts of lotus root[J].Journal of Food Science and Technology,2016,34(4):18-25.
莲藕是多年生水生植物莲(Nelumbo nucifera Gaertn.)的肥大根茎,亦是我国种植面积最大且产量最高的水生蔬菜[1]。莲藕因风味独特且富含碳水化合物、蛋白质、氨基酸、矿物质、维生素等营养成分而颇受消费者喜爱,同时作为一种药用植物亦备受关注[2]。据中药药典所述,莲藕生用可清热、凉血、散疲、治热病烦渴,熟用可健脾、开胃、益血、生肌、止泻[3],但当前对其功效成分及作用机理所知甚少。
多糖作为一种重要的生物活性大分子,成为莲藕营养功能评价的重要切入点。研究证实,莲藕多糖具有良好的抗氧化活性[4-7],包括:有效清除多种自由基;抑制红细胞氧化损伤;增强糖尿病小鼠多种组织器官的SOD活性,并降低MDA含量。鉴于莲藕加工水平低且产品同质化严重的现状,活性多糖开发利用有望成为高值化新产品创制的重要途径之一,然而,相关研究选材以藕渣和藕节为主,尚缺乏对莲藕这一资源中活性多糖的全面分析评价。
植物不同组织部位中多糖的含量、理化特性和抗氧化活性往往存在显著差异[8-9],而莲藕不同部位多糖的理化及活性差异鲜见报道。此外,多糖的理化特性与抗氧化活性之间的关系极为复杂,如蛋白质含量[10-13]和分子量[14-15]等对多糖抗氧化活性的影响尚无定论,涉及莲藕多糖理化特征与抗氧化活性的相互关系亦未见报道。本研究拟采用分步醇沉法制备莲藕不同部位多糖,分析其基本组成、光谱特征和分子量分布,并评价其体外抗氧化活性,旨为莲藕天然抗氧化活性多糖开发提供参考。
1 材料与方法
1.1材料与试剂
新鲜莲藕,购于武汉市常青花园武商量贩超市;1,1-二苯基-2-三硝基苯肼(DPPH)和2,4,6-三吡啶基三嗪(TPTZ),东京化成工业株式会社;α-淀粉酶(BR),阿拉丁试剂公司;总蛋白测定试剂盒,南京建成生物工程研究所;水溶性聚氧化乙烯标准品(重均分子量分别为24.2,41.3,67.5,149,313 ku),美国Waters公司;浓硫酸、苯酚、葡萄糖、3,5-二硝基水杨酸、丙三醇、乙醇、硫酸亚铁等,国药集团化学试剂有限公司。
1.2仪器与设备
高效液相色谱系统(包括2414型差示折光检测器、2489型紫外检测器、1525型二元泵、Ultrahydrogel 1000型分子排阻色谱柱),Waters公司;Nicolet 5SXC型红外光谱仪,美国Thermo公司;RE-2000A型旋转蒸发仪,上海亚荣生化仪器厂;12N型冷冻干燥仪和XHF-D型高速分散器,宁波新芝生物科技股份有限公司;V-1100D型可见分光光度计,上海美谱达仪器有限公司。
1.3方法
1.3.1莲藕多糖的分离制备
新鲜莲藕经洗净后切分为藕皮、藕节和食用部位,并分别粉碎,参考文献[16]方法提取多糖。取粉碎原料100 g加入1 L蒸馏水中,采用高速匀浆机以11 800 r/min转速均质处理5 min,将匀浆置于89℃热水浴中浸提2 h;离心(4 500 r/min,10 min)、过滤分离上清液,进一步真空浓缩至约200 mL;采用α-淀粉酶酶解浓缩液至碘反应不显色,并应用Sevage法脱除蛋白质;浓缩液中加入无水乙醇(体积分数为60%,75%,90%)分步沉淀多糖,并经冷冻干燥成粉末。相应地,藕食用部位分离制备得到多糖EP60、EP75和EP90,藕皮制备得到多糖PP60、PP75和PP90,藕节制备得到多糖NP60、NP75和NP90,而得率以所得多糖占原料鲜重的质量百分比计。
1.3.2莲藕多糖的理化特征分析
1.3.2.1基本组成测定
采用DNS法[17]和苯酚-硫酸法[17-18]分别测定样品中还原糖和总糖的质量分数,而多糖质量分数以总糖和还原糖的质量分数之差计;样品中蛋白质质量分数采用考马斯亮蓝试剂盒测定。
1.3.2.2紫外和红外光谱扫描
制备100 μg/mL的样品溶液,在波长190~400 nm进行紫外光谱扫描。取1 mg样品与100~200 mg KBr粉末在研钵中混匀研磨,置于模具内压成透明薄片,在波数400~4000 cm-1进行红外扫描。
1.3.2.3分子量分布测定
分子量分布参考文献[16]中高效分子排阻色潽法(HPSEC)测定,采用紫外检测器和差示折光检测器进行串联分析,并以已知分子量的聚氧化乙烯标准品建立标准曲线,计算色谱峰对应的分子量大小。
1.3.3莲藕多糖的抗氧化活性评价
DPPH自由基清除活性参考文献[16]测定。FRAP总抗氧化能力参考文献[18]测定。羟自由基清除活性参考文献[19]方法(稍作修改)测定:0.6 mL不同浓度的多糖溶液与1 mL FeSO4溶液(1.5 mmol/L)、0.4 mL水杨酸溶液(2 mmol/L)和1 mL H2O2(6 mmol/L)混匀后置于37℃恒温水浴反应1 h;反应结束后以蒸馏水调零测定510 nm吸光值;空白组用蒸馏水代替多糖溶液,对照组用蒸馏水代替水杨酸。羟自由基清除率按式(1)计算。

式(1)中:A1为测试样品的吸光度;A2为对照组的吸光度;A0为空白组的吸光度。
1.4数据统计分析
采用IBM SPSS19软件进行组间数据的S-N-K检验,显著性水平为p<0.05。
2 结果与分析
2.1莲藕不同部位粗多糖的基本组成
分步醇沉制备莲藕食用部位、皮和节中多糖,各步醇沉多糖的得率及基本组成如表1。乙醇体积分数为90%时的粗多糖得率较高,其质量分数占各部位粗多糖总量的55%以上。藕食用部位制备粗多糖得率较高,达2.28%,而藕皮次之。不同部位所得粗多糖主要由多糖、还原糖和蛋白质组成,但各成分质量分数存在明显差异。食用部位多糖EP60、EP75和EP90中蛋白质质量分数无显著差异(p>0.05),但均显著低于其他多糖(p<0.05)。藕皮和藕节多糖PP60和NP60具有相对较高的蛋白质质量分数,分别达9.70%和7.06%。EP60、EP75和EP90中还原糖质量分数介于29.60%~42.93%,显著高于其他多糖(p<0.05)。相应地,藕皮和藕节粗多糖的纯度较高,多糖质量分数均大于70%。
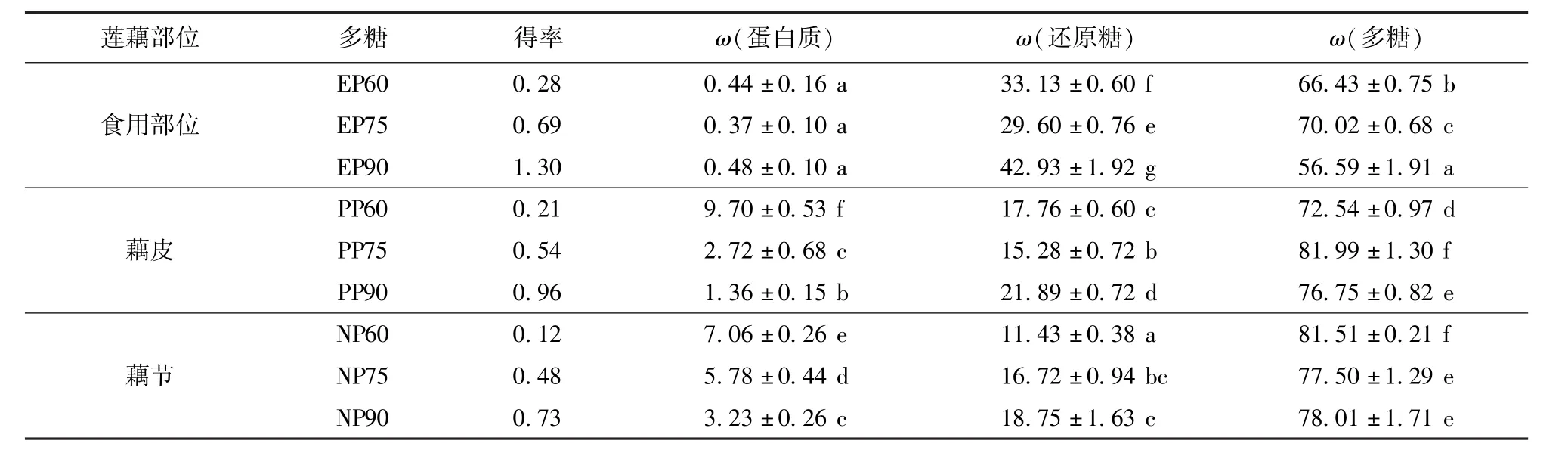
表1 莲藕不同部位粗多糖的基本组成Tab.1 Basic components of crude polysaccharides from different parts of lotus root%
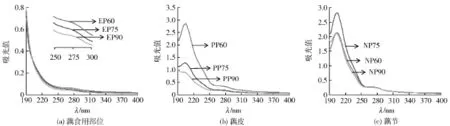
图1 莲藕不同部位粗多糖的紫外光谱Fig.1 Ultraviolet spectrograms of crude polysaccharides from different parts of lotus root
2.2莲藕不同部位粗多糖的光谱特征
分析莲藕不同部位粗多糖的紫外光谱特征(图1),结果发现:藕食用部位多糖EP60、EP75和EP90在280 nm附近无明显吸收峰,呼应较低蛋白质含量(<0.5%);PP60、NP60、NP75和NP90在280 nm附近有较弱的吸收峰,吸收信号稍强于PP75和PP90,与蛋白质含量高低结果一致。扫描莲藕不同部位粗多糖的红外光谱,如图2。各粗多糖均显现多糖的特征谱带,包括:3 200~3 600 cm-1和1 010~1 075 cm-1范围O—H伸缩/弯曲振动的羟基特征吸收峰,2 926 cm-1附近C—H伸缩振动产生的烷基特征吸收峰,1 410 cm-1附近C—O伸缩振动的羧基吸收峰。同时,在1 610~1 630 cm-1因N—H弯曲振动产生氨基特征峰,印证所有粗多糖均含有蛋白质。此外,EP90和NP90在1 733 cm-1附近的吸收峰来源于糖醛酸羧基形成酯键—COOR中C==O的伸缩振动;EP90和PP90分别在925.42和933.12 cm-1处的反对称环振动吸收峰,以及777.30和775.58 cm-1处的对称环振动吸收峰,均说明其中含有D吡喃葡萄糖,与严浪等[20]对藕渣多糖的分析结果吻合。

图2 莲藕不同部位粗多糖的红外光谱Fig.2 Infrared spectrograms of crude polysaccharides from different parts of lotus root
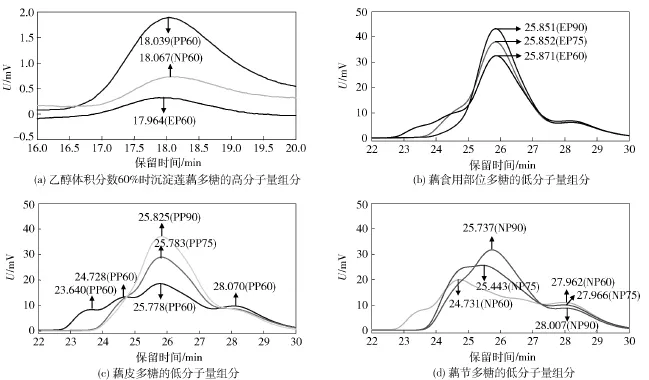
图3 莲藕不同部位粗多糖的HPSEC-RI色谱Fig.3 HPSEC-RI chromatograms of crude polysaccharides from different parts of lotus root
2.3莲藕不同部位粗多糖的分子量分布特征
采用分步醇沉法制备莲藕不同分子量多糖,乙醇体积分数越高,沉淀多糖的分子量越小。应用HPSEC-RI法分析不同部位粗多糖的分子量分布情况(图3),并计算各信号峰保留时间对应的分子量,汇总于表2。60%乙醇沉淀多糖的分子量分布较其他多糖宽且平均分子量较大,仅EP60、PP60和NP60在保留时间18 min处出现高分子量组分峰,对应分子量分别为85.56,82.23,81.02 ku。莲藕不同部位多糖均以介于1.30~1.63 ku的低分子组分为主,导致乙醇分步醇沉的分子量梯度分布不明显,而不同部位粗多糖在保留时间28 min附近的弱响应可能源于所含还原糖。此外,通过280 nm紫外吸收分析粗多糖中蛋白质对应的分子量分布情况,HPSEC-UV色谱图见图4。9种粗多糖的UV吸收峰与RI信号峰均一一对应(因紫外检测器置前,UV吸收峰的保留时间稍短),说明其中含有少量结合蛋白。江筠[6]采用体积分数为50%和67%的乙醇分步醇沉莲藕粗多糖,确定67%乙醇沉淀多糖的低分子组分分子量为18 ku。严浪等[20]采用离子交换柱层析分离得到一种莲藕酸性杂多糖,其相对分子量大于2 000 ku。莲藕多糖分子量测定与文献报道的显著差异可能与不同原材料和分离制备方法有关。

表2 莲藕不同部位粗多糖的分子量分布Tab.2 Molecular weight distributions of crude polysaccharides from different parts of lotus root
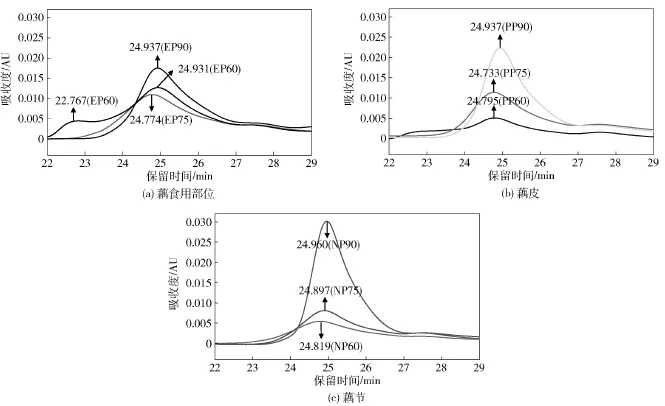
图4 莲藕不同部位粗多糖的HPSEC-UV色谱图Fig.4 HPSEC-UV chromatograms of crude polysaccharides from different parts of lotus root
2.4莲藕不同部位粗多糖的抗氧化活性
多糖的抗氧化机理涉及还原能力、阻止链引发、结合过渡金属催化剂、清除自由基等多个方面[21-22],采用DPPH自由基清除能力、羟自由基清除能力和FRAP总抗氧化能力综合评价莲藕多糖的抗氧化活性,结果如表3。藕食用部位多糖的DPPH自由基清除活性和FRAP总抗氧化能力均弱于藕皮多糖和藕节多糖(p<0.05),其中EP60的抗氧化活性相对较强。藕皮多糖的3种抗氧化活性均为PP60>PP75>PP90。藕节多糖中NP60和NP90的抗氧化活性相当,其DPPH自由基清除能力与NP75无显著差异(p>0.05),羟自由基清除能力较NP75强(p<0.05),但FRAP总抗氧化能力较弱(p<0.05)。前期研究发现,莲藕多糖的超氧阴离子和DPPH自由基的清除能力较弱,但能有效清除羟自由基并抑制H2O2诱导的红细胞氧化溶血[4-5],其有效成分可能主要为食用部位多糖。
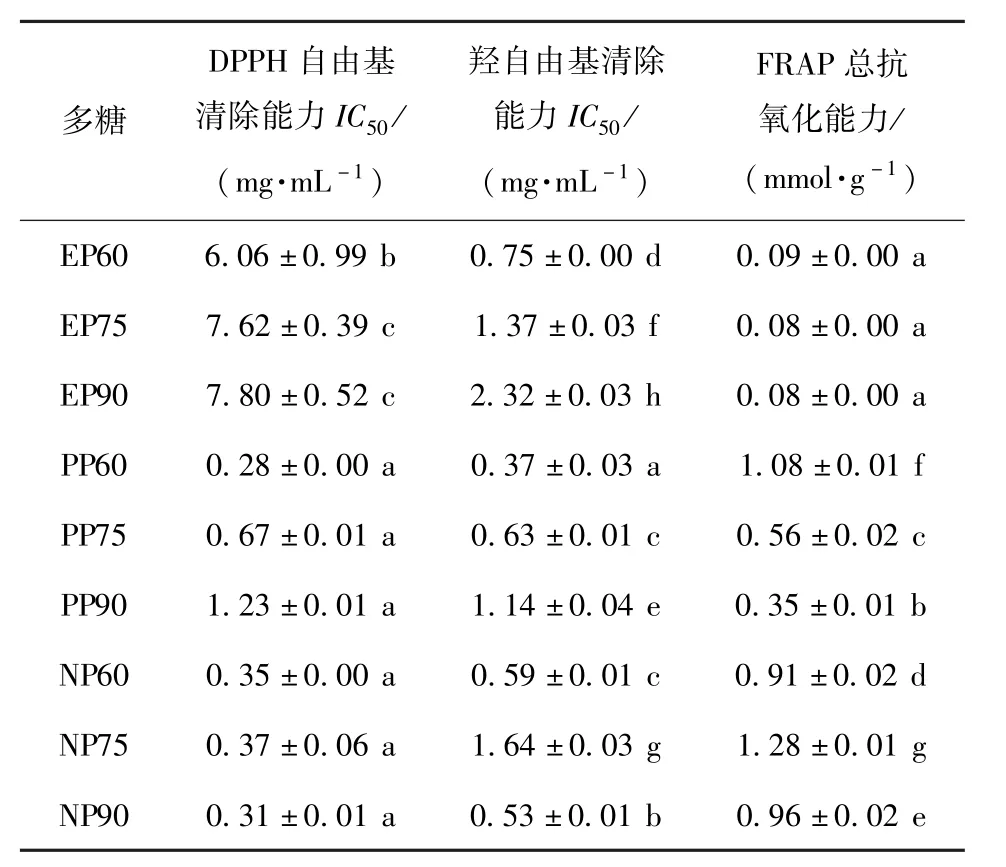
表3 莲藕不同部位粗多糖的抗氧化活性Tab.3 Antioxidant activities of crude polysaccharides from different parts of lotus root
多糖中蛋白质含量对其自由基清除能力的影响尚存在争议,有研究认为蛋白质含量与多糖的自由基清除能力存在显著相关性[10-11],亦有研究表明两者无关联[12-13]。PP60和NP60较强的自由基清除能力可能与其较高的蛋白质含量有关,亦或与较高的分子量相关。川芎多糖和香菇多糖的抗氧化活性,涉及DPPH自由基清除、超氧阴离子清除、羟自由基清除和脂质过氧化抑制能力等,与其分子量大小呈正相关[14]。多糖抗氧化的构效关系受许多复杂因素的影响,包括分子量、蛋白质含量、糖醛酸含量、活性羟基数量、分子构象等,莲藕多糖的结构特征有待于进一步深入解析。
3 结 论
采用乙醇沉淀法制备莲藕不同部位的多糖,所得粗多糖纯度均小于82%,其主要杂质为还原糖,而蛋白质可能主要以结合形式存在。莲藕不同部位中多糖均以1.30~1.63 ku的低分子组分为主,导致不同浓度乙醇分步沉淀所得多糖的分子量梯度分布并不明显,可结合离子交换柱层析和凝胶过滤柱层析对莲藕多糖进一步分离纯化。藕食用部位多糖的抗氧化能力整体弱于藕皮多糖和藕节多糖,尤以DPPH自由基清除能力和FRAP总抗氧化能力较弱,说明藕节和藕皮是莲藕抗氧化活性多糖开发的重要资源。多糖PP60和NP60的抗氧化活性较强,推测可能与相对较高的蛋白质含量和分子量相关,然而,多糖抗氧化的构效关系极为复杂,莲藕多糖单糖组成、糖苷键链接、构象等结构特征还需进一步系统解析。
[1] 熊桂云,童军,刘冬碧,等.湖北省莲藕生产与施肥现状调查[J].湖北农业科学,2011,50(19):3934-3939.
XIONG G Y,TONG J,LIU D B,et al.Present status investigation of production and fertilization on rhizome lotus in Hubei Province[J].Hubei Agricultural Sciences,2011,50(19):3934-3939.
[2] TSURUTA Y,NAGAO K,SHIROUCHI B,et al.Effects of lotus root(the edible rhizome of Nelumbo nucifera)on the development of non-alcoholic fatty liver disease in obese diabetic db/db mice[J].Bioscience,Biotechnology,and Biochemistry,2012,76(3):462-466.
[3] 南京中医药大学.中药大辞典[M].上海:上海科学技术出版社,2006:963.
[4] 严浪,石宝霞,李全宏.莲藕多糖的分离纯化及抗氧化活性研究[J].食品科学,2008,29(4):66-69.
YAN L,SHI B X,LI Q H.Antioxidant properties of polysaccharide extracted and purified from lotus roots promace[J].Food Science,2008,29(4):66-69.
[5] 王瑜,高畅,姜丽艳,等.莲藕多糖的提取及生物活性的研究[J].食品科技,2007(5):113-116.
WANG Y,GAO C,JIANG L Y,et al.Extraction of thelotus roots polysaccharides and their antioxidative effect[J].Food Science and Technology,2007(5):113-116.
[6] 江筠.莲藕中抗氧化成分的抗HIV-1活性及其作用机制研究[D].天津:南开大学,2010.
[7] 罗登宏,周桃英,袁仲,等.莲藕多糖的降血糖活性及对体内抗氧化能力的影响[J].安徽农业科学,2011,39(6):3334-3335.
LUO D H,ZHOU T Y,YUAN Z,et al.Hypoglycemic activity of Rhizoma nelumbinis Nuciferae polysaccharide and its effect on in vivo antioxidant activity[J].Journal of Anhui Agricultural Sciences,2011,39(6):3334-3335.
[8] 张汇,鄢嫣,聂少平,等.黑灵芝不同部位多糖成分分析及抗氧化活性[J].食品科学,2011,32(1): 56-61.
ZHANG H,YAN Y,NIE S P,et al.Monosacchaide composition and antioxidant activity in vitro of polysaccharides from different parts of Ganoderma atrum[J].Food Science,2011,32(1):56-61.
[9] 周桂芬,庞敏霞,陈素红,等.铁皮石斛茎、叶多糖含量及多糖部位柱前衍生化-高效液相色谱指纹图谱比较研究[J].中国中药杂志,2014,39(5):795-802.
ZHOU G F,PANG M X,CHEN S H,et al.Comparison on polysaccharide content and PMP-HPLC fingerprints of polysaccharide in stems and leaves of Dendrobium officinale[J].China Journal of Chinese Materia Medica,2014,39(5):795-802.
[10] LIU F,OOI V E C,CHANG S T.Free radical scavenging activities of mushroom polysaccharide extracts[J]. Life Sciences,1997,60(10):763-771.
[11] CHEN H X,ZHANG M,QU Z S,et al.Antioxidant activities of different fractions of polysaccharide conjugates from green tea(Camellia Sinensis)[J].Food Chemistry,2008,106(2):559-563.
[12] LIN C L,WANG C C,CHANG S C,et al.Antioxidative activity of polysaccharide fractions isolated from Lycium barbarum Linnaeus[J].International Journal of Biological Macromolecules,2009,45(2):33-34.
[13] ZHU B W,WANG L S,ZHOU D Y,et al.Antioxidant activity of sulphated polysaccharide conjugates from abalone(Haliotis discus hannai Ino)[J].European Food Research&Technology,2008,227(6):1663-1668.
[14] YUAN J F,ZHANG Z Q,FAN Z C,et al.Antioxidant effects and cytotoxicity of three purified polysaccharides from Ligusticum chuanxiong Hort[J].Carbohydrate Polymers,2008,74(4):822-827.
[15] ZHA X Q,WANG J H,YANG X F,et al.Antioxidant properties of polysaccharide fractions with different molecular mass extracted with hot-water from rice bran[J]. Carbohydrate Polymers,2009,78(3):570-575.
[16] 孙杰,易阳,王宏勋,等.莲藕多糖的提取工艺优化及理化特性研究[J].食品工业科技,2016,37(12):256-260.
SUN J,YI Y,WANG H X,et al.Optimization of extraction and physicochemical property of polysaccharides from lotus root[J].Science and Technology of Food Industry,2016,37(12):256-260.
[17] 赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8): 534-536.
ZHAO K,XU P J,GU G Y.Study on determination of reducing sugar content using 3,5-dinitrosalicylic acid method[J].Food Science,2008,29(8):534-536.
[18] 王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4): 276-279.
WANG W P,GUO S Y,LI L,et al.Assay study on conetnt of plysacchiardes in Stanuntonia chinensis by phenol-sulfuric acid method[J].Food Science,2007,28(4):276-279.
[19] SMIRNOFF N,CUMBES Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[20] 严浪,张树明,张凡华,等.莲藕渣中多糖的提取及性质初步研究[J].食品科学,2007,28(12):226-230.
YAN L,ZHANG S M,ZHANG F H,et al.Extraction and characteristics of polysaccharides from lotus root pomace[J].Food Science,2007,28(12):226-230.
[21] YANG X B,GAO X D,HAN F,et al.Sulfation of a polysaccharide produced by a marine filamentous fungus Phoma herbarum YS4108 alters its antioxidant properties in vitro[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2005,1725(1):120-127.
[22] KE C L,QIAO D L,GAN D,et al.Antioxidant acitivity in vitro and in vivo of the capsule polysaccharides from Streptococcus equi subsp.zooepidemicus[J].Carbohydrate Polymers,2009,75(4):677-682.
Study on Physicochemical Characteristics and Antioxidant Activities of Polysaccharides from Different Parts of Lotus Root
LI Zhengyi1,LIAN Chengjie1,SUN Jie1,MIN Ting1,2,YI Yang1,2,*
(1.College of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China;2.Hubei Engineering Research Center for Fresh Food,Wuhan 430023,China)
To explore the distribution of polysaccharides with higher antioxidant activities in lotus root,polysaccharides in edible part,peel,and node(i.e.EP60/75/90,PP60/75/90 and NP60/75/90)were respectively isolated using a precipitation method coupled with gradually increased alcohol concentrations.While the basic components,physicochemical characteristics,and antioxidant activities were further analyzed.Polysaccharides from different parts of lotus root showed obvious differences in composition,and edible part polysaccharides(EPs)had lower purities compared with peel polysaccharides(PPs)and node polysaccharides(NPs).Based on high performance molecular-exclusion chromatography,it was found that lotus root polysaccharides were mainly composed of fractions with low molecular weight(1.30-1.63 ku)and less binding protein.The antioxidant evaluations in vitro confirmed that the antioxidant activities of EPs were weaker than those of PPs and NPs,especially DPPH radical scavenging ability and FRAP total antioxidant capacity(p<0.05).The antioxidant activities of PPs could be ordered as PP60>PP75>PP90.Meanwhile,the activities of NP60 and NP90 were matched,which exhibited stronger hydroxyl radical scavenging capacities and weaker FRAP total antioxidant capacities than NP75(p<0.05).The polysaccharides with higher antioxidant activities mainly exist in the peel and node of lotus root,which might be related to binding protein content and molecular weight.
lotus root;polysaccharide;physicochemical characteristics;antioxidant activity
TS201.4
A
10.3969/j.issn.2095-6002.2016.04.004
2095-6002(2016)04-0018-08
(责任编辑:叶红波)
20160702
湖北省科技支撑计划项目(2015BBA203)。
李正一,男,本科生,研究方向为果蔬活性成分分析;
*易 阳,男,副教授,博士,主要从事功能食品方面的研究。通信作者。

