高氧气调包装对宰后猪肉蛋白质氧化、钙蛋白酶活性及蛋白质降解的影响
陈 琳,周光宏,徐幸莲,张万刚
(南京农业大学食品科技学院/肉品加工与质量控制教育部重点实验室/食品安全与营养协同创新中心,南京 210095)
高氧气调包装对宰后猪肉蛋白质氧化、钙蛋白酶活性及蛋白质降解的影响
陈琳,周光宏,徐幸莲,张万刚
(南京农业大学食品科技学院/肉品加工与质量控制教育部重点实验室/食品安全与营养协同创新中心,南京 210095)
【目的】研究高氧气调包装(HiOx,80% O2/20% CO2)对宰后猪肉蛋白质氧化、钙蛋白酶活性及蛋白质降解的影响,探讨高氧气调包装影响猪肉品质的内在机制。【方法】选取12条冷却(4℃)24 h后的杜洛克×长白×约克夏三元杂交猪背最长肌,分别进行高氧气调包装和真空包装(VP),4℃冷库贮藏,分别在1、4、6 d测定羰基含量及分布、巯基含量、肌节变化、钙蛋白酶活性、肌联蛋白及肌钙蛋白-T降解变化。【结果】高氧气调包装组羰基含量高于真空包装组且贮藏第4和6天差异显著(P<0.05)。贮藏第1和4天,高氧气调包装组肌细胞外围出现羰基氧化荧光信号,荧光以靠近细胞膜处密度更高,并且逐渐向细胞内部扩散;贮藏第6天,高氧气调包装组细胞膜呈高亮荧光圈,胞内荧光增强,而真空包装组荧光信号较弱。贮藏第6天,高氧气调包装组巯基含量显著低于真空包装组(P<0.05)。真空包装组宰后肌节M线弱化、A带模糊、肌原纤维Z线断裂;高氧气调包装组肌节结构相对完整。高氧气调包装组在贮藏第1天钙蛋白酶活性显著低于真空包装组(P<0.05);高氧气调包装抑制了肌联蛋白和肌钙蛋白-T的降解,且在贮藏第4和6天差异显著(P<0.05)。【结论】高氧气调包装能够显著提高宰后猪肉蛋白质氧化程度,抑制钙蛋白酶活性发挥及其底物蛋白质的降解。
猪肉;高氧气调包装;真空包装;蛋白质氧化;钙蛋白酶活性;蛋白质降解
0 引言
【研究意义】随着人们生活节奏的加快,包装销售因其高度便捷性受到越来越多消费者的欢迎。高氧气调包装、真空包装以及透氧包装是目前肉制品行业3大主要包装方式。高氧气调包装常以80%O2和20%CO2相混合的方式对肉品进行包装,一方面高浓度氧气的存在可以使冷却肉呈现亮红色,更能刺激消费者的购买欲;另一方面,二氧化碳能够抑制微生物生长而延长商品货架期[1-2]。然而高氧气调包装的富氧环境不可避免会带来蛋白质氧化的问题[3],加强此方面的研究,对探讨高氧气调包装影响猪肉品质的内在机制具有重要意义。【前人研究进展】前期研究表明氧化会导致蛋白质羰基化,一些必需氨基酸如精氨酸、苏氨酸、赖氨酸结构上会发生不可逆转的氧化修饰,使得蛋白质功能丧失[4-5]。现已证实[6-7],蛋白质氧化能够导致肽链及功能基团结构改变、蛋白酶活性丧失、影响蛋白水解敏感性,以及促进分子间交联、聚集产生。动物宰后肌肉成熟过程会发生一系列复杂的生理生化变化。其中,肌原纤维蛋白以及一些肌肉骨架蛋白的降解,对维持肌原纤维结构完整性十分重要。蛋白水解会破坏肌原纤维结构的完整性,改变肌细胞的有序结构,影响肌细胞间收缩与传导过程,从而影响肌细胞内水分含量、分布以及肉质嫩化[8-9]。而这些蛋白被认为是钙蛋白酶所降解的底物蛋白[10]。宰后早期钙蛋白酶活性的变化被认为是调控肉品质改善的关键原因之一[10-11]。然而,钙蛋白酶的活性位点上存在组氨酸以及含有巯基的半胱氨酸残基,这些是极易被氧化的基团,从而使钙蛋白酶因氧化而丧失活性[12]。ROWE等[13]对牛肉进行辐照氧化处理,证实了蛋白质氧化可通过抑制钙蛋白酶活性来降低宰后成熟过程中蛋白质降解程度,辐照氧化组嫩度显著低于未辐照组,且肌间线蛋白和肌钙蛋白-T降解产物更少,钙激活酶的自溶程度较低。然而,蛋白质氧化调控宰后肉品品质的具体机制尚不清楚。【本研究切入点】目前,在肉的成熟过程中,肌原纤维蛋白和与其降解相关的关键酶被氧化后,底物蛋白的结构、降解情况变化以及关键酶的活性变化尚未被阐明,有关高氧气调包装下蛋白质氧化影响猪肉钙蛋白酶活性、底物蛋白质降解等尚无报道。【拟解决的关键问题】本试验以高氧气调包装和真空包装的杜洛克×长白×约克夏三元杂交猪背最长肌为研究对象,从蛋白质氧化、钙蛋白酶活性及蛋白质降解3方面揭示高氧气调包装影响宰后猪肉成熟品质的内在机制,为指导高氧气调包装方式的生产应用提供理论依据。
1 材料与方法
试验于2015年在南京农业大学食品科技学院进行。
1.1材料与试剂
试验以杜洛克×长白×约克夏三元杂交商品猪背最长肌为研究对象。采样6头6月龄、活体重为(100±5)kg健康商品猪,于江苏淮安苏食屠宰场宰杀。在4℃冷库排酸24 h,取左右背最长肌共12条。
聚丙烯热成型托盘、封口膜和真空包装袋,快卫尔(中国)有限公司;DNPH(2,4-二硝基苯肼,2,4-dinitrophenylhydrazine)和DTNB(5,5'-二硫代-2-硝基苯甲酸,5,5'-Dithiobis-2-nitrobenzoic acid),上海阿拉丁试剂有限公司;盐酸胍(国药集团化学试剂公司);TCA(三氯乙酸,trichloroacetic acid),上海凌峰化学试剂有限公司;CY3-羊抗兔IgG(BA1032)、山羊及兔血清,武汉博士得公司;DNPH抗体(D9556)和肌钙蛋白-T抗体(T6277),美国Sigma-Aldrich公司;HRP标记羊抗鼠IgG(ab6789),英国Abcam公司;ECL化学发光试剂盒(NCI4106)和BCA试剂盒(23250),美国Thermo公司;聚丙烯酰胺凝胶电泳缓冲液(161-0732)和聚丙烯酰胺凝胶电泳转移液(161-0734),美国Bio-Rad公司;蛋白预制凝胶(W002-6),南京建成化学试剂公司;其他试剂均为市售分析纯。
1.2仪器与设备
Smart 500气调包装机,西班牙Ulma包装公司;真空包装机,美国快卫尔包装公司;H-7650透射电子显微镜,日本日立公司;LSM 700 META激光共聚焦显微镜,德国蔡司公司;CM1950超薄冷冻切片机,德国Leica公司;PowerPac 1000垂直电泳仪和Mini-protein Tetra Cell电泳设备,美国Bio-Rad公司;ImageQuant LAS 4000分子成像系统和Imagescanner凝胶成像系统,美国GE公司;UV-2450紫外分光光度计,日本岛津公司;Spectral Max M2e酶标仪,美国MDC公司;Ultra Turrax T25 BASIS高速匀浆机,德国IKA公司;Avanti J-E落地式高速冷冻离心机,美国Beckman Coulter公司;TW20水浴锅,德国Julabo公司;低温冰柜,日本Hitachi公司。
1.3方法
1.3.1样品包装剔除背最长肌表面筋膜、脂肪及结缔组织,均分为3块,修剪成厚约2.5 cm、重400 g左右的肉块,肉样随机分为两组分别进行高氧气调包装和真空包装。高氧气调包装:首先将样品放入聚丙烯热成型托盘(6 cm×23 cm×13 cm)中,采用填充比例为80% O2/20% CO2、充气压力为105 kPa的混合气体,于140℃封口(标准大气压下封口膜透氧率<1 cm3·m-2·d-1)完成高氧气调包装。真空包装:采用聚丙烯材质的真空包装袋,标准大气压下透氧率<30 cm3·m-2·d-1,真空包装机抽真空至气压<1 kPa,抽空30 s,100℃热封5 s。两种包装的肉样在4℃冷库中贮藏,在第1、4、6天取样进行指标测定。
1.3.2肌原纤维蛋白和肌浆蛋白的制备肌原纤维蛋白提取参考XIONG[14]并稍作修改。将包装成熟1、4、6天肉样取出,称取1 g剔除脂肪及筋膜的样品,加入5倍体积的肌原纤维蛋白提取液(10 mmol·L-1磷酸盐缓冲液、100 mmol·L-1氯化钠、2 mmol·L-1氯化镁、1 mmol·L-1EGTA,pH 7.0)。4℃匀浆30 s,10 s间隔一次,转速为15 000 r/min。匀浆液以1 000×g转速离心10 min,取沉淀。以上步骤重复3次。离心后沉淀中加入5倍体积的100 mmol·L-1氯化钠洗脱液。15 000 r/min转速匀浆30 s,10 s间隔一次。匀浆液以1 000×g转速离心10 min,取沉淀,以上步骤重复3次。离心后所得沉淀即为肌原纤维蛋白。肌原纤维蛋白与电泳上样缓冲液(125 mmol·L-1Tris-base、4% SDS、20%甘油、0.5% β-巯基乙醇、0.1%溴酚蓝,pH 6.8)充分混合,BCA试剂盒法测定肌原纤维蛋白浓度后统一蛋白质浓度为7 mg·mL-1。蛋白质溶液按体积比1∶1与电泳上样缓冲液混合,50℃水浴20 min。分装样品,-80℃存放用于蛋白电泳检测。
肌浆蛋白的提取参考VEISETH等[15]的方法并稍作修改。将包装后成熟1 d的肉样取出,称取1 g剔除筋膜和脂肪的肉样,加入3倍体积4℃预冷的活性蛋白提取液(100 mmol·L-1Tris-base、0.1% β-巯基乙醇、10 mmol·L-1EDTA,pH 8.3),15 000 r/min匀浆2次,每次15 s,5 s间隔一次。匀浆液以转速15 000 ×g,4℃离心30 min,所得上清通过滤纸过滤后,BCA试剂盒法测定蛋白质浓度。去离子水调节统一蛋白质浓度为8 mg·mL-1,按蛋白体积∶活性电泳上样缓冲液(150 mmol·L-1Tris-base、20%甘油、0.75% β-巯基乙醇、0.02%溴酚蓝,pH 6.8)=1∶1进行稀释。混合后样品进行分装,-80℃冷冻用于钙蛋白酶活性检测。
1.3.3羰基含量测定参考ZHANG等[7]的方法并稍作修改。称取0.5 g剔除脂肪及筋膜的肉样,加入5 mL焦磷酸盐缓冲液匀浆3次,每次10 s,转速最高为15 000 r/min。取0.5 mL匀浆液置于2个2 mL离心管中,加入0.5 mL 20%三氯乙酸(TCA),振荡混匀后以12 000×g离心5 min。除去上清液,沉淀加入0.5 mL 10% TCA振荡混匀后再次离心,离心条件同上。对照组将离心后沉淀加0.5 mL 2 mol·L-1HCl,试验组加0.5 mL 10 mmol·L-12,4-二硝基苯肼(DNPH)。暗处理30 min,每隔10 min迅速取出混匀10 s。待DNPH与羰基充分反应,对照组与试验组加入0.5 mL 20% TCA,振荡混匀后相同条件离心。沉淀用10 mmol·L-1HCl(溶解于1∶1(vol/vol)乙醇/乙酸乙酯)重复洗脱3次。所得沉淀加入1 mL 6 mol·L-1盐酸胍(溶解在20 mmol·L-1磷酸二氢钾溶液,pH 2.3),4℃震荡过夜。未溶解物12 000×g离心5 min,上清液在紫外370 nm处测定吸光度。消光系数为22 000 L·mol-1·cm-1,羰基含量用每毫克蛋白里含有羰基的纳摩尔数表示。
1.3.4羰基肌细胞内分布测定采用免疫荧光法,参考ASTRUC等[16]的方法并做一定修改。将包装后成熟1、4、6 d的肉样取出,随机选取肉样区域沿着平行于肌原纤维方向将肌肉切成肉条并立即浸泡于液氮中30 s,每个肉样取6个平行。冰冻超薄切片机切取10 μm厚切片,37℃烘干2 h后与0.04% DNPH(溶解在20 mmol·L-1磷酸盐和0.1 mol·L-1氯化钠的混合液中,pH 6.0)暗处反应16 h。反应结束后样品用含0.1%吐温的PBS(pH 6.75)重复冲洗(5 min,6次)。37℃兔血清一次封闭切片1 h。去除封闭液,滴加1∶100稀释DNPH多克隆抗体孵育,4℃反应过夜。一抗孵育结束后,切片样品用含0.1%吐温的PBS(pH 6.75)重复冲洗(5 min,6次),37℃山羊血清二次封闭1 h。去除封闭液,滴加CY3标记的羊抗兔免疫球蛋白溶液(1∶50)避光孵育1 h,PBS漂洗(5 min,6次)。采用激光共聚焦显微镜在激发波长555 nm、发射波长570 nm下,将样品放大200倍,统一曝光时间下观察羰基在肌细胞内分布。
1.3.5巯基含量测定巯基测定参考ELLMAN[17]的方法,并稍作修改。0.5 mL肌原纤维蛋白溶液(4 mg·mL-1)加入4.5 mL缓冲液(50 mmol·L-1磷酸盐缓冲液、10 mmol·L-1EDTA、0.6 mol·L-1氯化钾,pH 7.0),与0.5 mL 10 mmol·L-15、5-二硫代-2-硝基苯甲酸(0.2 mol·L-1磷酸盐缓冲液配置,pH 8.0)混合均匀。混合液在40℃水浴中反应25 min,412 nm处测定吸光度值。摩尔吸光系数为136 000 L·mol-1·cm-1,活性巯基含量用每毫克蛋白里含有巯基的纳摩尔数表示。
1.3.6电镜观察肌节变化参考徐舶等[18]方法,将成熟1、4、6 d的样品沿着肌原纤维方向切成约0.5 cm×0.5 cm×0.5 cm的肉条,肉条浸泡在2.5%戊二醛中(20 mmol·L-1磷酸缓冲液溶解,pH 7.2)初步固定7 d,每隔一天更新戊二醛固定液。样品用2%饿酸二次固定,固定完成后经磷酸缓冲液反复冲洗,梯度乙醇脱水,100%丙酮置换,最后采用Spurr树脂浸透包埋。超薄切片机进行切片,日立H-7650透射显微镜将样本放大3 000倍观察肌节变化。
1.3.7钙蛋白酶活性测定参考酪蛋白酶原法[19],采用4%的浓缩胶(丙烯酰胺∶甲叉丙烯酰胺=75∶1, 125 mmol·L-1Tris-base(pH 6.8),0.05%过硫酸铵,0.05%四甲基乙二胺)和12.5%的分离胶(丙烯酰胺∶甲叉丙烯酰胺=75∶1,375 mmol·L-1Tris-base(pH 8.8),2.1 mmol·L-1酪蛋白,0.05%过硫酸铵,0.05% 四甲基乙二胺)。缓慢加入4℃预冷的电泳缓冲液(25 mmol·L-1Tris-base,192 mmol·L-1甘氨酸,1 mmol·L-1EDTA,0.05% β-巯基乙醇),接通电源100 V,预跑15 min后上样。蛋白样品在100 V、4℃环境电泳6 h至电泳结束。活性电泳反应液(50 mmol·L-1Tris-base、 5 mmol·L-1氯化钙、0.1% β-巯基乙醇,pH 7.8)室温孵育胶体前1 h,每20 min更换活性电泳反应液。继续孵育16 h后胶体进行染色和脱色,凝胶成像仪拍照。钙蛋白酶活性条带采用Quanity one分析软件进行半定量分析。
1.3.8肌联蛋白和肌钙蛋白-T降解测定肌联蛋白采用5%的连续聚丙烯酰胺连续电泳(丙烯酰胺∶甲叉丙烯酰胺=100∶1,1.5 mol·L-1Tris-base(pH 8.0),0.1% SDS,0.05%过硫酸铵,0.05%四甲基乙二胺)。每块胶体恒流4.5 mA电泳20 h至电泳结束[20]。肌联蛋白胶体采用改进型考马斯亮蓝染色和脱色[21]。肌钙蛋白-T的聚丙烯酰胺变性凝胶电泳采用浓缩胶浓度4%、分离胶浓度10%的蛋白预制胶。恒压80 V电泳30 min后,调整电压为120 V至溴酚蓝标记跑至胶体底部,电泳结束[22]。取出肌钙蛋白-T的胶体通过湿法转印技术将蛋白转移到聚偏氟乙烯膜上[23]。转印条件为恒压70 V,转印70 min。转印完成后将聚偏氟乙烯膜正面放入含有5%牛血清白蛋白的TBST(20 mmol·L-1Tris-base,137 mmol·L-1氯化钠,5 mmol·L-1氯化钾,0.05%吐温20)溶解液中,室温封闭2 h。肌钙蛋白-T抗体(1∶500)4℃继续孵育16 h。TBST反复漂洗(5 min,6次)后将聚偏氟乙烯膜置于HRP标记二抗(1∶500)中,室温反应2 h。TBST反复漂洗(5 min,6次),膜表面滴加化学显色剂ECL,暗箱反应6 min后终止反应,凝胶成像仪扫描并拍照。蛋白免疫印记条带采用Quanity one分析软件进行半定量分析。
1.4数据分析
数据采用SAS 8.1统计软件进行方差分析,并通过Duncan's法比较处理组间差异,差异显著性水平为P<0.05,数据以均值±标准差(means±SD,n=6)表示。
2 结果
2.1高氧气调包装对猪肉羰基含量及肌细胞内分布的影响
图1结果显示,贮藏第1天处理组间羰基含量无显著差异(P>0.05),贮藏第4天和第6天,高氧气调包装组羰基含量显著高于真空包装组(P<0.05)。
激光共聚焦显微镜观察结果见图2,其中阴性对照组肌细胞形态比较规则,胞膜完整,细胞饱满,细胞间隙致密,无荧光着色。图示红色荧光信号部分即特异性结合的氧化羰基。高氧气调包装组和真空包装组荧光信号在贮藏期间均呈现动态变化。宰后贮藏第1天,高氧气调包装组视野下部分肌细胞外周近胞膜处出现氧化荧光信号,荧光分布不均匀。宰后贮藏第4天,高氧气调包装组荧光多分布于细胞膜边缘,以细胞靠膜处密度更高,逐渐向胞内扩散呈暗红色。真空包装组荧光分布于细胞膜包围的很小区域,荧光信号较弱。宰后贮藏第6天,高氧气调包装组肌细胞外周呈高亮荧光圈,细胞内部荧光信号增强。肌细胞间荧光信号分布基本均匀。此外,相对于高氧气调包装组,真空包装组荧光信号较弱,分布多集中在细胞膜周围,且肌细胞变形严重,肌细胞形态出现脱水、皱缩,骨架结构坍塌,细胞间裂隙变大。
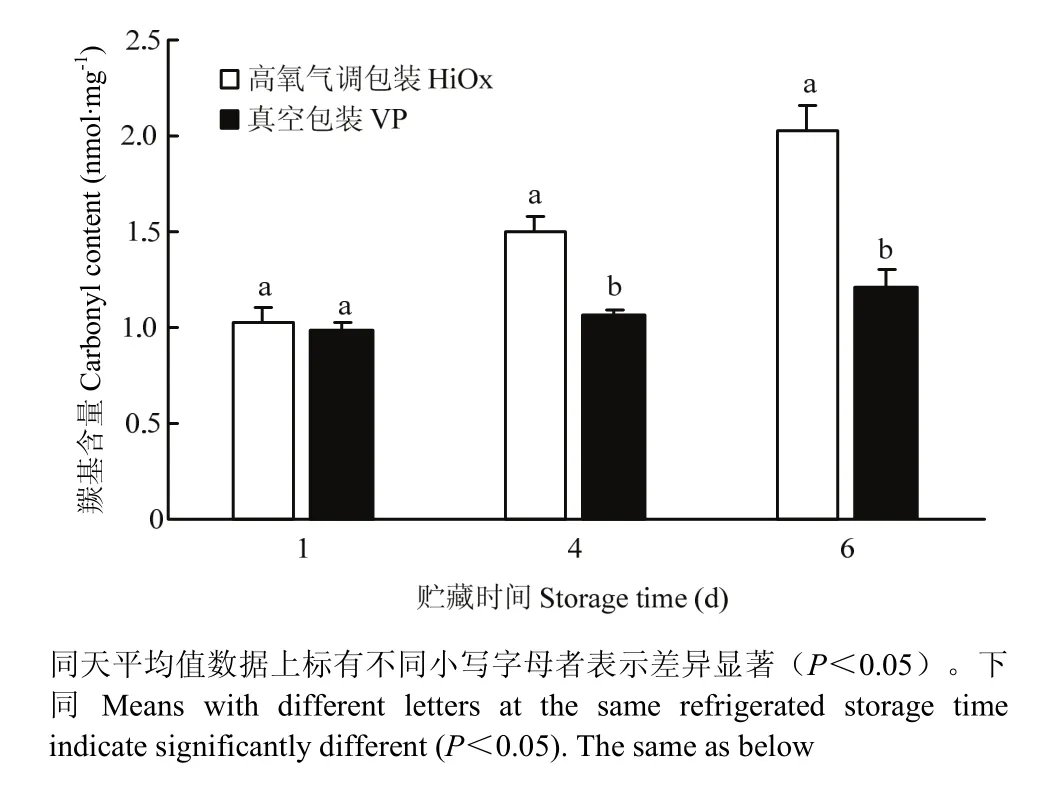
图1 高氧气调包装对宰后贮藏期间猪肉羰基含量的影响Fig. 1 Effects of HiOx on carbonyl content of pork during postmortem refrigerated storage
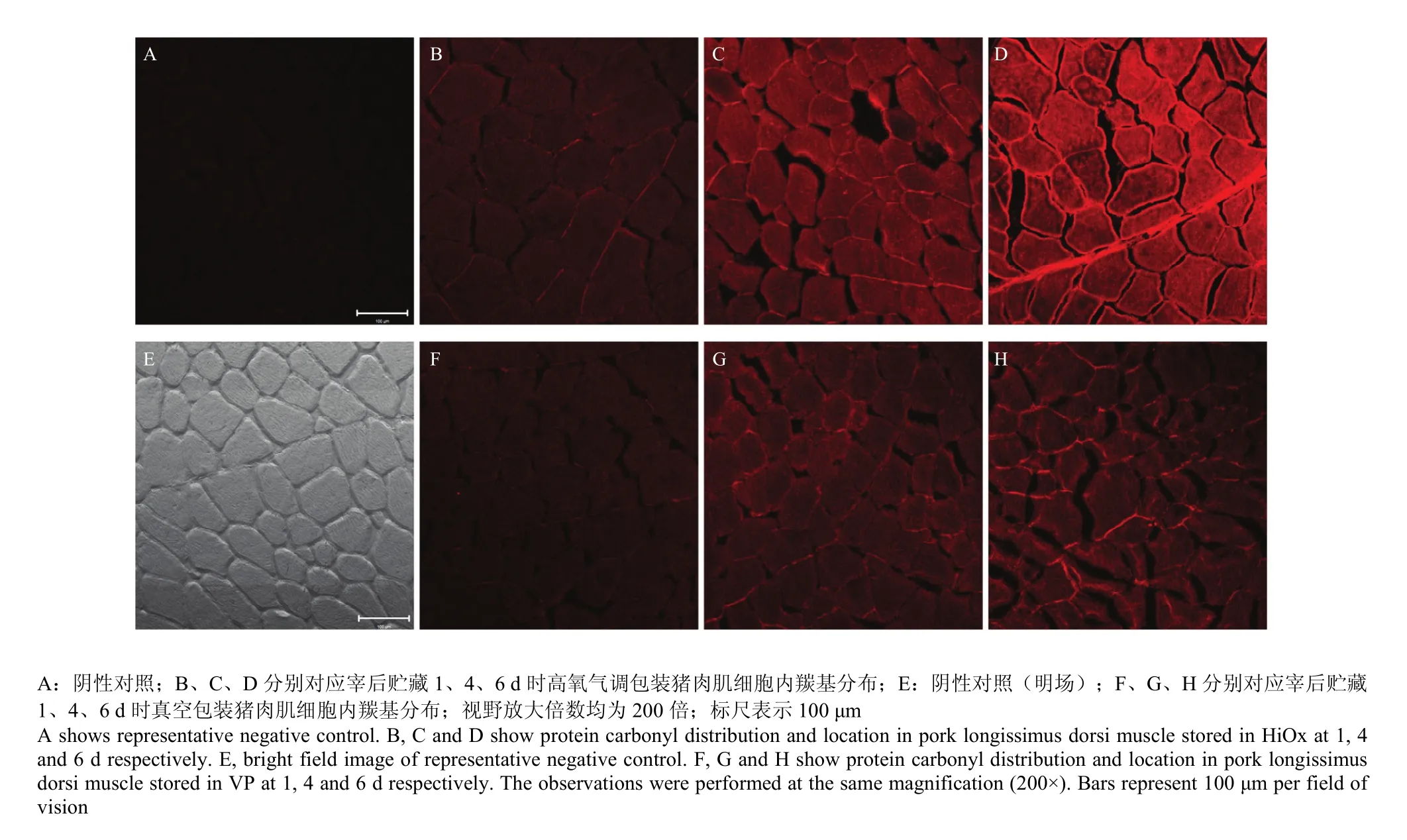
图2 高氧气调包装和真空包装猪肉肌细胞内羰基分布的免疫荧光显微图Fig. 2 Fluorescence microscopic images showing protein carbonyl distribution from pork longissimus dorsi muscle in HiOx and VP during postmortem refrigerated storage
2.2高氧气调包装对猪肉活性巯基含量的影响
由图3可知,宰后贮藏期间高氧气调包装组的活性巯基含量均低于真空包装组。在贮藏第6天,高氧气调包装组活性巯基含量与真空包装组差异显著(P<0.05)。
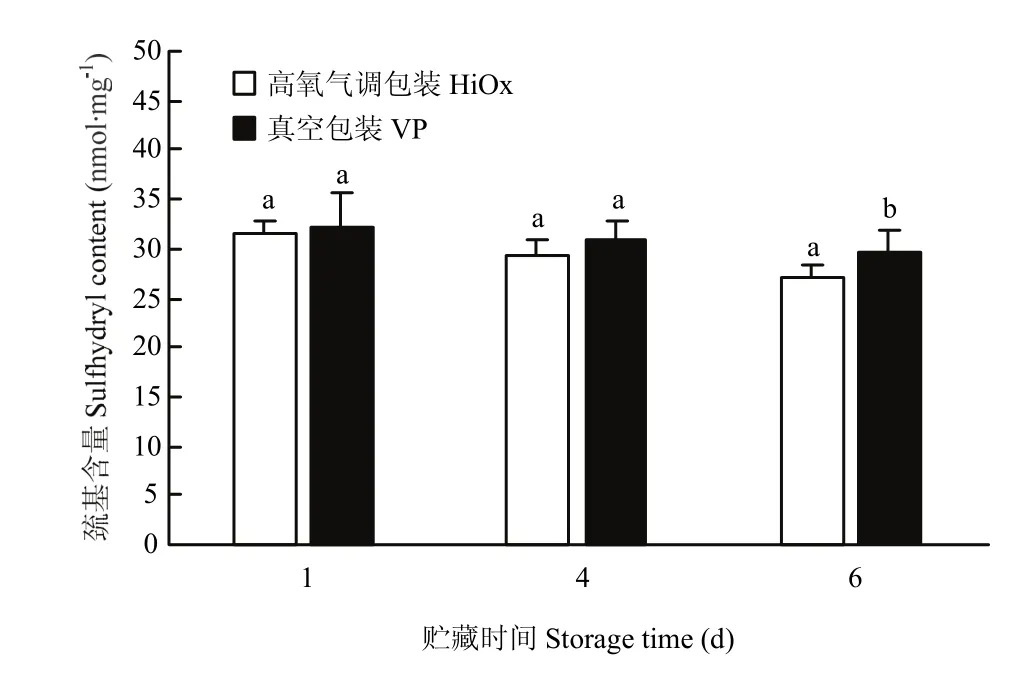
图3 高氧气调包装对宰后猪肉活性巯基含量的影响Fig. 3 Effects of HiOx on free sulfhydryl content of pork during postmortem refrigerated storage
2.3高氧气调包装对猪肉肌节的影响
由图4可知,高氧气调包装和真空包装组肌原纤维超微结构在宰后贮藏期间均发生显著变化。宰后贮藏第1天,高氧气调包装组和真空包装组A带和I带清晰可辨,Z线和M线均保持完整,肌原纤维之间连接紧密,处理组间无明显差异。宰后贮藏第4天,相对于高氧气调包装组,真空包装组Z线附近发生较为明显断裂,Z线周围的细丝与Z线的连接开始弱化,M线也出现弱化。宰后贮藏第6天,真空包装相对于高氧气调包装,大量肌节出现Z线的裂解,肌节分裂成细丝状,A带模糊,M线基本消失,肌节结构遭到破坏。肌节形态学结果表明,高氧气调包装抑制了宰后猪肉成熟过程。

图4 高氧气调包装和真空包装宰后猪肉肌节变化的透射电镜图Fig. 4 Transmission electron micrographs showing sarcomere changes of pork longissimus dorsi muscle in HiOx and VP during postmortem refrigerated storage
2.4高氧气调包装对猪肉钙蛋白酶活性的影响
从图5和表1可知,高氧气调包装组在宰后贮藏第1天μ-钙蛋白酶条带相对光密度值显著高于真空包装组(P<0.05),即相对于真空包装组,高氧气调包装组μ-钙蛋白酶活性显著低于真空包装组(P<0.05),高氧气调包装组猪肉在宰后早期μ-钙蛋白酶活力的发挥受到抑制。
2.5高氧气调包装对猪肉蛋白质降解的影响
2.5.1高氧气调包装对猪肉肌联蛋白降解的影响由图6和表2可知,在宰后贮藏1 d,高氧气调包装组和真空包装组降解条带含量没有明显差异(P>0.05)。在宰后贮藏第4和6天,真空包装组肌联蛋白降解条带含量显著低于高氧气调包装组(P<0.05),即高氧气调包装组抑制了宰后猪肉肌联蛋白的降解。

图5 高氧气调包装对贮藏1天猪肉钙蛋白酶活性的影响Fig. 5 Effects of HiOx on calpain activity at 1 d of postmortem refrigerated storage

表1 高氧气调包装和真空包装猪肉宰后贮藏第1天钙蛋白酶活性Table 1 μ-Calpain activity of pork in HiOx and VP at 1 d of postmortem refrigerated storage

图6 高氧气调包装对猪肉肌联蛋白降解的影响Fig. 6 Effects of HiOx on degradation of titin at 1, 4 and 6 d of postmortem refrigerated storage

表2 高氧气调包装和真空包装猪肉肌联蛋白蛋白质降解的变化Table 2 Changes of degraded titin of pork in HiOx and VP
2.5.2高氧气调包装对猪肉肌钙蛋白-T降解的影响由图7和表3可知,在贮藏第4天和第6天,高氧气调包装组中肌钙蛋白-T 30 kDa降解产物含量显著低于真空包装组(P<0.05),而贮藏第1天,高氧气调包装对肌钙蛋白-T 30 kDa的降解产物含量并无显著影响(P>0.05)。

图7 高氧气调包装对宰后猪肉贮藏期间肌钙蛋白-T降解的影响Fig. 7 Effects of HiOx on degradation of troponin-T at 1, 4 and 6 d of postmortem refrigerated storage

表3 高氧气调包装和真空包装猪肉肌钙蛋白-T的降解变化Table 3 Changes of degraded troponin-T of pork in HiOx and VP
3 讨论
蛋白质氧化指由氧分压产生的活性氧(ROS)与蛋白质反应导致蛋白共价修饰[24]。肌肉蛋白质在ROS作用下,某些特定氧基酸残基发生反应,导致蛋白质结构变化,使得蛋白质与氧化物亲和力加强,易于产生水解、交联、聚合,从而损害肌细胞功能[25]。蛋白质氧化损伤反应涉及蛋白质羰基的产生,羰基生成是一个复杂的过程。STADTMAN[26]认为羰基生成是由活性氧攻击氨基酸自由氨基或亚氨基,经反应最终生成NH3和相应羰基衍生物。另外,ROS所致蛋白质肽链断裂,在断裂处也可产生羰基。ZAKTYS-WALIWANDER等[22]发现高氧气调包装的牛肉在4℃贮藏8 d和14 d的羰基含量均显著高于真空包装组,同时蛋白质氧化能够抑制牛肉的嫩化。DELLES等[27]同样发现高氧气调包装相对于真空包装和透氧包装,显著增加了猪肉蛋白质羰基含量,且证实了蛋白质氧化是解释宰后猪肉较差持水力的原因之一。这与本研究结果一致,由羰基含量反映的肽链、氨基酸结构和功能的改变、蛋白质氧化程度增加提示了影响宰后成熟肉品质的可能原因。ASTRUC等[16]认为,相对于通过羰基含量评价蛋白质氧化程度,通过激光共聚焦显微镜观察羰基在肌细胞内的荧光分布,更能清楚地了解肌细胞氧化通路的动态变化。本试验中,高氧气调包装组比真空包装组较先出现蛋白质氧化,且氧化荧光信号集中于肌细胞膜边缘,逐渐向细胞内部扩散,肌细胞间荧光信号分布相对均匀。ASTRUC[16]试验发现宰后动物体内蛋白质氧化起始于细胞膜;这主要因为细胞膜是磷脂双分子层,其富含的多不饱和脂肪酸(可保持细胞膜的相对流动性以保证细胞正常生理功能)极易被氧化,膜上蛋白质又因接近磷脂双分子层,由脂肪氧化形成的羟自由基能够夺取蛋白质分子的氢离子,使得细胞膜上蛋白质开始了与脂肪氧化类似的自由基链式反应[28]。ROS从肌细胞膜向细胞内部传递的过程中肌浆蛋白和肌原纤维蛋白逐渐氧化。
巯基是蛋白质残基中最具有反应活性的基团,极易被氧化为二硫键、次磺酸、亚磺酸及磺酸,或被一氧化氮亚硝基化。LUND等[6]通过对肌球蛋白的重链进行一维电泳时发现,蛋白质分子间通过二硫键交联、聚集,是巯基含量降低的主要原因之一。此外,目前已鉴定了一大批易受氧化还原调控的蛋白质,其活性部位均含有巯基基团,通过对巯基的修饰可以显著改变细胞内的信号转导[29-30]。HUFF-LONERGAN等[8]报道,钙蛋白酶通过降解对细胞有序性和完整性十分重要的肌原纤维蛋白和细胞骨架蛋白从而调控牛肉嫩度和猪肉的保水性。然而钙蛋白酶活性区域的巯基极易被氧化形成二硫键,导致钙激活酶失活,底物肌原纤维蛋白降解受到抑制,肌肉细胞的有序性和完整性遭到破坏。因此,蛋白质巯基完全可以作为影响细胞内氧化还原信号转导过程的更直接、更相关的“探针”。本研究发现,由活性巯基含量降低反映的高氧气调包装下氧化程度增加,与羰基的结果相一致。
在宰后成熟过程中,蛋白质氧化反应主要包括肌原纤维蛋白和相关酶系统氧化,这些氧化都是通过改变肌原纤维的降解从而影响肉品品质。其中,钙蛋白酶能够调控肌原纤维蛋白以及一些肌肉骨架蛋白的降解,例如肌联蛋白、伴肌动蛋白、肌钙蛋白-T、整联蛋白、肌间线蛋白等[31]。目前普遍认为肉类在宰后成熟过程中成熟品质的改善主要归功于这些蛋白质的降解。有关钙蛋白酶系统动力学研究发现,氧化能改变宰后动物体内的离子水平,使得钙蛋白酶活性改变,从而导致底物降解情况发生改变[10]。此外,钙蛋白酶活性的发挥必须保证其活性区域还原性。LAMETSCH等[12]发现μ-钙蛋白酶半胱氨酸活性区域对氧化环境十分敏感,钙激活酶肽段残基92—114间存在二级结构螺旋,其可伸展性缩短Cys 108与Cys 115空间距离,从而为活性区域Cys 108和Cys 115之间形成二硫键提供可能,导致钙蛋白酶活性丧失。本研究表明,由羰基含量及分布、巯基含量、肌节变化反映的蛋白质氧化增加,钙蛋白酶活性区域极易受到氧化攻击,蛋白质结构破坏,从而抑制了钙蛋白酶功能活性发挥。
μ-钙蛋白酶活力可以预测宰后成熟过程中肌原纤维蛋白以及肌肉骨架蛋白的降解[9,11,31]。不论是μ-钙蛋白酶被氧化还是其底物蛋白被氧化,均会对肉类宰后成熟品质产生影响。肌联蛋白(titin)是肌细胞骨架蛋白中含量最多且分子量最大的蛋白,位于M线和Z线之间,其C末端与M线相接,N末端是Z线的组成部分,几乎横跨了半个肌节[20,32]。titin将粗丝维持在肌节的中央,具有保持粗丝稳定、调节粗丝收缩、保持肌节及肌细胞完整性等功能。肌钙蛋白-T(troponin-T)是肌钙蛋白和原肌球蛋白相结合亚基,对钙离子具有较高的敏感性,它能与原肌球蛋白结合调节横纹肌的收缩。肌肉宰后成熟过程中,troponin-T由分子量35 kDa产生28—30 kDa的特征降解产物。目前,troponin-T的降解特征产物已作为预测肉品成熟品质的重要指标之一[33]。FU等[34]报道,高氧气调包装的宰后成熟第4—7天,牛肉的μ-钙蛋白酶活性显著低于真空包装和透氧包装组,且troponin-T的降解受到抑制。本试验也证实高氧气调包装能够通过抑制宰后猪肉早期μ-钙蛋白酶活性的发挥,对troponin-T和titin在宰后贮藏第4天和第6天的降解具有显著抑制作用。肌原纤维蛋白降解弱化一定程度上也解释了高氧气调包装下宰后肌节超微形态的改变。肌节是组成肌原纤维的基本单位,高氧气调包装能够抑制猪肉肌原纤维蛋白及细胞骨架蛋白的降解,体现在连接Z线和M线的titin降解产物变少,构成骨骼肌完整细丝的troponin-T降解弱化,进而抑制Z线附近断裂,维持Z线周围细丝与Z线间的连接,阻碍肌原纤维经宰后成熟过程中的小片化,保持肌节结构的相对完整性。
4 结论
高氧气调包装能够增加宰后猪肉羰基含量,扩大羰基在肌细胞内分布,降低活性巯基含量,加剧宰后猪肉蛋白质氧化。同时高氧气调包装具有抑制早期μ-钙蛋白酶活性发挥,抑制肌联蛋白和肌钙蛋白-T等关键肌原纤维蛋白的降解,阻碍宰后猪肉肌节成熟的作用。
References
[1] MCMILLIN K W. Where is MAP Going? A review and future potential of modified atmosphere packaging for meat. Meat Science,2008, 80: 43-65.
[2] CLAUSEN I, JAKOBSEN M, ERTBJERG P, MADSEN N T. Modified atmosphere packaging affects lipid oxidation, myofibrillar fragmentation index and eating quality of beef. Packaging Technology and Science, 2009, 22(2): 85-96.
[3] CHEN L, ZHOU G H, ZHANG W G. Effects of high oxygen packaging on tenderness and water holding capacity of pork through protein oxidation. Food and Bioprocess Technology, 2015, 8(11),2287-2297.
[4] REFSGAARD H H F, TSAI L, STADTMAN E R. Modifications of proteins by polyunsaturated fatty acid peroxidation products. Proceedings of the National Academy of Sciences of the USA, 2000,97(2): 611-616.
[5] AMICI A, LEVINE R L, TSAI L, STADTMAN E R. Conversion of amino acid residues in proteins and amino acid homopolymers to carbonyl derivatives by metal-catalyzed oxidation reactions. Journal of Biological Chemistry, 1989, 264(6): 3341-3346.
[6] LUND M N, HEINONEN M, BARON C P, ESTEVEZ M. Protein oxidation in muscle foods: A review. Molecular Nutrition & Food Research, 2011, 55(1): 83-95.
[7] ZHANG W G, XIAO S, AHN D U. Protein oxidation: basic principles and implications for meat quality. Critical Reviews in Food Science and Nutrition, 2013, 53(11): 1191-1201.
[8] HUFF-LONERGAN E, LONERGAN S M. Mechanisms of waterholding capacity of meat: The role of postmortem biochemical and structural changes. Meat Science, 2005, 71(1): 194-204.
[9] HUFF-LONERGAN E, MITSUHASHI T, BEEKMAN D D,PARRISH F C, OLSON D G, ROBSON R M. Proteolysis of specific muscle structural proteins by mu-calpain at low pH and temperature is similar to degradation in postmortem bovine muscle. Journal of Animal Science, 1996, 74(5): 993-1008.
[10] GOLL D E, THOMPSON V F, LI H, WEI W E I, CONG J. The calpain system. Physiological Reviews, 2003, 83(3): 731-801.
[11] ZHANG W G, LONERGAN S M, GARDNER M A, HUFFLONERGAN E. Contribution of postmortem changes of integrin,desmin and μ-calpain to variation in water holding capacity of pork. Meat Science, 2006, 74(3): 578-585.
[12] LAMETSCH R, LONERGAN S, HUFF-LONERGAN E. Disulfide bond within µ-calpain active site inhibits activity and autolysis. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2008,1784(9): 1215-1221.
[13] ROWE L J, MADDOCK K R, LONERGAN S M, HUFFLONERGAN E. Oxidative environments decrease tenderization of beef steaks through inactivation of μ-calpain. Journal of Animal Science, 2004, 82(11): 3254-3266.
[14] XIONG Y L. Role of myofibrillar proteins in water-binding in brine-enhanced meats. Food Research International, 2005, 38(3): 281-287.
[15] VEISETH E, SHACKELFORD S D, WHEELER T L, KOOHMARAIE M. Effect of postmortem storage on mu-calpain and m-calpain in ovine skeletal muscle. Journal of Animal Science, 2001, 79(6): 1502-1508.
[16] ASTRUC T, MARINOVA P, LABAS R, GATELLIER P, SANTÉLHOUTELLIER V. Detection and localization of oxidized proteins in muscle cells by fluorescence microscopy. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9554-9558.
[17] ELLMAN G L. Tissue sulfhydryl groups. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[18] 徐舶, 周光宏, 徐幸莲, 李春保. 不同部位鹿肉在宰后成熟过程中超微结构的变化.南京农业大学学报, 2008, 31(1): 107-111.
XU B, ZHOU G H, XU X L, LI C B. Changes of ultrastructure in different part of venison during postmortem aging. Journal of Nanjing Agricultural University, 2008, 31(1): 107-111. (in Chinese)
[19] RASER K J, POSNER A, WANG K K W. Casein zymography: A method to study μ-calpain, m-calpain, and their inhibitory agents. Archives of Biochemistry and Biophysics, 1995, 319(1): 211-216.
[20] LI Y P, LIU R, ZHANG W G, FU Q Q, LIU N, ZHOU G H. Effect of nitric oxide on μ-calpain activation, protein proteolysis, and protein oxidation of pork during post-mortem aging. Journal of Agricultural and Food Chemistry, 2014, 62(25): 5972-5977.
[21] CANDIANO G, BRUSCHI M, MUSANTE L, SANTUCCI L,GHIGGERI G M, CARNEMOLLA B, RIGHETTI P G. Blue silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis, 2004, 25(9): 1327-1333.
[22] ZAKRYS-WALIWANDER P I, O'SULLIVAN M G, O'NEILL E E,KERRY J P. The effects of high oxygen modified atmosphere packaging on protein oxidation of bovine M. longissimus dorsi muscle during chilled storage. Food Chemistry, 2012, 131(2): 527-532.
[23] DAVIS K J, SEBRANEK J G, HUFF-LONERGAN E, LONERGAN S M. The effects of aging on moisture-enhanced pork loins. Meat Science, 2004, 66(3): 519-524.
[24] LIU Q, XIONG Y L. Electrophoretic pattern, thermal denaturation,and in vitro digestibility of oxidized myosin. Journal of Agricultural and Food Chemistry, 2000, 48(3): 624-630.
[25] WITKO-SARSAT V, GAUSSON V, DESCAMPS-LATSCHA B. Are advanced oxidation protein products potential uremic toxins? Kidney International, 2003, 63: 11-14.
[26] STADTMAN E R. Metal ion-catalyzed oxidation of proteins: biochemical mechanism and biological consequences. Free Radical Biology and Medicine, 1990, 9(4): 315-325.
[27] DELLES R M, XIONG Y L. The effect of protein oxidation on hydration and water-binding in pork packaged in an oxygen-enriched atmosphere. Meat Science, 2014, 97(2): 181-188.
[28] SITTE N, MERKER K, VON ZGLINICKI T, GRUNE T. Protein oxidation and degradation during proliferative senescence of human MRC-5 fibroblasts. Free Radical Biology and Medicine, 2000, 28(5): 701-708.
[29] VAN MONTFORT R L, CONGREVE M, TISI D, CARR R, JHOTIH. Oxidation state of the active-site cysteine in protein tyrosine phosphatase 1B. Nature, 2003, 423(6941): 773-777.
[30] SALMEEN A, ANDERSEN J N, MYERS M P, MENG T C, HINKS J A, TONKS N K, BARFORD D. Redox regulation of protein tyrosine phosphatase 1B involves a sulphenyl-amide intermediate. Nature,2003, 423(6941): 769-773.
[31] KOOHMARAIE M, GEESINK G H. Contribution of postmortem muscle biochemistry to the delivery of consistent meat quality with particular focus on the calpain system. Meat Science, 2006, 74(1): 34-43.
[32] LONERGAN E H, ZHANG W G, LONERGAN S M. Biochemistry of postmortem muscle-Lessons on mechanisms of meat tenderization. Meat Science, 2010, 86(1): 184-195.
[33] PENNY I F, DRANSFIELD E. Relationship between toughness and troponin T in conditioned beef. Meat Science, 1979, 3(2): 135-141.
[34] FU Q Q, LIU R, ZHANG W G, LI Y P, WANG J, ZHOU G H. Effects of different packaging systems on beef tenderness through protein modifications. Food and Bioprocess Technology, 2014, 8(3): 580-588.
(责任编辑赵伶俐)
Effects of High Oxygen Modified Atmosphere Packaging on Protein Oxidation, Calpain Activity and Protein Proteolysis of Pork During Postmortem Refrigerated Storage
CHEN Lin, ZHOU Guang-hong, XU Xing-lian, ZHANG Wan-gang
(College of Food Science and Technology, Nanjing Agricultural University/Key Laboratory of Meat Processing and Food Control,Ministry of Education/Synergetic Innovation Center of Food Safety and Nutrition, Nanjing 210095)
【Objective】 The objective of this study was to investigate the effect of high oxygen modified atmosphere packaging(HiOx, 80% O2/20% CO2)on protein oxidation, calpain activity and protein proteolysis of pork during refrigerated storage. This could help explaining the mechanism of regulation behind HiOx in pork quality. 【Method】 Twelve Longissimus dorsi muscles of Duroc × Landrace × Yorkshire crossbred pork were precooled at 4℃ for 24 h, and then randomly assigned to either HiOx or vacuum packaging (VP) and stored for 1, 4 and 6 d at 4℃. The carbonyl content and distribution, sulfhydryl content, sarcomere changes,calpain activity, titin and troponin-T degradation were determined, respectively. 【Result】 Carbonyl content of samples from HiOx was significantly higher than the samples from VP at 4 and 6 d of storage (P<0.05). HiOx samples showed fluorescence signal in the peripheral area of cell membrane and then the fluorescence signal spread to the internal cellular environment at 1 and 4 d of postmortem refrigerated storage. At 6 d of postmortem refrigerated storage, samples under HiOx presented a strong fluorescencelight, with a glaring fluorescence intensity more pronounced in a peripheral area corresponding to the cell membrane and to a region in close contact with the cell membrane, while VP samples presented weaker fluorescence signal. Sulfhydryl content of HiOx samples was significantly lower compared with VP samples at 6 d of postmortem storage (P<0.05). Samples from VP showed weakening M line, blurry A band as well as broken Z line during postmortem refrigerated storage, whereas samples under HiOx remained less affected. μ-Calpain activity was less in samples from HiOx compared with that from VP at 1 d of storage (P<0.05). Titin and troponin-T showed less proteolysis in samples from HiOx than that from VP at 4 and 6 d of postmortem refrigerated storage(P<0.05). 【Conclusion】 Increased protein oxidation under HiOx could inhibit μ-calpain activity and protein proteolysis of pork during postmortem refrigerated storage.
pork; high oxygen modified atmosphere packaging; vacuum packaging; protein oxidation; calpain activity; protein proteolysis
2016-01-25;接受日期:2016-04-07
“十二五”国家科技支撑计划(2012BAD28B03)、国家自然科学基金(31271899)
联系方式:陈琳,E-mail:njauchenlin@163.com。通信作者张万刚,E-mail:wangang.zhang@njau.edu.cn

