寡糖·链蛋白对小麦抗黄花叶病毒的免疫诱抗作用
徐润东,盛世英,杨秀芬,刘 勇
(1山东农业大学植物保护学院,山东泰安 271018;2中国农业科学院植物保护研究所,北京 100081)
寡糖·链蛋白对小麦抗黄花叶病毒的免疫诱抗作用
徐润东1,盛世英2,杨秀芬2,刘勇1
(1山东农业大学植物保护学院,山东泰安 271018;2中国农业科学院植物保护研究所,北京 100081)
【目的】激发子可以诱导寄主植物的系统获得抗病性,具有有效性、持久性和广谱性的特点。研究旨在明确新型激发子寡糖·链蛋白(oligosaccharins·plant activator protein)对小麦黄花叶病毒(Wheat yellow mosaic virus,WYMV)的免疫诱抗作用,为该激发子的研究和大面积推广应用提供技术支撑。【方法】选用小麦黄花叶病感病品种‘矮抗58’,在室内将消毒的小麦种子播种于自感病田带回的病土中,在(27±2)℃下培养。5叶期叶面喷施稀释1 000倍的6%寡糖·链蛋白。喷施7 d后,将麦苗置于(12±1)℃培养箱中接种培养。30 d后取出麦苗,分别测量小麦株高和叶片的叶绿素含量,计算病情指数和防治效果。在田间,同品种小麦种植于小麦黄花叶病常发地块,小麦返青后每周喷施1次6%寡糖·链蛋白,连续喷施3次。每周测量小麦株高和叶绿素含量,计算病情指数和防治效果。并于调查期间,每小区取20片植株最上部第一片完全展开的叶片,通过qPCR检测小麦植株内WYMV-CP基因拷贝数。在小麦收获时测定千粒重和穗粒数,测算产量。【结果】低温培养30 d后,经寡糖·链蛋白喷施处理的小麦较对照组的株高没有显著差异,但叶绿素含量则明显高于对照组(P<0.05);同时处理组的病情指数较对照组明显降低,防治效果达到63.32%。田间经寡糖·链蛋白处理后,小麦株高和叶绿素含量较对照没有显著差异。小麦返青期,喷施1周后病情指数与对照没有显著变化;而2周后病情指数显著降低,防治效果可达46.67%。小麦收获时调查发现,经寡糖·链蛋白处理后小麦穗粒数显著高于对照组(P<0.05),小麦产量明显升高(P<0.05)。病株内WYMY-CP基因拷贝数在喷施1周后抑制率达到69.30%,2周后达到85.50%,3周后最高达到99.20%。【结论】寡糖·链蛋白可诱导小麦植株对小麦黄花叶病毒的抗性,显著降低小麦植株内WYMV-CP基因拷贝数;在田间可以减轻小麦黄花叶病的危害,减少产量损失。
小麦黄花叶病毒;寡糖·链蛋白;诱导抗性;激发子;WYMV-CP
0 引言
【研究意义】小麦是中国最重要的粮食作物之一,近年来,小麦黄花叶病在中国局部地区呈发展蔓延趋势,严重影响小麦生产。小麦黄花叶病毒(Wheat yellow mosaic virus,WYMV)属马铃薯Y 病毒科(Potyviridae),大麦黄花叶病毒属(Bymouirus),是由禾谷多黏菌(Polymyxa graminis)传播的弯曲线状病毒。田间症状为叶片黄化、退绿,严重时植株矮小,分蘖减少,引起小麦品质和产量下降[1]。自1990年以来,该病在陕西、四川、湖北、山东、河南、安徽、江苏和浙江等省发生严重,并随着全球变暖逐渐向北蔓延,目前在中国每年发生面积为66.7万hm2左右,感病田块一般减产10%—30%,重病区减产严重时达到70%以上。因而研发小麦黄花叶病的控制方法和技术具有重要意义[2]。【前人研究进展】小麦黄花叶病最早于1927年在日本发现并被描述,19世纪60年代该病在中国四川首次被报道[3]。小麦黄花叶病在小麦越冬期病毒呈休眠状态,小麦返青前后开始表现症状,拔节期危害最重,气温升至20℃后,花叶症状逐渐消失,出现隐症[3-5]。病毒主要依靠病土、病根残体、病田流水中的带毒禾谷多黏菌休眠孢子进行传播;也可以通过混杂在种子里的带毒土壤进行远距离传播。发病严重时,会造成田间带毒禾谷多黏菌休眠孢子大量积累,导致病毒蔓延加速,引起病害流行,危害严重。由于该病毒存在于禾谷多黏菌休眠孢子体内,而禾谷多黏菌休眠孢子堆壁厚,具有很强的抗逆性,很难用化学方法防治[6]。因而在实际生产中,采用抗病品种是最经济和有效的措施。虽然抗病品种在生产中可以发挥一定的作用,但由于小麦品种资源中小麦土传病毒的抗源有限,小麦土传病毒病的防治一直是生产中的一个难题[7-8]。而且,目前也尚无以基因修饰法培育抗黄花叶病小麦新品种的成功案例。自1901年RAY用接种锈菌的弱毒小种来抵抗锈病病菌侵染以来,研究者发现在一定条件下,一些物质可以激发或诱导植物的抗性,继而在这一领域的研究有了长足的进展。如发现了一系列能够诱导植物产生抗性的生物和非生物因子[9]。目前将这类能够刺激植物产生防卫反应的物质统称为激发子(activator)[10]。大多数激发子在提高作物抗逆性以及抵御有害生物危害上具有潜在的应用价值。如苯并噻二唑(BTH)、β-氨基丁酸(BABA)、2,6-二氯异烟酸(INA)等都可以诱导植物的抗性,并且对多种植物细菌、真菌和病毒的侵染具有一定的抗性[11-16]。寡糖·链蛋白是基于极细链格孢菌(Alternaria tenuissima)中分离的蛋白激发子PeaT1(GenBank登录号EF030819)和Hrip1(GenBank登录号HQ713431)而研制的蛋白质生物农药。PeaT1在大肠杆菌中的表达产物能提高植物体内相关防卫基因的表达,诱导抗逆性产生,提高作物的产量与品质[17-18]。Hrip1能改善和提高植株的耐盐抗旱能力[19]。目前在防治烟草和水稻病毒病害上效果明显[20-23]。【本研究切入点】针对小麦黄花叶病难以有效控制的客观现实,而且使用激发子诱导植物抗性来防治病毒病在国内外已有成功案例。【拟解决的关键问题】通过试验室内和田间在小麦黄花叶病病株上喷施寡糖·链蛋白,并分析其对小麦植株抵御黄花叶病病毒侵染的免疫诱抗作用,以期为有效控制小麦黄花叶病提供新途径和科学依据。
1 材料与方法
1.1试验材料
1.1.1供试小麦小麦品种为小麦黄花叶病感病品种‘矮抗58’。
1.1.2主要试剂6%寡糖·链蛋白由中国农业科学院植物保护研究所蛋白质农业研究组提供。RNA提取试剂盒为全式金RNA提取试剂盒ER301-01。
1.2室内试验设计及调查和评价方法
1.2.1试验设计与处理每盆(内径20 cm)40粒小麦种子播种于试验田取回的病土中,温度(27±2)℃,光周期L∶D=16 h∶8 h,5叶期植株用于试验。由于小麦黄花叶病毒为土传真菌介导传播,病毒本身为线状粒子容易断裂,病毒外壳蛋白极不稳定,采用机械接种比较困难且效率极低,故本试验采用低温条件下的土传接种[24]。以1 000倍6%寡糖·链蛋白叶面喷施,清水为对照。3 d后,置于(12±1)℃,光周期L∶D=12 h∶12 h条件下的培养箱中低温接种[24]。重复3次。
1.2.2调查和评价方法上述小麦在培养箱内生长30 d后取出,分别调查小麦植株的发病级别,并测量株高和叶绿素含量。病情分级标准如下:0级:无症状;1级:新叶出现退绿条纹或黄化症状;2级:多数叶片出现退绿条纹或黄化症状,有时会出现新叶扭曲,植株矮化不明显;3级:全株呈现严重花叶症状,老叶上出现坏死斑,植株明显矮化,部分分蘖死亡或者全株死亡[8]。小麦的叶绿素含量以AWOS_YL01叶片参数仪,取小麦最上部第1片完全展开的叶测定[25]。病情指数和防治效果计算公式如下:

1.3田间试验设计及调查和评价方法
1.3.1田间试验设计田间试验自2014年10月至2015年6月在山东省泰安市徐家楼(117°09′E, 36°09′N)进行。试验地多年以冬小麦-玉米的种植模式,地块平整,水肥条件一致,小麦黄花叶病发病均匀且严重,而且没有采取任何防控措施。田间试验设对照区和寡糖·链蛋白处理区。小区完全随机设计,重复3次。小区面积为10 m×10 m,间隔2 m。分别于2015年小麦返青后(3月13日、3月19日和3月30日)喷施(100 g/667 m2),共喷施3次。喷施量为参照在其他作物中的试验使用量确定,播种及生长期间管理措施一致,小麦生长期间不使用任何化学农药[21-23]。
1.3.2调查和评价方法自2015年3月13日开始,每7 d按双对角线5点取样法,每小区取小麦30株,调查发病级别。发病分级及病情指数和防治效果计算同1.2.2。2015年3月30日后,小麦黄花叶病开始隐症,以同样的方法每小区取30株小麦测量植株的株高和叶绿素含量。小麦收获时,仍以双对角线5点取样法,每小区取麦穗50个,剥查穗粒数,并以GB/T5519-88标准测定千粒重并以穗粒数和千粒重进行产量测算[26]。
1.4小麦叶片总RNA的提取与WYMV-CP在小麦体内蓄积量检测
1.4.1小麦叶片总RNA的提取自3月19日开始,每7 d按双对角线5点取样法,每小区取植株最上部第一片完全展开的叶片20片,带回实验室置于-80℃冰箱中保存,用以提取总RNA,检测WYMV-CP基因拷贝数。植物RNA提取参照试剂盒说明书进行。测定各样品的A260和A260/A280值来计算RNA浓度和估计总RNA的纯度。RNA的完整性通过在1%琼脂糖凝胶电泳来评估。
1.4.2引物设计根据NCBI核酸数据库中的WYMV-CP基因序列,利用引物设计软件Primers 5.0设计WYMV-CP引物F:5′-GCAGAAAACCAGA CCATGCA-3′和R:5′-TTCATCACTGTAGGCTCGCA -3′。
1.4.3标准曲线的制作带有WYMV-CP的质粒(中国农业大学韩成贵教授惠赠)起始浓度为500 ng·μL-1。将带有基因的质粒标准品进行10倍系列梯度稀释,荧光定量PCR体系中加入标准品1 μL,每个浓度设置3个重复。荧光定量PCR仪(型号为Biorad IQ5)能自动生成基因拷贝数与Ct值的标准曲线。
1.4.4荧光定量PCR检测小麦叶片中的WYMV-CP含量分别取各样品相同量的总RNA,以RNA为模板在荧光定量PCR仪上进行荧光定量RT-PCR扩增,反应体系为10 μL,PCR程序:45℃ 30 min;95℃ 10 min;然后95℃变性15 s,60℃退火并延伸1 min,44个循环。把样品加入同一块96孔板中,设置3个重复。PCR扩增结束后,根据每个样品的Ct值以及标准曲线方程式进行定量分析。
1.5统计方法
小麦株高、叶绿素含量、穗粒数和千粒重的差异性比较采用SPSS 16.0的独立样本T检验(Independent samples T test)分析。
2 结果
2.1室内寡糖·链蛋白处理后小麦的植株特征、病情
指数和防治效果
低温培养30 d后,尽管经寡糖·链蛋白喷施处理的小麦较对照组的株高没有显著差异,而叶绿素含量则明显高于对照组(P<0.05)。同时处理组的病情指数较对照组明显降低,防治效果达到63.32%(表1)。
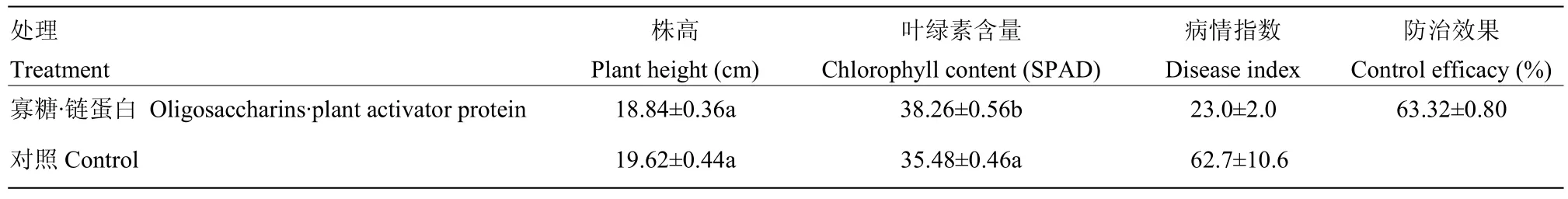
表1 室内寡糖·链蛋白处理对小麦株高、叶绿素含量、病情指数的影响及防治效果Table 1 Effects of oligosaccharins·plant activator protein on wheat height, chlorophyll content and disease reduction of WYMV in laboratory
2.2寡糖·链蛋白处理对田间病毒病发生的影响
田间处理中,3月12日部分小麦开始表现出轻微黄化症状,3月19日小麦植株全部出现黄化症状,部分出现重度黄花和矮化症状,3月30由于气温回升,部分症状消失,4月8日则完全隐症。由表2可知,在经小麦返青后喷施寡糖·链蛋白,至3月30日,处理区的病情指数明显下降,防治效果达到46.67%。
2.3寡糖·链蛋白处理的小麦叶片中病毒外壳蛋白基因的积累
免疫蛋白处理小麦叶片后的不同待检样品与标准品在相同条件进行qRT-PCR检测,得到的Ct值根据标准曲线线性方程计算出不同样品中外壳蛋白基因的蓄积量。测定结果表明,寡糖链蛋白的样品标准曲线为y= -3.239x+6.696(图1),其中y为Ct值,x为lgCo,Co为WYMV外壳蛋白起始浓度。由表3可以得知,小麦植株在田间经寡糖·链蛋白处理7 d后,WYMV-CP的复制得到明显抑制,抑制率达到了69.30%,并且在此后的14 d内表现持续的抑制作用(3月30日:抑制率85.50%;4月8日,抑制率99.20%)。
2.4田间寡糖·链蛋白处理对小麦穗粒数及产量的影响
田间调查期间,尽管对照组和处理组的株高和叶绿素含量均没有显著差异,但从图2得知,经过寡糖·链蛋白处理的小麦穗粒数较对照组明显增高(P<0.05),而千粒重没有明显变化。在最后的产量测定中经寡糖·链蛋白处理的小麦产量较对照组明显增高。
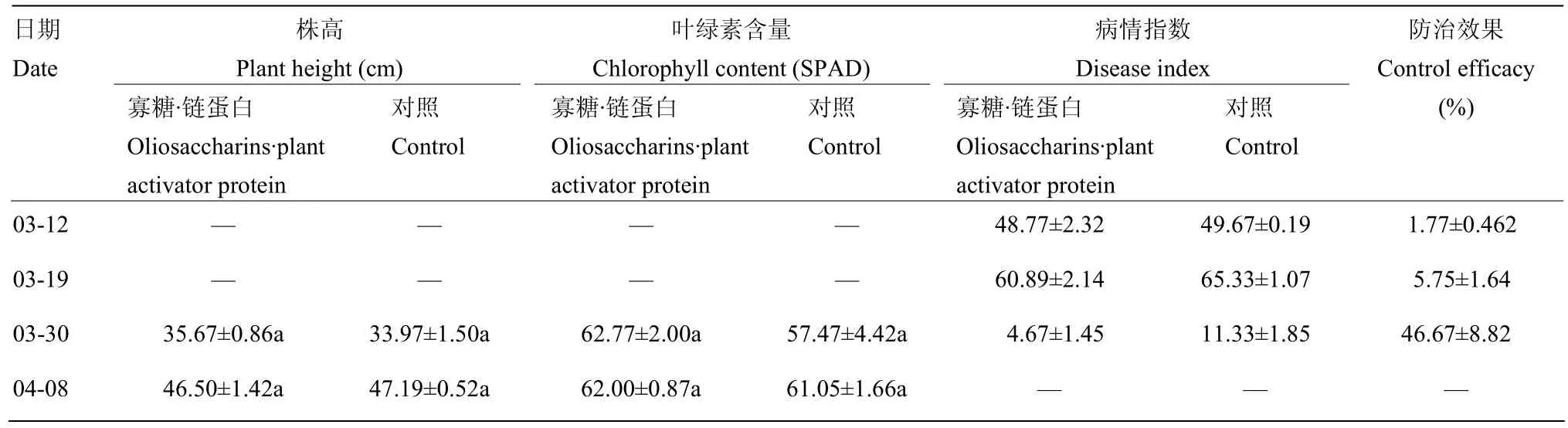
表2 田间寡糖·链蛋白处理对小麦株高、叶绿素含量、病情指数的影响及防治效果Table 2 Effects of oligosaccharins·plant activator protein on wheat height, chlorophyll content and disease index and its efficacy in control WYMV in field
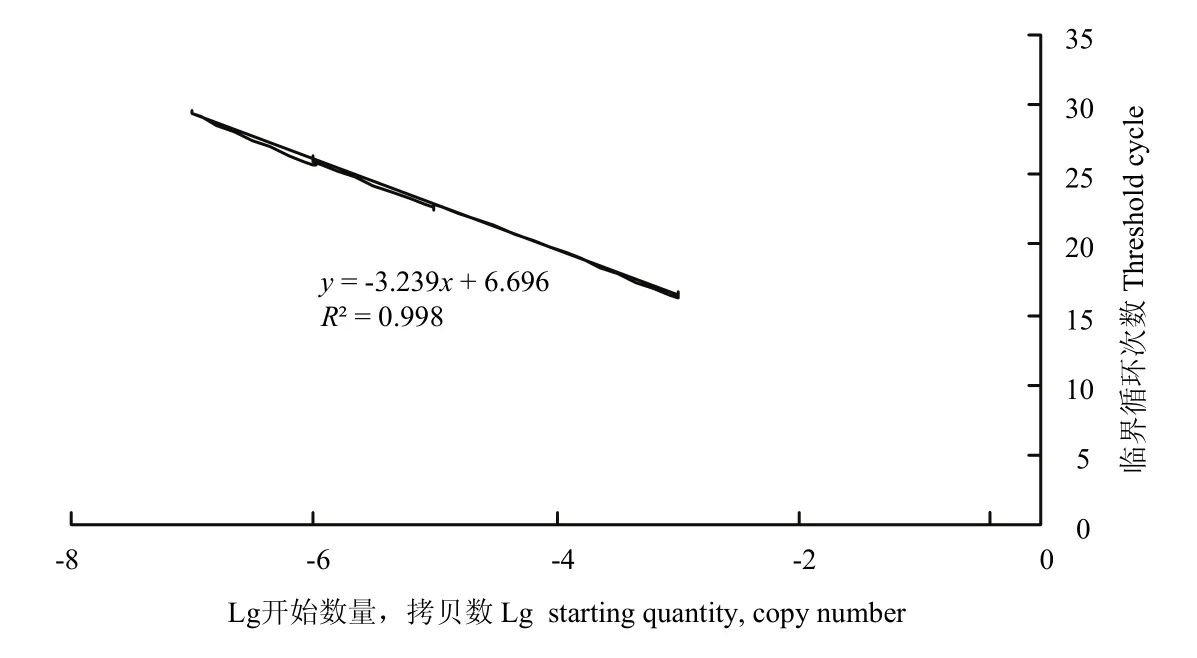
图1 携带WYMV-CP标准品的标准曲线Fig. 1 Standard curve of quantitative real-time PCR for WYMV-CP
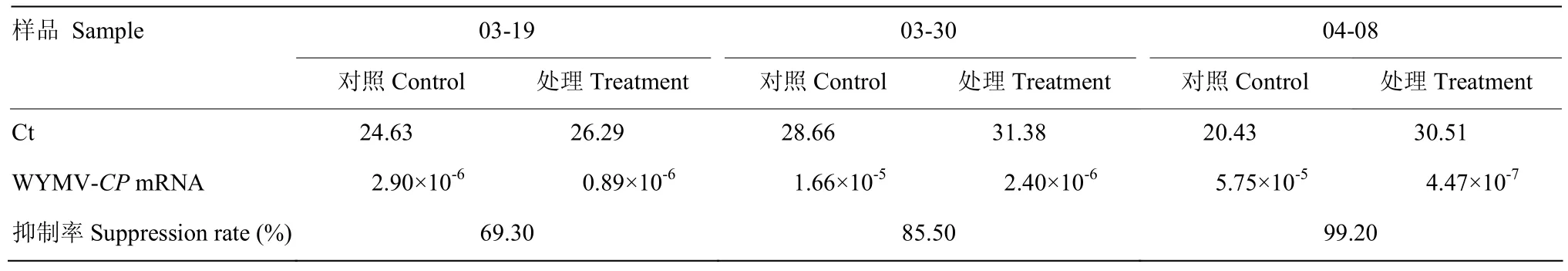
表3 寡糖·链蛋白诱导后对小麦叶片WYMV-CP基因拷贝数的影响Table 3 WYMV-CP gene copies with or without oligosaccharins·plant activator protein treatment

图2 寡糖·链蛋白对小麦黄花叶病病株的穗粒数、千粒重和产量的影响Fig. 2 Effects of oligosaccharins·plant activator protein on seeds per ear, thousand grain weight and yields of wheat infected by WYMV
3 讨论
植物通过复杂的调节网络系统抵御外界不良因子的侵袭,这是植物防卫反应所特有的。多酚氧化物酶(PPO)、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)是植物形成多种次生代谢产物的关键酶,这些代谢产物有限制病原生长和抗菌的功能[27]。同时病程相关基因(pathogenesis-related genes,PRs)的表达上调,在植物的诱导抗病反应中发挥重要作用。PR基因最初发现主要是由于它们在植物受到病原菌侵染时会大量表达,目前,在所有植物中几乎都有PR基因的报道[28-29]。大量证据表明,PR基因在植物抗病反应中不仅发挥作用,而且也是不同植物系统获得抗性(system acquired resistance,SAR)启动表达的重要防卫反应标志基因[30-33]。用寡糖·链蛋白诱导烟草对TMV抗性时发现,经诱导的植株PPO、POD和PAL酶活增高[32]。同时用寡糖·链蛋白处理小麦植株后,小麦植株体内的PR1、PR2、PR5的表达量在12—24 h内均有大幅度上调(未发表资料)。所以笔者推测寡糖·链蛋白诱导小麦产生了对WYMV的系统获得抗病性。
对于禾谷多黏菌传播的小麦黄花叶病,该病发生的最适温度为15℃,变动范围为5—17℃,一旦温度超过20℃就会发生隐症,很难从外观准确判断病状。同时小麦黄花叶病发病时会伴随一定的植株矮化和叶片黄花[7-8]。所以本试验在调查病情等级时,也同时调查了小麦植株株高和叶片叶绿素含量,用此作为辅助参数。结果表明在实验室内,对照组小麦植株发病严重时,叶绿素含量明显低于处理组(P<0.05)。尽管田间对照组与处理组相比小麦叶绿素含量没有显著差异,但也有所降低。这表明,对于小麦黄花叶病的发病程度,可以通过植株的叶绿素含量来评价。
田间施用寡糖·链蛋白后,处理植株WYMV-CP基因拷贝数明显受到抑制,穗粒数显著增加。并且防治效果可达46.67%,说明寡糖·链蛋白可以通过抑制WYMV病毒的复制,而减轻病害的发生,提高产量。
激发子诱导植物对病原菌的抗性具有时滞性。间隔期因不同植物和不同诱导子而异。如菜豆(Phaseolus vulgaris)在接种非病原菌Colletotrichum lindemuthianum 24—36 h后显示出对Helminthosporium carbonum和Alternaria sp.的过敏反应[34-35]。从表3可以得知,寡糖·链蛋白在田间处理小麦植株7 d后(2015年3月19日),WYMV-CP基因拷贝数就明显受到抑制,抑制率达到69.30%,但在田间病情等级调查中没有发现明显的防治效果。直到2周后(2015年3月30日),外在症状上才表现出对小麦黄花叶病的明显抗性,防治效果为46.67%。同时,植物的诱导抗性只能使植株对病原菌表现出相对的抗性,减轻病原菌对寄主植物的侵染程度[36]。在诱导抗性的持久性上,经诱导的植物并不能永久保持这种因诱导而产生的抗性,通常会随着诱导处理时间的延长抗性会减弱[37]。另外,根据小麦黄花叶病自身的发病规律及其与温度的关系,建议在小麦黄花叶病发病的最适温度前2周喷施。
相对于稳定的室内环境,田间植株要面临更多的生物和非生物因子的胁迫[38]。田间的小麦植株,在无防控措施的条件下,除受到小麦黄花叶病的侵染,也可能遭受其他有害生物的危害。干旱等非生物因子的胁迫也时有发生。这些生物及非生物因子对激发子的诱抗作用及防治效果都可能产生不利影响。寡糖·链蛋白在实验室内对于小麦黄花叶病的防治效果好于田间试验(表1、表2),可能是由于田间复杂的生物及非生物因子的影响所致。
由于植株缺乏与动物类似的免疫系统,一旦被病毒感染就处于终生受害状态。目前仍没有有效的治疗植物病毒的药剂[37]。通过激发子诱导植物的抗性是抵抗植物病毒侵害的重要手段,国际上已经有部分激发子上市,用于控制病毒病的危害[11-13]。激发子不会对病原菌产生选择压力,不易产生抗药性,而且还具有抗非生物胁迫和促进作物生长的特点,因此,激发子生物农药是经济、安全高效的绿色防控新产品。尽管目前对激发子的作用机理尚需深入研究,但不可否认,激发子如寡糖·链蛋白在病害防治、提高作物抗逆性等方面可能具有广阔的应用前景。
4 结论
寡糖·链蛋白可诱导小麦植株产生对小麦黄花叶病的抗性,降低病情指数,提高小麦穗粒数,增加产量。其作用机理可能与显著抑制小麦体内WYMV-CP基因拷贝数有关。在小麦黄花叶病的常发地块,可以在小麦返青前2周左右喷施寡糖·链蛋白,通过增强植株的抗性,抵御病害,减少产量损失。
References
[1] CLOVER G, HENRY C. Detection and discrimination of Wheat spindle streak mosaic virus and Wheat yellow mosaic virus using multiplex RT-PCR. European Journal of Plant Pathology, 1999,105(9): 891-896.
[2] CHEN J P. Occurrence of fungally transmitted wheat mosaic viruses in China. Annals of Applied Biology, 1993, 123(1): 55-61.
[3] HAN C, LI D, XING Y, ZHU K, TIAN Z, CAI Z, YU J, LIU Y. Wheat yellow mosaic virus widely occurring in wheat (Triticum aestivum) in China. Plant Disease, 2000, 84(6): 627-630.
[4] 王鸣岐, 刘国士, 陆秀海. 小麦梭斑花叶病毒病在我国发生的初步证实. 四川农业科技, 1980(1): 34-35.
WANG M Q, LIU G S, LU X H. A primary confirmation on Wheat spindle streak mosaic virus occurring in China. Sichuan AgriculturalScience and Technology, 1980(1): 34-35. (in Chinese)
[5] 张宗英, 徐建美, 韩成贵, 张振臣, 李大伟, 于嘉林. 小麦黄花叶病毒河南驻马店分离物的鉴定与全序列分析. 华北农学报, 2010,25(2): 5-11.
ZHANG Z Y, XU J M, HAN C G, ZHANG Z C, LI D W, YU J L. Detective and complete sequence analysis of Wheat yellow mosaic virus from Zhumadian in Henan Province. Acta Agriculturae Boreali-Sinica, 2010, 25(2): 5-11. (in Chinese)
[6] KÜHNE T. Soil-borne viruses affecting cereals—Known for long but still a threat. Virus Research, 2009, 141(2): 174-183.
[7] 王锡锋, 刘艳, 韩成贵, 吴云峰, 赵中华. 我国小麦病毒病害发生现状与趋势分析. 植物保护, 2010, 36(3): 13-19.
WANG X F, LIU Y, HAN C G, WU Y F, ZHAO Z H. Present situation and development strategies for the research and control of wheat viral diseases. Plant Protection, 2010, 36(3): 13-19. (in Chinese)
[8] 孙炳剑, 李洪连, 杨新志, 谢联辉, 陈剑平. 河南省主要推广品种对小麦黄花叶病毒抗性的评价. 植物保护学报, 2011, 38(2): 102-108.
SUN B J, LI H L, YANG X Z, XIE L H, CHEN J P. Evaluation of commercial wheat cultivars for resistance to Wheat yellow mosaic virus in Henan. Acta Phytophylacica Sinica, 2011, 38(2): 102-108. (in Chinese)
[9] CUI H, TSUDA K, PARKER J E. Effector-triggered immunity: from pathogen perception to robust defense. Annual Review of Plant Biology, 2015, 66: 487-511.
[10] HUFFAKER A. Plant elicitor peptides in induced defense against insects. Current Opinion in Insect Science, 2015, 9: 44-50.
[11] BENHAMOU N, BELANGER R R. Benzothiadiazole-mediated induced resistance to Fusarium oxysporum f. sp. radicis-lycopersici in tomato. Plant Physiology, 1998, 118: 1203-1212.
[12] ZHU Y J, QIU X H, MOORE P H, BORTH W, HU J, FERREIRA S,ALBERT H H. Systemic acquired resistance induced by BTH in papaya. Physiological and Molecular Plant Pathology, 2003, 63: 237-248.
[13] SLAUGHTER A R, HAMIDUZZAMAN M M, GINDRO K,NEUHAUS J M, MAUCH-MANI B. Beta-aminobutyric acid-induced resistance in grapevine against downy mildew: involvement of pterostilbene. European Journal of Plant Pathology, 2008, 122: 185-195.
[14] COHEN Y, RUBIN A E, KILFIN G. Mechanisms of induced resistance in lettuce against Bremia lactucae by DL-β-amino-butyric acid (BABA). European Journal of Plant Pathology, 2009, 126: 553-573.
[15] DURNER J, KLESSIG D F. Inhibition of ascorbate peroxidase by salicylic acid and 2, 6-dichloroisonicotinic acid, two inducers of plant defense responses. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(24): 11312-11316.
[16] CAO H, LI X, DONG X. Generation of broad-spectrum disease resistance by overexpression of an essential regulatory gene in systemic acquired resistance. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(11): 6531-6536.
[17] YANG X, QIU D, ZENG H, YUAN J, MAO J. Purification and characterization of a glycoprotein elicitor from Alternaria tenuissima. World Journal of Microbiology and Biotechnology, 2009, 25(11): 2035-2042.
[18] LI G, YANG X, ZENG H, MAO J, LIU H, ZHANG Y, QIU D. Stable isotope labelled mass spectrometry for quantification of the relative abundances for expressed proteins induced by PeaT1. Science China. Life Sciences, 2010, 53(12): 1410-1417.
[19] PENG X, QIU D, ZENG H, GUO L, YANG X, LIU Z. Inducible and constitutive expression of an elicitor gene Hrip1 from Alternaria tenuissima enhances stress tolerance in Arabidopsis. Transgenic Research, 2015, 24: 135-145.
[20] MAO J, LIU Q, YANG X, LONG C, ZHAO M, ZENG H, LIU H,YUAN J, QIU D. Purification and expression of a protein elicitor from Alternaria tenuissima and elicitor-mediated defense responses in tobacco. Annals of Applied Biology, 2010, 156(3): 411-420.
[21] ZHANG W, YANG X, QIU D, GUO L, ZENG H, MAO J, GAO Q. PeaT1-induced systemic acquired resistance in tobacco follows salicylic acid-dependent pathway. Molecular Biology Reports, 2011,38(4): 2549-2556.
[22] KULYE M, LIU H, ZHANG Y, ZENG H, YANG X, QIU D. Hrip1, a novel protein elicitor from necrotrophic fungus, Alternaria tenuissima,elicits cell death, expression of defence-related genes and systemic acquired resistance in tobacco. Plant, Cell and Environment, 2012,35(12): 2104-2120.
[23] 刘见平, 唐涛, 赵明平. 寡糖·链蛋白对南方水稻黑条矮缩病的防治效果及其对水稻的促长增产作用. 农药, 2015, 54(8): 606-609.
LIU J P, TANG T, ZHAO M P. Control efficacy on Southern rice black-streaked dwarf virus of oligosaccharins·plant activator protein and its effects on growth promotion and yield increase of rice. Agrochemicals, 2015, 54(8): 606-609. (in Chinese)
[24] 尚巧霞, 韩成贵, 于嘉林, 杨莉莉, 刘仪. 小麦黄花叶病毒人工侵染体系的研究. 华北农学报, 2002, 17(4): 54-58.
SHANG Q X, HAN C G, YU J L, YANG L L, LIU Y. Artificial inoculation of Wheat yellow mosaic virus to wheat. Acta AgriculturaeBoreali-Sinica, 2002, 17(4): 54-58. (in Chinese)
[25] 赵满兴, 周建斌, 翟丙年, 杨绒, 李生秀. 旱地不同冬小麦品种氮素营养的叶绿素诊断. 植物营养与肥料学报, 2005, 11(4): 461-466.
ZHAO M X, ZHOU J B, ZHAI B N, YANG R, LI S X. Chlorophyll diagnoses of N nutrition for different winter wheat cultivars on dry land. Plant Nutrition and Fertilizer Science, 2005, 11(4): 461-466. (in Chinese)
[26] 邢君, 田灵芝. 小麦测产方法综述. 安徽农学通报, 2011(8): 94-95.
XING J, TIAN L Z. Summary of calculate wheat yield methods. Anhui Agricultural Science, 2011(8): 94-95. (in Chinese)
[27] GENGER R K, JURKOWSKI G I, MCDOWELL J M, LU H, JUNG H W, GREENBERG J T, BENT A F. Signaling pathways that regulate the enhanced disease resistance of Arabidopsis “defense, no death”mutants. Molecular Plant-Microbe Interactions, 2008, 21(10): 1285-1296.
[28] WARD E R, UKNES S J, WILLIAMS S C, DINCHER S S,WIEDERHOLD D L, ALEXANDER D C, AHL-GOY P, METRAUX J P, RYALS J A. Coordinate gene activity in response to agents that induce systemic acquired resistance. The Plant Cell, 1991, 3(10): 1085-1094.
[29] UKNES S, MAUCH-MANI B, MOYER M, POTTER S, WILLIAMS S, DINCHER S, CHANDLER D, SLUSARENKO A, WARD E,RYALS J. Acquired resistance in Arabidopsis. The Plant Cell, 1992,4(6): 645-656.
[30] YALPANI N, SILVERMAN P, WILSON T, KLEIER D A, RASKIN I. Salicylic acid is a systemic signal and an inducer of pathogenesisrelated proteins in virus-infected tobacco. The Plant Cell, 1991, 3(8): 809-818.
[31] ALEXANDER D, GOODMAN R M, GUT-RELLA M, GLASCOCK C, WEYMANN K, FRIEDRICH L, MADDOX D, AHL-GOY P,LUNTZ T, WARD E, RYALS J. Increased tolerance to two oomycete pathogens in transgenic tobacco expressing pathogenesis-related protein 1a. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(15): 7327-7331.
[32] KOORNNEEF A, VERHAGE A, LEON-REYES A, SNETSELAAR R, VAN LOON L, PIETERSE C M. Towards a reporter system to identify regulators of cross-talk between salicylate and jasmonate signaling pathways in Arabidopsis. Plant Signaling & Behavior, 2008,3(8): 543-546.
[33] 张薇, 杨秀芬, 邱德文, 曾洪梅, 郭立华, 毛建军. 激活蛋白PeaT1诱导烟草对TMV的系统抗性. 植物病理学报, 2010, 40(3): 290-299.
ZHANG W, YANG X F, QIU D W, ZENG H M, GUO L H, MAO J J. Activator protein PeaT1 induced systemic resistance to Tobacco mosaic virus in tobacco. Acta Phytopathologica Sinica, 2010, 40(3): 290-299. (in Chinese)
[34] 赵立尚, 潘正茂, 王梦扬, 范春燕. 小麦黄花叶病的研究. 农业灾害研究, 2012(2): 12-13.
ZHAO L S, PAN Z M, WANG M Y, FAN C Y. Study on wheat yellow mosaic. Journal of Agricultural Catastrophology, 2012(2): 12-13. (in Chinese)
[35] RAHE J, KUC J, CHUANG C M, WILLIAMS E. Induced resistance in Phaseolus vulgaris to bean anthracnose. Phytopathology, 1969, 59: 1641-1645.
[36] ANDEBRHAN T, WOOD R K S. The effect of ultraviolet radiation on the reaction of Phaseolus vulgaris to species of Colletotrichum. Physiological Plant Pathology, 1980, 17(1): 105-110.
[37] DEAN R A, KUC J. Induced systemic protection in cucumber: Effects of inoculum density on symptom development caused by Colletotrichum lagenarium in previously infected and uninfected plants. Phytopathology, 1986, 76(2): 186-189.
[38] GOUINGUENÉ S P, TURLINGS T C J. The effects of abiotic factors on induced volatile emissions in corn plants. Plant Physiology, 2002,129(3): 1296-1307.
(责任编辑岳梅)
Effect of Induced Resistance of Oligosaccharins·Plant Activator Protein on Wheat to WYMV
XU Run-dong1, SHENG Shi-ying2, YANG Xiu-fen2, LIU Yong1
(1College of Plant Protection, Shandong Agricultural University, Taian 271018, Shandong;2Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100081)
【Objective】Plant activator could trigger effective, persistent and broad-spectrum resistance in plants. The objective of this experiment is to study the resistance induced by oligosaccharins·plant activator protein against Wheat yellow mosaic virus(WYMV), thus providing a technical basis for the research and promotion of the use of activator proteins on a large scale.【Method】In laboratory, WYMV susceptible wheat cultivar ‘Aikang 58' was sowed in the soil that was collected from the WYMV infested field and grown in the incubator under (27±2)℃. When the wheat grown up to five-leaf stage, the 6% oligosaccharins·plant activator protein that was diluted 1 000 times was sprayed. After 7 days, the wheat was put in incubator for 30 days under (12±1)℃, so as to get WYMV inoculated plants. Then the height of wheat plant, chlorophyll content, disease index, and control efficiency weremeasured or calculated. In filed, wheat was sowed in the plot that infested with WYMV for many years. The oligosaccharins·plant activator protein was sprayed once a week for successive three times of spray when wheat plant was at returning green stage. At the same time, the height of wheat plant, chlorophyll content, disease index, and control efficiency were measured or calculated. Moreover, 20 upper first fully expanded leaves in each plot were taken every week to detect the copy number of WYMV-CP by qPCR during the field investigation. The thousand grain weight, the seeds per ear and the yields were measured and calculated at harvest.【Result】The laboratory experiment showed that after 30 days of the activator spray, the chlorophyll content increased dramatically (P<0.05), the disease index decreased as the result of the control efficiency reached up to 63.32%, but no difference was found in plant height compared to the control. The field experiment showed that no significant control efficiency after one time spray, but the control efficiency reached up to 46.67% after two times of spray. The suppression rate of the copy number of WYMV-CP reached up to 69.30% in the first week, 85.50% in the second week, and the highest suppression reached up to 99.20% in the third week. However, the chlorophyll content and the height of wheat plants showed no significant differences. Although the seed numbers per ear significantly increased, but no difference was observed in thousand grain weight. As a result, the yields were significantly increased.【Conclusion】Oligosaccharins·plant activator protein could induce wheat plant resistance to WYMV. The copy number of WYMV-CP dramatically decreased in activator protein treated plants. It was showed that the activator could relieve WYMV damage and reduce yield loses in wheat fields.
Wheat yellow mosaic virus (WYMV); oligosaccharins·plant activator protein; induced resistance; activator;WYMV-CP
2016-03-15;接受日期:2016-05-25
科技部国际科技合作专项(2014DFG32270)、国家公益性行业(农业)科研专项(201503130)
联系方式:徐润东,E-mail:aphid@sdau.edu.cn。通信作者刘勇,E-mail:liuyong@sdau.edu.cn

