IL-18、OPN、INF—γ及hs-CRP在肺结核中的检测意义
袁 媛,陈 骥
(成都医学院第一附属医院,成都 610500)
IL-18、OPN、INF—γ及hs-CRP在肺结核中的检测意义
袁 媛,陈 骥
(成都医学院第一附属医院,成都 610500)
目的: 探析血清白介素18(IL-18)、骨桥蛋白(OPN)、干扰素-γ(INF—γ)以及超敏C反应蛋白(hs-CRP)表达水平在肺结核患者中的变化以及其临床价值。方法: 分析2012年3月至2015年5月在我院接受治疗的52例肺结核患者(观察组)的临床资料,其中16例体温超过39.0℃(高热症状),30例痰涂片抗酸杆菌呈阳性。另外选取同期在我院门诊部接受健康体检的健康者45例作为本次实验的对照组。比较观察组与对照组、高热组与非高热组、痰菌阴性与阳性组以及不同病变程度组间血清INF—γ、IL-18、OPN、hs-CRP的水平。结果: 对照组血清INF—γ、IL-18、OPN、hs-CRP水平明显低于观察组。非高热者血清INF—γ、IL-18、OPN、hs-CRP水平明显低于高热者。痰菌阴性者的血清INF—γ、IL-18、OPN水平均明显低于痰菌阳性者,而两组间的血清hs-CRP水平无统计学差异。病变程度相对严重的粟粒性组、空洞性组患者的血清INF—γ、IL-18、OPN水平均比浸润性组、结核性胸膜炎组患者高;而各组间的血清hs-CRP水平无统计学差异。结论: 肺结核患者的血清INF—γ、IL-18、OPN、hs-CRP水平显著上升,IL-18和OPN是肺结核患者病情严重性和病变活动性判断的敏感指标。
白介素18;骨桥蛋白;超敏C反应蛋白;肺结核;干扰素-γ
在肺结核的病理机制中,细胞免疫扮演了重要的角色。人体被结核杆菌感染后使T淋巴细胞和巨噬细胞被激活,分泌和产生了大量的炎性递质和细胞因子。其中启动细胞免疫与骨桥蛋白(OPN)关系密切。有资料显示,在T淋巴细胞和巨噬细胞活化的较早阶段,就会有大量的OPN产生[1]。巨噬细胞活化期间,干扰素-γ(INF—γ)作为调节因子扮演了重要的角色,而其产生又受到了白介素18(IL-18)的强烈诱导[2]。超敏C反应蛋白(hs-CRP)起免疫调节的作用,在炎性反应中起重要递质的作用[3]。近几年的研究发现,肺结核患者体内的INF—γ、IL-18、OPN、hs-CRP表达水平均显著上升,但是目前还不清除其与肺结核病变的严重程度以及活动性是否相关。本文旨在通过对肺结核患者体内血清INF—γ、IL-18、OPN、hs-CRP表达水平的检测及其与病变严重程度、发热以及痰菌阳性间关系的分析,探析早期肺结核患者病变严重程度和病变活动性的敏感指标。
1 资料与方法
1.1 研究对象 分析2012年3月 2015年5月在我院接受治疗的52例肺结核患者(观察组)的临床资料,入选者均符合中华医学会结核病学分会2013年制定的关于肺结核的诊断标准,排除免疫性疾病、肾脏病、肝炎、糖尿病以及肺部其它疾病患者;无皮质类固醇激素使用史。其中女性16例,男性36例,平均年龄(35.5± 11.2)岁。16例体温超过39.0℃(高热症状),30例痰涂片抗酸杆菌呈阳性。另外选取同期在我院门诊部接受健康体检的健康者45例作为本次实验的对照组,其中女10例,男35例,平均年龄(32.3±9.7)岁。
1.2 研究方法 清晨空腹抽取受试者4 mL肘静脉血,室温下静置20 min,以2500 r/min的速度离心(半径135 mm)20 min,提取上清液于-70℃的冰箱内保存待测。采用酶联免疫吸附法(ELISA)检测血清INF—γ、IL-18、OPN的浓度;胶乳增强免疫比浊法检测血清hs-CRP的浓度。
主要试剂: 武汉博士德公司生产的INF—γ、OPN检测试剂盒;北京中杉金桥公司生产的IL-18试剂盒;绍兴圣康公司生产的hs-CRP检测试剂盒。
1.3 统计学方法 本研究中的数据均采用SPSS19.0软件进行分析。数据计量以均数±标准差形式表示,比较采用t检验和卡方(χ2)检验。我们定义P<0.05为差异具有统计学意义。
2 结果
2.1 血清INF—γ、IL-18、OPN、hs-CRP水平 表1结果提示对照组血清INF—γ、IL-18、OPN、hs-CRP水平明显低于观察组(P<0.01)。
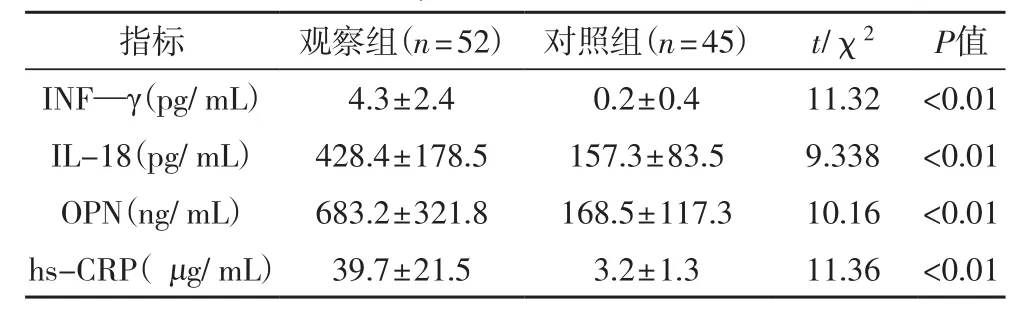
表1 两组血清INF—γ、IL-18、OPN、hs-CRP水平的比较
2.2 伴或不伴高热者血清INF—γ、IL-18、OPN、hs-CRP水平 表2结果提示非高热者血清INF—γ、IL-18、OPN、hs-CRP水平明显低于高热者(P<0.05)。

表2 伴或不伴高热者血清INF—γ、IL-18、OPN、hs-CRP水平的比较
2.3 痰菌阴、阳性者血清INF—γ、IL-18、OPN、hs-CRP水平 表3结果提示痰菌阴性者的血清INF—γ、IL-18、OPN水平均明显低于痰菌阳性者(P<0.05),而两组间的血清hs-CRP水平无统计学差异(P>0.05)。

表3 痰菌阴性和阳性患者血清INF—γ、IL-18、OPN、hs-CRP水平的比较
2.4 不同病变程度组间血清INF—γ、IL-18、OPN、hs-CRP水平 表4结果提示病变程度相对严重的粟粒性组患者的血清INF—γ、IL-18、OPN水平均比浸润性组、结核性胸膜炎组患者高(P<0.01);空洞性组患者的血清INF—γ、IL-18、OPN水平比浸润性组、结核性胸膜炎组患者高(P<0.01);而各组间的血清hs-CRP水平无统计学差异(P>0.05)。
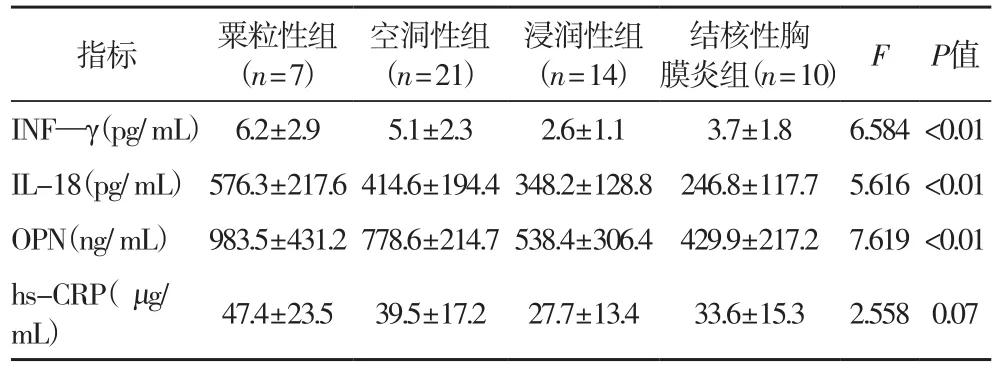
表4 不同病变程度组间血清INF—γ、IL-18、OPN、hs-CRP水平的比较
3 讨论
机体被结核杆菌感染后,巨噬细胞激活并往感染部位聚集,其将所吞噬的大量结核杆菌杀灭。此外,T淋巴细胞活化后与巨噬细胞联合产生了许多细胞因子,使细胞免疫反应得到了进一步地增强。OPN产生于T淋巴细胞和巨噬细胞活化的较早阶段,属于促炎因子,对Th1介导的机体免疫反应起诱导的作用,有利于结合杆菌的清除[4]。故OPN增强了机体对结核感染的防御能力。本实验的结果显示,对照组的OPN水平明显低于观察组,这与以往的相关报道结果相似[5],提示OPN致使的细胞免疫反应在肺结核发病期间扮演了一定的角色。深入的研究结果显示,非高热组血清OPN比高热组低,痰菌阴性者的血清OPN比痰菌阳性者低,提示肺结核患者中,非活动性者的血清OPN明显低于活动性者。病变较轻的结膜性胸膜炎和浸润性肺结核者的血清OPN水平明显低于空洞性、粟粒性肺结核者,说明细胞免疫反应随着肺结核患者病变严重程度的加重而加重,OPN释放入血的量也随之增多。大量的研究发现,OPN是结核杆菌感染致使的细胞免疫反应中的必不可少的一个细胞因子,其对白介素12(IL-12)介导的Th1型反应起诱导的作用,参与了抗结核免疫反应[6],故本实验认为血清OPN是体现早期肺结核病变严重程度和病变活动性的一个重要的敏感指标。
IL-18产生于活化巨噬细胞,协同IL-12对T淋巴细胞有着强大的诱导作用,使其产生INF—γ[7]。INF—γ主要是由自然杀伤细胞和活化T淋巴细胞分泌的一种对免疫具有调节作用的因子[8]。IL-18、INF—γ均是Th1型细胞因子,对机体的抗结核免疫反应均有重要作用。本实验发现,对照组血清IL-18、INF—γ的表达水平明显低于观察组,提示在肺结核发病期间IL-18、INF—γ扮演了重要的角色。非高热组的血清IL-18、INF—γ表达水平明显低于高热组,痰菌阴性者的血清IL-18、INF—γ表达水平明显低于痰菌阳性者,提示血清IL-18、INF—γ浓度也是体现肺结核患者病变活动性的一个重要指标。同时,病变较轻的结膜性胸膜炎和浸润性肺结核者的血清IL-18、INF—γ水平明显低于空洞性、粟粒性肺结核者,说明肺结核患者病变程度越严重,IL-18、INF—γ释放入血量则越多。此外,本实验还发现肺结核患者INF—γ水平的上升幅度不及OPN、IL-18明显,故可认为在肺结核患者病变严重程度或病变活动性的判断上,血清OPN和IL-18的检测比INF—γ的敏感度更高。
Hs-CRP属于急性时相反应蛋白(APRP),对吞噬细胞调节免疫应答、激活补体以及吞噬细菌等具有一定地促进作用[9]。正常人体中hs-CRP水平极低,但一旦发生组织受损、冠心病或者感染时hs-CRP水平会显著上升,特别是细菌感染的时候上升就更明显[10]。有学者发现活动性的肺结核患者体内血清hs-CRP表达水平显著上升[11]。本研究发现对照组患者的血清hs-CRP水平明显低于观察组,提示肺结核病变期间存在组织受损以及炎性反应的现象。非高热组的血清hs-CRP水平低于高热组,说明伴发高热症状的肺结核患者的炎性反应更为激烈。然而,痰菌阴性和阳性患者的血清hs-CRP水平无统计学差异,肺结核患者不同病变程度组间也无明显差异,说明血清hs-CRP尚不适合作为敏感指标对肺结核严重程度和病变活动性进行评估。
总之,肺结核者血清INF—γ、IL-18、OPN、hs-CRP水平明显上升。血清IL-18和OPN可以作为体现肺结核病变严重程度和病变活动性的两个重要敏感指标,在抗结核药物治疗效果的监测方面和病情的临床评估方面均有着极其重要的价值。至今尚未明确血清IL-18和OPN在肺结核免疫反应中是否存在联系,需要更深入地研究在肺结核细胞免疫反应中各炎性因子的关系,给今后的抗结核+免疫调节剂治疗提供良好的理论基础。
[1] Hasibuan FM, Shiratori B, Senoputra MA et al. Evaluation of matricellular proteins in systemic and local immune response to Mycobacterium tuberculosis infection[J]. Microbiol Immunol, 2015; 59(10): 623-32.
[2] Vecellio M, Roberts AR, Cohen CJ et al. The genetic association of RUNX3 with ankylosing spondylitis can be explained by allele-specific effects on IRF4 recruitment that alter gene expression[J]. Ann Rheum Dis, 2015.
[3] Dones P, Di GM, Failla MC et al. Intestinal tuberculosis in a child living in a country with a low incidence of tuberculosis: a case report[J]. BMC Res Notes, 2014; 7: 762.
[4] Shiratori B, 0000-0001-8234-5691 AO, Leano S et al. Elevated OPN,IP-10, and neutrophilia in loop-mediated isothermal amplification confirmed tuberculosis patients[J]. Mediators Inflamm, 2014; 2014: 513263.
[5] Siddiqi UR, Chagan-Yasutan H, Nakajima C et al. Distinct clinical features in nontuberculous mycobacterial disease with or without latent tuberculosis infection[J]. Tohoku J Exp Med, 2012; 226(4): 313-9.
[6] Ridruechai C, Sakurada S, Yanai H et al. Association between circulating full-length osteopontin and IFN-gamma with disease status of tuberculosis and response to successful treatment[J]. Southeast Asian J Trop Med Public Health, 2011; 42(4): 876-89.
[7] Mortaz E, Adcock IM, Tabarsi P et al. Interaction of Pattern Recognition Receptors with Mycobacterium Tuberculosis[J]. J Clin Immunol, 2014.
[8] Molza AE, Mangat K, Le RE et al. Structural Basis of Neuronal Nitric-Oxide Synthase Interaction with Dystrophin Repeats 16 and 17[J]. J Biol Chem, 2015.
[9] 张韵. VEGF、hs-CRP及TNF-α在鉴别肺结核及肺癌胸腔积液的应用价值[J]. 临床肺科杂志, 2013; 18(7): 1279-1280.
[10] Larsson G, Shenoy KT, Ramasubramanian R et al. Faecal calprotectin levels differentiate intestinal from pulmonary tuberculosis: An observational study from Southern India[J]. United European Gastroenterol J,2014; 2(5): 397-405.
[11] 汪海涛, 凌敏. 联合检测降钙素原、血沉、C-反应蛋白在活动性肺结核中的临床意义[J]. 临床肺科杂志, 2014; 19(8): 1466-1468, 1469.
The detective value of IL-18, OPN, INF—γ and hs-CRP in tuberculosis
Yuan Yuan, Cheng Ji
(The First Affiliated Hospital Of ChengDu Medical College, Chengdu 610500 China)
Objective Our retrospective study was aimed toanalyze the clinical value and the changes of the expressions of IL-18, OPN, INF—γ and hs-CRP in patients with tuberculosis. Methods Clinical data of 52 patients with tuberculosisreceived treatment at our hospitalfrom March, 2012 to May, 2015 was retrospectivelyanalyzed, including 16 patients with hyperpyrexia (temperature>39.0℃) , 39 patients with positive sputum smear. 45healthy persons at the same time at our hospital were chosen as the control group. The expressions of IL-18, OPN, INF—γ and hs-CRP in observe group and control group, hyperpyrexia group and non- hyperpyrexia group, positive and negative group, different degree of lesion group were compared. Results The expressions of IL-18, OPN, INF—γ and hs-CRP in control group were significantly lower than those in observe group. The expressions of IL-18,OPN, INF—γ and hs-CRP in non- hyperpyrexia group were lower than those in hyperpyrexia group. The expressions of IL-18,OPN, INF—γ in negative group were lower than those in positive group, but the expressions of hs-CRP in two groups had no statistical difference. The expressions of IL-18, OPN, INF—γ in miliary pulmonary tuberculosis group, cavity pulmonary tuberculosis group which had serious extent of lesion were all higher than those in epituberculosis group, tuberculous pleurisy group, but the expressions of hs-CRP in four groups had no statistical difference. Conclusion The levels of IL-18, OPN, INF—γ and hs-CRP in patients with tuberculosis are significantly increasing. The serumIL-18 and OPN are sensitive indexes in judging disease severity and disease activity of patients with tuberculosis.
IL-18, OPN, hs-CRP, tuberculosis, INF—γ
R593.22
A
1673-016X(2016)02-0117-04
2015-10-20
袁媛,E-mail: y20030272@163.com

