BrMC对肿瘤相关巨噬细胞条件培养基诱导内皮细胞管结构形成的影响
孙姝雯,崔迎红,邹 辉,郑 郁,任凯群,宋振威,全梅芳,李 朵,曹建国
(湖南师范大学医学院药学系,长沙 410013)
BrMC对肿瘤相关巨噬细胞条件培养基诱导内皮细胞管结构形成的影响
孙姝雯,崔迎红,邹 辉,郑 郁,任凯群,宋振威,全梅芳,李 朵,曹建国
(湖南师范大学医学院药学系,长沙 410013)
目的:研究8-溴-7-甲氧基白杨素(BrMC)对肝癌干样细胞活化的THP-1源性肿瘤相关巨噬细胞条件培养基诱导人脐静脉内皮HUVEC-12细胞系细胞管结构形成的作用。方法:存在或缺失BrMC处理的SMMC-7721细胞系肝癌干样细胞条件培养基孵育THP-1源性巨噬细胞。细胞免疫荧光检测CD68和CD163表达。ELISA检测IL-10和IL-12浓度。内皮管结构形成试验测定相应处理的肿瘤相关巨噬细胞条件培养基对HUVEC-12细胞管结构形成的影响。结果:肿瘤相关巨噬细胞CD163高水平表达,细胞因子分泌谱为IL-10high/IL-12low。BrMC降低肝癌干样细胞活化的肿瘤相关巨噬细胞条件培养基VEGF浓度,抑制其诱导HUVEC-12细胞管结构形成作用。结论:BrMC逆转肝癌干样细胞活化的肿瘤相关巨噬细胞条件培养基诱导HUVEC-12细胞管结构形成,其机制涉及减少VEGF分泌。
肝癌干样细胞;肿瘤相关巨噬细胞;8-溴-7-甲氧基白杨素;内皮管结构;VEGF
肿瘤新生血管形成为恶性肿瘤生长提供必需的营养物质和氧,是肿瘤侵袭和转移的重要原因之一[1]。肿瘤干细胞招募并重编程单核细胞源性巨噬细胞是促进肿瘤血管生成的重要因素[2]。抑制肿瘤血管生成,切断肿瘤生长和转移所依赖的营养物质和氧来源以及转移途径已经成为当前治疗肿瘤的重要策略之一[3]。我们最近的研究已经证实8-溴-7-甲氧基白杨素(8-bromo-7-methoxychrysin,BrMC)显著抑制肝癌干细胞侵袭能力[4]。本文研究BrMC对肝癌干样细胞活化的THP-1源性肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)诱导人脐静脉内皮HUVEC-12细胞系细胞管结构形成的调控作用。
1 资料与方法
1.1 细胞与试剂 人肝癌SMMC-7721细胞系、人单核细胞THP-1细胞系、人脐静脉内皮HUVEC-12细胞系细胞均购自中国科学院细胞库(中国上海市),由湖南师范大学医药学实验中心保存,SMMC-7721维持于含10%胎牛血清的高糖DMEM培养基,THP-1和HUVEC-12均用含10%胎牛血清的1640培养基培养,细胞置37℃、5% CO2的培养箱中培养。8-溴-7-甲氧基白杨素(BrMC)依据文献[5]合成,经高效液相色谱测定纯度大于95%。用二甲基亚砜稀释为10mmol/L,临用前稀释至所需浓度。IL-10、 IL-12和VEGF的ELISA试剂盒均购自欣博盛公司(中国深圳市)。
1.2 肝癌干样细胞条件培养基的收集
1.2.1 人肝细胞癌SMMC-7721细胞系干样细胞培养与扩增 参照文献[4]描述的方法,采用干细胞培养基超低粘附板悬浮培养法得到人肝细胞癌SMMC-7721细胞系球形成细胞。取第3代球形成细胞作为肝癌干样细胞用于后续实验。
1.2.2 BrMC处理的人肝癌SMMC-7721细胞系干样细胞条件培养基的制备 取肝癌干样细胞,5000个/ mL接种于3块超低粘附6孔板,每孔2.0 mL。分别加入终浓度为0、5、10、20 µmol/L BrMC。收集细胞培养基,0.22µm孔径的滤器过滤,即获取BrMC处理的肝癌干样细胞条件培养基(BrMC/ LCSLC-CM)。
1.3 THP-1源性肿瘤相关巨噬细胞的制备 取计数后的人单核细胞THP-1细胞系细胞,调节细胞密度2×105/ mL,接种于6孔板中,每孔加入2 mL含10% FBS的RPMI1640培养基。加入PMA(终浓度为100 ng/ mL),培养48h,细胞呈单层贴壁生长,即获取THP-1源性巨噬细胞,PBS洗涤3次,换为新鲜无血清培养基,加入IFN-γ(50ng/ mL)+ LPS(1μg/ mL)继续培养24 h,即可获得M1型THP-1巨噬细胞。更换为肝癌干样细胞培养基(LCSLC-CM)处理24 h,得到THP-1源性肿瘤相关巨噬细胞。
1.4 细胞免疫荧光 取M1型THP-1巨噬细胞和肿瘤相关巨噬细胞,PBS洗涤3次,加入4% 多聚甲醛固定10 min。PBS洗涤3次,0.1% Triton X-100-PBS透化10 min。PBS洗涤3次,2% BSA于37℃孵育30 min。PBS洗涤3次,加入CD68(1:200稀释,santa cruz biotechnology)和CD163(1:200稀释,santa cruz biotechnology),4℃孵育过夜。PBS洗涤3次,荧光标记二抗37℃下孵育60 min。PBS洗涤3次,hochest33258染核,荧光显微镜下观察并照相。
1.5 ELISA检测 IL-10、IL-12和VEGF的ELISA检测根据供应商的说明书进行,依据标准品工作曲线获得培养基样品中IL-10、 IL-12和VEGF浓度(单位为pg/ mL)。
1.6 内皮管结构形成试验 LCSLC-CM或BrMC/ LCSLC-CM孵育M1型THP-1源巨噬细胞24 h,收集BrMC/肿瘤相关巨噬细胞培养基,同时取M1型THP-1源巨噬细胞培养基作为对照,0.22µm孔径的滤器过滤用于内皮管结构形成实验。首先将24孔细胞培养板(平底)和200 µL tip头置冰箱预冷过夜。4℃下融化matrigel基质胶。24孔板冰上加入基质胶,每孔200 µL,放置5分钟,待其铺平培养板底后放入培养箱30 min,待基质胶凝固后取出。取人脐静脉内皮HUVEC-12细胞系细胞,调整细胞密度为1×105/ mL,离心后弃上清,用M1型THP-1巨噬细胞条件培养基或肝癌相关巨噬细胞条件培养基重悬后接种于matrigel基质胶铺底的24孔细胞培养板中,37℃,5%CO2饱和湿度培养12 h,4% 多聚甲醛固定并拍摄照片,计数完整的管结构数。管结构形成效率按照以下公式计算:管结构形成率(%)=各相应处理组管结构均数/完全培养基处理组管结构均数×100%。以上实验重复2次。
1.7 统计学分析 各组实验数据录入Spss 15.0 for windows evaluation 软件建立数据库,数据用均数±标准差(Mean±SD)表示。采用One Way ANOVA方差分析;首先进行方差齐性检验,在方差齐性时,多组均数比较采用LSD法;在方差不齐时,多组均数间比较采用Tukey's检验。P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤相关巨噬细胞的表征 细胞免疫荧光结果显示,M1型THP-1巨噬细胞和肿瘤相关巨噬细胞均表达巨噬细胞标志物CD68,然而,相比于M1型THP-1巨噬细胞,肿瘤相关巨噬细胞高表达M2型巨噬细胞标志物CD163(图1A)。此外,ELISA检测显示,肿瘤相关巨噬细胞高分泌IL-10而低分泌IL-12,而M1型THP-1巨噬细胞培养基呈IL-10low/IL-12high(图1B),进一步证实肿瘤相关巨噬细胞具有M2表型。
A,M1型巨噬细胞与肿瘤相关巨噬细胞表面标志物的免疫荧光显微图像(×20),两者同时表达CD68,但肿瘤相关巨噬细胞高表达CD163。B,M1型巨噬细胞与肿瘤相关巨噬细胞(TAM)培养基IL-10和IL-12的含量,肿瘤相关巨噬细胞(TAM)显示IL-10high/IL-12low。
2.2 BrMC对肝癌干样细胞活化的肿瘤相关巨噬细胞条件培养基诱导人脐静脉内皮HUVEC-12细胞管结构形成的影响 内皮管结构形成实验结果证明:BrMC呈浓度依赖拮抗肝癌干样细胞活化的肿瘤相关巨噬细胞条件培养基诱导人脐静脉内皮HUVEC-12细胞系细胞管结构形成作用(图2)。
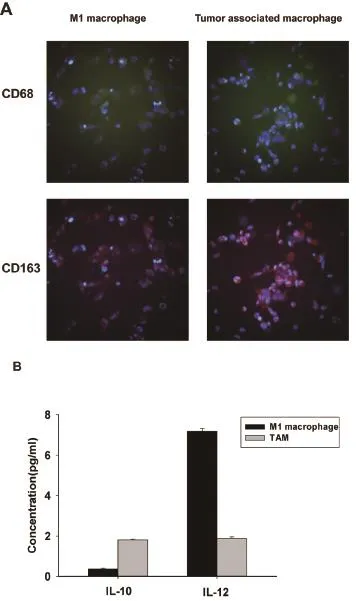
图1 肿瘤相关巨噬细胞表现M2型巨噬细胞特性
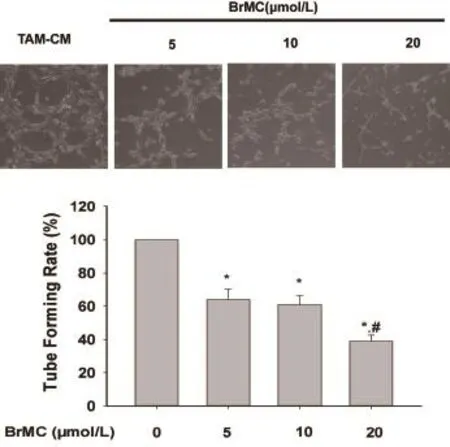
图2 BrMC抑制肝癌干样细胞活化的肿瘤相关巨噬细胞条件培养基诱导HUVEC-12细胞系细胞管结构形成
2.3 BrMC对肝癌干样细胞活化的肿瘤相关巨噬细胞VEGF分泌的影响 ELISA检测细胞培养基中VEGF的含量,结果显示,相比与M1型THP-1源巨噬细胞,肿瘤相关巨噬细胞培养基中VEGF增加(图3A),BrMC能有效地降低肝癌干样细胞活化的肿瘤相关巨噬细胞培养基VEGF含量,呈浓度依赖性(图3B)。
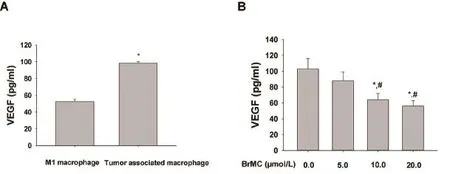
图3.BrMC抑制肝癌干样细胞活化的肿瘤相关巨噬细胞VEGF分泌A,M1型巨噬细胞与肿瘤相关巨噬细胞培养基VEGF含量的比较。
3 讨论
组织浸润单核细胞源性巨噬细胞在不同的环境因素诱导下,可极化为不同亚型,包括经典活化(M1)型和替代活化(M2)型。肿瘤微环境中存在的巨噬细胞已经定义为肿瘤相关巨噬细胞(TAMs),趋向于M2亚型特征。研究表明,TAMs在肿瘤进展中发挥至关重要的作用,促进肿瘤细胞增殖、血管生成、转移、侵袭、上调肿瘤干细胞相关基因[6]。M1型巨噬细胞表达高水平致炎因子(IL-1、TNF-α、IL-6、IL-12 和 IL-23),而M2型巨噬细胞通常表达抗炎细胞因子如IL-10和高表达清道夫、甘露糖和半乳糖受体为特征[7]。肿瘤微环境中招募的单核细胞源性巨噬细胞是肿瘤间质中的重要免疫调节细胞,在肿瘤微环境中参与和促成非可控性炎症[8]。本文的实验结果表明,SMMC-7721细胞系球形成细胞(肝癌干样细胞)活化的THP-1源性巨噬细胞(肿瘤相关巨噬细胞)高水平表达CD163蛋白,高分泌IL-10而低分泌IL-12;这些结果说明,肝癌干样细胞活化的肿瘤相关巨噬细胞呈M2表型。
肿瘤干细胞是构成肿瘤异质细胞中小部分细胞亚群,其与正常干细胞具有相似的特点如自我更新和多向分化潜能,因而,具有在免疫缺陷小鼠体内重构异质性肿瘤的能力等[9],其干细胞特性是肿瘤转移和复发等不良预后的最危险因素。此外,肿瘤新生血管形成亦是肿瘤侵袭和转移的重要原因之一。已有研究发现:在肿瘤血管内皮细胞与正常内皮细胞之间存在高达1000个以上的差异表达基因,包括成纤维细胞生长因子受体,基质金属蛋白酶(MMPs),NF-κB靶基因等[1,10]。在本文中,我们研究发现:SMMC-7721细胞系球形成细胞(肝癌干样细胞)活化的THP-1源性巨噬细胞(肿瘤相关巨噬细胞)VEGF分泌增加。
大量的研究证实,植物源性黄酮类化合物可能通过抑制内皮细胞增殖[11]或调控血管生成相关因子如VEGF[12]合成和分泌抑制肿瘤血管生成。我们之前的研究证实:BrMC相对选择性抑制肝癌干细胞的增殖、自我更新、上皮-间充质转化和侵袭[4,13]。在本文的研究中,我们证实新型白杨素类似物8-溴-7-甲氧基白杨素通过抑制SMMC-7721细胞系球形成细胞(肝癌干样细胞)活化的THP-1源性巨噬细胞(肿瘤相关巨噬细胞)VEGF分泌抑制内皮管结构形成。这些研究结果首次凸显了BrMC通过靶向作用于肝癌干样细胞与巨噬细胞交互作用,调控肿瘤微环境产生抗肝细胞癌作用的药效学特性。
[1] Bhati R, Patterson C, Livasy C A, et al. Molecular characterization of human breast tumor vascular cells [J]. Am J Pathol, 2008, 172(5):1381-1390.
[2] Riabov V, Gudima A, Wang N, et al. Role of tumor associated macrophages in tumor angiogenesis and lymphangiogenesis [J]. Front Physiol,2014, 5: 75.
[3] 吕祥, 冯彦军, 夏英,等. 淫羊藿素抑制人脐静脉内皮细胞血管生成及其机制 [J]. 世界中医药, 2014, 01: 71-75.
[4] Quan MF, Xiao LH, Liu ZH, et al. 8-bromo-7-methoxychrysin inhibits properties of liver cancer stem cells via downregulation of beta-catenin [J]. World J Gastroenterol, 2013, 19(43): 7680-7695.
[5] Zheng X, Meng W D, Xu Y Y, et al. Synthesis and anticancer effect of chrysin derivatives [J]. Bioorg Med Chem lett, 2003, 13(5): 881-884.
[6] Biswas SK, Allavena P, Mantovani A. Tumor-associated macrophages:functional diversity, clinical significance, and open questions [J]. Se mina Immunopathol, 2013, 35(5): 585-600.
[7] Allavena P, Sica A, Solinas G, et al. The inflammatory micro-environment in tumor progression: the role of tumor-associated macrophages [J]. Criti Rev Oncolo Hematol, 2008, 66(1): 1-9.
[8] Yang T, Zhang X, Wang M, et al. Activation of mesenchymal stem cells by macrophages prompts human gastric cancer growth through NF-kappaB pathway [J]. PloS one, 2014, 9(5): e97569.
[9] Su YC, Li SC, Wu YC, et al. Resveratrol downregulates interleukin-6-stimulated sonic hedgehog signaling in human acute myeloid leukemia [J]. Evid Based Complement Alternat Med, 2013, 2013: 547430.
[10] Ferrara N. VEGF and the quest for tumour angiogenesis factors [J]. Nat Revi Cancer, 2002, 2(10): 795-803.
[11] Grimm D, Bauer J, Schoenberger J. Blockade of neoangiogenesis, a new and promising technique to control the growth of malignant tumors and their metastases [J]. Curr Vasc Pharmacol, 2009, 7(3): 347-357.
[12] Yang X, Wu XZ. Main Anti-tumor Angiogenesis Agents Isolated From Chinese Herbal Medicines [J]. Mini Revi Medi Chem, 2015, 15(12):1011-1023.
[13] Ren KQ, Cao XZ, Liu ZH, et al. 8-bromo-5-hydroxy-7-methoxychrysin targeting for inhibition of the properties of liver cancer stem cells by modulation of Twist signaling [J]. Int J Oncol, 2013, 43(5): 1719-1729.
Effects of 8-bromo-7-methoxychrysin on angiogenesis of endothelial cells induced by tumorassociated macrophages
Sun Shu-wen, Cui Ying-hong, Zou Hui, Zheng Yu, Ren Kai-qun, Song Zhen-wei,Quan Mei-fang, Li Duo, Cao Jian-guo
(Department of Pharmaceutical Science, Medical College, Hunan Normal University, Changsha 410013, China )
Objective To investigate whether 8-bromo-7-methoxychrysin (BrMC) has an effect on angiogenesis of human umbilical vein endothelial cells induced by tumor-associated macrophages conditioned medium activated by liver cancer stemlike cell. Methods THP-1-drived macrophages incubated with SMMC-7721 liver cancer stem-like conditioned medium treated with or without BrMC. CD68 and CD163 protein expression was deter mined by cell immunofluorescence. IL-10 and IL-12 concentration was detected by ELISA assay. The effect of tumor-associated macrophage conditioned medium on HUVEC-12 endothelial cell tube formation was investigated. Results High level expression of CD163 in tumor-associated macrophages and its cytokine spectrum showed IL-10high/IL-12low. BrMC reduces VEGF in tumor-associated macrophage medium activated by liver cancer stem-like cells, and inhibit HUVEC-12 endothelial cell tube formation. Conclusion BrMC reverses HUVEC-12 endothelial cell tube formation reduced by tumor-associated macrophage-conditioned medium activated by liver cancer stemlike conditioned medium, which is involved in decrease VEGF secretion.
liver cancer stem-like cells; tumor-associated macrophages;8-bromo-7-methoxychrysin; endothelial cell tube formation; VEGF
R735.35
A
1673-016X(2016)02-0001-04
2016-01-10
国家自然科学基金面上项目(No 81172375);国家自然科学青年基金项目(No 30760248)
曹建国,E-mail:caojianguo2005@126.com

