结核分枝杆菌重组融合蛋白TB10.4-Hsp16.3诊断结核病*
谢 琳,任琪琪,郭婧玮,谭云洪,蒋华科,袁仕善
(1.湖南师范大学第一附属医院 / 湖南省人民医院检验科,长沙 410002;2.湖南师范大学医学院,长沙 410013;3湖南省胸科医院,长沙 410013)
结核分枝杆菌重组融合蛋白TB10.4-Hsp16.3诊断结核病*
谢 琳1,任琪琪2,郭婧玮3,谭云洪3,蒋华科2,袁仕善2
(1.湖南师范大学第一附属医院 / 湖南省人民医院检验科,长沙 410002;2.湖南师范大学医学院,长沙 410013;3湖南省胸科医院,长沙 410013)
目的:重组表达结核分枝杆菌融合蛋白TB10.4-Hsp16.3,分析其诊断结核病的价值。方法:重组PCR扩增TB10.4-Hsp16.3融合基因,克隆至pMD18-T载体,测序鉴定后,亚克隆至原核表达载体pET28a(+),PCR和双酶切鉴定阳性重组子,将重组DNA转化E.coli BL21,筛选阳性菌株,经IPTG诱导表达融合蛋白TB10.4-Hsp16.3,超声裂解菌体,对包涵体进行变性溶解和复性,金属螯合层析纯化,Western blot分析其免疫学活性,ELISA评价其诊断结核病的价值。结果:成功获得约750bp的融合基因TB10.4-Hsp16.3,构建了融合蛋白的重组表达质粒pETTB10.4-Hsp16.3,表达、纯化获得分子量约29kDa的融合蛋白,能被结核病患者血清特异识别;其ELISA诊断结核病的灵敏度为89.3%,特异度为90.7%,阳性预测值为90.9%,阴性预测值为89.1%,诊断效率达90.0%。结论:成功表达可用于结核病诊断的结核分枝杆菌融合蛋白TB10.4-Hsp16.3。
结核分枝杆菌;TB10.4-Hsp16.3;表达;结核病
结核病(Tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的一种严重危害人类健康的慢性传染病。早期诊断和治疗是TB防治的重要手段[1]。血清学诊断的关键在抗原,单一抗原的抗原谱较窄,含多个结核特异性抗原决定簇的融合蛋白是一种有效的寻找TB诊断特异性抗原的方法[2]。本文旨在构建Mtb融合蛋白TB10.4-Hsp16.3的原核表达体系,为其用于TB诊断和疫苗研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂及菌种 PCR扩增试剂盒、DNA胶回收纯化试剂盒、pMD18-T vector、限制性内切酶BamH I 和Hind III均购自大连宝生物工程公司;E.coli DH5ɑ,E.coli JM109,E.coli BL21,pET-28a(+)为本室保存;Mtb标准菌株H37Rv由湖南省胸科医院检验科提供。
1.1.3 血清 TB阳性血清由湖南省胸科医院检验科提供;非结核肺病患者及健康体检者血清由湖南省人民医院检验科提供。
1.2 方法
1.2.1 融合基因TB10.4-Hsp16.3的扩增 根据Genbank报道的Mtb H37Rv株TB10.4和Hsp16.3基因序列设计如下引物:TB10.4上游引物(P1):GGAT CCATGTCGCAAATCATGTACAACT,TB10.4下游重叠引物(P2):GCTTCCACCGCCACCGCCGCCCCATTTG;Hsp16.3上游重叠引物(P3):GGTGGCGGTGGAAGCATG GCCACCACC,Hsp16.3下游引物(P4):AAGCTTTCAGTT GGTGGACCGGATC。P1含BamH I 酶切位点,P4含Hind III酶切位点。委托上海铂尚生物技术公司合成。按文献[3]提取Mtb H37Rv基因组DNA为模板,分别以P1和P2、P3和P4为引物对,扩增TB10.4和Hsp16.3基因片段。回收纯化TB10.4和Hsp16.3,重叠延伸PCR扩增融合基因TB10.4-Hsp16.3,回收纯化融合基因TB10.4-Hsp16.3。
1.2.2 TB10.4-Hsp16.3的克隆与鉴定 将TB10.4-Hsp16.3连接到克隆载体pMD18-T载体,转化E.coli JM109感受态细胞,菌落PCR筛选阳性克隆,进行测序鉴定。
1.2.3 重组TB10.4-Hsp16.3表达载体的构建 将含pMD18-T-TB10.4-Hsp16.3与pET28a(+)的E.coli JM109分别接种于相应抗性的LB培基中放大培养,碱裂解法提取质粒DNA。BamH I、Hind III双酶切并回收纯化目的基因及表达载体片段,将载体和目的基因混合,用T4DNA连接酶于16℃连接过夜,转化E.coli DH5ɑ感受态细胞,筛选阳性重组子,PCR及质粒DNA双酶切鉴定。
1.2.4 TB10.4-Hsp16.3的表达与纯化 将重组子质粒DNA转化E.coli BL21,筛选阳性菌株,接种于含50mg/L卡那霉素的LB培基中培养过夜,按1:100放大培养至OD600约0.6,加IPTG至0.01mmol/L,37℃诱导2h,离心收集菌体,裂解液重悬,反复冻融3次,冰浴超声(250W,5s,40次),4℃ 11 000 r/min离心30min,收集上清和沉淀。将沉淀溶解于含8mol/L尿素的裂解液,4℃静置平衡约1h,4℃ 11 000 r/min 离心20min,收集上清,缓慢加入裂解液梯度倍比稀释至尿素浓度为4mol/L、2mol/L,使蛋白缓慢复性,4℃静置过夜。11 000 r/min离心30min,取上清,His-bindTM柱亲和层析纯化TB10.4-Hsp16.3,12%SDS-聚丙烯酰胺凝胶电泳分析蛋白的表达。用 pH7.4的磷酸盐缓冲液透析去除咪唑,中间换液6次。
1.2.5 TB10.4-Hsp16.3的免疫活性分析 纯化的重组蛋白经12%SDS-PAGE分离后,转移至NC膜,5%脱脂奶粉封闭,将膜分别与1:100稀释的TB患者阳性混合血清和健康体检者混合血清于37℃作用2h,洗膜,加1:3000稀释的HRP-羊抗人IgG,37℃ 作用2h,洗膜,以增强型ECL化学发光检测观察结果。
1.2.6 TB10.4-Hsp16.3的ELISA检测结核病人血清抗体 将TB10.4-Hsp16.3稀释至0.25μg/100µL,100µL/孔包被微孔板,4℃孵育过夜;弃包被液,加封闭液于37℃作用2h;洗板;加1:100稀释的待测血清,37℃ 作用2h;洗板;加1:3000稀释的HRP-羊抗人IgG,37 ℃作用2h;洗板;加TMB显色液A、B各1滴,显色5-10min,加终止液1滴,于酶标仪上读取 OD450。以健康体检者血清OD450均值+2SD为界限值,评价待测血清的检测结果。
2 结果
2.1 融合基因TB10.4-Hsp16.3的扩增 重组PCR技术扩增融合基因的电泳图谱如图1和图2。由图1可知,PCR技术分别获得了约300bp的 TB10.4基因和约450bp 的Hsp16.3基因,重叠PCR获得约750bp的融合基因TB10.4-Hsp16.3。
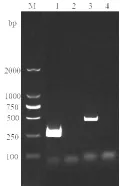
图1 TB10.4、Hsp16.3基因的扩增

图2 TB10.4-Hsp16.3基因的扩增
2.2 TB10.4-Hsp16.3的克隆与鉴定 阳性克隆菌落PCR见图3。由图3可知,阳性克隆菌落PCR获得约750bp的片段。测序分析发现,克隆序列与GenBank报道的TB10.4及Hsp16.3序列相比,在Hsp16.3的第115位由A突变为G,相应氨基酸由苯丙氨酸变为丝氨酸,第424位由G突变为A,相应氨基酸由丝氨酸变为苯丙氨酸。
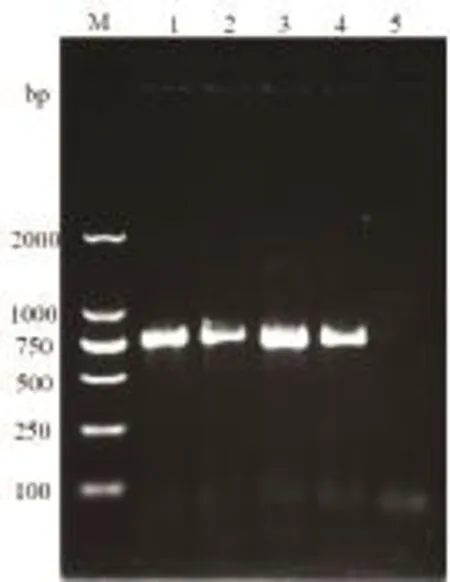
图3 pMD18-T-TB10.4-Hsp16.3的菌落PCR
2.3 重组TB10.4-Hsp16.3表达质粒的构建 重组TB10.4-Hsp16.3表达质粒的PCR和双酶切图谱见图4,pET-TB10.4-Hsp16.3质粒PCR和双酶切均获得750bp的目的片段。
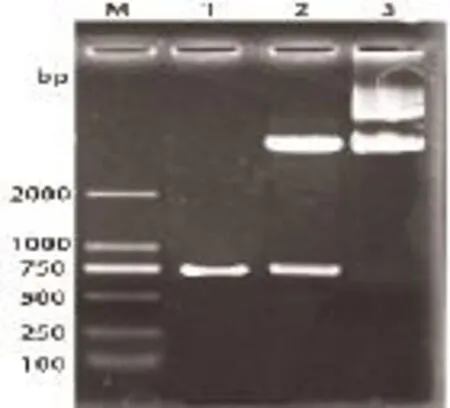
图4 pET-TB10.4-Hsp16.3的菌落PCR及双酶切鉴定
2.4 TB10.4-Hsp16.3的表达与纯化 重组TB10.4-Hsp16.3的电泳图谱见图5。由图5可知,表达的融合蛋白主要存在于包涵体中。经尿素变性溶解、复性后,金属螯合层析获得约29kDa的目的蛋白。
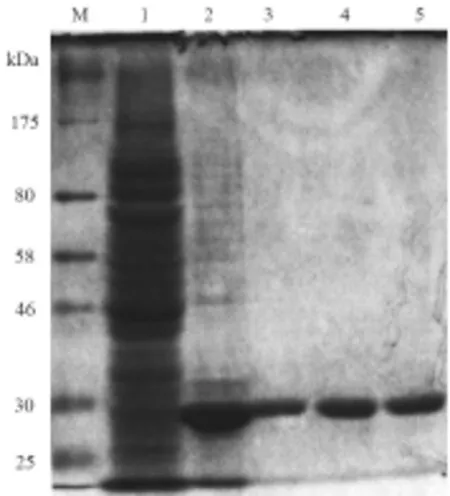
图5 TB10.4-Hsp16.3的表达与纯化
2.5 TB10.4-Hsp16.3的免疫活性分析 TB10.4-Hsp16.3的免疫印迹图谱见图6,纯化的TB10.4-Hsp16.3可被TB患者混合血清识别,在约29kDa处有特异的显色条带,而与正常体检者混合血清无反应,表明其具有良好的免疫活性。

图6 TB10.4-Hsp16.3的免疫活性鉴定
2.6 TB10.4-Hsp16.3的ELISA检测结核病人血清抗体 以健康体检者血清OD450均值+2SD为正常界限值,56例TB患者中阳性为50例,53例非结核肺病患者中阳性为5例,54例健康体检者中阳性为5例,其检测灵敏度、特异度、阳性预测值、阴性预测值、诊断效率依次为89.3%、90.7%、90.9%、89.1%、90.0%。
3 讨论
TB在全球范围内又呈现出蔓延的趋势[4],这给TB的诊断提出了更高的要求。血清学诊断简便、快速、价格低廉,已在多个TB高负担国家得到广泛应用[5],但该法关键是获得敏感性和特异性均高的诊断抗原。TB10.4作为Mtb主要的T细胞抗原,是Mtb早期分泌蛋白ESAT-6家族新发现的成员,能被约70%以上TB病人T细胞强烈识别,释放高水平的γ-IFN,更好地促进Th1细胞增殖分化,活化巨噬细胞、CTL细胞等,清除感染Mtb的靶细胞,具有比其他家族成员更强的免疫原性,能在Mtb感染过程中刺激机体产生抗体,是Mtb表现其毒力必不可少的因子,其作为一种替代ESAT-6的结核候选抗原不断受到关注[6,7]。Mtb小分子热休克蛋白Hsp16.3是Mtb在进入宿主巨噬细胞等情况下大量诱导合成的一种蛋白,是Mtb重要免疫保护性抗原,对Mtb在宿主巨噬细胞内长期生长、繁殖和致病有重要作用[8]。Hsp16.3作为一种TB血清学抗原已被广泛研究。以Hsp16.3蛋白为抗原的ELISA检测临床标本Mtb抗体的灵敏度67.0%,特异度100%,准确度84.0%,具有潜在的诊断价值(苏明权等,2006)。
现有的单一抗原均不能被全部或大多数TB患者血清识别,将多个抗原或多肽融合表达,可获得更有效和广泛的抗原表位,提高免疫反应效率和检测灵敏度[9,10],以期满足TB临床诊断的需要。融合蛋白Ag85B-Hspl6.3具有Ag85B和Hsp16.3的抗原表位,既可检出Mtb活动期病人,也可检出Mtb休眠期病人,可进一步提高Mtb感染检测的灵敏度和特异性[11]。融合蛋白作为一种抗原来诊断Mtb感染,其敏感性高于单一的蛋白,同时保持了较高的特异性[12,13],具有良好的应用前景和研究价值。
本文采用重叠延伸PCR扩增获得融合基因TB10.4-Hsp16.3,其阳性克隆测序结果显示,第115位由A突变为G,相应氨基酸由苯丙氨酸变为丝氨酸,第424位由G突变为A,相应氨基酸由丝氨酸变为苯丙氨酸,其他氨基酸序列未发生改变;且经ProtScale蛋白质亲疏水性分析、SOPM二级结构分析、TMHMM Server v.2.0跨膜螺旋分析,以及免疫印迹及ELISA证实不影响融合蛋白的免疫活性。表达的重组融合蛋白主要为包涵体形式存在。将包涵体用尿素溶解变性、复性,用金属螯合层析纯化,获得纯化的TB10.4-Hsp16.3。重组融合蛋白TB10.4-Hsp16.3具有较好的检测灵敏度和诊断效率。下一步研究将建立重组TB10.4-Hsp16.3的纳米金生物传感器,为开发新型的Mtb诊断试剂提供新的实验依据。
[1] 袁仕善, 邓志高, 谭云洪, 等. 重组结核分枝杆菌ESAT-6的克隆与表达[J]. 湖南师范大学学报(医学版), 2013, 10(3): 8-10.
[2] 张灵霞, 李国利, 陈彭, 等. 结核分枝杆菌组合蛋白的表达及血清学诊断价值的评价[J]. 临床肺科杂志, 2013, 18(1): 97-99.
[3] Zhang ZQ. Ishaque M. Evaluation of methods for isolation of DNA from slowly and rapidly growing Mycohacteria[J]. International Journal of Leprosy, 1997, 65(4): 469-476.
[4] World Health Organization. Global tuberculosis report. 2015. http: http://www. who. int/tb/Global_TB_Facts. pdf?ua=1.
[5] Grenier J, Pinto L, Nair D, et al. Widespread use of serological tests for tuberculosis: data from 22 high-burden countries[J]. Eur Respir J,2012, 39(2): 502-505.
[6] Hervas-Stubbs S, Majlessi L, Simsova M, et al. High frequency of CD4 +T cells specific for the TB10. 4 protein correlates with protection against Mycobacterium tuberculosis infection [J]. Infect Immun, 2006,74(6): 3396-3407.
[7] Axelsson-Robertson R, Weichold F, Sizemore D, et al. Extensive major histocompatibilitycomplex class I binding promiscuity for Mycobacterium tuberculosis TB10. 4peptides and immune dominance of human leucocyte antigen (HLA)-B*0702 and HLA-B*0801 alleles in TB10. 4CD8 T-cell responses[J]. Immunology, 2010, 129(4): 496-505.
[8] 徐芳, 姚楠, 田玺泽, 等. 结核分枝杆菌热休克蛋白Hsp16. 3的表达、纯化及鉴定[J]. 中国病原生物学杂志, 2012, 7(1): 1-4.
[9] 郄霜, 戴振华, 冯晓燕, 等. 重组结核分枝杆菌抗原在结核病诊断中的应用[J]. 中国卫生检验杂志, 2013, 23(4): 1051-1053.
[10] Dietrich J, Aagaard C, Leah R, et al. Exchanging ESAT6 with TB10. 4 in an Ag85B fusion molecule-based tuberculosis subunit vaccine: efficient protection and ESAT6-based sensitive monitoring of vaccine efficacy[J]. J Immunol, 2005, 174(10): 6332-6339.
[11] 张彩勤, 张海, 赵勇, 等. 结核分枝杆菌分泌蛋白Ag85B, Hsp16. 3和ESAT6在血清学检测中的初步应用[J]. 现代生物医学进展, 2011,11(3): 401-404.
[12] Souza II, Melo ES, Ramos CA, et al. Screening of recombinant proteins as antigens in indirect ELISA for diagnosis of bovine tuberculosis[J]. Springerplus, 2012, 1(1): 77.
[13] 张艳, 范大鹏, 岳永宁, 等. 结核分枝杆菌rHpsX-MPT64融合蛋白的制备与临床应用[J]. 中国人兽共患病学报, 2014, 30(1): 40-44.
Diagnosis of Tuberculosis with recombinant fusion protein TB10.4-Hsp16.3 from Mycobacteria tuberculosis
Xie Lin1, Ren Qi-qi2,Guo Jing-wei3, Tan Yun-hong3, Jiang Hua-ke2, Yuan Shi-shan2,
(1.Clinical Laboratory, The First Affiliated Hospital of Hunan Normal University, Changsha, 410002, China;2.Hunan Normal University School of Medicine, Changsha 410013, China;3. Hunan Chest Hospital, Changsha, 410013, China)
Objective To clone and express the recombinant fusion protein TB10.4-Hsp16.3 of Mycobacteria tuberculosis(M. tuberculosis) and analyze the value of diagnosis of tubercul-osis. Methods The fusion gene TB10.4-Hsp16.3 was amplified by recombinant PCR from ge-nomic DNA of M. tuberculosis and was cloned into pMD18-T vector. Positive clones was identified by clony PCR and DNA sequencing. The fusion gene TB10.4-Hsp16.3 was subcl-oned into the prokaryotic expression vector pET28a(+) and identified by colony PCR and do-uble enzyme digestion,TB10.4-Hsp16.3 was expressed in E.coli BL21 containing recombinant plasmid pET-TB10.4-Hsp16.3 when induced by IPTG; Bacterial precipitation was dis-sociated by ultrasonic lysis method, the inclusion body was dissolved in 8mol/L urea and the fusion protein TB10.4-Hsp16.3 was renatured by low urea gradient and then purified by nickel ch-elate affinity chromatography.The immunological activity of TB10.4-Hsp16.3 was analyzed by western-bolt and the diagnosis efficiency for tuberculosis was evaluated by enzyme-linked immunosorbent assay.Results The Amplified fusion gene TB 10.4-Hsp16.3 was about 750bp; the recombinant expression plasmid pET-TB10.4-Hsp16.3 was constructed through subcloning the fusion gene TB10.4-Hsp16.3 into prokaryotic expression vector pET28a(+);The fusion pro-tein was expressed in E.coli BL21 containing plasmid pET-TB10.4-Hsp16.3 when induced by IPTG and was purified from the lysate; the fusion protein was about 29 kDa and recognizedby antibodies of tuberculosis sera. The sensitivity,specificity,positive predictive value, negativepredictive value and the diagnostic efficiency of ELISA using fusion protein TB10.4-Hsp16.3 as antigen to detect tuberculosis was showed to be 89.3%, 90.7%, 90.9%, 89.1%, 90% re-spectively. Conclusion The recombinant fusion protein TB10.4-Hsp16.3 which can be used to test tuberculosis was successfully expressed and purified from prokaryotic expression E.coli lysate.
Mycobacteria tuberculosis; TB10.4-Hsp16.3; expression; Tuberculosis
R52
A
1673-016X(2016)02-0012-04
2015-12-03
湖南省研究生创新性项目(CX2015B184)
袁仕善,E-mail:yuanshishan@aliyun.com

