Mir-148a慢病毒表达载体构建及其稳定表达细胞系的筛选
李 悦,罗艳红,谌 思,王照飞,彭小宁
(1.湖南师范大学医学院,长沙 410006;2.湖南师范大学第一附属医院,湖南省人民医院,长沙 410005)
Mir-148a慢病毒表达载体构建及其稳定表达细胞系的筛选
李 悦1,罗艳红1,谌 思2,王照飞2,彭小宁1
(1.湖南师范大学医学院,长沙 410006;2.湖南师范大学第一附属医院,湖南省人民医院,长沙 410005)
目的: 构建人源性mir-148a慢病毒过表达载体,并筛选过表达mir-148a稳定细胞株U251、U87、BT325,鉴定mir-148a在稳定细胞系中的表达水平。方法: 设计并合成mir-148a上下游引物,PCR扩增mir-148a基因片段,经过酶切后克隆至慢病毒载体上,构建pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin-mir-148a过表达载体,在293T细胞中与pHelper1.0、pHelper2.0包装产生慢病毒,测定mir-148a慢病毒滴度。用构建好的慢病毒感染神经胶质瘤细胞系U251、U87、BT325,用嘌呤霉素筛选,筛选稳定细胞系后qRT-PCR检测mir-148a的表达情况。结果: 测序结果证明mir-148a慢病毒载体构建成功并获得了相应的慢病毒。嘌呤霉素筛选后获得稳定表达mir-148a的U251、U87、BT325细胞系,mir-148a表达水平在三种细胞中分别升高167.38倍、 7.19倍、11.46倍。结论: 成功构建了mir-148a的慢病毒载体,筛选得到了mir-148a过表达稳定胶质瘤细胞系U251、U87、B325。
mir-148a;慢病毒载体;神经胶质瘤细胞;q RT-PCR
微小RNA(microRNA,miRNA)是一类广泛存在于动植物中的长度为19-25个核苷酸的非编码单链小分子RNA,它是一类新的基因调控分子,其通过5’端种子序列与靶基因3’UTR互补配对,对靶基因产生负性调控作用。miRNA 与其靶基因组成了一个复杂的调控网络,控制细胞以及整个个体多种重要的生命活动,包括早期发育、细胞增殖、细胞分化、细胞凋亡等[1,2]。miRNA还可以通过调控肿瘤细胞侵袭、转移等恶性生物行为而参与肿瘤的眼睛过程。
mir-148a基因定位于7号染色体p15.2,目前研究发现,多种miRNAs参与调控胶质瘤的发生发展,其中包括高表达的mir-148a[3,4]。研究发现mir-148a在胶质母细胞瘤中作为负性风险因子存在,高表达的mir-148a促进胶质母细胞瘤的恶性化进程的演变,且与患者生存率成负相关性[5,6]。Li等[7]发现mir-148a在异柠檬酸脱氢酶1(IDH1)突变型胶质瘤组织中表达下降,起到抑瘤基因的作用,这是由于在IDH1突变型胶质瘤中mir-148a启动子CpG岛甲基化抑制其表达并且促进恶性化进程。为了进一步研究mir-148a在胶质瘤中的功能及作用机制构建mir-148a慢病毒表达载体,建立mir-148a过表达的胶质瘤稳定细胞系。
1 资料与方法
1.1 实验材料 病毒载体GV369(pGC-FU-3FLAGSV40-EGFP-IRES-puromycin)、包装质粒pHelper1.0、pHelper2.0、polybrene购买于上海吉凯基因公司,Taq聚合酶购买于SinoBio公司,AgeⅠ、NheⅠ、T4连接酶购于美国NEB公司,dNTP购于Takara公司,质粒抽提试剂盒购于Promega公司,台盼兰购于上海捷倍思基因技术公司,DMEM高糖培养基、胎牛血清购于Gibco公司,DMSO购于上海生物试剂厂,胰酶购于Hyclone公司,lipofecta mine2000购于Invitrogen公司,逆转录试剂盒购于Thermo公司,qRT-PCR试剂盒购于唯赞生物公司,嘌呤霉素购于Sigma公司,293T细胞、DH5α、神经胶质瘤细胞U251、U87、BT325购于广州龙龙生物有限公司。
1.2 实验方法与步骤
1.2.1 引物设计与目的片段的扩增 从miRBase数据库中搜索到mir-148a成熟序列,并由上海吉凯基因生物有限公司进行引物合成。正向引物mir-148a-F:GAGGATCCCCGGGTACCGGTCGAGTTATTCTTCTTTGT CTTAGC,反向引物mir-148a-R: CACACATTCCACAGG CTAGCCCAAGGGAAAGGCGCAGCGAC,下划线区域为酶切位点,正向引物的酶切位点为AgeⅠ,反向引物的酶切位点为NheⅠ。以含有目的基因序列的cDNA为模板进行PCR扩增,反应体系如下: cDNA模板 1µL,5× PCR Buffer 4µL,2.5mM dNTPs 1.6µL,10µM mir-148a-F 0.4µL,10µM mir-148a-R 0.4µL,Taq polybrene 0.2µL,ddH2O 12.4µL,总反应体系为25µL。PCR反应条件: 95℃预变性5 min,94℃变性30sec,55℃退火30sec,72℃延伸30sec,循环30次,72℃延长10 min,4℃保存。
1.2.2 mir-148a慢病毒表达载体的构建及鉴定 将PCR扩增产物用1%琼脂糖凝胶电泳进行分离纯化,回收目的片段。对所得目的片段进行AgeⅠ、NheⅠ双酶切,酶切后与慢病毒表达载体pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin质粒连接,连接反应条件为: 酶切后产物 1µL,pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin质粒载体 1µL,10× T4 Buffer 2µL,T4 DNA连接酶 1µL,ddH2O 13µL,总反应体系20µL。反应条件为: 16℃ 水浴反应6h。连接产物转化感受态细胞DH5α,将已转化的感受态细胞铺于AMP抗性的LB琼脂培养基上,37℃平板倒置培养过夜,挑选单克隆菌落送公司测序。
1.2.3 mir-148a慢病毒的包装和滴度测定 将pGCFU-3FLAG-SV40-EGFP-IRES-puromycin -mir-148a载体20µg和pHelper1.0 15µg、pHelper2.010µg混合,按照Lipofecta mine2000说明书共转染293T细胞,37℃、5%CO2培养箱中培养8h后倒去含有转染混合物的培养基,更换成新的完全培养基继续培养48h。48h后收集细胞上清液,4℃,4000g离心10 min,去除细胞碎片,用0.45µm滤过器过滤上清液,获得慢病毒原液。测定滴度前一天,将293T细胞铺于96孔板,每个孔4×104个细胞,体积为100µL。准备7个无菌Ep管,每管加入90µL无血清培养基,取待测定的病毒原液10µL加入第一个管中,混匀后,取10µL加入第二个管中,依次类推稀释直至最后一管。选取细胞孔并做好标记后,吸弃90µL原培养基,加入90µL稀释好的病毒溶液,放入培养箱培养24h。24h后加入完全培养基100µL,继续培养96h,观察荧光表达情况,并计算病毒原液滴度,计算公式: 病毒滴度(Tu/ mL)=GFP阳性细胞数/稀释倍数。
1.2.4 mir-148a慢病毒感染神经胶质瘤细胞 将处于对数生长期的U251、U87、BT325细胞接种于24孔板,每孔细胞数为2×104个,37℃、5%CO2条件下培养至细胞融合度为70%左右时进行病毒感染,稀释病毒滴度为1×108TU/ mL,MOI=1。弃去孔板中的原培养基,加入重组慢病毒pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin-mir-148a混合液(无血清培养基1000 µL、pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin-mir-148a质粒 1µL),与此同时设立慢病毒空载体pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin组(无血清培养基1000µL、滴度为1×108TU/ mL的pGC-FU-3FLAGSV40-EGFP-IRES-puromycin质粒 1µL)和慢病毒阴性对照组(无血清培养基1000µL),培养8h后更换成为新鲜完全培养基,感染24h后再更换为含有嘌呤霉素(浓度为1.25µg/µL)的完全培养基进行筛选,嘌呤霉素筛选14天,培养细胞并扩增至6孔板。
1.2.5 qPCR检测稳定细胞系中mir-148a的表达 收集嘌呤霉素筛选的U251、U87、BT325细胞,用Trizol法提取总RNA,去离子水溶解沉淀,测定RNA浓度,选定RNA在A260mm/A280mm≥1.8的样品逆转录成cDNA(包括mir-148a、内参U6),逆转录反应体系及条件:①总RNA 5µg,Bulge-loop mir-148a/U6 RT primer 1µL,ddH2O to 12µL 65℃ 5 min;②5×Reacting Buffer 4µL,Rnase Inhibitor 1µL,反转录酶 1µL,10×dNTP Mixture 2µL,42℃ 60 min;70℃ 5 min;4℃保持。应用唯赞公司的qRT-PCR试剂盒检测mir-148a在稳定转染后的细胞系中的表达水平,反应体系为20µL,其中cDNA 2µL,mir-148a/U6正向引物0.8µL,mir-148a/U6通用引物 0.8µL,2× SYBR Green Mix 10µL,ddH2O to 20µL。反应条件为: 95℃预变性5 min,变性95℃ 10sec,60℃退火/延伸 30sec,循环40次。扩增过程由Bio-Rad CF×96 qPCR仪完成。每个样品设置3个复孔,重复试验3次,得出-△△CT值,按照目的基因表达量=2-△△CT公式计算各样品这个mir-148a的表达量。
1.3 数据统计分析 实验所得数据均以mean±SD表示,采用SPSS13.0进行统计分析,Hsa-mir-148a表达水平采用两组均数比较t检验分析。
2 结果
2.1 慢病毒载体pGC-FU-3FLAG-SV40-EGFPIRES-puromycin-mir-148a的构建与鉴定 在目的基因引物的两端设计了AgeⅠ、NheⅠ两个酶切位点,普通PCR扩增mir-148a基因,并将扩增产物连接于pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin质粒,构建慢病毒载体pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin-mir-148a,通过转化、培养挑选阳性克隆测序(图1),测序结果与NCBI数据库前体序列相一致(图2)。通过测序及数据库比对得到了正确的pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin-mir-148a重组慢病毒载体进行大量扩增,并进行质粒抽提。
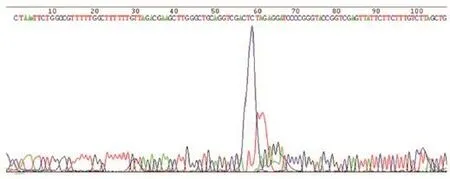
图1 慢病毒重组载体pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin-mir-148a的部分测序结果

图2 慢病毒重组载体pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin-mir-148a的测序结果与NCBI数据库比对结果
2.2 慢病毒的包装和滴度测定 将慢病毒包装三质粒系统的DNA转染293T细胞,培养48h后倒置显微镜下观察,可见GFP绿色荧光(图3),证明慢病毒包装成功。收集病毒上清,4℃,4000g离心10 min,去除细胞碎片,用0.45µm滤过器过滤,分装保存于-80℃冰箱。根据病毒预期滴度,进行成倍递减稀释病毒后感染293T细胞,培养96h后观察GFP表达情况,计算得到慢病毒滴度为8×108TU/ mL。

图3 293T细胞感染mir-148a慢病毒(×200)A为可见光;B为荧光
2.3 筛选稳定过表达mir-148a的U251、U87、BT325细胞系 将mir-148a慢病毒感染神经胶质瘤细胞系U251、U87、BT325,通过14天的嘌呤霉素筛选后,更换培养皿扩大培养,获得稳定表达mir-148a的胶质瘤细胞系(图4)。
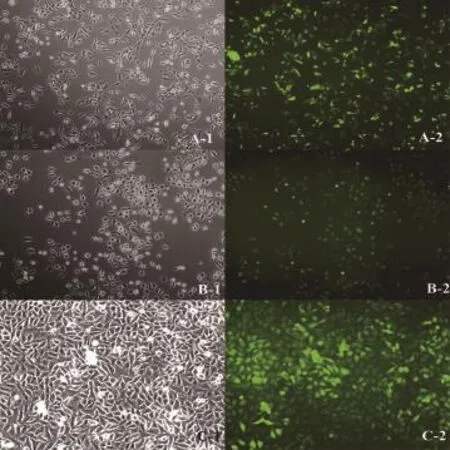
图4 mir-148a慢病毒感染胶质瘤细胞系稳定筛选结果(×200)
2.4 qPCR检测稳定转染细胞系中mir-148a表达提取稳定转染慢病毒pGC-FU-3FLAG-SV40-EGFPIRES-puromycin-mir-148载体的U251、U87、BT325三种细胞系的RNA并逆转录成cDNA后,使用qRTPCR对感染了pGC-FU-3FLAG-SV40-EGFP-IRES-puromycin-mir-148a病毒载体和pGC-FU-3FLAGSV40-EGFP-IRES-puromycin病毒空载体的U251、U87、BT325细胞进行mir-148a表达水平检测,检测发现在RNA水平,mir-148a表达水平升高,其中在U251细胞系中升高167.38倍,U87细胞中升高7.19倍,BT325细胞系中升高11.46倍(图5),说明稳定细胞系构建成功。
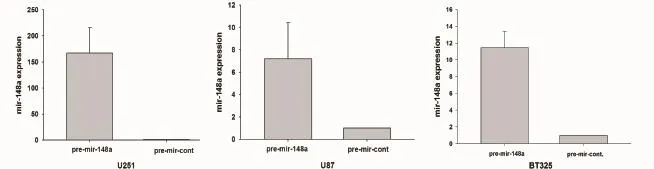
图5 筛选的稳定细胞系U251、U87、BT325中,Mir-148a在mir-148a过表达组与对照组比较的表达情况。
3 讨论
MiRNA作为一类新型的基因表达调控小分子,参与生物体内的多种生理学或病理学功能,尤其参与到肿瘤的发生发展中,在肿瘤的迁移、转移中起到重要作用。近年来关于miRNA的功能研究越来越多。MiRNA的瞬时转染或稳定转有利于其自身功能的研究。
慢病毒载体是以HIV-1为基础发展起来的新载体,可以高效率地感染非周期性和有丝分裂细胞,使病毒基因组整合到宿主基因组,长时间、稳定表达外源性基因[8]。同时,慢病毒为自杀性病毒,感染目的细胞后不再感染其他细胞或生成新的病毒颗粒,安全性高,在复杂多样的体内和体外环境、动物模型及人类临床试验中,慢病毒的安全性也是可靠的。因此慢病毒是一类强有力的基因运输工具,成为基因研究中的热点载体。
本实验中我们采用分子技术成功构建了mir-148a慢病毒过表达载体,并成功建立了稳定表达mir-148a 的U251、U87、BT325细胞株。到目前为止,大量的研究报答mir-148a异常表达与多种肿瘤相关,其中包括胃癌[9]、肝癌[10]、骨肉瘤[11]、非小细胞肺癌[12]等,mir-148a在这些肿瘤中通过抑制靶基因的表达发挥其调控肿瘤细胞增殖、转移、侵等生物学功能的作用。由此可见,mir-148a与肿瘤的发生发展进程密切相关,但是关于mir-148a如何在肿瘤的发生发展进程中的产生作用,尤其是在神经胶质瘤中的所起到作用的深入研究的报道相对较少,因此成功构建的mir-148a慢病毒过表达载体能够为进一步研究mir-148a在胶质瘤发生发展过程中的作用奠定了坚实基础。
[1] Wei R,Yang J,Liu GQ,et al.Dynamic expression of microRNAs during the differentiation of human embryonic stem cells into insulinproducing cells[J].Gene. 2013 Apr 15;518(2):246-55.
[2] Ono K, Horie T, Nishino T,et al.MicroRNA-33a/b in lipid metabolism -novel “thrifty” models[J].Circ J. 2015;7 9(2): 278-84.
[3] Roth P, Wischhusen J, Happold C, et al. A specific miRNA signature in the peripheral blood of glioblastoma patients[J]. J Neurochem. 2011 Aug; 118(3):449-57.
[4] Hua D, Mo F, Ding D, et al. A catalogue of glioblastoma and brain MicroRNAs identified by deep sequencing[J]. OMICS. 2012 Dec; 16(12):690-9.
[5] Kim J, Zhang Y, Skalski M, et al. microRNA-148a is a prognostic oncomiR that targets MIG6 and BIM to regulate EGFR and apoptosis in glioblastoma[J]. Cancer Res. 2014 Mar 1; 74(5): 1541-53.
[6] Wang H, Pan JQ, Luo L, et al. NF-κB induces miR-148a to sustain TGF-β/Smad signaling activation in glioblastoma[J]. Mol Cancer. 2015 Feb 11; 14: 2.
[7] Li S, Chowdhury R, Liu F1, et al. Tumor-suppressive miR148a is silenced by CpG island hypermethylation in IDH1-mutant gliomas[J]. Clin Cancer Res. 2014 Nov 15; 20(22): 5808-22.
[8] Simmons, A. , et al. , Use of recombinant lentivirus pseudotyped with vesicular stomatitis virus glycoprotein G for efficient generation of human anti-cancer chimeric T cells by transduction of human peripheral blood lymphocytes in vitro[J]. Virol J, 2006. 3: 8.
[9] Juzėnas S, Saltenienė V, Kupcinskas J, et al. Analysis of Deregulated microRNAs and Their Target Genes in Gastric Cancer[J]. PLoS One. 2015 Jul 14; 10(7): e0132327.
[10] Ajdarkosh H, Dadpay M, Yahaghi E, et al. Decrease expression and clinicopathological significance of miR-148a with poor survival in hepatocellular carcinoma tissues[J]. Diagn Pathol. 2015 Aug 7; 10: 135.
[11] Ma W, Zhang X, Chai J, et al. Circulating miR-148a is a significant diagnostic and prognostic biomarker for patients with osteosarcoma[J]. Tumour Biol. 2014 Dec; 35(12): 12467-72.
[12] Joshi P, Jeon YJ, Laganà A, et al. MicroRNA-148a reduces tumorigenesis and increases TRAIL-induced apoptosis in NSCLC[J]. Proc Natl Acad Sci U S A. 2015 Jul 14; 112(28): 8650-5.
Construction of mir-148a Lentiviral Expression Vector and Screening of Cell Lines for Stable Expression of mir-148a
Li Yue1,Luo Yan-hong1, Chen Si2,Wang Zhao-fei2,Peng Xiao-ning1
(1.Medical College of Hunan Normal University,Changsha 410006, China;2.The People’s Hospital of Hunan Province,Changsha,410005, China)
Objects To construct a lentivirus expression vector of has-mir-148a, to screen cell lines for stable expression of mir-148a and to test the expression level of mir-148a in stable-expression mir-148a cell lines. Methods To design and synthesis forward and reverse primer of mir-148a and use PCR amplification the purpose gene, then clone it into lentivirus vector after digesting by restriction endonuclease. After constructed the pGC-FU-3FLAG-SV40-EGFP-IRES-puromycinmir-148a overexpression vector, the overexpression vector was co-transfected with pHelper1.0、pHelper2.0 into 293T cells to abtain mir-148a lentivirus vector and detect the infection. To infect glioma cell lines U251, U87, BT325, screen the cell lines by puromycin and detect the mir-148a expression level by qRT-PCR. Results The mir-148a lentivirus vector was successfully constructed according to DNA sequencing and obtain the mir-148a lentivirus vector. Getting stable expression mir-148a cell lines U251,U87,BT325,and the expression of mir-148a was increased respectively by 167.38,7.19,11.46 in U251,U87,BT325. Conclusion mir-148a lentivirus vector is constructed successfully, and screening for the U251,U87,BT325 cell lines of stable expression mir-148a.
mir-148a; lentivirus vector; glioma ; q RT-PCR
R735.7
A
1673-016X(2016)02-0005-04
2015-08-20
国家自然科学基金项目(81472860)
彭小宁,E-mail: Pxiaoning@hunnu.edu.cn

