分散固相萃取-超声辅助分散液液微萃取/高效液相色谱法测定土壤中溴氰菊酯残留
于 玲*, 董丽丽
(邢台学院化学工程与生物技术学院,河北邢台 054001)
溴氰菊酯俗称敌杀死,是拟除虫菊酯中杀虫活性最大的一个品种,可有效防治粮、棉、油、果、菜、茶等多种农作物、经济林木的害虫,对昆虫具有触杀、胃毒作用,杀虫效力比其他拟除虫菊酯大5~10倍,是目前杀虫活性最高的杀虫剂之一。但其使用后残留的毒副作用逐步显现[1 - 3]。据初步估计,施入果园的溴氰菊酯有 80%~90%最终都进入土壤,而使果园土壤环境的潜在污染日趋严重[4]。土壤自身虽有净化作用,但如果进入土壤中的农药含量在数量和速度上超过土壤的自净能力,终将导致土壤的农药残留。因此,准确的测定土壤中溴氰菊酯的含量对农药的科学使用具有重大意义。
目前,测定溴氰菊酯的主要方法有气相色谱法(GC)[5]、气相色谱-质谱联用法(GC-MS)[6,7]、液相色谱法(HPLC)[8]和液相色谱-质谱联用法(HPLC-MS)[9]等。而使用的样品前处理技术主要是索氏提取法[10]、微波辅助提取法[11]和固相萃取法[12],但这些处理方法使用有毒有害有机溶剂且耗费量大,操作繁琐费时。分散固相萃取(Dispersive Solid-phase Extraction)是Lehotay 等[13]开发的一种新型样品前处理方法,目前广泛用于果蔬中的农药残留检测。分散液液微萃取(DLLME)是Rezaee等[14]于 2006 年首次报道的一种前处理方法。该方法集采样、萃取和富集于一体,具有快速、环保、低成本特点。本文将以上两种前处理方法相结合,采用分散固相萃取技术净化后经超声辅助分散液液微萃取技术富集,结合高效液相色谱法(HPLC)测定土壤中溴氰菊酯的含量。建立的方法具有有机溶剂消耗少,富集倍数高,操作快速简单,绿色环保等显著优点,可以作为土壤中痕量溴氰菊酯残留的常规检测方法。
1 实验部分
1.1 仪器、试剂和材料
LC-20AT高效液相色谱仪(日本,岛津公司),配SPD-M20A二极管阵列检测器(DAD);SC-36112 型低速离心机(安徽中科中佳科学仪器有限公司);Exceed-Ad-24型超纯水机(成都艾柯水处理设备有限公司);KQ-50B型超声波清洗器(天津市瑞普电子仪器公司)。
溴氰菊酯(纯度98%,上海市农药研究所);N-丙基乙二胺(PSA)、C18、石墨炭黑(GCB)(天津博纳艾杰尔公司);二氯甲烷、氯仿、二氯乙烷、四氯乙烷、四氯化碳、氯苯、二硫化碳、甲醇、丙酮、乙醇、乙腈均为分析纯(北京化工厂);甲醇为色谱纯。实验用水为超纯水。
敌杀死农药(拜耳作物科学有限公司),有效成分:2.5%溴氰菊酯,喷洒浓度:1∶1 500(V/V)。土壤样品取自河北省邢台县的三个不同桃园。
1.2 实验方法
1.2.1样品前处理土壤采样深度为0~15 cm,采集量为100 g,经过分拣、研磨、过20目筛。称取处理好的土壤试样10 g于具塞锥瓶中,加入甲醇∶水(1∶4,V/V) 50 mL,用0.1 mol/L HCl调节溶液pH=3,超声提取30 min,静置,将上层清液用布氏漏斗抽滤后,备用。
取滤液10 mL于10 mL带刻度尖底玻璃离心管中,将分散固相萃取吸附剂PSA粉25 mg、C18粉15 mg、GCB粉10 mg直接加入到清液中进行净化。经3 500 r/min离心3 min,取上清液6 mL于另一10 mL离心管中,用移液枪快速注入50 μL氯仿萃取剂,剧烈振荡混匀,使萃取剂均匀地分散在水相中,形成水/分散剂/萃取剂的乳浊液体系,超声3 min,以3 500 r/min离心5 min,萃取剂沉积在离心管底部,然后用微量进样器吸取5 μL沉积相,进行HPLC分析测定。
1.2.2色谱条件WondaSilTM C18色谱柱(250×4.6 mm i.d.,5 μm);流动相为甲醇∶水=90∶10(V/V),流速:1 mL/min,柱温:30 ℃,检测波长:230 nm,进样量:5 μL。
2 结果与讨论
2.1 分散固相萃取吸附剂的选择
以土壤样品中的加标回收率为指标,考察了PSA、C18、GCB对溴氰菊酯的吸附情况。溴氰菊酯在0.1 mg/kg添加浓度下,选择用量均为50 mg的三种吸附剂进行净化,在3次平行试验后得到回收率数据。结果发现:GCB对溴氰菊酯的吸附最强,平均回收率为85%,其次是C18为92%,PSA最小为96%,三者虽有差别,但不明显。同时考虑到GCB具有片层结构,对样品中色素的去除效果显著;PSA是正相硅胶键和吸附剂,具有较强的离子交换能力;C18是反相硅胶键和吸附剂,可以吸附溶液中弱极性的干扰物如脂肪、多环芳烃等。三者配合使用可以效果互补,对杂质的吸附范围更广。另外,吸附剂粉末的用量是影响前处理净化效果和回收率的重要因素。如果添加量太多,会导致农药的吸附,影响回收率。如果添加量少,杂质去除效果差,经离心后萃取剂上层会形成白色沉淀,很难直接吸取进样。通过实验最终确定吸附剂粉末的用量为PSA粉25 mg、C18粉15 mg、GCB粉10 mg。
2.2 超声辅助分散液液微萃取方法的优化
取不含溴氰菊酯的土壤样品,加入一定体积的100 μg/mL溴氰菊酯标准溶液,按照1.2.1的前处理方法,配制成100 mL终含量为0.1 μg/mL的土壤样品溶液,供以下条件优化实验使用。
2.2.1萃取剂的种类采用甲醇∶水(1∶4,V/V)制备的0.1 μg/mL溴氰菊酯的土壤样品溶液5 mL,分别与50 μL不同萃取剂(氯仿、四氯化碳、二氯甲烷、二硫化碳、氯苯、二氯乙烷、四氯乙烷)进行萃取实验。结果表明:采用氯仿为萃取剂时,色谱峰形极佳而且吸收很强,富集效果良好;四氯化碳、氯苯、二硫化碳3种萃取剂富集效果都较差;二氯甲烷、四氯乙烷、二氯乙烷萃取的沉积相中没有目标物,这是因为他们在此环境中对溴氰菊酯的溶解度太小。综上所述,本实验采用氯仿作为萃取剂。
2.2.2萃取剂的体积采用甲醇∶水(1∶4,V/V)配制的0.1 μg/mL溴氰菊酯的土壤样品溶液5 mL,选择不同体积的氯仿(30、40、50、60、70、80、90 μL)做微萃取实验。结果表明:随着萃取剂用量的增加,沉积相体积逐渐增多,相应的萃取相中溴氰菊酯的浓度先增高后降低,方法回收率和富集倍数也呈现同样的趋势。当采用30 μL氯仿时,由于溶解损失,离心后无沉积相;当采用40 μL氯苯时,离心后萃取相不稳定,且体积不足5 μL,精密度较差。增加萃取剂用量,下层萃取相的体积也随萃取剂加入量的增加而增加,这在一定程度上稀释了萃取相中溴氰菊酯的浓度,不利于富集倍数的提高。当氯仿加入量为50 μL时,既可以保持较高富集倍数,也能满足进样测定所需的体积,所以氯仿体积选择50 μL。
2.2.3分散剂的种类分别采用乙腈、甲醇、丙酮、乙醇4种分散剂和水的比例为1∶4制备土壤样品溶液,取样品溶液5 mL,分别加50 μL的氯仿,考察对溴氰菊酯的萃取效果。结果表明:以甲醇作为分散剂时,萃取效率最高,其次为乙醇,最后是丙酮。以乙腈为分散剂时,没有沉积相,不能形成两相体系,这可能与其较大的溶解性有关。综上所述,本实验采用甲醇为分散剂。
2.2.4提取溶剂的选择和分散剂的关系通过实验发现,溴氰菊酯不溶于水,为了提高水溶液对土壤样品中溴氰菊酯的提取率,需在水中加一定量的有机溶剂。由于分散剂为甲醇,为了保证溶剂体系的一致,因此选用甲醇-水混合溶液对土壤样品进行提取。同时研究了甲醇-水混合溶液对土壤样品萃取效率的影响。实验分别用1∶2、1∶3、1∶4、1∶5、1∶6的5组不同体积比的甲醇-水混合溶液提取土壤样品,并向5 mL样品溶液中加入50 μL氯仿进行萃取实验。结果表明:甲醇-水比例从1∶4变到1∶2,富集倍数逐渐变小,这是因为随着分散剂甲醇含量的增加,使萃取剂溶解损失增大,引起更大的分析物溶解损失,所以回收率低,富集效率小;在甲醇-水比例为1∶4时富集效率达到最大;随后甲醇-水比例从1∶4变到1∶6时,分散剂甲醇体积较小,萃取剂未能均匀的分散在水相中,萃取效率降低,所以选择甲醇-水比例为1∶4。
2.2.5样品体积分别采用甲醇∶水(1∶4,V/V)制备的溴氰菊酯土壤样品溶液3、4、5、6、7、8 mL,分别加入50 μL的氯仿进行萃取实验。结果表明:土壤样品溶液体积在3~6 mL时,富集效率逐渐增加,这是因为更多的样品溶液可以提供多一些的目标物质。此后,当土壤样品溶液体积在7~9 mL时,富集效率迅速下降,说明当样品溶液体积为6 mL时,萃取基本达到平衡,再增加样品溶液体积,不能提高富集效果,因此本实验样品体积确定为6 mL。
2.2.6超声时间的影响实验采用体积为6 mL的土壤样品溶液,改变超声时间,分别为0、1、2、3、5、7、10、15、20 min,其他条件不变,考察对目标物富集倍数的影响。结果表明:在前3 min,随着超声时间的延长,目标物的富集倍数逐渐增大;在3 min后,富集倍数有所下降。这是因为一方面超声促进了两相的混合加快了萃取过程中的传质作用,从而提高了萃取效率;另一方面过长的超声时间产生热量更多,可能增加试剂的挥发程度而降低萃取效果。本实验选择超声时间为3 min。
2.2.7盐度的影响实验考察了土壤样品溶液中的NaCl含量分别为0~10%时,盐浓度对萃取效率的影响。结果表明:随着NaCl浓度的增加,富集倍数和回收率均显著降低。这是由于随着离子强度的增加,有机萃取剂在水相中的溶解度减小,萃取剂在体系中未能达到均匀状态,未能形成微小液滴,从而沉积相体积增加,萃取效率均低于不加盐的情况,所以本实验选择不加盐。
2.2.8pH的影响根据溴氰菊酯的性质,在酸性条件下能够稳定存在,在碱性条件下不稳定。考虑到pH=1~2时,强酸对色谱柱可能存在的损害,本文考察pH=3~8之间目标分析物的萃取效率。土壤空白溶液的pH为7,通过在水相中加入HCl或NaOH稀溶液调节待测溶液pH,实验得到的沉积相体积均为10 μL左右,说明pH对沉积相体积基本无影响。pH=3时,富集倍数最大,随着pH的增加,富集倍数逐渐变小,当pH=8时显著降低,这是因为一方面在酸性条件下溴氰菊酯更易于分配到有机相中,另一方面,在碱性条件下溴氰菊酯极易分解。因此选择pH=3为最佳条件。
2.3 工作曲线与检出限
准确称取8份10 g研碎过筛的不含溴氰菊酯的土壤试样,分别加入一定体积的溴氰菊酯标准溶液,使其含量分别为0、0.005、0.025、0.05、0.25、0.5、1.0、2.5 mg/kg,按实验方法绘制标准曲线。以平均峰面积值(Y)对待测物质量浓度(X)做线性回归。在0.005~2.5 mg/kg范围内线性良好,其线性方程为:Y=1756593X-3569,相关系数r=0.9998。检出限(LOD,以信噪比S/N=3计)为0.001 mg/kg,定量限(LOQ,以信噪比S/N=10计)为0.005 mg/kg,可满足实际样品测定的需要。在该实验条件下,土壤样品中溴氰菊酯浓度为0.5 mg/kg时,富集倍数为565倍。
2.4 准确度和精密度
选用阴性土壤样品,进行不同添加浓度的萃取、测定。溴氰菊酯添加量分别为0.05、0.1、0.2 mg/kg,计算得方法的回收率与相对标准偏差(RSD)见表1。平均加标回收率为70.3%~94.5%,RSD为2.5%~4.7%,方法的准确度和精密度令人满意。土壤空白色谱图及标准添加色谱图见图1。
2.5 样品分析
按上述样品处理及色谱方法测定了邢台县地区三个不同桃园的土壤样品,分别取施药后第2、5、10、30 d的土壤样品,按照1.3中的样品前处理方法萃取、测定。结果列于表2。
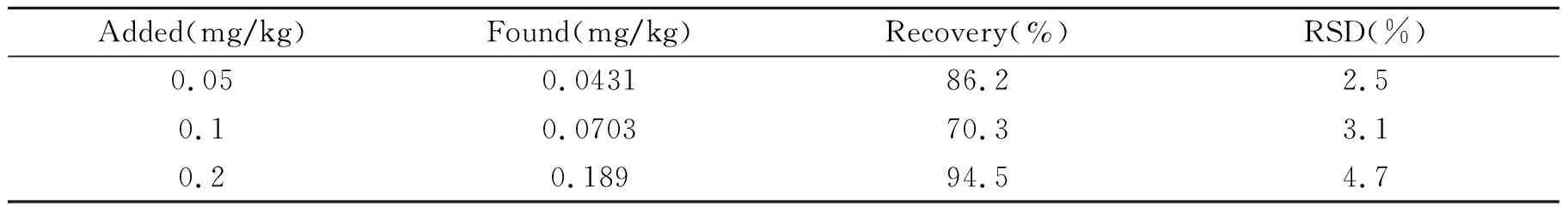
表1 土壤中溴氰菊酯的加标回收率与相对标准偏差(n=5)

Sample No.Application time(day)Amount of deltamethrin(mg/kg)120.02750.018100.016300.006220.09250.081100.053300.047320.01650.013100.01030-
"-":not detected.
结果表明:在施药后10 d内,三个果园均检出溴氰菊酯,其含量都在0.01 mg/kg以上,在第30 d,桃园3中土壤里的溴氰菊酯含量低于了本方法的检出限,未检出。考虑到喷洒农药人员的主观因素和果树种植的密度不同,由表2可以看出三个果园土壤中溴氰菊酯的含量基本相同。同时,可得溴氰菊酯在土壤中的残留随时间的延长而逐渐减少,但其减少的量是由于自身净化作用还是转移到更深的土壤中,需在今后的工作中做进一步的研究。
3 结论
本文建立了分散固相萃取净化/超声辅助分散液液微萃取-高效液相色谱法测定土壤中溴氰菊酯含量的新方法,系统地讨论了分散固相萃取吸附剂的选择及分散液液微萃取的最优条件。本方法将净化与富集两个前处理方法结合使用,用于复杂基质土壤中溴氰菊酯含量的测定,使富集倍数提高,测定结果更加准确。方法具有操作简便、效率高、成本低,环保等优点。

