乙酰化微管蛋白α在肺、肝和肾纤维化中的表达及其病理意义
耿玉聪,高学敏,李世峰,徐丁洁,徐 洪,杨 方
乙酰化微管蛋白α在肺、肝和肾纤维化中的表达及其病理意义
耿玉聪1,高学敏1,李世峰1,徐丁洁2,徐洪1,杨方1
目的研究乙酰化微管蛋白α(Ac-α-Tub)在动式染尘矽肺大鼠肺纤维化模型、单侧输尿管结扎(UUO)肾纤维化模型和硫代乙酰胺(TAA)致肝纤维化模型中的表达及其病理意义。方法采用动式染尘构建矽肺大鼠模型,采用UUO构建肾纤维化模型,采用TAA构建肝纤维化模型。采用免疫组织化学染色观察Ac-α-Tub及波形蛋白(vimentin)在组织中的差异表达,采用HistoQurst图像分析软件对免疫组织化学结果进行分析。结果随着染尘时间的延长,vimentin的阳性表达率明显上调,而Ac-α-Tub的阳性表达率明显下调;在肝、肾纤维化中,随着造模时间的延长,vimentin和Ac-α-Tub的阳性表达率均明显上调。结论Ac-α-Tub在肺、肝和肾纤维化中阳性细胞的定位及临床病理意义均具有差异,其缺失表达可能提示肺纤维化进展,而在肝、肾纤维化过程中则可能起到相反作用。
微管蛋白;乙酰化作用;纤维化;免疫组织化学;染色与标记
细胞骨架蛋白(包括微管、微丝和中间丝)在维持细胞的形态、调控其可塑性以及细胞的粘附、迁移、物资运输和增殖方面发挥了重要的调节作用。本课题组前期研究发现,乙酰化微管蛋白(acetylated α-tubulin,Ac-α-Tub)、微丝蛋白α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和中间丝蛋白波形蛋白(vimentin)在矽肺大鼠模型中差异表达,其中α-SMA是公认的肌成纤维细胞标记物,vimentin在肺组织中主要标记了活化的巨噬细胞,二者是矽肺大鼠纤维化较为明确的标记物,反映了矽肺大鼠纤维化的病变程度;而作为支气管纤毛上皮细胞标记物的Ac-α-Tub,可在正常肺泡壁的多种细胞(肺泡上皮细胞、成纤维细胞和内皮细胞)中阳性表达,而在矽结节及间质纤维化区域缺失表达,可能是矽肺纤维化另一个新的标记物[1-2]。然而,Ac-α-Tub在其他纤维化模型中是否也具有类似的表达特点,目前仍未所知。因此,本实验以Ac-α-Tub作为研究靶向,采用免疫组织化学染色方法检测其在动式染尘构建的矽肺大鼠模型、单侧输尿管结扎(unilateral ureteral occlusion,UUO)构建的肾纤维化模型和硫代乙酰胺(thioacetamide,TAA)构建的肝纤维化模型中的差异表达,采用HistoQurst图像分析软件进行图像分析并探讨其病理学特点,现报道如下。
1 材料与方法
1.1材料
1.1.1动物成年清洁级雄性Wistar大鼠72只,体质量(180±10)g(170~190 g)[北京维通利华实验动物技术有限公司(许可证号:SCXK京2009-0003],饲养于华北理工大学动物实验中心屏障实验室(许可证号:SYXK冀2010-0038),自由饮食进水。
1.1.2试剂TAA(美国Sigma公司);伊红染液(BA4041)、苏木精(BA4024,珠海BASO生物技术有限公司);Ac-α-Tub鼠抗(sc-23950,美国Santa Cruz公司);vimentin兔抗(Ab92547,美国Abcam公司);通用型免疫组织化学试剂盒(PV-6000)及DAB显色试剂盒(ZLI-9032,北京中杉金桥)。
1.2方法
1.2.1构建矽肺纤维化模型采用动式染尘控制系统(HPOE-ED8050)构建矽肺纤维化模型,在温度20~25 ℃、湿度70%~75%、柜内压力-50~+50 Pa、氧含量20%、SiO2流速3.0~3.5 mL/min、SiO2浓度2 000 mg/m3的条件下染尘,3 h/d,分别于4,8和16周处理(每组n=6)。对照组(n=6)未做处理。
1.2.2构建肾纤维化模型大鼠麻醉后,分离左侧输尿管,用4-0慕丝线双结扎输尿管的近膀胱端,双结扎中间离断输尿管以防逆行性感染,肌肉、皮肤缝合。于1,2,3周处理(每组n=6)。对照组(n=6)暴露左侧输尿管后不结扎,之后缝合[3]。
1.2.3构建肝纤维化模型腹腔注射TAA(每次200 mg/kg),每周3次,持续1,3,6周处理(每组n=6)。对照组(n=6)腹腔注射生理盐水,剂量及时间同模型组。
1.2.4免疫组织化学检测Ac-α-Tub、vimentin的表达石蜡切片常规脱蜡至水,高压修复,H2O2去除内源性过氧化物酶,一抗(1∶200)4 ℃过夜,二抗37 ℃ 20 min,DAB显色,苏木精轻度复染,中性树胶封片。采用HistoQuest全景组织细胞定量分析系统(奥地利TissueGnostics公司)分析图像。首先进行全景组织扫描(×200),随机选取5个视野(1 mm2)进行苏木精和DAB染色拆分,依据软件的回溯功能,设定阳性细胞参数(包括苏木精染色平均强度、DAB染色平均强度、染色面积、形状比斜率等),自动分析后获得阳性细胞百分比[4]。由于Ac-α-Tub在肺组织支气管纤毛上皮、肾小球区域恒定表达,因此在分析时需去除该区域。
2 结 果
2.1Ac-α-Tub在动式染尘肺纤维化模型中的差异表达H-E染色结果显示,染尘4周偶见细胞性矽结节的形成,染尘8周可见多个孤立的细胞性矽结节,而染尘16周见多个细胞性矽结节的融合,可见细胞纤维性矽结节的形成。与原有支气管灌注SiO2构建的大鼠矽肺模型一致,Ac-α-Tub可强阳性表达于支气管纤毛上皮细胞,在正常肺泡组织中的多种细胞成分(肺泡上皮细胞、成纤维细胞和内皮细胞)中均有阳性表达,而在矽结节及间质纤维化区域中缺失表达(图1)。vimentin可表达于间质的成纤维细胞,且强阳性表达于巨噬细胞。图像分析结果显示,在对照组及染尘4,8,16周组中,Ac-α-Tub阳性细胞百分比逐渐增高,其中染尘8,16周组与对照组比较,差别均具有统计学意义(P<0.05,表1)。而vimentin阳性细胞百分比随着染尘时间的延长而增高,染尘各时间组与对照组比较,差别均具有统计学意义(P<0.05)。
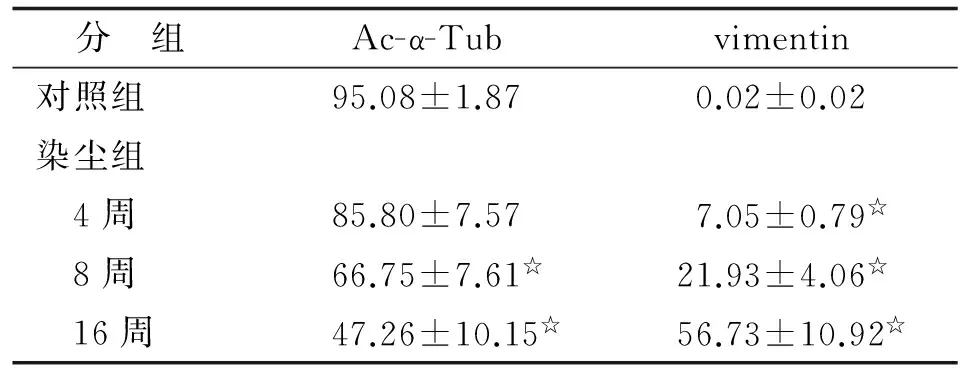
表1 Ac-α-Tub、vimentin在大鼠矽肺模型中的阳性细胞表达Tab 1 The positive expression rate of Ac-α-Tub and vimentin in silicotic rats %
n=6.Ac-α-Tub:乙酰化微管蛋白;vimentin:波形蛋白.与对照组比较,☆:P<0.05.
2.2Ac-α-Tub在UUO大鼠肾纤维化模型中的差异表达H-E染色结果显示,对照组无明显病理改变,而UUO 1周组肾小球结构基本正常,肾小管扩张,肾间质略增宽,间质出现较多炎细胞浸润;2,3周组可见肾小囊增宽,梗阻区域肾小管萎缩,多见肾间质细胞增殖,部分肾小球萎缩。免疫组织化学染色结果显示,Ac-α-Tub可阳性表达于肾小球,同时在部分肾小管上皮细胞中阳性表达,随着造模时间延长,其在梗阻/纤维化区域的肾小管上皮细胞阳性表达,且阳性表达率逐渐上调,UUO 1,2,3周组与对照组比较,差别均具有统计学意义(P<0.05,图2)。而vimentin在对照组仅表达于肾小球系膜细胞,偶见肾小管间质细胞阳性表达;在UUO组中的间质纤维化区域和肾小管上皮细胞中均有明显的阳性表达,且随病变程度的加重而增加,UUO 1,2,3周组与对照组比较,差别均具有统计学意义(P<0.05,表2)。
表2Ac-α-Tub、vimentin在UUO模型中的阳性细胞表达
Tab 2The positive expression rate of Ac-α-Tub and vimentin in UUO rats%

n=6.Ac-α-Tub:乙酰化微管蛋白;vimentin:波形蛋白; UUO:单侧输尿管结扎.与对照组比较,☆:P<0.05.
2.3Ac-α-Tub在TAA大鼠肝纤维化模型中的差异表达H-E染色结果显示,对照组无明显改变。TAA染毒1周可见大量肝细胞空泡样变性、坏死;3周可见门管区及其周围组织星芒状纤维化;6周可见纤维化间隔形成,肝小叶结构凌乱,可见假小叶形成。在对照组中偶见Ac-α-Tub阳性表达的肝星状细胞,随着染毒时间增加,Ac-α-Tub阳性表达的星状细胞数目增多,多集中于纤维化区域,其在对照组及TAA 1,3和6周组中的阳性表达率逐渐增高(图3,表3),TAA 1,3,6周组与对照组比较,差别均具有统计学意义(均为P<0.01)。vimentin亦可阳性标记肝星状细胞,随着染毒时间延长,能够较为明确的标记纤维化区域,阳性表达率随造模时间延长而逐渐增多,TAA 1,3,6周组与对照组比较,差别具有统计学意义(均为P<0.01)。
表3Ac-α-Tub、vimentin在TAA模型中的阳性细胞表达
Tab 3The positive expression rate of Ac-α-Tub and vimentin in TAA rats%

n=6.Ac-α-Tub:乙酰化微管蛋白;vimentin:波形蛋白;TAA:硫代乙酰胺.与对照组比较,☆:P<0.05.
3 讨 论
微管蛋白作为细胞骨架蛋白的重要组成部分,在稳定细胞形态、可塑性,参与调控细胞迁移、粘附、分裂、细胞内的物质运输及信号的传递等方面发挥着重要的调控作用。微管蛋白的氨基酸序列和微管结构在进化上高度保守,其功能的多样性主要取决于翻译后修饰作用,其中乙酰化修饰对于维持微管蛋白聚合的稳定具有重要意义。研究证明,Ac-α-Tub主要表达于具有纤毛上皮、鞭毛和轴突的组织或细胞中,在肺组织中可以作为支气管纤毛上皮细胞的标记物[5]。本课题组前期研究也发现,Ac-α-Tub主要强表达于脑组织,在食管、胃和大肠组织中多标记于神经细胞,在脾脏中可阳性表达于单核细胞,在主动脉、心脏和骨骼肌中不表达,而在矽肺大鼠模型(支气管灌注SiO2)中缺失表达,体外研究也显示,血管紧张素(angiotensin,Ang)Ⅱ诱导的肌成纤维细胞伴随Ac-α-Tub的表达下调[2]。在本研究中,采用动式染尘构建矽肺大鼠模型,能够出现“细胞性矽结节-细胞纤维性矽结节-纤维细胞性矽结节”逐渐进展的病理学特征。与本课题组以往研究一致,Ac-α-Tub在矽结节内及间质纤维化区域中缺失表达,相反vimenitn则在此区域内阳性高表达,提示Ac-α-Tub的缺失表达在矽肺大鼠模型中能够作为一个反映纤维化进展的指标。本研究结果显示,在肝、肾纤维化模型中,Ac-α-Tub所反映的差异表达与肺纤维化模型不同。在肾组织中,Ac-α-Tub常被用作初级纤毛的标记物,在肾组织缺血4 h和缺血后1 d内,Ac-α-Tub标记的初级纤毛长度缩短,而在缺血后8 d内逐渐升高,至16 d恢复至正常长度,且体外实验显示,处于增殖期的细胞初级纤毛长度短、成熟的细胞较分化状态的细胞长度短[6-7]。而在单肾切除模型中,由于尿液流体剪切力的增加,能够诱导近曲小管粘附连接蛋白E-钙黏蛋白、紧密连接蛋白ZO-1表达的下调,同时伴有初级纤毛的缺失[8]。体外研究也显示,肾小管上皮细胞初级纤毛的缩短与抵抗自噬有关[9]。本研究中,Ac-α-Tub在对照组中阳性表达于肾小球细胞和远曲小管上皮细胞,而在UUO模型中还可表达于近曲小管上皮细胞,随病变程度增加而阳性表达增加,推测可能是梗阻性病变引起的一种适应性反应。本研究还发现,Ac-α-Tub可阳性表达于肝星状细胞,随着TAA肝纤维化模型的进展而阳性表达率明显上调。在酒精性肝病大鼠模型和体外肝细胞予以乙醇刺激,均能够显著诱导Ac-α-Tub表达的上调,推测可能是肝细胞对乙醇的一种应激性反应[10]。
体外研究显示,在转化生长因子(transforming growth factor,TGF)β1诱导的肺泡Ⅱ型上皮A549细胞及人肺成纤维细胞、Ang Ⅱ诱导的内皮细胞迁移实验中,均发现α-Ac-Tub表达下调,与上皮-间质转化(epithelial-mesenchymal transition,EMT)、肌成纤维细胞分化和内皮屏障功能障碍密切相关[11-13]。而在正常大鼠肾成纤维细胞中,TGF-β1能够促进微管蛋白mRNA水平表达的上调[14],提示α-Ac-Tub在纤维化疾病中的作用差异可能与组织特异性有关。同时,乙酰化是微管蛋白翻译后修饰动态的一种动态调控机制,而Ac-α-Tub是微管蛋白乙酰化的产物,参与了微管蛋白的聚合/解聚以形成细胞骨架或特定的细胞器(如纤毛、鞭毛、轴突等),这是3个不同层次的概念,在纤维化疾病发生、发展中的具体作用机制仍需进一步研究探讨。本研究发现了Ac-α-Tub表达的组织特异性,且在不同器官的纤维化病变中,细胞定位和病理意义并不相同,其在肺纤维化中的缺失表达,在肝、肾纤维化中的高表达,值得进一步研究探讨。
[1]徐洪,孙月,徐丁洁,等.α-平滑肌肌动蛋白、波形蛋白在大鼠矽肺模型中表达的病理形态学特点及其意义[J].解剖学杂志,2014,37(3):300-303.
[2]李世峰,高学敏,徐丁洁,等.A-SDKP调节乙酰化微管蛋白α抑制矽肺肌成纤维细胞转化的研究[J].中华劳动卫生职业病杂志,2015,33(11):816-821.
[3]Yuan Y,Zhang F,Wu J,et al.Urinary candidate biomarker discovery in a rat unilateral ureteral obstruction model[J].Sci Rep,2015,5:9314.
[4]Schlederer M,Mueller K M,Haybaeck J,et al.Reliable quantification of protein expression and cellular localization in histological sections[J].PLoS One,2014,9(7):e100822.
[5]Perdiz D,Mackeh R,Poüs C,et al.The ins and outs of tubulin acetylation:more than just a post-translational modification[J]? Cell Signal,2011,23(5):763-771.
[6]Bulinski J C,Richards J E,Piperno G.Posttranslational modifications of alpha tubulin:detyrosination and acetylation differentiate populations of interphase microtubules in cultured cells[J].J Cell Biol,1988,106(4):1213-1220.
[7]Kim J I,Kim J,Jang H S,et al.Reduction of oxidative stress during recovery accelerates normalization of primary cilia length that is altered after ischemic injury in murine kidneys[J].Am J Physiol Renal Physiol,2013,304(10):1283-1294.
[8]Maggiorani D,Dissard R,Belloy M,et al.Shear stress-induced alteration of epithelial organization in human renal tubular cells[J].PLoS One,2015,10(7):e0131416.
[9]Wang S,Livingston M J,Su Y,et al.Reciprocal regulation of cilia and autophagy via the MTOR and proteasome pathways[J].Autophagy,2015,11(4):607-616.
[10]Kannarkat G T,Tuma D J,Tuma P L.Microtubules are more stable and more highly acetylated in ethanol-treated hepatic cells[J].J Hepatol,2006,44(5):963-970.
[11]Shan B,Yao T P,Nguyen H T,et al.Requirement of HDAC6 for transforming growth factor-beta1-induced epithelial-mesenchymal transition [J].J Biol Chem,2008,283(30):21065-21073.
[12]Wang Z,Chen C,Finger S N,et al.Suberoylanilide hydroxamic acid:a potential epigenetic therapeutic agent for lung fibrosis [J]? Eur Respir J,2009,34(1):145-155.
[13]Hashimoto-Komatsu A,Hirase T,Asaka M,et al.Angiotensin Ⅱ induces microtubule reorganization mediated by a deacetylase SIRT2 in endothelial cells [J].Hypertens Res,2011,34(8):949-956.
[14]Thompson K L,Assoian R,Rosner M R.Transforming growth factor-beta increases transcription of the genes encoding the epidermal growth factor receptor and fibronectin in normal rat kidney fibroblasts [J].J Biol Chem,1988,263(36):19519-19524.
(编辑:何佳凤)
The Expression and Pathological Significances of Ac-α-Tub in Lung,Liver and Renal Fibrosis
GENG Yucong1,GAO Xuemin1,LI Shifeng1,XU Dingjie2,XU Hong1,YANG Fang1
1.Medical Research Center; 2.College of Chinese Traditional Medicine,North China University of Science and Technology,Tangshan 063000,China
ObjectiveTo observe the expression and pathological significance of acetylated α-tubulin (Ac-α-Tub) in rats with silicosis,unilateral ureteral obstruction (UUO) and thioacetamide (TAA).MethodsSilicosis model was established with inhalation of d SiO2in a dynamic manner.Renal fibrosis model was established by UUO.Hepatic fibrosis model was established by TAA intraperitoneal injection.The expression of Ac-α-Tub and vimentin were measured by immunohistochemistry staining and analyzed by HistoQurst software.ResultsWith the time of dust exposure extended,the positive rate of vimentin was increased accompanyinga down-regulation of Ac-α-Tub.In the renal and hepatic fibrosis,the positive rate of Ac-α-Tub and vimentin was all increased with the extension of the time of models creation.ConclusionThere is a differential expression of Ac-α-Tub and pathological significance in lung,renal and hepatic fibrosis.The down-expression of Ac-α-Tub in silicosis,and up-expression of it in UUO and TAA in rats.
tubulin; acetylation; fibrosis; immunohistochemistry; staining and labeling
2016-04-16
国家自然科学基金(81472953);河北省自然科学基金(H201409115);河北省研究生创新项目(2015S04)
华北理工大学,唐山 0630001.医学实验研究中心;2.医学中医学院
耿玉聪(1989-),女,华北理工大学2015级硕士研究生
杨方.Email:fangyang1955@163.com
R135.2;R693.2;R575.3;R977.6
A
1672-4194(2016)04-0232-05

