獭兔酪氨酸酶相关蛋白1(Tyrp1)基因序列分析及外显子多态性研究
郝晔 施丽娟 闫晓荣 赵博昊 朱杰 陈阳 翁巧琴 吴信生

摘要[目的]探索獭兔酪氨酸相关蛋白1(Tyrp1)基因在毛色形成过程中的分子机制。[方法]对獭兔Tyrp1基因序列的核苷酸序列、编码产物的基本理化性质等进行预测和分析,同时利用PCRSSCP(Single strand conformation polymorphism analysis of polymerase chain reaction products)技术检测Tyrp1基因CDS序列的多态性分布状况。[结果]信息学分析发现,TYRP1蛋白是不稳定的亲水性蛋白,有信号肽,具有酪氨酸酶家族特征性功能结构域。多态性检测发现仅在Tyrp1基因CDS的483 bp处存在1个C→T的同义突变,位于外显子2上,该碱基的突变没有造成氨基酸的改变(AUC→AUT,异亮氨酸)。HardyWeinberg 平衡检验表明,青紫蓝色獭兔群体处于非平衡状态,白色獭兔群体处于平衡状态。青紫蓝兔群体为中度多态信息含量(0.25 关键词 獭兔;Tyrp1;SNPs;序列分析 中图分类号 S829.1 文献标识码 A 文章编号 0517-6611(2016)09-164-04 Abstract [Objective] To discuss the molecular mechanism of tyrosinaserelated protein 1 (Tyrp1) gene of Rex rabbit (Oryctolagus cuniculus) during the formation of hair color. [Method] The Tyrp1 gene sequence, the nucleotide sequence, and the basic physical and chemical properties of coding products were forecasted and analyzed. At the same time, PCRSSCP(singlestrand conformational polymorphism)was used to detect the distribution of CDS sequences of Tyrp1. [Result] Bioinformatics analysis found out that Tyrp1 protein was an unstable hydrophilic protein, which had a signal peptide and a functional domain of the tyrosinase family. The polymorphism detection result indicated that the exon 2 of Tyrp1 in 29 bp (the gene CDS 483 bp) had a C→T mutation, and the nucleotide mutation did not lead to the amino acid change (AUC→AUT, isoleucine). HardyWeinberg equilibrium test showed that the Chinchilla Rex rabbit population was at HardyWeinberg disequilibrium, the white Rex rabbit population was at HardyWeinberg equilibrium. PIC of chinchilla Rex rabbit population was of medium polymorphism (0.25 < PIC < 0.50), white Rex rabbit population was of low polymorphism (PIC < 0.25). [Conclusion] Tyrp gene has certain effects on the hair color of Rex rabbit. This research provides certain references for the selection of hair color of Rex rabbit. Key words Rex rabbit; Tyrp1; SNPs; Sequence analysis Tyrp1基因是第1個克隆成功的色素基因,由于该基因编码的蛋白与酪氨酸酶同源,因此被称为酪氨酸酶相关蛋白1(Tyrosinaserelated protein1,TYRP1)[1]。很多学者提出了黑色素生物合成的三酶理论,即酪氨酸酶、多巴色素互变酶和5,6二羟基吲哚羧酸氧化酶,它们对黑色素的形成都有十分重要的作用,其中Tyrp1基因编码的5,6二羟基吲哚羧酸氧化酶是酪氨酸酶重要的协同因子,与酪氨酸(Tyrosine,TYR)、酪氨酸酶相关蛋白2(Tyrosinaserelated protein2,TYRP2)一起组成酪氨酸酶相关蛋白家族[2]。也有研究表明,Tyrp1基因除了直接参与黑色素的生成反应外,还可能帮助稳定并调节酪氨酸酶的催化活性,参与维持黑色素小体的结构,并影响着黑色素细胞的增殖和凋亡[3-4]。笔者通过PCR技术扩增Tyrp1基因7个外显子的序列,对Tyrp1基因氨基酸序列进行了生物学信息分析,并利用PCR-SSCP技术和直接测序的方法对每个外显子进行多态性检测,分析Tyrp1基因在不同颜色獭兔(Oryctolagus cuniculus)群体的多态性,探索其与獭兔毛色形成的关系,旨在为獭兔毛色的选种选育提供一定的参考。
1 材料与方法
1.1 试验材料
1.1.1 试验动物。
随机抽取同批出生、健康的6月龄青紫蓝色獭兔392只、白色獭兔174只,共566只獭兔作为试验对象,试验个体均来自浙江省余姚市欣农兔业有限公司。
1.1.2 试剂。蛋白酶K、10 × TBE、Tris、EDTA、丙烯酰胺等试剂均购自生物(上海)工程有限公司;10%过硫酸铵、TEMED、SDS、甘油、甲醛等试剂均购自北京鼎国生物技術有限责任公司。
1.1.3 引物设计。
根据NCBI网站上公布的兔Tyrp1基因全序列(登录号:NC_013669.1),分别在7个外显子区域外的邻近内含子区域设计并合成特异性较好的引物,引物由生工生物工程(上海)有限公司合成,引物信息见表1。
1.1.4 Tyrp1基因序列分析软件。
利用ExPASy工具对基因编码的蛋白质性质进行分析,利用ProtParam分析蛋白的氨基酸序列组成、相对分子质量和等电点等理化性质,利用网上在线工具SMART(http://smart.emblheidelberg.de/),分析TYRP1蛋白结构域,并使用 NPS@服务器上的SCOPMA分析预测蛋白的二级结构。利用TMPRED(http//www.ch.embnet.org/software/TMPRED_form.html)进行蛋白质序列的跨膜区分析;运用ProtScale(http://web.expasy.org/protscale/)进行氨基酸序列的亲水性分析。利用SwissModel(http://swissmodel.expasy.org/)对TYRP1编码蛋白进行高级结构预测。
1.2 试验方法
1.2.1 DNA提取。
采用传统酚/氯仿抽提法提取獭兔耳组织样基因组DNA,使用TE稀释到100 ng/μL,使用NanoDrop ND1000核酸浓度测定仪测定DNA浓度,一般OD值的范围为1.7~1.9,峰图平滑的样品可用。
1.2.2 PCR扩增。
PCR反应体系(20 μL)为:10×PCR Buffer 2 μL、10 mmol/L dNTPs 2 μL、10 pmol/L上、下游引物各1 μL、5 U/μL Taq酶0.2 μL、100 ng/μL DNA 模板1 μL、ddH2O 12.8 μL。PCR反应条件如下:95 ℃预变性5 min;95 ℃变性30 s,适宜的温度退火30 s,72 ℃延伸30 s,35个循环;72 ℃最终延伸10 min,10 ℃下保存。
1.2.3 PCRSSCP检测。
在20 μL PCR扩增产物中加入5 μL上样缓冲液,混合体系在98 ℃变性10 min后,置于-20 ℃冰箱中冷却5 min,于10%非变性聚丙烯酰胺凝胶电泳迅速点样,先用250 V电泳,10 min后将电压调至120 V,电泳12 h。银染显色后观察是否有不同带型。若有不同带型出现,将其PCR产物送至生工生物工程(上海)有限公司测序,以鉴定碱基突变的类型。
1.3 数据分析
1.3.1 基因频率和基因型频率。
基因频率(Gene frequency)是指群体中某一特定等位基因与其他等位基因的比率;基因型频率(Genotypic frequency)是指群体中某特定基因型个体数占全部个体数的比率。
2 结果与分析
2.1 Tyrp1基因各外显子的扩增结果
对该基因的7个外显子序列进行扩增,并用2%的琼脂糖凝胶电泳检测。检测扩增片段大小所用的Marker均为DL 500 Marker。从图1可以看出,Tyrp1基因各外显子的条带特异性均较好,杂带较少,特异条带的片段大小与理论值一致。经PCRSSCP检测后,在Tyrp1基因外显子1、3、4、5、6、7中均未检测到多态位点,仅在外显子2上检测到2个等位基因、3种基因型(AA、BB、AB)。
2.2 Tyrp1基因多态序列分析
使用AlignIR V2.0软件,将测序得到的DNA序列进行对比。从图2~3可以看出,Tyrp1基因外显子2在29 bp(整个基因CDS的483 bp)处有1个C→T的突变,碱基的突变并没有造成氨基酸的改变(AUC→AUT,异亮氨酸),为同义突变。
2.3 Tyrp1基因外显子2的遗传多样性分析
白色和青紫蓝色獭兔外显子2各基因型和基因型频率经卡方适合性检验,BB基因型频率在青紫蓝色獭兔中较高,在白色獭兔中较低,表明等位基因B是青紫蓝色獭兔群体中的优势等位基因,而在白色獭兔中等位基因A是优势等位基因。HardyWeinberg 平衡检验表明,青紫蓝色獭兔群体处于非平衡状态,白色獭兔群体处于平衡状态。青紫蓝兔群体为中度多态信息含量(0.25 2.4 Tyrp1基因序列分析 2.4.1 TYRP1氨基酸序列的理化性质。 根据 GenBank数据库上已发表的家兔的Tyrp1基因序列可知,家兔的Tyrp1基因位于1号染色体上,全长15 843 bp,有7个外显子和6个内含子。编码序列由1 683个碱基组成,编码560个氨基酸残基,是一个较为保守的基因。经ProtParam在线软件预测,分子式为C2802H4268N786O831S30,原子总数为8 717个,分子量为63 223.2 kD,理论等电点为6.06。在所有编码氨基酸中,Leu(L)含量最高,为8.6%,Trp(W)只占1.8%(表3)。带负电荷残基的总数量(ASP + Glu)为56,带正电荷残基的总数量(Arg+Lys)为47,不稳定指数是52.92,证明这个蛋白质不稳定。
从图4可以看出,TYRP1蛋白疏水性最大值为3.711,最小值为-3.133。TYRP1的主要亲水平均数(GRAVY)值是-0.381,由于 GRAVY 值的范围介于-2与2之间,其为正值时表明此蛋白为疏水蛋白,而负值表明为亲水蛋白,因此该蛋白是亲水蛋白。同时,TYRP1氨基酸序列内绝大多数为亲水性残基,表明Tyrp1基因编码蛋白为水溶性蛋白。
2.4.2 TYRP1氨基酸序列的二级结构和三级结构预测。
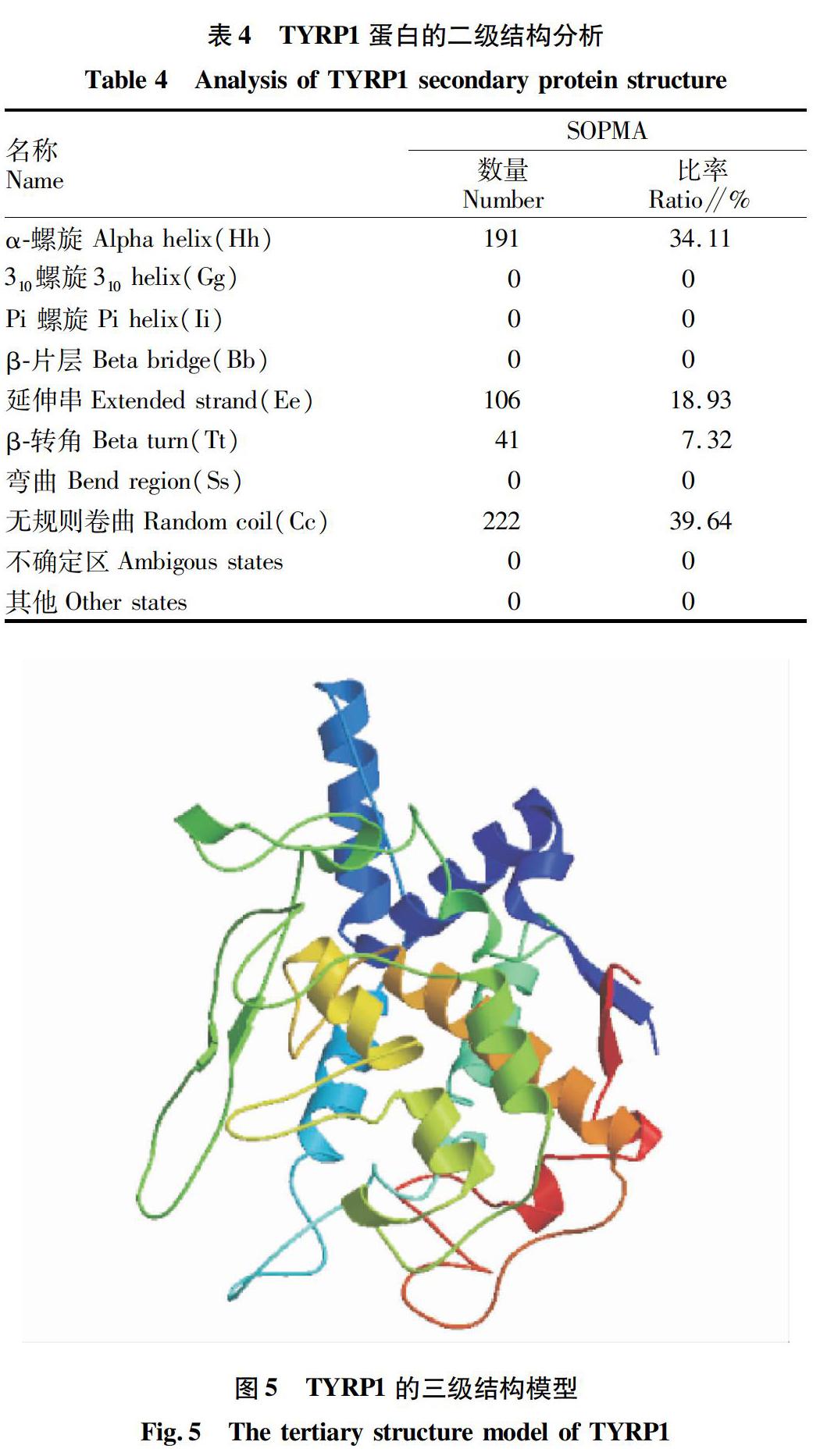
通过NPS@服务器上的SOPMA对TYRP1进行二级结构预测,结果如表4所示。其中,TYRP1蛋白二级结构以α螺旋和无规则卷曲为主,有利于稳定蛋白质的结构,无规则卷曲是TYRP1蛋白最大的结构元件。这表明TYRP1蛋白的二级结构为混合型。
从图5可以看出,三级结构序列的相似度达到84.17%,Evalue值为0,说明模型与提交的预测蛋白序列匹配性较好。
2.4.3 TYRP1氨基酸序列的功能性结构域预测。
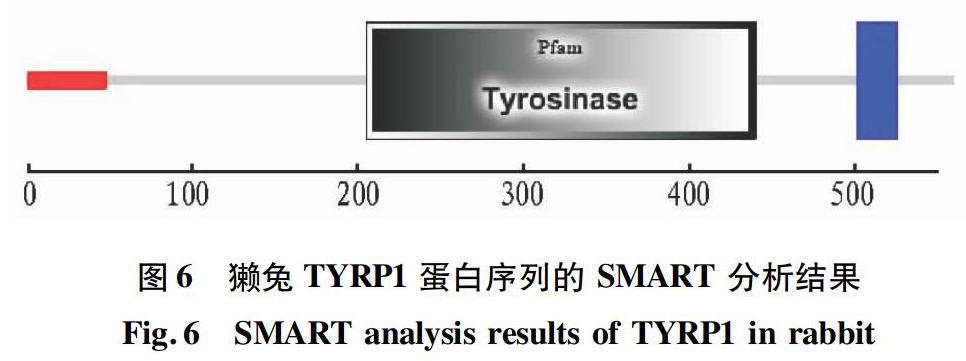
利用SMART(Simple Modular Architecture Research Tool,简单模块构架搜索工具)分析结果显示 TYRP1蛋白有3个功能性片段(图 6)。红色区(1~47)代表信号肽;灰色区(205~440)代表酪氨酸酶家族特征性区域;蓝色区(502~524)代表跨膜区。
3 讨论与结论
大量研究表明,Tyrp1基因与动物的毛发颜色和羽色相关,该基因编码的5,6二羟基吲哚羧酸氧化酶,是酪氨酸酶重要的协同因子,在黑色素的形成中具有十分重要的作用。人类Tyrp1基因外显子6上的1个碱基缺失,致使开放阅读框截短,导致TYRP1蛋白丧失活性,使得其对酪氨酸羟化酶的催化作用减弱,引起眼皮肤白化病3(OCA3)[5]。Rieder等[6]研究发现灰色马皮肤中Tyrp1基因的表达量较非灰色马低,推测Tyrp1基因与马的隱性灰毛色性状相关。Li等[7]研究发现,鸭不同羽色中Tyrp1基因的表达存在差异,黑羽鸭中Tyrp1基因的表达量为白羽鸭的10 000倍以上。研究表明,Tyrp1基因编码的TYRP1多巴色素互变异构酶(DCT)一起催化多巴醌转化为真黑色素,影响黑色素小体的成和黑色素细胞的增殖与凋亡,也可直接参与黑色素的生成[8]。
为了揭示Tyrp1基因在毛色形成过程中的作用机制,笔者获取了獭兔Tyrp1基因序列,对Tyrp1氨基酸序列的理化性质进行分析,初步断定该蛋白为亲水不稳定蛋白,加上二级结构及模体分析,可以对该蛋白的结构及功能进行初步推测。笔者对 TYRP1 蛋白氨基酸序列的分析结果与已有的报道[9]相吻合,该蛋白为 I 型跨膜糖蛋白,定位在黑色素体的囊膜上,相当大部分区域溶于黑色素体囊内的溶胶内,单独工作不稳定,需要通过类表皮生长因子基序等同其他蛋白如酪氨酸酶结合的方式稳定工作,α螺旋和无规则卷曲是TYRP1蛋白序列最大量的结构元件,散布于整个蛋白质中;SMART分析显示了该蛋白的3个功能性片段,即N端的信号肽,中间相当大片段的酪氨酸酶相关家族特征性结构域及C端的跨膜结构域。
目前,很多国内外学者研究Tyrp1基因的多态性在毛色形成过程中的作用。李蓓等[10]研究发现蒙古马Tyrp1基因外显子2的1个错义突变与深色毛色相关。Rieder 等[11]研究发现马Tyrp1基因外显子2的SNP(C189T)引起苏氨酸到蛋氨酸的错义突变。Gratten等[12]对黑色和浅色索艾绵羊Tyrp1基因的研究发现,外显子4的869 bp处存在错义突变(T869G),浅色索艾羊基因型全为TT,黑色索艾羊基因型为GG或GT,表明该位点的突变与索艾绵羊毛色相关。徐莹[13]对3种羽色朝鲜鹌鹑Tyrp1基因PCRSSCP 分析发现在 Tyrp1基因存在2个多态性位点(T367C 和C1153T),但是未发现这2个多态性位点与朝鲜鹌鹑羽色之间存在显著相关性。该研究中对Tyrp1的CDS序列的多态性分布状况进行检测,检测了獭兔Tyrp1基因7个外显子的多态性,在其基因外显子1、3、4、5、6、7中未检测到多态位点,仅在外显子2的29 bp(整个基因CDS的483 bp)处有1个C→T的同义突变。遗传多样性分析发现,青紫蓝獭兔群体的He值高于白色獭兔群体,说明它们具有更为丰富的遗传多样性,更好的选择潜力。多态信息含量(PIC)是用来衡量基因片段多态性的重要指标,在外显子2的基因型中,青紫蓝獭兔群体的PIC值介于0.25与0.50之间,外显子2基因座呈中度多态,说明该群体对于外显子2基因型的选择具有一定的潜力,这些结果与基因杂合度的研究结果基本一致。此外,青紫蓝色獭兔群体偏离了哈代-温格平衡,可以初步断定该位点的突变有利于真黑色素的合成。基因及基因型在群体中的分布情况也支持该推论,因此Tyrp1基因对獭兔的毛色有一定影响。
参考文献
[1]崔嘉,孙守荣,苗鲁旭,等.TYRP1基因控制动物色素形成的研究进展[J].中国畜牧兽医,2009,36(9):94-96.
[2] 高莉,赵英虎,刘朝亮,等.酪氨酸酶相关蛋白1调控黑色素形成的研究进展[J].畜牧与饲料科学,2010,31(10):114-116.
[3] KOBAYASHI T,HEARING V J.Direct interaction of tyrosinase with Tyrp1 to form heterodimeric complexes in vivo[J].J Cell Sci,2007,120(Pt 24):4261-4268.
[4] RAD H H,YAMASHITA T,JIN H Y,et al.Tyrosinaserelated proteins suppress tyrosinasemediated cell death of melanocytes and melanoma cells[J].Exp Cell Res,2004,298(2):317-328.
[5] BOISSY R E,ZHAO H,OETTING W S,et al.Mutation in and lack of expression of tyrosinaserelated protein1(TRP1)in melanocytes from an individual with brown oculocutaneous albinism:A new subtype of albinism classified as "OCA3"[J].Am J Hum Genet,1996,58(6):1145-1156.
[6] RIEDER S,STRICKER C H,JOERG H,et al.A comparative genetic approach for the investigation of ageing grey horse melanoma[J].J Anim Breed Genet,2000,117(2):73-82.
[7] LI S J,WANG C,YU W,et al.Identification of genes related to white and black plumage formation by RNASeq from white and black feather bulbs in ducks[J].PloS one,2012,7(5):36592.
[8] AROCA P,URABE K,KOBAYASHI T,et al.Melanin biosynthesis patterns following hormonal stimulation[J].J Biol Chem,1993,268(34):25650-25655.
[9] SARANGARAJAN R,BOISSY R E.Tyrp1 and oculocutaneous albinism type 3[J].Pigment Cell Res,2001,14(6):437-444.
[10] LI B,HE X,ZHAO Y,et al.Tyrosinaserelated protein 1(TYRP1)gene polymorphism and skin differential expression related to coat color in Mongolian horse[J].Livestock science,2014,167:58-64.
[11] RIEDER S,TAOURIT S,MARIAT D,et al.Mutations in the agouti(ASIP),the extension(MC1R),and the brown(TYRP1)loci and their association to coat color phenotypes in horses(Equus caballus)[J].Mamm Genome,2001,12(6):450-455.
[12] GRATTEN J,BERALDI D,LOWDER B V,et al.Compelling evidence that a single nucleotide substitution in TYRP1 is responsible for coatcolour polymorphism in a freeliving population of Soay sheep[J].P Roy Soc Lond B Bio,2007,274(1610):619-626.
[13] 徐瑩.TYR、TYRP1 基因与朝鲜鹌鹑羽色相关性研究[D].洛阳:河南科技大学,2014:29-39.

