Fe1Co0.5Ba2.5氧化物纳米颗粒芬顿催化降解亚甲基蓝的研究
贾若琨,马宗伟,宫俊霞,徐 凯,艾丽莎,杨文胜
(1.东北电力大学化学工程学院,吉林 132012;2.吉林大学化学学院,长春 130000)
Fe1Co0.5Ba2.5氧化物纳米颗粒芬顿催化降解亚甲基蓝的研究
贾若琨1,马宗伟1,宫俊霞2,徐凯1,艾丽莎2,杨文胜2
(1.东北电力大学化学工程学院,吉林132012;2.吉林大学化学学院,长春130000)
采用溶胶-凝胶法制备的铁钴钡氧化物纳米颗粒作为非均相类芬顿催化剂,研究其催化降解亚甲基蓝,考察催化剂投加量,H2O2投加量,温度等对亚甲基蓝降解效率和降解速率的影响。结果表明,在最佳的实验条件下该氧化物颗粒与过氧化氢组成的芬顿试剂在20 min内,亚甲基蓝降解率达到95%。该反应符合一级动力学模型,55 ℃条件下,速率常数为0.10 min-1,反应活化能为54.1 kJ/mol。
非均相芬顿; 铁钴钡氧化物纳米颗粒; 亚甲基蓝
1 引 言
芬顿(Fenton)氧化技术以其设备流程简便、成本低、技术要求不高[1,2],生成的羟基具有强氧化性[3]等优点,受到国内外学者的广泛关注[4-7]。已经应用于苯酚,亚甲基蓝等[8]工业废水处理领域。
然而传统芬顿试剂存在pH范围较窄、铁难以回收以及铁离子的二次污染、需要外加能量或设备等缺点。为解决芬顿技术在应用中的不足,研究者采用含铁的固体物质或载体固定铁离子作为催化剂,从而形成一系列非均相芬顿技术。如Daud等[9]制备Fe/高岭土芬顿催化剂,在240 min时间里,对酸性红1的降解率可达98.46%。 Inbasekaran等[10]制备了 Fe(III)-Al2O3非均相芬顿催化剂,在60 min内,对酸性紫7号,降解率可以达到99.5%。Hassan等[11]制备了铁球粘土催化剂,在140 min内,对活性蓝4号,降解率可达99%。赵等[12]制备了铁改性累托石,在100 min内,对罗丹明B的降解率达到90%。陈利用铁柱撑蛭石来降解活性艳橙(X-GN),在75 min内,降解率分别可达到98.7%。
本文制备了Fe1Co0.5Ba2.5氧化物纳米颗粒,研究铁钴钡氧化物纳米颗粒芬顿试剂对亚甲基蓝的降解性能、影响因素及反应动力学。
2 实 验
2.1试剂与仪器
实验试剂:Fe(NO3)3·9H2O(分析纯,天津市光复精细化工研究所);硝酸钡Ba(NO3)2(分析纯,西陇化工股份有限公司);硝酸钴Co(NO3)2·6H2O(分析纯,西陇化工股份有限公司);亚甲基蓝C16H18ClN3S·3H2O(分析纯,国药);氢氧化钠NaOH(分析纯,国药);过氧化氢(30%)(分析纯,国药)等。
实验仪器:UV-7504型紫外可见分光光度计(Hitachi,日本); SEM(Nova NanoSEM 450,Hitachi,日本)。XRD(X'Pert Pro,帕纳科公司,荷兰)。ICP电感耦合等离子体光谱仪(美国珀金埃尔默公司)。
2.2FeCoBa纳米氧化物颗粒的制备过程
将Fe(NO3)3·9H2O、Ba(NO3)2、Co(NO3)2·6H2O置于坩埚中,用适量蒸馏水溶解,混合均匀,加入氢氧化钠,过滤出沉淀,放入马弗炉中,在设定温度(如800 ℃)下烧结2 h,制得FeCoBa纳米氧化物芬顿催化剂。
2.3降解实验过程
取10 mL亚甲基蓝溶液放入30 mL的试剂瓶中,加入0.012 g催化剂。然后将试剂瓶统一放入水浴锅中,水温设置为50 ℃无需搅拌。放在暗处静置30 min后测定亚甲基蓝溶液初始吸光度,分光光度计的吸收波长设置为664 nm。随后向试剂瓶中加入0.5 mL过氧化氢(H2O2)(30%)溶液,反应即开始计时。每隔5 min测定溶液的吸光度,实验测试的最大时长为3h。
3 结果与讨论
3.1FeCoBa纳米氧化物颗粒的表征
图1为不同放大倍数时FeCoBa氧化物纳米颗粒的SEM图。从图1可以看出,催化剂颗粒尺寸大约在200 nm到300 nm之间,催化剂呈片状堆叠结构,且厚度大约为40 nm,颗粒有团聚现象,这可能是由于其自身的铁磁性以及分子间的吸引力所引起的。

图1 Fe1Co0.5Ba2.5纳米氧化物颗粒的SEM图Fig.1 SEM images of Fe1Co0.5Ba2.5 oxide nano particles
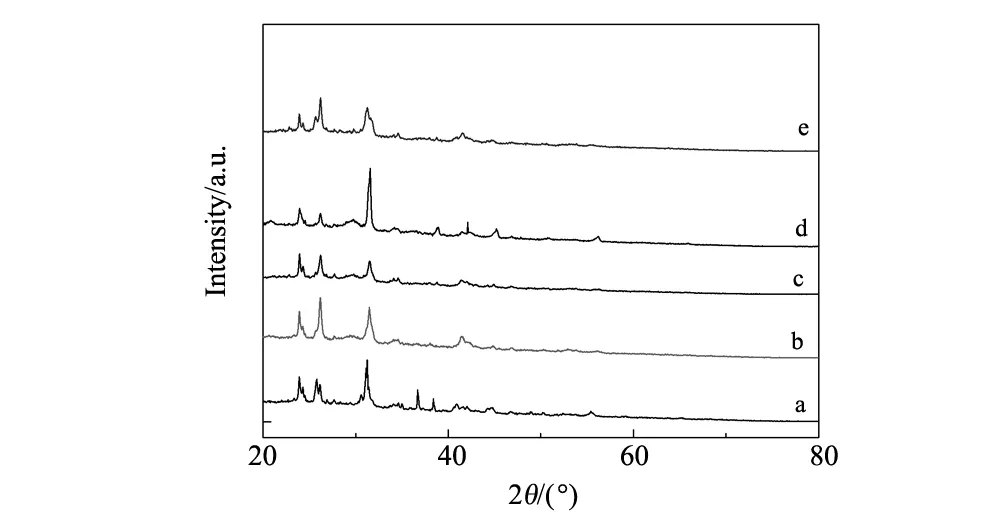
图2 Fe1Co0.5Ba2.5纳米氧化物颗粒的XRD图(a)500 ℃(b)600 ℃(c)700 ℃(d)800 ℃(e)900 ℃Fig.2 XRD patterns of Fe1Co0.5Ba2.5oxide nano particles at different sintering temperature
图2为Fe1Co0.5Ba2.5纳米氧化物颗粒的XRD图,通过Jade5.0对谱图进行分析计算可以得到晶粒尺寸约等于240 nm,这与SEM的分析结果较为符合。由图2可知存在Fe3O4、CoO、BaO的衍射峰,随着烧结温度的升高,各衍射峰明显变尖锐,强度明显增大,表明升高温度能够促进晶粒的生长,有利于氧化物晶体结构更加完整。
3.2催化剂最佳配比的研究
图3为不同配比FeCoBa纳米氧化物对亚甲基蓝去除率的影响。从图3可以看出,Fe1Co0.5Ba2.5的催化性能最佳,这可能是因为,通过掺杂钴,其不仅与铁有着相似的化学行为[8],当其与铁联用时,存在某种协同效应,改善了铁在反应中的活性,达到提高反应效率的目的从而促进铁的催化反应[13]。但有研究表明:钴很容易与氧化物间形成强的相互作用,进而减弱催化剂的还原性及自身的分散性,影响催化剂的性能[14]。钡,由于其在周期表中特殊的位置,使其兼具有碱金属,稀土,过渡金属以及碱土金属的诸多优点[15],有利于反应物在载体上的分散。氧化钡可以改善氧化物表面的钴原子的分散度,并降低钴的粒度,同时,有文献表明:钡的碱金属性具有影响金属-碳键的能力[16],其特有的供电子能力,能够增加碳物种的迁移速率或碳物种溢流到载体位上的速率[17]。这些都对催化剂性能的改善起到促进的作用。
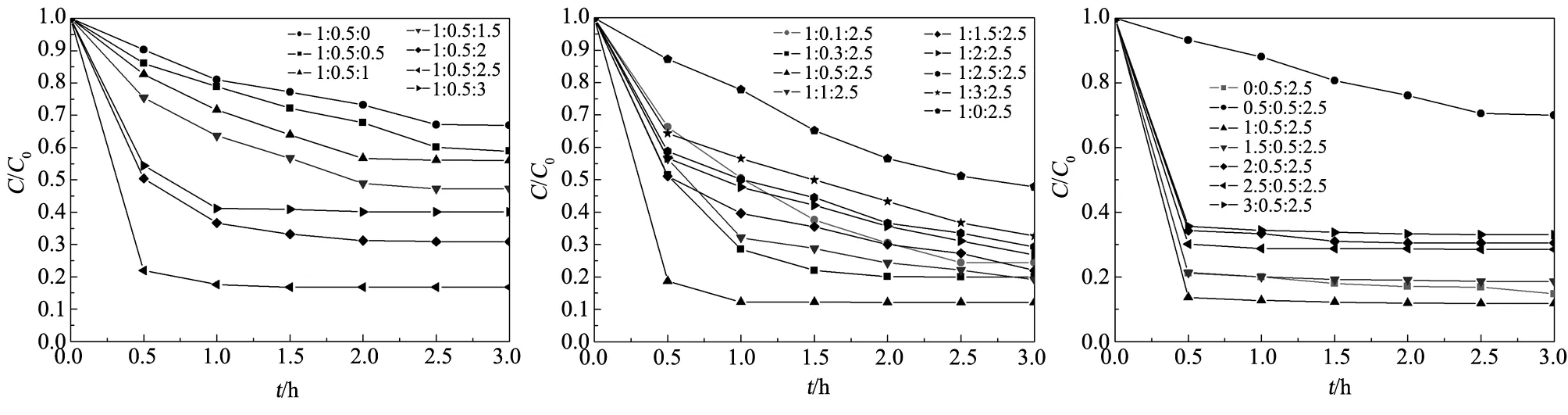
图3 不同配比FeCoBa纳米氧化物对亚甲基蓝去除率的影响Fig.3 Effect of FeCoBa at different molar proporitions on the degradation of methylene blue
3.3催化剂投加量对亚甲基蓝降解率的影响
图4为催化剂投加量对亚甲基蓝降解率的影响。从图4可以看出,催化剂的最佳投加量为1.2 g/L。这可能因为随催化剂投加量的增加,催化剂所提供的活性位点会相应增多,反应速率和降解率都相应提高。但投加量大于1.2 g/L时,过多的活性位点可能会在单位时间内产生过多的羟基自由基而发生了副反应,从而导致降解率的下降。
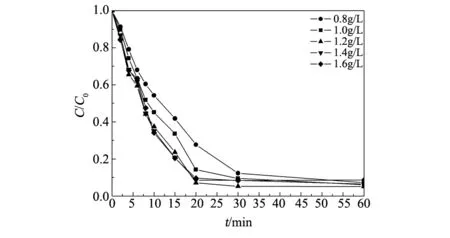
图4 催化剂投加量对降解率的影响Fig.4 Effect of catalyst dosage quantity on the degradation of methylene blue
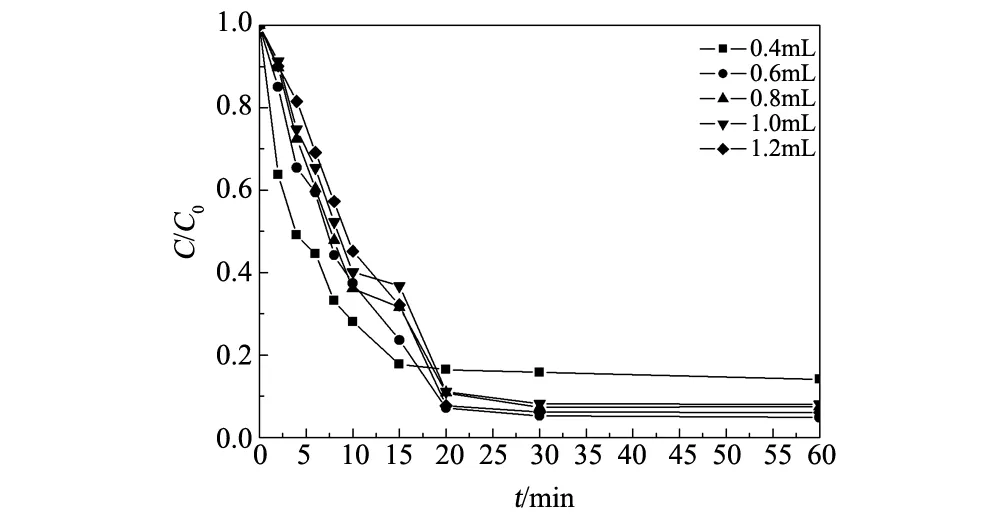
图5 H2O2投加量对降解率的影响Fig.5 Effect of H2O2 dosage quantity on the degradation of methylene blue
3.4H2O2投加量对亚甲基蓝降解率的影响
图5为H2O2投加量对亚甲基蓝降解率的影响。从图5可以看出,H2O2最佳投加量为0.6 mL。这可能因为投加量小于0.6 mL时,不能及时而充足的提供羟基自由基。投加量大于0.6 mL时,过量的过氧化氢会在单位时间内分解生成过多的羟基自由基,进而发生歧化反应,导致“自身消耗”。
3.5反应温度对亚甲基蓝降解率的影响
图6为反应温度对亚甲基蓝降解率的影响。从图6可以看出,最佳的反应温度为55 ℃。这可能因为催化降解速率和效果随温度的升高而升高,较高的反应温度可以加剧分子之间的碰撞接触,从而促进反应的发生。

图6 反应温度对降解率的影响Fig.6 Effect of reaction temperature on the degradation of methylene blue
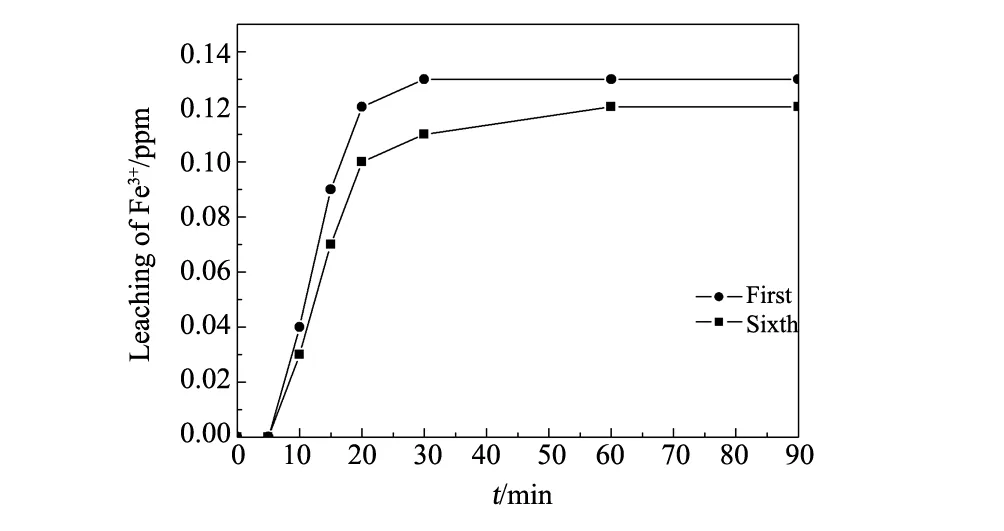
图7 反应体系中溶出Fe3+的浓度Fig.7 Leaching of Fe3+ in the reaction system
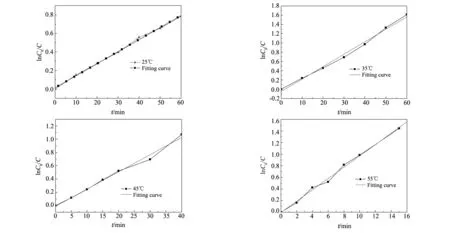
图8 不同温度下反应的动力学曲线Fig.8 The dynamic fitting curve at different Temperature
3.6反应中溶出铁的研究
图7为反应中铁的溶出量。从图7可以看出,溶液中的Fe3+子浓度随反应时间而逐渐增加,但基本从60 min开始Fe3+的浓度基本保持稳定,为0.135 ppm,低于国际的排放标准,同时,溶液中均相的铁离子较少(小于20 ppm)也说明均相芬顿过程对总的催化过程的贡献可以忽略不计,同时较少的溶出铁量也说明该催化剂有较好的稳定性。
3.7铁钴钡氧化物纳米颗粒芬顿降解亚甲基蓝的动力学研究
本次研究中亚甲基蓝的浓度为1 mg/L,因此浓度与吸光度之间存在着较好的线性关系。故浓度可以用相应的吸光度得到。
图8为55 ℃下动力学曲线。从图8可以看出该反应符合一级动力学模型,速率常数为0.10 min-1。
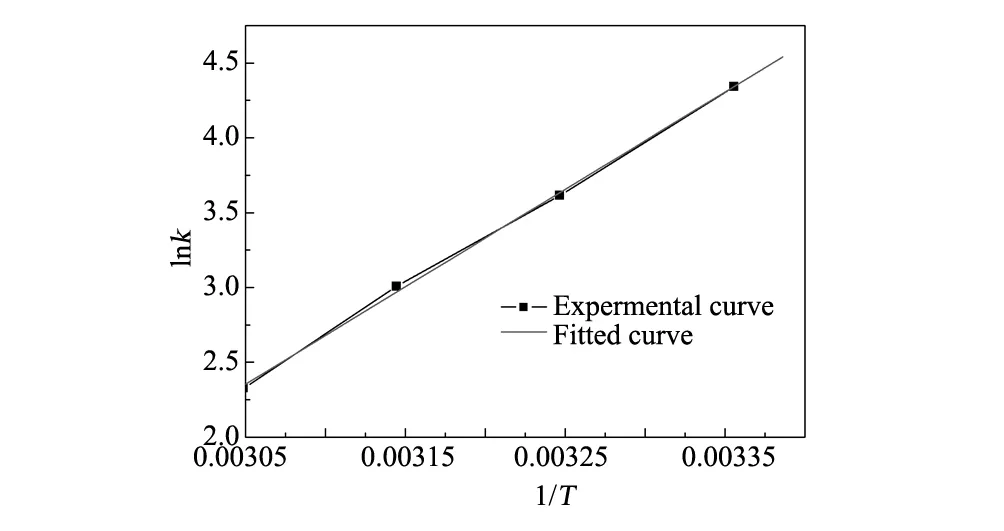
图9 Arrhenius拟合曲线Fig.9 Linear fitting curve of Arrhenius equation
根据 dlnk/dt=Ea/RT2(Arrhenius S A公式),进行拟合,结果如图9所示。从图9可以看出该反应活化能为54.1 kJ/mol。由于该体系温度变化不大,故Ea可视为常量。其中:A为表观活化因子,Ea为活化能,T为温度(开尔文温度)。
根据阿伦尼乌斯(Arrhenius)拟合结果,可以看出该活化能值明显高于扩散过程的活化能(10~13 kJ/mol)。这也进一步表明:该反应过程表观速率是受内在的化学反应速率支配,而不是受传质速率所支配[18,19]。该活化能与文献所报道的非均相芬顿反应的活化能为20.7~56.1 kJ/mol[20-24]吻合。该反应的活化能值处于范围值的上限,说明反应更倾向于高温条件下进行。
4 结 论
通过溶胶凝胶法制备了Fe1Co0.5Ba2.5氧化物纳米颗粒,通过SEM,XRD表征,可知该氧化物纳米颗粒呈类片状堆叠结构,直径大小为200 nm到300 nm之间,厚度约为40 nm,且存在Fe3O4、CoO、BaO的衍射峰。在最佳反应条件下,20 min内,对1 mg/L亚甲基蓝降解率可达95%。动力学研究发现,符合一级动力学模型,反应活化能为54.1 kJ/mol。55 ℃时速率常数为0.098 min-1。
[1]郑怀礼, 谢礼国, 胡鹏,等. 非均相类反应催化氧化脱色降解直接桃红[J].光谱学与光谱分析, 2010,6(30): 1647-1651.
[2]孙根行, 刘梅. 非均相Fenton反应处理污水的研究现状及展望[J]. 江西师范大学学报(自然科学版)[J]. 2008,32(5): 563-568.
[3]Sandra F, Leticia V, Alvarez G A. Decolorizing textile wastewater with fenton's reagent electrogenerated with a solar photovoltaic cell[J].WaterResearch,2009,43(2): 283-294.
[4]杨春维, 王栋, 王坤,等. 非均相Fenton催化剂的制备及催化性能[J]. 化工环保, 2011,31(6): 557-560.
[5]Mario R R, Fernando P, Daniel W, et al. Modeling of advanced oxidation of trace organic contaminants by hydrogen peroxide photolysis and fenton’s reaction[J].Industrial&EngineeringChemistryResearch,2010,49(22): 11331-11343.
[6]Aditya R, Souhail R A A, Dionysios D D. Effect of inorganic, synthetic and naturally occurring chelating agents on Fe(II) mediated advanced oxidation of chlorophenols water research[J].WaterResearch,2009,43(3): 684-694.
[7]Bum G K, Kim E J, Jai H L. Pentachlorophenol decomposition by electron beam process enhanced in the presence of Fe(III)-EDTA[J].Chemosphere,2009,74(10): 1335-1339.
[8]Zhang L J, Zhang Z M, Lu C, et al. Improved chemiluminescence in fenton-like reaction via dodecylbenzene-sulfonate-intercalated layered double hydroxides[J].PhysicalChemistryC,2012,116(27): 14711-14716.
[9]Daud N K, Hameed B H. Acid red 1 dye decolorization by heterogeneous Fenton-like reaction using Fe/kaolin catalyst[J].Desalination,2011,269(1-3): 291-293.
[10]Inbasekaran M, Meenakshisundaram S. Photoassisted fenton mineralisation of acid violet 7 by heterogeneous Fe(III)-Al2O3catalyst[J].CatalysisCommunications,2007,8(7): 981-986.
[11]Hassan H, Hameed B H. Fe-clay as effective heterogeneous Fenton catalyst for the decolorization of Reactive Blue 4[J].ChemicalEngineering,2011,171(3): 912-918.
[12]Zhao X R, Zhu L H, Zhang Y Y, et al. Removing organic contaminants with bifunctional iron modified rectorite as efficient adsorbent and visible light photo-Fenton catalyst[J].JournalofHazardousMaterials,2012,215-216: 57-64.
[13]Zheng G M. Study on the catalytic degradation of dye wastewater using CoFe/MgO-fenton process[D]. Bei Jing: BeiJing University of Chemiscal Technology. 2011(in Chinese).
[14]Chang H L, Cheng T K. Properties of Si-C-N films prepared on Si substrate using cobalt interfacial layers[J].MaterialsChemistryandPhysics,2001,72: 236-239.
[15]Niemel M K, Backman L, Krausea A O I, et al. The activity of the Co/SiO2catalyst in relation to pretreatment[J].AppliedCatalysisAGeneral,1997,156(2):319-334.
[16]Li X N, Liu H Z, Zhang Y, et al. Reduction performance of Co/SiO2catalyst promoted by barium oxide and its catalytic activity for methane decomposition[J].ChineseJournalofCatalysis,2003,24, 1
[17]Tijs K,Marc J A G Deelen,Rutger A van Santen. Hydrocarbon formation from methane by a low-temperature two-step reaction sequence[J].JournalofCatalysis,1992,138, 1: 101-114.
[18]Soltan J,Mohammad Z,Kevin J S.Kinetics of CH4decomposition on supported cobalt catalysts[J].JournalofCatalysis,1998,176: 115-124.
[19]Martin H, Radek Z, Ivo M, et al. Catalytic efficiency of iron(III) oxides in decomposition of hydrogen peroxide: competition between the surface area and crystallinity of nanoparticles[J].J.Am.Chem.Soc,2007,129(35):10929-10936.
[20]Lin S S, Mirat D, Gurol. Catalytic decomposition of hydrogen peroxide on iron oxide: kinetics,mechanism,and implications[J].Environ.Sci.Technol,1998,32(10):1417-1423.
[21]Xue X F, Hanna K, Mustapha A, et al. Adsorption and oxidation of PCP on the surface of magnetite: Kinetic experiments and spectroscopic investigations[J].AppliedCatalysisB:Environmental,2009,89(34): 432-440.
[22]Luo W, Zhu L H, Wang N, et al. Efficient removal of organic pollutants with magnetic nanoscaled BiFeO3as a reusable heterogeneous fenton-like catalyst[J].environmentalscience&technology,2010,44(5):1786-1791.
[23]Dükkanc M, Gündüza G, Yilmaz S, et al. Heterogeneous fenton-like degradation of rhodamine 6G in water using CuFeZSM-5 zeolite catalyst prepared by hydrothermal synthesis[J].JournalofHazardousMaterials,2010,181(1-3): 343-350.
[24]Ramirez J H, Maldonado-Hódar F J, Pérez-Cadenas A F, et al. Azo-dye orange II degradation by heterogeneous fenton-like reaction using carbon-Fe catalysts[J].AppliedCatalysisB:Environmental,2007,75(3-4): 312-323.
Fe1Co0.5Ba2.5Oxide Nano Particles as Heterogeneous Catalysts for Fenton Degradation of Methylene Blue
JIARuo-kun1,MAZong-wei1,GONGJun-xia2,XUKai1,AILi-sha2,YANGWen-sheng2
(1.College of Chemical Engineering,Northeast Dianli Univerdity,Jilin 132012,China;2.College of Chemistry,Jilin Univerdity,Changchun 130000,China)
Fe1Co0.5Ba2.5nano oxide particles were prepared by the sol-gel method as a Heterogeneous Fenton catalyst, studying on the catalytic degradation of methylene blue, Effect of temperature, catalyst dosage, H2O2dosage on the degradation efficiency and degradation rate of methylene blue. The results show under the best experimental conditions, the Fe1Co0.5Ba2.5oxide particles with hydrogen peroxide consisting of Fenton's reagent could realize degradation rate reach to 90% within 20 min. The reaction follows the first order kinetic process, when the reaction takes place at 55 ℃, the rate constant is 0.10 min-1and the reaction activation energy is 54.1 kJ/mol.
Heterogeneous Fenton;Fe1Co0.5Ba2.5nano oxide particles;methylene blue
国家自然科学基金(51003010) ;吉林省科技厅项目(20140101090JC)
贾若琨(1977-),男,教授,主要从事材料物理化学方面的研究.
杨文胜,教授
TU528
A
1001-1625(2016)05-1396-06

