沟稃草属及其近缘属植物颖片微形态特征研究
王燕红,张学杰,樊守金
(山东师范大学 生命科学学院逆境植物重点实验室,济南 250014)
沟稃草属及其近缘属植物颖片微形态特征研究
王燕红,张学杰,樊守金*
(山东师范大学 生命科学学院逆境植物重点实验室,济南 250014)
通过扫描电镜对沟稃草属及其近缘属共14属20种2变种植物颖片微形态进行观察。结果显示:(1)沟稃草属颖片脉间长细胞长筒形或短筒形,细胞壁波状弯曲,显著增厚;脉间短细胞单生,脉间栓细胞近圆形,脉间硅细胞缺失;脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞平行形至低圆屋顶形;脉上、脉间刺毛常见,有钩毛,无微毛,有乳突,无大毛。(2)根据颖片微形态特征所构建的系统发育树显示,沟稃草属与早熟禾族植物聚为一支,表明其亲缘关系较近,支持将沟稃草属置于早熟禾族中。(3)沟稃草属与拂子茅属、野青茅属植物相距较远,颖片微形态证据不支持将沟稃草属作为广义拂子茅属的成员,其应该单独成属。
沟稃草属;颖片;微形态;扫描电镜
沟稃草属(Aniselytron)为多年生草本植物,隶属于禾本科(Poaceae)早熟禾亚科(Pooideae),主要分布于中国、日本、马来西亚、菲律宾、印度尼西亚、印度等地。经荷兰学者Korthof and Veldkamp[1]修订,全世界有沟稃草属植物两种:沟稃草(Aniselytrontreutleri(Kuntze) Soják)和小颖沟稃草(AniselytronagrostoidesMerrill),中国均有分布。
沟稃草属是1907年Hackel[2]建立的属,成立之初,命名为AulacolepisHack。1979年, 人们发现Aulacolepis在一冷杉类化石中使用, 因此,Soják[3], Raizada and Bennet[4]分别发表论文,以AniselytronMerr.作为沟稃草属的属名。由于对沟稃草属特征难以把握,它在禾本科早熟禾亚科中的系统位置以及其是否应该独立成属一直存在着争议。Clayton and Renvoize[5]、Shukla[6]和Noltie[7]把沟稃草属作为广义拂子茅属(CalamagrostisAdans.s.l.)的成员,认为它与野青茅属(Deyeuxia)、拂子茅属(Calamagrostis)植物的亲缘关系较近。《中国主要植物图说(禾本科)》[8]和《中国植物志》[9]将沟稃草属放在了剪股颖族(Agrostideae)中,《中国被子植物科属综论》[10]将其置于燕麦族(Aveneae)中,马海英[11]、Gillespie等[12]、Soreng等[13]基于分子证据认为其应置于早熟禾族(Poeae),《Flora of China》[14]采用了相同的处理,将其置于早熟禾族中。由此可见,沟稃草属的系统分类存在分歧较多,仍需进一步研究。禾本科植物的颖片作为生殖器官在植物的进化中具有相当的保守性和稳定性,常被用作分类检索的特征[15-16]。随着技术的发展,扫描电镜被广泛用于植物微形态特征的研究中[17-19]。但目前,尚未见对沟稃草属及其近缘属植物颖片微形态特征的报道,将颖片微形态特征用于沟稃草属系统位置的研究将是一个有意义的探讨。本研究利用电镜扫描技术,对沟稃草属及其近缘属植物颖片微形态特征进行比较研究,以期为沟稃草属系统位置的确定提供更多的依据。
1 材料和方法
1.1 实验材料
供试材料全部取自腊叶标本,凭证标本(表1)均存放于山东师范大学植物标本室(SDNU)。我们选取沟稃草属模式种——沟稃草及其相关属共14属20种2变种植物进行研究。
1.2 实验方法
1.2.1 扫描电镜观察 试验设置3个重复,每个重复取自不同单株,分别取1枚完整成熟的小穗,编号后置于三氯甲烷中浸泡24 h[20]。经KH-5200B型超声波清洗仪震荡1 h 后,将小穗颖片剥下,外表面朝上粘于样品台上,置SC7620型离子溅射仪中喷金2 min,在SUPRATM55型扫描电子显微镜下(加速电压15 kv)进行观察。

表2 用于聚类分析的颖片微形态性状
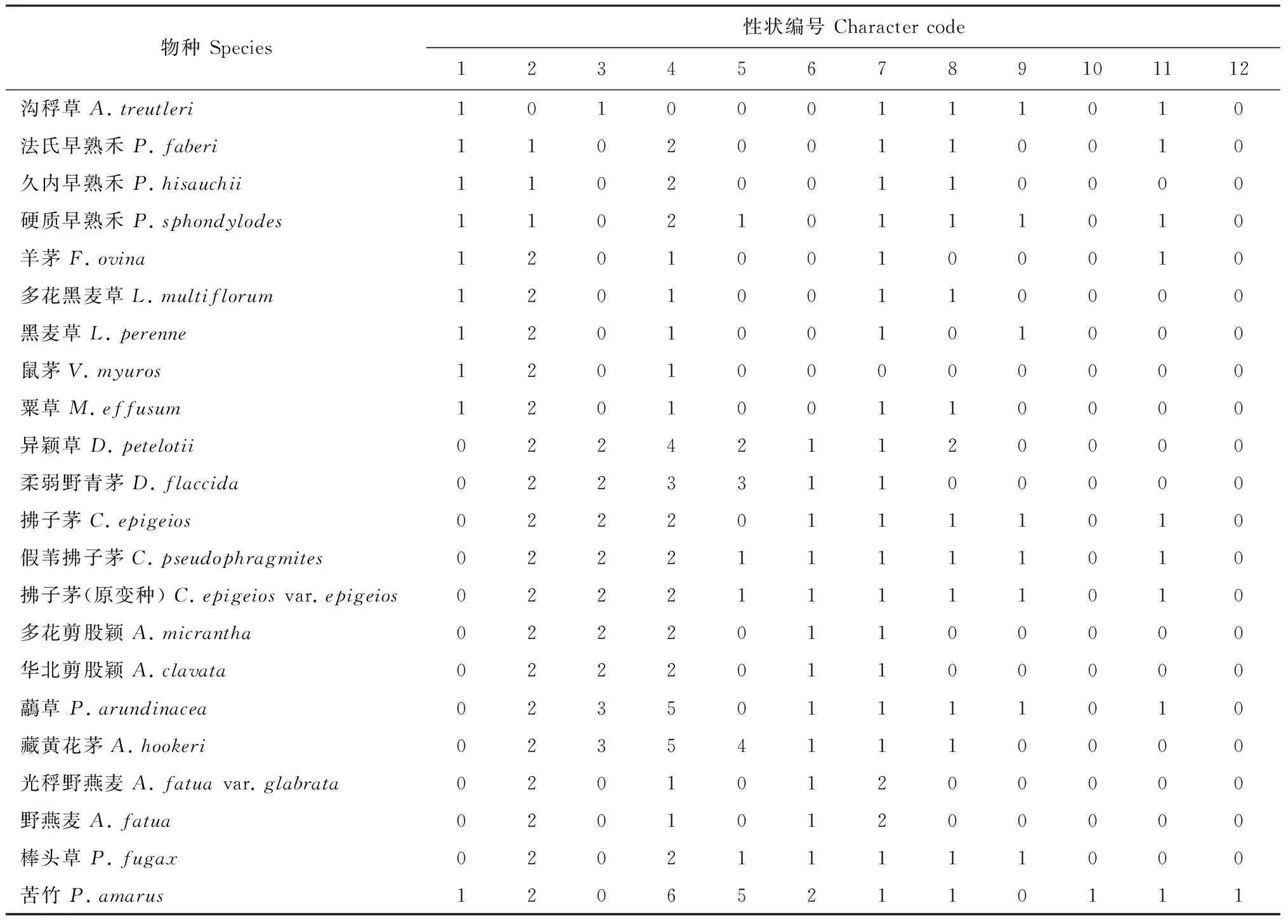
表3 颖片微形态性状数据矩阵
1.2.2 微形态性状聚类分析
参照Ellis[21]和陈守良等[22]的微形态性状描述术语, 选取12个颖片微形态特征进行聚类分析,如表2所示。所有性状均做无序处理,不详或未知性状以“?”表示,编码结果如表3所示。选取苦竹(Pleioblastusamarus)作为外类群,运用PAUP*version 4.0b10对编码数据矩阵进行邻接法分析。
2 实验结果
2.1 颖片微形态观察结果
2.1.1 沟稃草属颖片微形态特征 脉间长细胞长筒形或短筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生,脉间栓细胞近圆形,脉间硅细胞缺失,脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞平行形至低圆屋顶形,脉上、脉间刺毛常见,有钩毛,无微毛,有乳突,无大毛(图版Ⅰ,1)。
2.1.2 早熟禾属颖片微形态特征 脉间长细胞长筒形或短筒形,细胞壁波状弯曲,显著增厚,脉间短细胞对生,脉间栓细胞新月形,脉间硅细胞圆形或半圆形,脉上硅细胞单生,半圆形或近圆形,有气孔器,气孔副卫细胞平行形至低圆屋顶形,脉上、脉间刺毛常见,钩毛存在或缺失,无微毛,乳突存在或缺失,无大毛(图版Ⅰ,2~4)。
2.1.3 羊茅属颖片微形态特征 脉间长细胞长筒形或短筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞新月形,脉间硅细胞近圆形,脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞平行形至低圆屋顶形,脉上刺毛常见,脉间缺失,无钩毛,无微毛,有乳突,无大毛(图版Ⅰ,5)。
2.1.4 黑麦草属颖片微形态特征 脉间长细胞长筒形或短筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞新月形,脉间硅细胞近圆形,脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞平行形至低圆屋顶形,脉上刺毛常见,脉间常见或缺失,钩毛存在或缺失,无微毛,无乳突,无大毛(图版Ⅰ,6~7)。
2.1.5 鼠茅属颖片微形态特征 脉间长细胞长筒形或短筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞新月形,脉间硅细胞近圆形,脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞平行形至低圆屋顶形,脉上、脉间刺毛缺失,无钩毛,无微毛,无乳突,无大毛(图版Ⅰ,8)。
2.1.6 粟草属颖片微形态特征 脉间长细胞长筒形或短筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞新月形,脉间硅细胞近圆形,脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞平行形至低圆屋顶形,脉上、脉间刺毛常见,无钩毛,无微毛,无乳突,无大毛(图版Ⅰ,9)。
2.1.7 野青茅属颖片微形态特征 脉间长细胞长筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞长方形或新月形,脉间硅细胞结节形、近圆形或近方形,脉上硅细胞单生,结节形、近圆形或近方形,有气孔器,气孔副卫细胞低圆屋顶形,脉上刺毛常见,脉间偶见或缺失,无钩毛,无微毛,无乳突,无大毛(图版Ⅰ,10~11)。
2.1.8 拂子茅属颖片微形态特征 脉间长细胞长筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞长方形或新月形,脉间硅细胞近圆形或半圆形,脉上硅细胞单生,近圆形或半圆形,有气孔器,气孔副卫细胞低圆屋顶形,脉上、脉间刺毛常见,有钩毛,无微毛,有乳突,无大毛(图版Ⅰ,12~14)。
2.1.9 剪股颖属颖片微形态特征 脉间长细胞长筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞长方形或新月形,脉间硅细胞近圆形或半圆形,脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞低圆屋顶形,脉上刺毛常见,脉间缺失,无钩毛,无微毛,无乳突,无大毛(图版Ⅰ,15~16)。
2.1.10 虉草属颖片微形态特征 脉间长细胞长筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞长方形,脉间硅细胞半圆形,脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞低圆屋顶形,脉上脉间刺毛常见,有钩毛,无微毛,有乳突,无大毛(图版Ⅰ,17)。
2.1.11 黄花茅属颖片微形态特征 脉间长细胞长筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞长方形,脉间硅细胞半圆形,脉上硅细胞单生,半圆形,有气孔器,气孔副卫细胞低圆屋顶形,脉上脉间刺毛常见,无钩毛,无微毛,无乳突,无大毛(图版Ⅰ,18)。
2.1.12 燕麦属颖片微形态特征 脉间长细胞长筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞新月形,脉间硅细胞近圆形,脉上硅细胞单生,近圆形,有气孔器,气孔副卫细胞低圆屋顶形,脉上刺毛偶见,脉间缺失,无钩毛,无微毛,无乳突,无大毛(图版Ⅰ,19~20)。
2.1.13 棒头草属颖片微形态特征 脉间长细胞长筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞新月形,脉间硅细胞近圆形或半圆形,脉上硅细胞单生,近圆形或半圆形,有气孔器,气孔副卫细胞低圆屋顶形,脉上脉间刺毛常见,有钩毛,无微毛,无乳突,无大毛(图版Ⅰ,21)。
2.1.14 大明竹属颖片微形态特征 脉间长细胞长筒形或短筒形,细胞壁波状弯曲,显著增厚,脉间短细胞单生或对生,脉间栓细胞新月形,脉间硅细胞竹节形,脉上硅细胞单生,竹节形,有气孔器,气孔副卫细胞高圆屋顶形至三角形,脉上脉间刺毛常见,无钩毛,有微毛,有乳突,有大毛(图版Ⅰ,22)。
2.2 聚类结果
基于颖片微形态性状构建的系统发育树如图1所示,所有的内类群植物形成两大分支,分支Ⅰ的类群颖片大多具有以下特征:脉间长细胞为长筒形或短筒形,脉间栓细胞为近圆形或新月形,气孔副卫细胞为平行形至低圆屋顶形,脉上刺毛为常见或缺失,由沟稃草属、早熟禾属(Poa)、羊茅属(Festuca)、鼠茅属(Vulpia)、黑麦草属(Lolium)及粟草属(Milium)植物构成,主要对应于早熟禾族植物。分支Ⅱ的类群颖片大多具有以下特征: 脉间长细胞为长筒形,脉间栓细胞为长方形或新月形,气孔副卫细胞为低圆屋顶形,脉上刺毛为常见或偶见,由野青茅属、剪股颖属(Agrostis)、拂子茅属、虉草属(Phalaris)、黄花茅属(Anthoxanthum)、棒头草属(Polypogon)、燕麦属(Avena)植物构成,主要对应于剪股颖族、虉草族(Phalarideae)和燕麦族植物。
3 讨 论
所研究植物的颖片在细胞类型上,由长细胞、短细胞、气孔器细胞、刺毛、钩毛、微毛、乳突、大毛等结构组成,但各类细胞在颖片的出现和分布情形是不一致的。长细胞和气孔器细胞是各个类群必备的基本细胞,长细胞通常成长筒形或短筒形,细胞壁常显著增厚,波状弯曲,气孔器副卫细胞有平行形、低圆屋顶形、高圆屋顶形、三角形,有些种处于两个形态类型间的过渡类型。短细胞、刺毛、钩毛、微毛、乳突、大毛等属于选择性着生的细胞,在有的类群中分布不完全。脉间短细胞根据细胞是否硅质化分为脉间栓细胞和脉间硅细胞,栓细胞多为新月形或长方形,硅细胞为近圆形、半圆形、竹节形、结节形、长条形等,说明硅细胞有丰富的变异式样。同种植物脉上硅细胞与脉间硅细胞形态大体相似。刺毛可生于脉上、脉间,脉上多为刺,脉间可为刺或钩。在内类群植物中未发现微毛的存在,在外类群苦竹中发现微毛,内类群植物中多为单域乳突,外类群植物中含有紊序乳突。从大毛的着生位置看,大毛主要着生于颖片的中下部。这些细胞在颖片的差异成为本研究分析沟稃草属系统位置的重要依据。
在基于颖片微形态特征构建的系统发育树上,沟稃草属植物位于分支Ⅰ中,分支Ⅰ主要对应于早熟禾族植物。耿以礼[8]和郭本兆[9]把沟稃草属置于剪股颖族中,吴征镒[10]将其置于燕麦族中,但在系统发育树上,沟稃草属和剪股颖族、燕麦族植物位于不同的分支,它们的亲缘关系较远。观察它们的颖片微形态,沟稃草属脉间长细胞为长筒形或短筒形,脉间短细胞单生,气孔副卫细胞为平行形至低圆屋顶形,而剪股颖族和燕麦族植物脉间长细胞为长筒形,脉间短细胞单生或对生,气孔副卫细胞为低圆屋顶形。Clayton and Renvoize[5],Shukla[6]和Noltie[7]等把沟稃草属作为广义拂子茅属的成员,认为它与野青茅属、拂子茅属植物的亲缘关系较近,但在系统发育树上,沟稃草属和野青茅属、拂子茅属植物相聚较远,因此,不支持将沟稃草属作为广义拂子茅属的成员。颖片微形态研究结果显示,沟稃草属与早熟禾族植物亲缘关系较近,与马海英[11]、Gillespie等[12]、Soreng等[13]基于分子证据的研究结果一致,支持将沟稃草属置于早熟禾族植物中。沟稃草属及其近缘属植物颖片微形态存在明显的差异,可以作为分属的参考依据,能为沟稃草属系统位置的确定提供一定的理论依据。
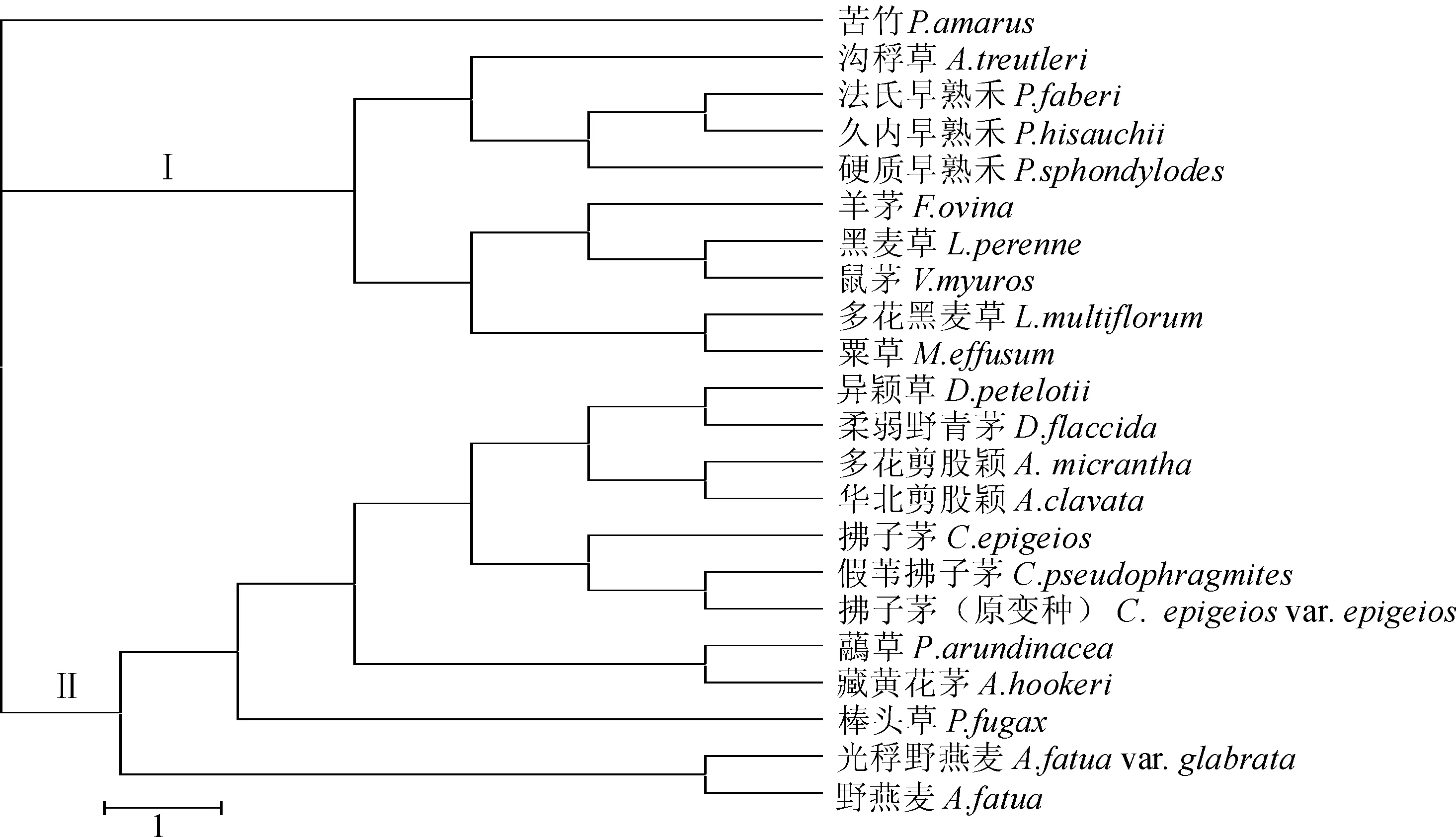
图1 基于颖片微形态特征构建的系统树Fig. 1 Phylogenetic tree based on glume micromorphological characteristics
[1] KORTHOF H M, VELDKAMP J F. A revision ofAniselytronwith some new combinations inDeyeuxiain Southeast Asia ( Gramineae)[J].GardBullSingapore, 1984, 37(2): 213-224.
[2] HACKEL E. Gramineae novae Ⅱ[J].FeedesRepSpNov. 1907, 3: 241-245.
[4] RAIZADA M B, BENNET S S R. Nomenclatural changes in some flowering plants[J].IndianForester, 1981, 107(7): 432-437.
[5] CLAYTON W D, RENVOIZE S A. Genera Graminum: Grasses of the World[M]. Kew Bulletin Additional Series 13. London: Her Majesty’s Stationery Office. 1986.
[6] SHUKLA U. The grasses of northeastern India[M]. Jodphur: Scientific Publishers. 1996.
[7] NOLTIE H J. Flora of Bhutan[M]. Edinburgh: Royal Botanic Garden Edinburgh. 2000, 3 (2):608-617.
[8] 耿以礼. 中国主要植物图说(禾本科)[M]. 北京: 科学出版社, 1959.
[9] 郭本兆, 卢生莲, 孙永华, 等. 中国植物志(第九卷第三分册)[M]. 北京:科学出版社,1987.
[10] 吴征镒, 路安民, 汤彦承, 等. 中国被子植物科属综论[M]. 北京:科学出版社. 2003.
[11] 马海英. 广义拂子茅属(禾本科)的系统学研究[D]. 北京: 中国科学院研究生院, 2005.
[12] GILLESPIE L J, ARCHAMBAULT A, SORENG R J,etal. A close phylogenetic relationship detected betweenPoasubg.Andinaeof Patagonia andHookerochloaandFestucellaof Australia (Poaceae, Pooideae, Poeae): evidence from nuclear and chloroplast DNA sequences and morphology[C]. XVII International Botanical Congress, Vienna, Austria Center, July 2005. 2005: 17-23.
[13] SORENG R J, PETERSON P M, ROMASCHENKO K,etal. A worldwide phylogenetic classification of the Poaceae (Gramineae)[J].JournalofSystematicsandEvolution, 2015, 53: 117-137.
[14] CHEN S L, SUN B X, LIU L,etal. Poaceae[M]//. In Flora of China. Beijing: Science Press & St. Louis: Missouri Botanical Garden Press. 2006, 22: 1-653.
[15] BUTZIN F. Zur Klassifizierung der Spelzenformen bei den Gramineen mit besonderer Berücksichtigung der begrannten Spelzen (On the Classification of the Glume Forms in the Gramineae, with Special Regard to Awned Glumes)[J].Willdenowia, 1969: 445-470.
[16] ADEL E G, EI-GHANI M, SHALABI L. Taxonomic significance of Glume morphology and leaf epidermal characteristics in some taxa of tribe Aveneae (Poaceae).NotulaeScientiaBiologicae,2013, 5(2), 144.
[17] 李密密, 舒 璞, 周义锋, 等.中国薯蓣属植物叶表皮微形态特征及其分类学意义[J].西北植物学报,2012, 32(11):2 232-2 242.
LI M M, SHU P, ZHOU Y F,etal. Micro-morphological characteristics of leaf epidermis and its taxonomic significance inDioscoreafrom China[J].ActaBotanicaBoreali-OccidentaliaSinica, 2012, 32(11): 2 232-2 242.
[18] 王悦云, 孙庆文, 杨 雯,等.中国淫羊藿属药用植物花粉特征及其分类学意义[J].西北植物学报,2015, 35(7):1 367-1 377.
WANG Y Y, SUN Q W, YANG W,etal. Pollen Characteristics and taxonomic significance of Chinese Epimedium Medicinal plant[J].ActaBotanicaBoreali-OccidentaliaSinica, 2015,35(7):1 367-1 377.
[19] 廖晨阳, 高 辉, 杨 洁. 中国伞形科狭义当归属果实表面微形态特征及其分类学研究[J].西北植物学报,2015,35(1):65-75.
LIAO C Y, GAO H, YANG J. Micromorphological characteristics of pericarp surface ofAngelicas.s.(Apiaceae) from China and its taxonomic significance[J].ActaBotanicaBoreali-OccidentaliaSinica, 2015, 35(1):65-75.
[21] ELLIS R P. A procedure for standardizing comparative leaf anatomy in the Poaceae. II. The epidermis as seen in surface view[J].Bothalia, 1979, 12(4): 641-671.
[22] 陈守良, 金岳杏, 吴竹君.禾本科叶片表皮微形态图谱[M].南京:江苏科学技术出版社.1993.

图版 Ⅰ 扫描电镜下沟稃草属及其近缘属植物颖片微形态1. 沟稃草; 2. 法氏早熟禾; 3. 久内早熟禾; 4. 硬质早熟禾; 5. 羊茅; 6. 多花黑麦草; 7. 黑麦草; 8. 鼠茅; 9. 粟草; 10. 异颖草; 11. 柔弱野青茅; 12. 拂子茅; 13. 假苇拂子茅; 14. 拂子茅(原变种); 15. 多花剪股颖; 16. 华北剪股颖; 17. 虉草; 18. 藏黄花茅; 19. 光稃野燕麦; 20. 野燕麦; 21. 棒头草; 22. 苦竹Plate Ⅰ SEM micrographs on glumes of Aniselytron and related generaFig.1. A. treutleri;Fig.2. P. faberi;Fig. 3. P. hisauchii;Fig. 4. P. sphondylodes;Fig. 5. F. ovina;Fig. 6. L. multiflorum;Fig. 7. L. perenne;Fig. 8. V. myuros;Fig. 9. M. effusum;Fig. 10. D. petelotii;Fig. 11. D. flaccida;Fig. 12. C. epigeios;Fig. 13. C. pseudophragmites;Fig. 14. C. epigeios var. epigeios;Fig. 15. A. micrantha;Fig.16. A. clavata;Fig. 17. P. arundinacea;Fig. 18. A. hookeri;Fig. 19. A. fatua var. glabrata;Fig. 20. A. fatua;Fig. 21. P. fugax;Fig. 22. P. amarus
(编辑:潘新社)
The Micromorphology of Glumes ofAniselytronand Its Related Genera
WANG Yanhong, ZHANG Xuejie, FAN Shoujin*
(Key Laboratory of Plant Stress Research, College of Life Science, Shandong Normal University, Ji’nan 250014, China)
The micromorphology of glumes for 20 species and 2 varieties belonging toAniselytronand its related genera of Poaceae was examined by scanning electron microscope. The results showed that: (1) the glumes ofAniselytronand its related genera were characterized by long tubular or short tubular intercostal long cells with markedly sinuous walls. Intercostal cork cells distributed solitary with the shape of subrotund and intercostal silica bodies were absent. The shapes of silica cells in costal zones were subrotund. Parallel-sides to low dome shaped subsidiary cells were found. Prickles were frequently occurred in both costal zones and intercostal zones. Hook-hairs and papillaes could be seen while no micro-hairs and macro-hairs were found. (2) A phylogenetic tree was constructed according to the characters of glumes micromorphology.Aniselytronand Poeae clustered together, which indicated that they have a close relationship and distantly related toCalamagrostisandDeyeuxia. (3) According to the micromorphology of the glumes, we draw the conclusion thatAniselytronshould not as a member ofCalamagrostiss. l. and should as an independent genus be placed in Poeae.
Aniselytron; glumes; micromorphology; SEM
1000-4025(2016)08-1608-07
10.7606/j.issn.1000-4025.2016.08.1608
2016-05-19;修改稿收到日期:2016-07-13
国家自然科学基金(31170173,31470298);山东省自然科学基金(ZR2012CM012);山东省科技攻关项目(2010GSF10205)
王燕红(1987-),女,在读博士研究生,主要从事植物资源分类研究。
*通信作者:樊守金,博士,教授,博士研究生导师,主要从事植物资源分类研究。E-mail: fanshoujin007@163.com
Q944.5
A

