携带人卵泡刺激素受体的慢病毒载体疫苗的构建及其免疫效应检测
马晓玲 刘红春 李江伟
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
携带人卵泡刺激素受体的慢病毒载体疫苗的构建及其免疫效应检测
马晓玲 刘红春 李江伟
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
制备携带卵泡刺激素受体的慢病毒载体疫苗,并研究其对小鼠的免疫效应。将卵泡刺激素受体胞外区(fshr366)基因克隆到慢病毒载体上,采用脂质体转染法将重组质粒转染至293T细胞中,包装并产生含有目的基因的病毒颗粒;分别利用RT-PCR和Western blot检测感染病毒颗粒的293T细胞中fshr366 在mRNA水平及蛋白水平的表达情况;用携带fshr366的病毒颗粒单次腹腔免疫BALB/c小鼠,分别在免疫0、14、21和28 d对小鼠眼眶采血,ELISA法检测免疫小鼠血清的特异性并测定抗体滴度。酶切和测序结果表明fshr366基因片段成功构建到慢病毒载体上。将包装产生的携带fshr366的慢病毒颗粒感染293T细胞后,RT-PCR和Western blot检测结果表明细胞在转录水平和蛋白水平均表达fshr基因。ELISA结果显示携带fshr366的慢病毒颗粒单次腹腔免疫小鼠后,免疫14 d就激起了机体的体液免疫反应,抗体滴度达到1∶1 600。成功制备了携带卵泡刺激素受体的慢病毒载体疫苗,其可以在小鼠体内激发FSHR抗原特异的早期持续性免疫反应。
卵泡刺激素受体;慢病毒载体;疫苗;体液免疫反应
卵泡刺激素(follicle-stimulating hormone,FSH)在人类生殖过程中发挥着重要作用,是促进和维持正常的性腺发育和生殖功能的重要激素[1],其生理功能是通过与卵巢颗粒细胞膜表面的特异性受体即卵泡刺激素受体(follicle-stimulating hormone receptor,FSHR)的结合来发挥的[2]。FSHR是一种跨膜糖蛋白,属于G蛋白偶联受体超家族中的糖蛋白亚家族成员。人的FSHR由695个氨基酸组成,其中氨基端17个氨基酸为疏水性信号肽,紧接着是FSHR的胞外区由349个氨基酸构成,其后是264个氨基酸构成的跨膜区,胞内区是65个氨基酸组成的羧基末端[3]。以往对FSHR与肿瘤关系的研究主要集中于卵巢癌,但是最新研究发现FSHR 除了在卵巢癌中表达,在其他多种实体瘤血管内皮细胞中也都有表达,但是在邻近的正常组织中不表达[7],推测FSH 与其受体FSHR可能通过不同信号途径参与促进肿瘤血管形成作用[8]。初步研究表明FSHR有可能作为潜在的肿瘤治疗靶点和肿瘤诊断以及愈后分子标志物[9,10]。因此,制备基于FSHR靶点的抗体对肿瘤的诊断以及治疗都有重要的意义。
本研究中采用的慢病毒表达载体是以人类免疫缺陷I型病毒(HIV-1)为基础发展起来的基因治疗载体[11]。它具有可以感染非分裂期细胞、容纳外源性大基因片段、基因导入效率及表达水平高等优点[12],慢病毒载体介导的转基因的表达能持续数月[13],从而达到良好的基因治疗效果。
本实验构建了携带人卵泡刺激素受体胞外区的慢病毒载体疫苗,将包装出的携带卵泡刺激素受体胞外区的慢病毒颗粒单次免疫小鼠研究其体液免疫效应,旨在为进一步研究靶向人卵泡刺激素受体的慢病毒载体疫苗的抗肿瘤机制和效果奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 pCMV-SPORT6-FSHR质粒购自长沙赢润生物技术有限公司;质粒Lenti-EGFP、pCMV-dR8.91、pCMV-VSVG购自上海斯丹赛生物技术有限公司;大肠杆菌菌株DH5α和293T细胞为新疆生物资源基因工程重点实验室提供;6-8周BALB/c小鼠,购买于新疆医科大学。
1.1.2 工具酶和主要试剂 Pfx聚合酶为Invitrogen公司产品;T4连接酶、各种限制性内切酶和逆转录酶为Fermentas公司产品;质粒小提试剂盒、PCR产物纯化试剂盒、DNA胶回收试剂盒购自上海生工生物工程有限公司;兔抗FSHR多克隆抗体为上海江莱生物科技有限公司产品;抗β-actin鼠单克隆抗体、羊抗兔HRP-IgG单克隆抗体、羊抗鼠HRP-IgG单克隆抗体为北京康为世纪生物科技有限公司产品;Opti-MEM培养基、DMEM 培养基和胎牛血清购自GIBCO公司。脂质体转染试剂为Promega公司产品;polybrene为Sigma公司产品;其他试剂均为国产分析纯。
1.2 方法
1.2.1 FSHR胞外区的扩增 以pCMV-SPORT6-FSHR质粒作为PCR扩增FSHR胞外区基因序列的模板,根据FSHR胞外区基因序列设计引物:P1:5'-GGCCTGATCAGCCACCATGGCCCTGCTCCTGGTCTC-3' 包含BclⅠ酶切位点,P2:5'-CCGGGCTAGCTCTGAGGATGTTGTACCCCATG-3'包含酶切位点NheⅠ,此引物扩增的序列为FSHR胞外区加信号肽的基因序列(即FSHR第1-366位氨基酸,共1 098 bp,将扩增出的片段简称为fshr366)。
1.2.2 基因克隆、构建及测序 用限制性内切酶BamHⅠ(BclⅠ的同尾酶)和NheⅠ双酶切慢载体Lenti-EGFP,切胶回收载体。用BclⅠ和NheⅠ双酶切fshr366基因片段。回收纯化步骤参考上海生工DNA胶回收试剂盒和PCR产物纯化试剂盒说明书。连接产物转化DH5α感受态细胞,挑取单克隆,对PCR以及双酶切鉴定为阳性的重组子进行测序。
1.2.3 重组质粒的转染及编码fshr366的慢病毒的包装 将提取的无菌处理过的重组质粒Lentifshr366/Lenti-EGFP∶pCMV-VSVG∶pCMV-dR8.91按4∶2∶3质量比例混于37℃预热的Opti-MEM,Opti-MEM∶三质粒总质量=50∶1(μL/μg)。充分混匀离心后将恢复到室温的fugene HD转染试剂与三质粒总质量的比为3∶1(μL/μg)加到液面下吹打混匀。室温静置15 min后,将混合液滴加到预铺的293T细胞中摇匀。分别收集48-96 h的病毒上清,用0.45 μm滤器过滤,过滤后上清即病毒液。得到空白对照病毒液以及含FSHR基因的病毒液。
1.2.4 RT-PCR检测慢病毒Lenti-fshr366感染的293T细胞中FSHR基因的表达 收集未感染的293T细胞和感染了携带fshr366的慢病毒颗粒的293T细胞,加入Trizol充分裂解细胞后提取细胞的总RNA,反转录合成cDNA。以cDNA为模板,fshr366的上游引物为:fshr366-5'-AAATCTTAAGAAGCTGAGGGCCA-3',下游引物为:fshr366-5'-GATGAAGCTCAGAGATTTGCCG-3';内参基因G3PD的上游引物为:G3PD-5'-AGGTCGGAGTCAACGGATTTGG-3',下游引物为:G3PD-5'-AGGCTGTTGTGATACTTCTCATGG-3'。PCR扩增慢病毒Lenti-fshr366感染的293T细胞中fshr基因以及内参基因的表达。
1.2.5 Western blot检测慢病毒Lenti-fshr366感染的293T细胞中FSHR蛋白表达 收集293T细胞、空载病毒颗粒感染的293T细胞和携带fshr366的慢病毒颗粒感染的293T细胞,加入细胞裂解液将细胞吹散,在冰上裂解10 min后,12 000 r/min离心5 min,弃细胞碎片,从上清中收集蛋白质。上清经12%SDSPAGE凝胶电泳,转膜,3% BSA 封闭过夜,PBST洗5次后,加入一抗兔抗人FSHR多克隆抗体,室温孵育2 h,PBST洗3次,加入二抗HRP-羊抗兔IgG,室温孵育1 h后化学发光显色,观察目的蛋白的表达情况。
1.2.6 重组慢病毒疫苗对小鼠的免疫效应研究 将BALB/c小鼠分为3组,每组7只,分别为A、培养基对照组;B、空载体慢病毒组;C、携带fshr366的慢病毒组。分别单次、腹腔注射:A、100 μL 含10%胎牛血清的DMEM培养基;B、100 μL含相当于500 ng/mL p24抗原的空载慢病毒颗粒;C、100 μL含相当于500 ng/mL p24抗原的携带fshr366的慢病毒颗粒。分别在免疫第0、14、21和28 d小鼠眼眶取血,分离血清,ELISA检测小鼠血清中IgG抗体特异性及抗体滴度。其中FSHR抗原包被浓度为8 μg/mL,一抗为不同稀释比例的小鼠血清,二抗为HRP标记的山羊抗小鼠IgG(H+L),其稀释比例为1∶5 000。终止后使用酶标仪于450 nm处测量OD值,采用GraphPad Prism5.0进行分析。
2 结果
2.1 目的基因fshr366的PCR扩增及纯化回收
以pCMV-SPORT6-FSHR质粒为PCR模板,用P1、P2引物PCR扩增获得fshr包含信号肽的胞外区的目的基因fshr366,电泳结果(图1)显示,在约1 098 bp附近处有明显条带。
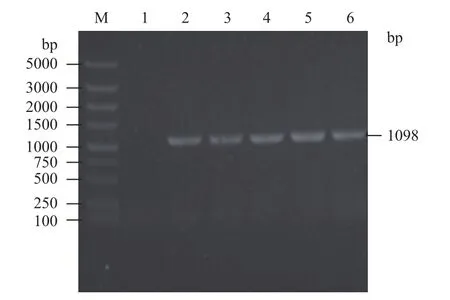
图1 PCR扩增目的基因fshr366
2.2 目的基因fshr366与载体的酶切、纯化回收
用限制性内切酶BamHⅠ和NheⅠ对慢载体Lenti-EGFP进行双酶切,用BclⅠ(BamHⅠ同尾酶),NheⅠ对目的基因fshr366进行双酶切。凝胶电泳结果(图2)显示,酶切结果正确(Lenti-EGFP为7.8 kb和911 bp,fshr366为1 098 bp)。将载体和目的基因的酶切产物进行切胶回收,得到条带大小正确的单一的条带。
2.3 重组质粒Lenti-fshr366的鉴定
将重组质粒转化入DH5α感受态细胞中,随机挑取单克隆进行菌液PCR扩增鉴定正确重组的基因克隆,如图3所示。因为载体上的BamHⅠ和基因上的BclⅠ为同尾酶,同尾酶连接后,酶的识别位点改变,所以选用载体和目的基因上都有的酶切位点EcoR V来进行酶切鉴定,载体上在4 253 bp处有EcoR V酶切位点,目的基因在1 074 bp处有EcoR V酶切位点,重组质粒酶切后的条带预期大小为1.3 kb和7.5 kb,选取PCR鉴定阳性的质粒用EcoRⅤ进行单酶切鉴定,符合预期片段大小,结果如图4所示。对阳性重组基因进行测序,测序结果显示fshr366已正确连接到慢病毒载体上。
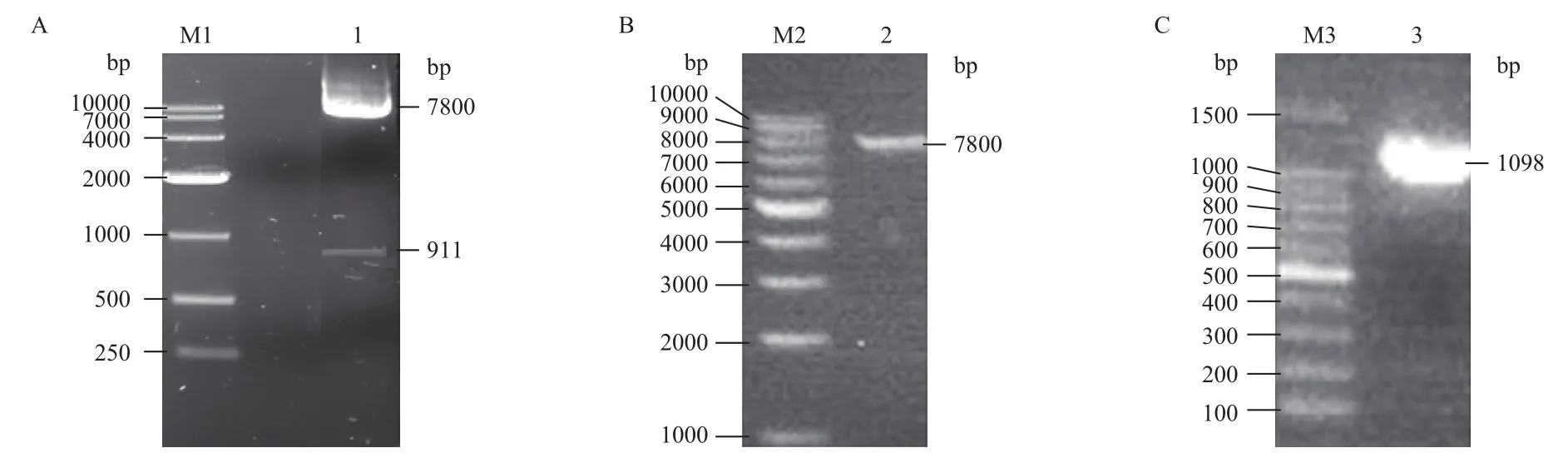
图2 Lenti-EGFP载体和目的基因fshr366的酶切及回收
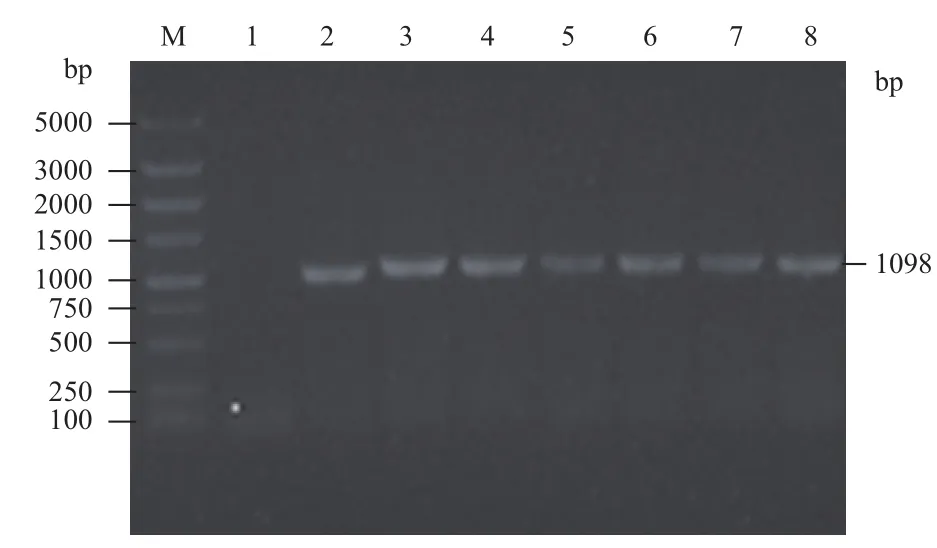
图3 菌液PCR鉴定重组质粒Lenti-fshr366
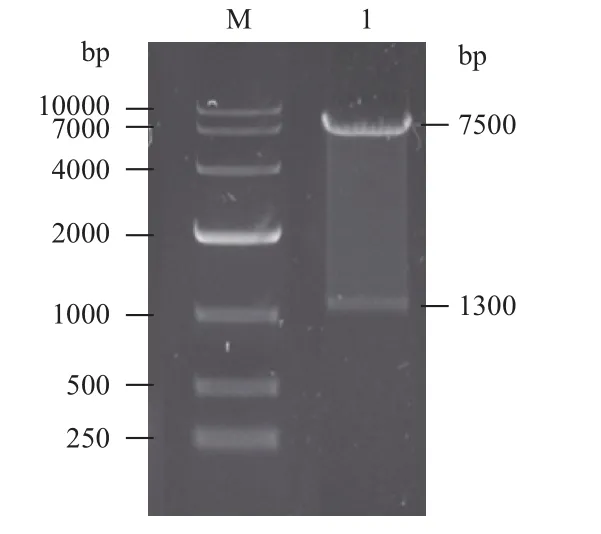
图4 重组质粒Lenti-fshr366的酶切鉴定
2.4 携带fshr366的慢病毒颗粒的包装及感染
采用脂质体转染法将Lenti-fshr366/Lenti-EGFP、pCMV-VSVG、pCMV-dR8.91共转染入293T细胞,转染24 h后,收集含有病毒颗粒的培养基,即得到含有目的基因fshr366的病毒和空载的病毒(图5)。
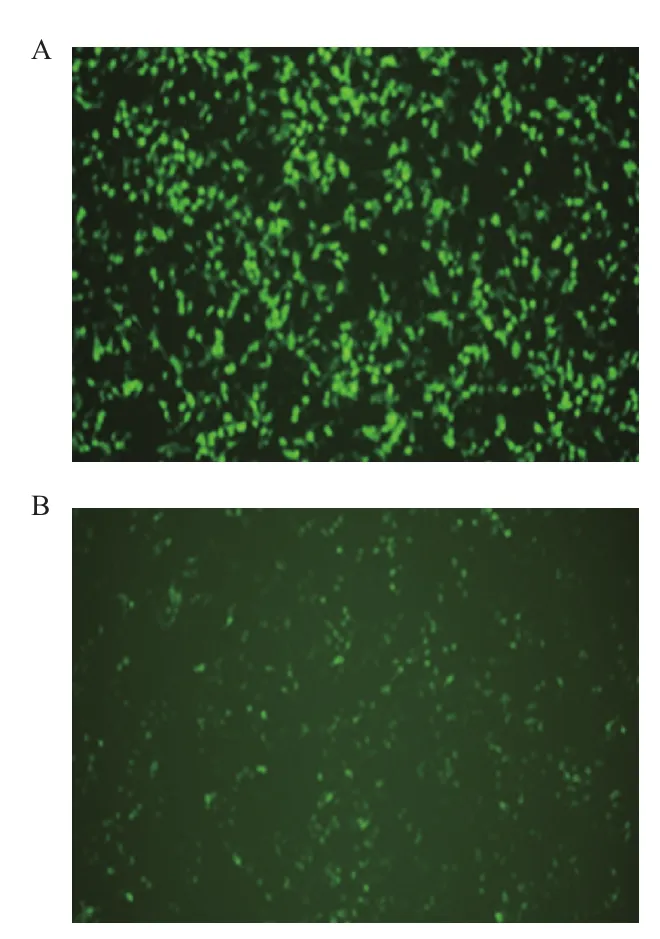
图5 空质粒Lenti-EGFP(A)和重组质粒Lenti-fshr366(B)转染293T细胞(10×)
2.5 RT-PCR检测fshr366基因在293T细胞中的表达
收集未感染的293T细胞及感染携带fshr366的慢病毒颗粒的293T细胞,提取各组细胞中的总RNA,反转后进行RT-PCR,结果(图6)显示fshr366在携带fshr366的慢病毒颗粒感染的293T细胞中表达量明显高于未转染的293T细胞组。
2.6 Western blot检测FSHR366蛋白在293T细胞中的表达
分别用空载慢病毒颗粒和携带fshr366的慢病毒颗粒感染293T细胞,感染48 h后收集并裂解细胞,Western blot结果(图7)显示,与空载慢病毒颗粒转染组和未转染293T细胞相比较,只有携带fshr366的慢病毒颗粒感染的293T细胞中有FSHR366蛋白的表达。
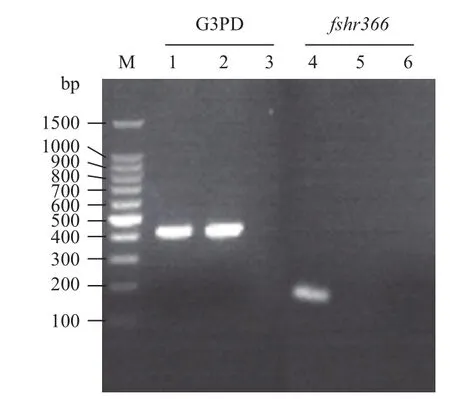
图6 RT-PCR检测293T细胞中fshr366的表达

图7 Western blot检测感染携带fshr366的慢病毒颗粒感染的293T细胞中FSHR366蛋白的表达
2.7 ELISA检测小鼠血清中IgG抗体水平
分别用培养基、空载病毒颗粒、携带fshr366的病毒颗粒单次腹腔免疫BALB/c小鼠,在免疫第0、14、21和28天对小鼠进行眼眶取血,用FSHR349蛋白作为抗原,ELISA检测血清中IgG抗体特异性及抗体滴度。
利用Graphpad Prism 5对ELISA结果进行单因素方差分析后得出,在小鼠血清稀释比例为1∶200时,检测携带fshr366的病毒颗粒免疫的小鼠的血清抗体水平,发现在第14、21和28天的抗体水平与免疫前相比有显著差异(P<0.05)。空载病毒颗粒免疫的小鼠免疫14、21和28天后与免疫前相比抗体水平有显著差异(P<0.05),表明空载病毒颗粒对激起小鼠的体液免疫反应有一定的影响。但免疫后14、21和28 d,实验组与空载病毒组相比差异显著(P<0.05),与培养基组相比差异极显著(P<0.01)。数据结果(图8)表明,携带fshr366的病毒颗粒单次免疫BALB/c小鼠后能激起小鼠的体液免疫反应。根据抗体滴度测定结果(图9)显示,实验组免疫后14 d和21 d抗体的滴度均为1∶1 600,在28 d时达到1∶3 200,表明此慢病毒疫苗激起早期的持续性体液免疫反应。
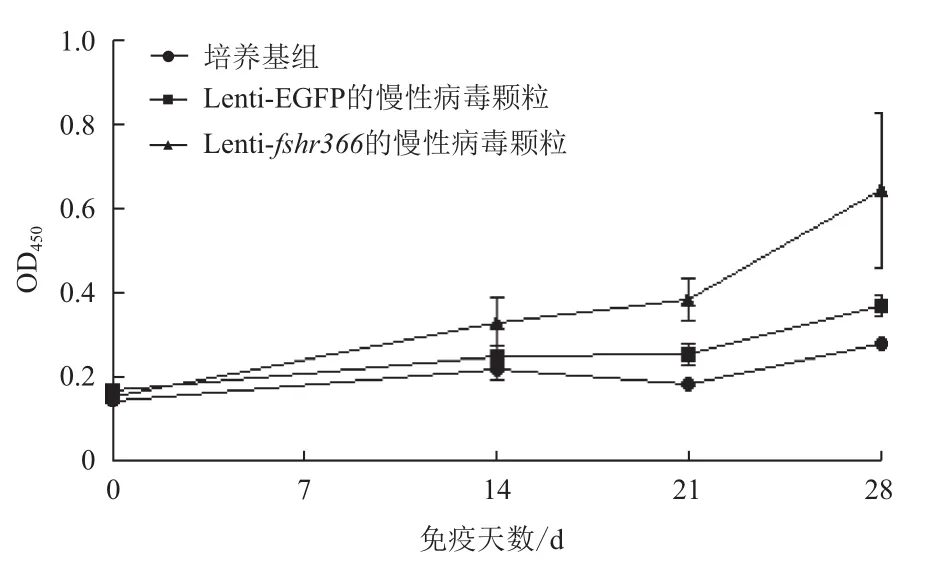
图8 ELISA检测小鼠血清中IgG抗体水平
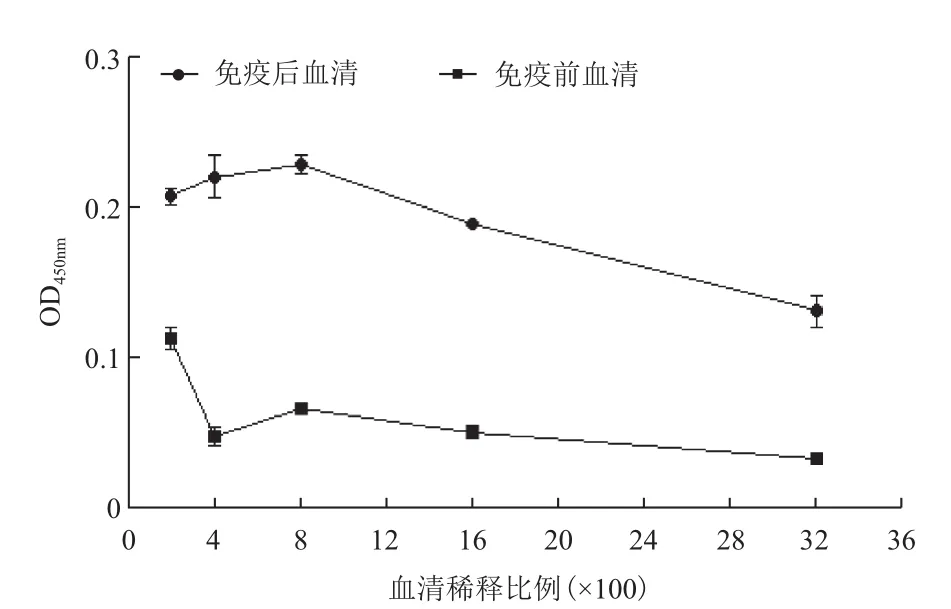
图9 ELISA测定fshr366的病毒颗粒免疫28 d小鼠血清中抗体的滴度
3 讨论
人类免疫缺陷病毒-1(HIV-1)来源的慢病毒载体是目前基因治疗中研究较多的载体,近来在疫苗研制领域也显现出极大的应用潜力[14]。与通常使用的腺病毒、腺相关病毒以及逆转录病毒载体相比,具有感染非分裂期细胞及容纳外源性目的基因片段大和免疫源性低等优点。本研究针对FSHR基因构建慢病毒载体疫苗,进一步证明了慢病毒载体可以作为激发体液免疫反应的有效工具。
以往基于慢病毒载体的疫苗的研究主要用于产生细胞免疫反应[15-18],作为产生体液免疫反应的应用并不多见,但 Iglesias等[19]通过构建基于西尼罗病毒的E型包膜糖蛋白的慢病毒载体疫苗,首次研究了慢病毒疫苗激起机体特异性和保护性的体液免疫。本研究结果扩展了慢病毒载体疫苗的应用,更有价值的是,在本研究中我们构建的携带FSHR胞外区的慢病毒载体疫苗,仅通过单次小剂量的病毒颗粒免疫小鼠便得到了持续时间达到28 d的抗体反应,抗体滴度达到1∶3 200。这些结果与Iglesias等[19]的研究相类似,表明慢病毒载体可以激发早期、持续性的体液免疫反应。由此显示,慢病毒载体具有作为一种主动免疫疫苗载体的潜能。
本实验所研究的靶点为FSHR,FSHR以往被认为主要表达在生殖细胞中,其与配体FSH共同作用促进卵巢内卵泡的发育。但由于FSHR本身结构的多态性及在正常组织及癌变组织中表达的差异性[20],使得FSHR与卵巢癌的发生发展有一定的联系。Zhang等[21]通过FSH肽将抗肿瘤药物紫杉醇靶向导入FSHR阳性的卵巢癌细胞,在体内外获得了显著的抗肿瘤效应,同样,董俊等[22]通过FSH肽将卵巢癌发生发展相关的趋化因子1(CXCL1)的siRNA靶向导入FSHR阳性的卵巢癌细胞,抑制了卵巢癌细胞的生长、迁移及侵袭,都证明了靶向FSHR的治疗方法是可行且有效的。最近又发现FSHR 在多种实体瘤血管内皮细胞内特异表达,这强烈提示FSHR可以作为肿瘤治疗的一个很好的切入点,激起了研究人员对该蛋白新的研究兴趣。Stilley等[23]发现,FSH与其受体结合可以促进HUVEC细胞的血管形成作用。本研究通过构建的携带FSHR的慢病毒疫苗初步证明,该疫苗可以激发持续的抗FSHR抗体,其产生的抗体有望阻断肿瘤血管细胞表面FSHR与配体的结合从而可能获得抗肿瘤效应。关于这一部分工作需要后期进一步的抗肿瘤动物实验验证。
4 结论
本研究构建了携带FSHR的慢病毒载体疫苗,单次腹腔免疫BALB/c小鼠,ELISA结果显示在免疫28 d时抗体滴度达到1∶3 200,说明疫苗在小鼠体内获得了持续的体液免疫反应。证明了慢病毒载体疫苗在激起机体体液免疫方面具有的潜在应用价值。
[1] Pierce JG, Parsons TF. Glycoprotein hormones:structure and function[J]. Annual Review of Biochemistry, 1981, 50(1):465-495.
[2]任春明, 字向东, 张重庆, 等. 卵泡刺激素的研究进展[J]. 科研前沿, 2006, 10(208):10-13.
[3] Simoni M, Gromoll J, Nieschlag E. The Follicle-stimulating hormone receptor:Biochemistry, molecular biology, physiology, and pathophysiology 1[J]. Endocrine Reviews, 1997, 18(6):739-773.
[4]Li Y, Ganta S, Cheng C, et al. FSH stimulates ovarian cancer cell growth by action on growth factor variant receptor[J]. Molecular and Cellular Endocrinology, 2007, 267(1):26-37.
[5]Parrott JA, Doraiswamy V, Kim G, et al. Expression and actions of both the follicle stimulating hormone receptor and the luteinizing hormone receptor in normal ovarian surface epithelium and ovarian cancer[J]. Molecular and Cellular Endocrinology, 2001, 172(1):213-222.
[6]Zheng W, Lu JJ, Luo F, et al. Ovarian epithelial tumor growth promotion by follicle-stimulating hormone and inhibition of the effect by luteinizing hormone[J]. Gynecologic Oncology, 2000, 76(1):80-88.
[7]Radu A, Pichon C, Camparo P, et al. Expression of folliclestimulating hormone receptor in tumor blood vessels[J]. New England Journal of Medicine, 2010, 363(17):1621-1630.
[8]Stilley JA, Guan R, Duffy DM, et al. Signaling through FSH receptors on human umbilical vein endothelial cells promotes angiogenesis[J]. The Journal of Clinical Endocrinology & Metabolism, 2014, 99(5):E813-E820.
[9]Gartrell BA, Tsao C, Galsky MD. The follicle-stimulating hormone receptor:a novel target in genitourinary malignancies[C]// Urologic Oncology:Seminars and Original Investigations. Elsevier,2013, 31(8):1403-1407.
[10]Ghinea N. A novel role for FSH receptor as a tumor endothelial cell marker[J]. Acta Endocrinologica(Buc), 2010, 6(4):507-512.
[11]柏琦, 那鑫妮, 冯姗姗. 病毒载体的发展历程及现状[J]. 中国医药指南, 2011, 9(23):224-225.
[12]Palmowski MJ, Lopes L, Ikeda Y, et al. Intravenous injection of a lentiviral vector encoding NY-ESO-1 induces an effective CTL response[J]. The Journal of Immunology, 2004, 172(3):1582-1587.
[13]李明峰, 候静, 熊伟民. 携带AFP基因慢病毒载体制备并感染树突状细胞的实验研究[J]. 细胞与分子免疫学杂志, 2009,25(9):791-793.
[14]罗望, 张泓, 许淼, 等. 慢病毒—基因转移的潜在新载体[J].江苏药学与临床研究, 2006, 14(6):366-371.
[15]Esslinger C, Chapatte L, Finke D, et al. In vivo administration of a lentiviral vaccine targets DCs and induces efficient CD8(+)T cell responses[J]. J Clin Invest, 2003, 111:1673-1681.
[16]Breckpot K, Dullaers M, Bonehill A, et al. Lentivirally transduced dendritic cells as a tool for cancer immunotherapy[J]. J Gene Med, 2003, 5:654-667.
[17]Esslinger C, Romero P, MacDonald HR. Efficient transduction of dendritic cells and induction of a T-cell response by thirdgeneration lentivectors[J]. Hum Gene Ther, 2002, 13:1091-1100.
[18]Palmowski MJ, Lopes L, Ikeda Y, et al. Intravenous injection of a lentiviral vector encoding NY-ESO-1 induces an effective CTL response[J]. J Immunol, 2004, 172:1582-1587.
[19] Iglesias MC, Frenkiel MP, Mollier K, et al. A single immunization with a minute dose of a lentiviral vector-based vaccine is highly effective at eliciting protective humoral immunity against West Nile virus[J]. The Journal of Gene Medicine, 2006, 8(3):265-274.
[20] Wunseh A, AhdaY, Banaz-Yasar F, et al. Single-nucleotide polymorphisms in the promoter region influence the expression of the human follicle-stimulating Hormone receptor[J]. Fertil Steril,2005, 84(2):446-453.
[21]Zhang X, Chen J, Zheng Y, et al. Follicle-stimulating hormone peptide can facilitate paclitaxel nanoparticles to target ovarian carcinoma in vivo[J]. Cancer Research, 2009, 69(16):6506-6514.
[22]董俊. 基于卵泡刺激素素受体介导的靶向治疗卵巢癌实验研究[D]. 上海:复旦大学, 2011.
[23] Stilley JA, Guan R, Duffy DM, et al. Signaling through FSH receptors on human umbilical vein endothelial cells promotes angiogenesis[J]. The Journal of Clinical Endocrinology & Metabolism, 2014,99(5):E813-E820.
(责任编辑 李楠)
Development of a Lentivirus Vector-based Vaccine Carrying Folliclestimulating Hormone Receptor and Assay of Its Immunological Effect
MA Xiao-ling LIU Hong-chun LI Jiang-wei
(Key Laboratory of Xinjiang Biological Resources and Gene Engineering,College of Life Sciences and Technology,Xinjiang University,Urumqi 830046)
This work aims to prepare lentivirus vaccine with a follicle-stimulating hormone receptor(FSHR)and investigate the immunological effect of it on mice. The gene(fshr366)of extracellular region of FSHR was cloned into lentivirus vector. The recombinant plasmids were transfected into the 239T cells by the method of lipidosome transfection,and the virus particles(Lenti-FSHR366)with target gene were produced after encapsulation. The expressions of fshr366 mRNA and FSHR366 protein in 293T cells infected by Lenti-FSHR366 were detected by RT-PCR and Western blot. For evaluating the immunological effects,BALB/c mice were intraperitoneally inoculated with single immunization of fshr366-carring virus,collecting the blood samples from the orbits of mice at day 0,14,21 and 28 after immunization,then ELISA method was used to detect the specificity of the sera from immunized mice and determine the titer of the antibody. The RE digestion and DNA sequencing results showed the gene fragment of fshr366 was successfully cloned into lentivirus vector. After transfection to 293T cells with the encapsulated lentivirus particles carrying fshr366,the detection results by RT-PCR and Western blot indicated the expression of gene fshr in the cells at transcription and protein level. The results of ELISA revealed that the humoral immune response in mice rose on day 14 after single immunization through intraperitoneally injection of lentivirus particles carrying fshr366,the titer of antibody was 1∶1 600.
follicle-stimulating hormone receptor;lentivirus vector;vaccine;humoral response
10.13560/j.cnki.biotech.bull.1985.2016.03.024
2015-09-03
国家自然科学基金项目(81260333),新疆自治区高技术研究发展项目(201110102)
马晓玲,女,硕士研究生,研究方向:肿瘤免疫诊断和治疗的分子基础研究;E-mail:1239598355@qq.com
李江伟,男,教授,研究方向:肿瘤免疫诊断和治疗的分子基础研究;E-mail:jwli67@sina.com

