电镜技术在植物病害研究中的应用
马丹丹 邓雨青 周彦 周常勇 李中安
(西南大学柑桔研究所,重庆 400712)
电镜技术在植物病害研究中的应用
马丹丹 邓雨青 周彦 周常勇 李中安
(西南大学柑桔研究所,重庆 400712)
电子显微镜(electron microscopy,EM)是20世纪最重要的发明之一,其特有的高分辨率,在植物病害检测、超微结构及形态观察中发挥了重要作用。对目前常用的透射电子显微镜,扫描电子显微镜、环境扫描电子显微镜、扫描隧道显微镜及原子力显微镜等新型电镜的原理及其在植物病害研究中的应用作一介绍,旨在为更好的运用电镜技术提供参考。
超微结构;电子显微镜;植物病害
植物在生长发育过程中常受细菌、真菌、病毒等病原物的危害,以及温度、湿度等不利环境因子的胁迫,从而使得植株的细胞及亚细胞结构发生变化,进而造成植株生长发育变缓甚至死亡。电镜技术是研究这一病变过程,以及病原物形态和结构的重要工具。本文就当前主要的电镜类型及其在植物病害研究中的应用进行概述,以期为更好的运用电镜技术提供借鉴。
1 透射电子显微镜
透射电镜(transmission electron microscope,TEM)的原理是电子束照射样本后,用电磁透镜收集穿透样本的电子,并放大成像,进而显示物体内部的超微结构。其放大倍数为40-100万倍,分辨率达0.2 nm。因样品类别和研究内容不同,透射电镜需辅以负染、超薄切片和免疫电镜技术。
1.1 负染技术
负染技术(negative staining)最早由Brenner和Home在研究番茄丛矮病毒(tomato bushy stunt virus,TBSV)时所提出[1]。其原理是将标本包埋在染色物质里,借助染色剂增强背景对电子的散射作用而使标本在荧光屏上形成暗背景下的亮像。常用的负染色剂有磷钨酸、醋酸铀、甲酸铀和钼酸铵等。
由于负染技术可显示生物大分子、细菌、病毒、分离的细胞器及蛋白质晶体等样品的形状、结构特征,且样品制备简单,只需用载膜铜网或镍网直接蘸取组织汁液,负染,晾干后便可用于电镜观察,因此该技术被广泛运用于莴笋(图1-A)、柑橘、烟草、甘薯(图1-B)等寄主中病原的检测[2-5]。此外,由于病毒在寄主中分布不均,且含量低,因此为提高检测的准确性,常将病毒颗粒经超离富集后再进行负染观察。该方法已成功应用于柑橘黄脉病毒(citrus yellow vein clearing virus,CYVCV)、烟草花叶病毒(tobacco mosaic virus,TMV)等的研究[6,7]。
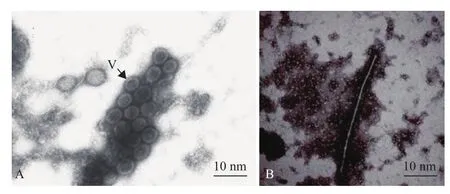
图1 电镜负染图片
1.2 超薄切片技术
负染技术虽可以通过观察病原粒子形态快速诊断病原,但无法观察病株超微结构的变化及病原在组织中的分布。超薄切片技术可解决这一难题。通过将样品固定、脱水、树脂渗透、包埋、聚合后,制备成50-80 nm的超薄切片,再经醋酸铀和柠檬酸铅双重染色,便可在电镜下进行观察。
研究人员借助超薄切片技术研究寄主感病后超微结构的变化,从而揭示了粗柠檬对柑橘黄龙病(citrus huanglongbing,HLB)具有较强耐性的原因[8],明确了苜蓿属中不同皂苷提高白杨抗病能力的机理[9],以及植物先天免疫反应中细胞自噬调控细胞程序性死亡的过程[10]。同时,运用超薄切片技术对病原在组织的分布进行定位,在马铃薯的韧皮部中发现存在一种与柑橘黄龙病菌十分相似的新型病原细菌,从而为研究马铃薯斑马片病(potatoes zebra chip disease,ZP)这种新发病害的系统发育提供了帮助[11]。超薄切片的TEM图片以黄龙病菌侵染的柑橘样品组织为例[12],如图2所示。

图2 电镜观察柑橘黄龙病组织结构[12]
1.3 免疫电镜技术
免疫电镜技术(immune electron microscopy,IEM)又称为免疫细胞化学技术(immunocy tochemistry),其原理是通过将免疫学与超微结构形态学相结合,利用抗原-抗体的特异性结合对抗原或抗体进行精确定位[13]。
根据标记方法的不同,免疫电镜技术又分为免疫铁蛋白技术、免疫酶标技术和免疫胶体金技术。但免疫铁蛋白技术存在Fe原子的分子量太大,难以透过细胞膜和组织,只适用于细胞表面抗原定位等缺点。早期,朱培坤[14]和吕文渊[15]分别将免疫酶标技术应用于长叶车前花叶病毒(ribgrass mosaic virus,RMV)和水仙花叶病毒(natcissus mosaic virus,NMV)在植物组织细胞内的分布,该技术虽可实现对细胞内外的抗原进行定位,但因酶反应产物比较弥散而分辨率较低。因此,这两种标记方法在植物病害研究中应用较少。免疫胶体金技术因其具有较高灵敏度而被广泛运用于番茄不孕病毒(tomato aspermy virus,TAV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)、柑橘鳞皮病毒(citrus psorosis virus,CPsV)、番茄环纹斑点病毒(tomato zonate spotvirus,TZSV)(图3)等病害的检测[5,16,17]。同时,由于免疫胶体金能够检测到亚细胞水平,因此也将该技术结合超薄切片技术被用于大麦条纹花叶病毒(barly strip mosaic virus,BSMV)、广藿香病毒X(patchouli virus X,PatVX)、甜菜坏死黄脉病毒(beet necrotic yellow vein virus,BNYVV)等病原在寄主细胞中的定位[18-20]。此外,免疫电镜技术还被用于揭示病毒编码的蛋白在病毒的复制、症状表达、移动及传播过程中所发挥的作用[21]。
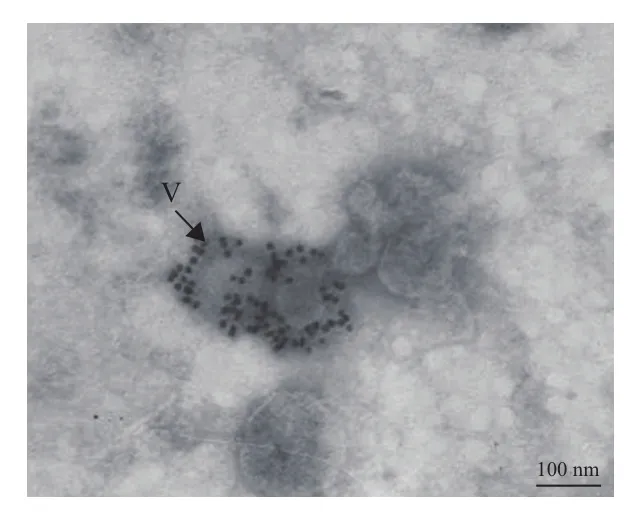
图3 胶体金免疫电镜观察到的TZSV病毒粒子[5]
2 电子显微镜的类型
2.1 扫描电子显微镜
扫描电子显微镜(scanning electron microscope,SEM)是继透射电镜之后发展起来的一种电子显微镜。其原理是利用高能电子束在涂有导电材料的样本上扫描,通过电子与样本元素互作,产生包含样本形态学、结晶学等信息的图像。
扫描电镜与光学显微镜观察相比,具有分辨率高、立体感强、图像直观等优点,更适于观察样品表面的微小形态特征。Motamedi[22]和Sadeghi[23]分别通过SEM技术,观察到异株荨麻(Urtica dioica)提取物和银纳米粒子(Ag-NPs)可分别使表皮葡萄球菌(Staphylococcus epidermidis)和金黄色葡萄球菌(Staphylococcus aureus)的大小、结构发生变化,进而明确其杀菌机理。此外,该技术还应用于研究恶臭假单胞菌(Pseudomonas putida)菌株THJ609-3(图4)、链霉菌(Streptomyces aureus)和蓝藻细菌(Cyanobacteria)等生防菌的抗病机理[24-26]。

图4 柑橘黑变病菌孢子的扫描电镜图片[24]
2.2 其他电子显微镜类型
除TEM和SEM这两种使用最为广泛的电子显微镜外,高压电子显微镜(high-voltage electron microscope,HVEM),以及环境扫描电子显微镜(environmental scanning electron microscope,ESEM)、扫描隧道显微镜(scanning tunneling microscope,STM)、原子力显微镜(atomic force microscope,AFM)等新型电镜技术也是植物病害研究的重要手段。
2.2.1 高压电子显微镜 HVEM 的原理与TEM基本相同,但前者的加速电压为200-1 000 kV,远高于后者的50-100 kV,因此所检测的切片厚度最大可达1 μm,制片过程较TEM简单[27]。该技术不仅用于观察细菌的形态结构,还因其强穿透能力、高分辨率、低损伤和占用空间小等优点,被用于研究植物中亚细胞器的结构差异[28]。
监测结束后,读取数据库,对固定周期(2 min)检测器和变周期数据传输检测器每次发送的数据分别进行提取,记录并累加数据字符的长度,每天统计一次。两种模式下,数据字符长度累加情况如图11所示。
2.2.2 环境扫描电子显微镜 ESEM是一种扫描式电子光学仪器,其样品室压力为10-2 700 Pa的高气压低真空环境[29]。生物样品可不经脱水、干燥、导电等处理而直接观察,避免了操作过程中样本的损伤,实现了样本结构的活体观察[30]。Fan等[31]运用该技术研究水稻稻曲病菌(Ustilaginoidea virens,Uv)时发现,Uv菌丝可穿透拟南芥和烟草表皮的角质层,并观察到其分生孢子到厚壁孢子的转变。而D'Aquino等[32]在柑橘绿霉病菌(Penicillium digitatum)的研究中,利用该技术观察经噻苯咪唑(thiabendazole,TBZ)处理的柑橘表皮的结构变化。此外,Zankel等[33]通过该技术对天竺葵叶片表皮细胞上腺毛的顶端细胞进行观察发现,在代谢非常活跃的细胞中内含大量的细胞器和小液泡,这为今后深入研究植物内部生理代谢活动及植株抗病性等都有重要意义。
2.2.3 扫描隧道电子显微镜 STM是IBM苏黎世实验室于1981年发明的,其主要原理是利用电子隧道效应,在分子、甚至原子水平上观察物体表面结构[34]。该技术可用于明确生物分子的结构特征,从而为研究病原菌的侵染机理,以及植株的抗性提供技术支持。如张玉忠等[35]将该技术应用于棉花纤维的研究中,因其高分辨率可清晰地观察到纤丝的超微结构。而Masai等[36]在研究嗜热细菌H+-ATPase亚基复合物时发现,利用STM比TEM等更适于观察H+-ATPase分子的结构。
2.2.4 原子力显微镜 AFM是在STM的基础上发展起来的一种新型电镜技术,与STM最大的差别在于利用原子间的范德华力作用,而非量子力学隧道效应来呈现样品的表面特征,其优势在于样品不受导电性质的影响,且具有高分辨率,可对感染病毒后的细胞表面形态的改变进行研究[37]。Imai等[38]利用AFM直接对TMV的二维成核生长过程进行了研究,避免了STM样本电涂层对内部细微结构观察的影响。而Drygin等[39]利用AFM对TMV高分子量的RNA分子和核糖核蛋白进行研究发现,TMV中存在因RNA分子突起造成的局部裸露结构。
3 不足与改进
电镜技术在植物病害研究中发挥越来越重要的作用。虽然各类电镜具有其特有的技术优势(表1),但仍面临如下问题。

表1 电镜在植物病害研究中的应用
3.1 负染色灵敏度问题
负染色检测技术虽可快速检测病原,但其灵敏度受载网支持膜上病原数量和分布的影响。尤其是在植物病原含量低时,如果直接粗提取负染则不易检出。为此,宋敬东等[40]提出利用超速离心浓度样本、提高载网吸附病原能力及改变病原在载网支持膜上分布均匀度等改进方法。
3.2 TEM中样品制备问题
TEM样品制作步骤环环相扣,任何一个环节的失误,均会影响电镜照片的质量,即无法客观真实的观察植物病害诱发的寄主超微结构病理变化及病原的组织定位。为此,李博[41]针对载网支持膜污染、切片污染及染色污染等环节提出了相应的改进措施。而Neweomb等和Kuntsche等[42,43]建立的超低温快速冷冻技术可有效解决常规化学固定因其作用时间长导致的生物组织结构发生变化,从而影响超微结构分析的难题。此外,杨瑞等[44]还根据材料的渗透性差异,比较了不同的树脂类型,并对样品的包埋方法进行了改进,以便获得高质量的包埋块。
胶体金标记技术在操作过程中仍存在标记效率不高和特异性不强等问题,严重影响植物病原诊断的准确性。为此,Roberts等[45]对预处理条件进行了探索,提出样品使用戊二醛单独固定、玻片用Decon75预处理等改进方法。
3.4 SEM的成像问题
SEM通常捕获的是灰色图像,缺乏视觉感染力,且图像信息贫乏。Sim等[46,47]通过将Canny边缘检测技术和现有的优化着色技术相结合,发展出的Canny自适应优化技术不仅可提供彩色图像,还提高了图像的质量。此外,新近出现的伪映射技术,进一步提高了SEM图像输出格式转换的灵活性[48]。
4 小结
自世界上第一台电镜问世至今,经过半个多世纪的发展,电镜技术已取得了重大的突破。今后随着多种技术的相互协作,尤其计算机技术的不断融合,将使电镜技术得到不断的完善,同时随着电镜样品制备技术的不断发展,电镜技术将在植物病害研究中发挥更为重要的作用。
[1] Crowther RA. Viruses and the development of quantitative biological electron microscopy[J]. IUBMB Life, 2004, 56(5):239-48.
[2]郑宽瑜, 董家红, 方琦, 等. 胶体金免疫电镜技术检测番茄环纹斑点病毒[J]. 电子显微学报, 2015, 1:12.
[3] Byadgi AS, Ahlawat YS. A new viral ringspot disease of citrus(citrus species)in India[J]. Indian Journal of Agricultural Sciences,1995, 65(10):763-770.
[4]Önelge N, Satar S, Elibüyük Ö, et al. Transmission studies on Citrus yellow vein clearing virus[C]. In:Proc 18th Conf IOCV IOCV,Riverside, CA:2011.
[5]谢礼, 吕明芳, 王芳, 等. 甘薯羽状斑驳病毒和甘薯褪绿矮化病毒复合侵染甘薯引起的细胞病理学研究[J]. 电子显微学报,2013(6):485-491.
[6] Loconsole G, Onelge N, Potere O, et al. Identification and characterization of citrus yellow vein clearing virus, a putative new member of the genus mandarivirus[J]. Phytopathology, 2012, 102(12):1168-1175.
[7] Mascia T, Nigro F, Abdallah A, et al. Gene silencing and gene expression in phytopathogenic fungi using a plant virus vector[J]. Proc Natl Acad Sci USA, 2014, 111(11):4291-4296.
[8] Fan J, Chen C, Achor DS, et al. Differential anatomical responses of tolerant and susceptible citrus species to the infection of ‘Candidatus Liberibacter asiaticus'[J]. Physiol Mol Plant Pathol, 2013, 83:69-74.
[9] Paparella S, Tava A, Avato P, et al. Cell wall integrity, genotoxic injury and pcd dynamics in alfalfa saponin-treated white poplar cells highlight a complex link between molecule structure and activity[J]. Phytochemistry, 2015, 111:114-123.
[10] Liu Y, Schiff M, Czymmek K, et al. Autophagy regulates programmed cell death during the plant innate immune response[J]. Cell, 2005, 121(4):567-577.
[11]Ferrari S, Savatin DV, Sicilia F, et al. Oligogalacturonides:plant damage-associated molecular patterns and regulators of growth and development[J]. Frontiers in Plant Science, 2013, 4:49.
[12]傅仕敏. 柑橘黄龙病的细胞病理及其寄主转录组学研究[D].重庆:西南大学, 2014.
[13]Liu S, Vijayendran D, Bonning BC. Next generation sequencing technologies for insect virus discovery[J]. Viruses, 2011, 3(10):1849-1869.
[14]朱培坤, 陆妙康, 朱孔生, 等. 长叶车前花叶病毒在青菜叶片叶柄内的免疫酶标定位[J]. 植物病理学报, 1983, 1:5.
[15] 沈明山, 洪维廉, 郭洁, 等. 水仙花叶病毒的免疫酶标检测方法[J]. 厦门大学学报:自然科学版, 1993, 2:19.
[16] Rao AL, Hatta T, Francki RI. Comparative studies on tomato aspermy and cucumber mosaic viruses. VII. Serological relationships reinvestigated[J]. Virology, 1982, 116(1):318-326.
[17]Achachi A, Barka EA, Ibriz M. Recent advances in Citrus psorosis virus[J]. Virus Disease, 2014, 25(3):261-276.
[18]Lin NS, Langenberg WG. Immunohistochemical localization of barley stripe mosaic virions in infected wheat cells[J]. J Ultrastruct, Res, 1983, 84(1):16-23.
[19]PE Filho M, de O Resende R, Lima M, et al. Patchouli virus X, a new potexvirus from Pogostemon clabin[J]. Annals of Applied Biology, 2002, 141(3):267-274.
[20] Pakdel A, Mounier C, Klein E, et al. On the interaction and localization of the beet necrotic yellow vein virus replicase[J]. Virus Research, 2015, 196:94-104.
[21] 李文财, 周常勇. 免疫电镜技术在植物病毒研究中的应用[J].南方农业, 2011(3):84-86.
[22] Motamedi H, Seyyednejad SM, et al. Introducing Urtica dioica, A native plant of khuzestan, as an antibacterial medicinal plant[J]. Jundishapur J Nat Pharm Prod, 2014, 9(4):e15904.
[23]Sadeghi B, Jamali M, Kia S, et al. Synthesis and characterization of silver nanoparticles for antibacterial activity[J]. International Journal of Nano, Dimension, 2010, 1(2):119-124.
[24]Ko YJ, Kim JS, Kim KD, et al. Microscopical observation of inhibition-behaviors against Diaporthe citri by pre-treated with Pseudomonas putida, strain THJ609-3 on the leaves of citrusplants[J]. Journal of Microbiology, 2014, 52(10):879-883.
[25]Gopalakrishnan S, Srinivas V, Alekhya G, et al. The extent of grain yield and plant growth enhancement by plant growth-promoting,broad-spectrum Streptomyces sp. in chickpea[J]. Springer Plus,2015, 4:31.
[26]Priya H, Prasanna R, Ramakrishnan B, et al. Influence of cyanobacterial inoculation on the culturable microbiome and growth of rice[J]. Microbiological Research, 2015, 171:78-89.
[27]Murata K, Esaki M, Ogura T, et al. Whole-cell imaging of the budding yeast Saccharomyces cerevisiae by high-voltage scanning transmission, electron tomography[J]. Ultramicroscopy, 2014,146:39-45.
[28]Marty F. High voltage electron microscopy of membrane interactions in wheat[J]. J Histochem Cytochem, 1980, 10:1129-1132.
[29] Stokes D. Investigating biological ultrastructure using environmental scanning electron microscopy(ESEM)[J]. Science, Technology and Education, of Microscopy:An Overview, 2003, 1:564-570.
[30] Pathan A, Bond J, Gaskin R. Sample preparation for scanning electron microscopy of plant surfaces—horses for courses[J]. Micron, 2008, 39(8):1049-1061.
[31] Fan J, Guo XY, Huang F, et al. Epiphytic colonization of Ustilaginoidea virens on biotic and abiotic surfaces implies the widespread presence of, primary inoculum for rice false smut disease[J]. Plant Pathology, 2014, 63(4):937-945.
[32] D'Aquino S, Fadda A, Barberis A, et al. Combined effects of potassium sorbate, hot water and thiabendazole against green mould of citrus fruit, and residue levels[J]. Food Chemistry, 2013, 2:858-864.
[33]Zankel A, Kraus B, Poelt P, et al. Ultramicrotomy in the ESEM, a versatile method for materials and life sciences[J]. Journal of Microscopy, 2009, 233(1):140-148.
[34]De Feyter S, Gesquière A, Abdel-Mottaleb MM, et al. Scanning tunneling microscopy:a unique tool in the study of chirality,dynamics, and reactivity in physisorbed organic monolayers[J]. Accounts of Chemical Research, 2000, 33(8):520-531.
[35] 张玉忠, 时东霞. 棉花纤维超微结构的扫描隧道显微镜观察[J]. 生物化学与生物物理学报:英文版, 2000, 32(5):521-523.
[36] Masai J, Shibata T, Kagawa Y, et al. Imaging of subunit complexes of thermophilic bacterium H+-ATPase with scanning tunneling microscopy[J]. Ultramicroscopy, 1992, 42:1194-1199.
[37]Kiselyova O, Yaminsky I, Karger E, et al. Visualization by atomic force microscopy of tobacco mosaic virus movement protein-RNA complexes formed in vitro[J]. J Gen Virol, 2001, 6:1503-1508.
[38]Imai K, Yoshimura K, Tomitori M, et al. Scanning tunneling and atomic force microscopy of t4 bacteriophage and tobacco mosaic virus[J]. Japn J Appl Phys, 1993, 32(6S):2962.
[39]Drygin YF, Bordunova OA, Gallyamov MO, et al. Atomic force microscopy examination of tobacco mosaic virus and virion RNA[J]. FEBS Letters, 1998, 425(2):217-221.
[40]宋敬东, 屈建国, 鲁茁壮, 等. 提高负染法透射电镜检测病毒灵敏度的制样方法及应用[J]. 病毒学报, 2010, 26(5):410-413.
[41] 李博. 关于透射电镜样品污染问题的探讨[J]. 临床与病理杂志, 2014, 5:39.
[42]Newcomb W, Jackson S, Racette S, et al. Ultrastructure of infected cells in the actinorhizal root nodules of Gymnostoma papuanum,(Casuarinaceae)prepared by high pressure freezing and chemical fixation[J]. Protoplasma, 1990, 157(1-3):172-181.
[43]Kuntsche J, Horst JC, Bunjes H. Cryogenic transmission electron microscopy(cryo-TEM)for studying the morphology of colloidal drug delivery systems[J]. Int J Pharm, 2011, 1:120-137.
[44]杨瑞, 范敬伟, 刘文可, 等. 植物透射电镜样品制备技术的改进及不同树脂选择比较[J]. 北京农学院学报, 2013, 4:5-7.
[45]Roberts IM. Factors affecting the efficiency of immunogold labelling of plant virus antigens in thin sections[J]. Journal of Virological Methods, 1994, 50(1-3):155-166.
[46]Sim KS, Tso CP, Ting HY. Canny optimization technique for electron microscope image colourization[J]. Journal of Microscopy, 2008, 232(2):313-334.
[47]Sim KS, Ting HY, Lai MA, et al. Improvement to the scanning electron microscope image colorization by adaptive tuning[J]. Journal of Microscopy, 2009, 234(3):243-250.
[48]Lo TY, Sim KS, Tso CP, et al. Improvement to the scanning electron microscope image adaptive Canny optimization colorization by,pseudo-mapping[J]. Scanning, 2014, 36(5):530-539.
(责任编辑 狄艳红)
Application of Electron Microscopy Technology in the Research of Plant Diseases
MA Dan-dan DENG Yu-qing ZHOU Yan ZHOU Chang-yong LI Zhong-an
(Citrus Research Institute,Southwest University,Chongqing 400712)
Electron microscopy(EM)is the most important invention in the 20th century. The EM plays a great role in detection of the plant disease and observation of ultrastructure and morphology because of its high resolution. The principles of electron microscopes commonly used at present and their applications in the plant disease research were introduced in this article,including transmission electron microscope(TEM),scanning electron microscope(SEM),environmental scanning electron microscope(ESEM),scanning tunneling microscope(STM)and atomic force microscope(AFM). This article is aimed to provide reference for the better utilization of electron microscopy.
ultrastructure;electron microscope;plant diseases
10.13560/j.cnki.biotech.bull.1985.2016.03.007
2015-05-18
国家公益性行业(农业)科研专项(201203076),国家科技支撑子课题(2012BAD19B06),重庆市两江学者项目,中央高校基本科研业务费(XDJK2014A001)
马丹丹,女,硕士研究生,研究方向:细胞生物学;E-mail:dandanmxz@163.com
李中安,男,研究员,研究方向:分子植物病理学,细胞生物学;E-mail:zhongan@cric.cn

