硒化合物抗肿瘤研究进展
陈霄汉,张 驰,2*
(1.湖北民族学院生物科学与技术学院,湖北恩施445000;2.生物资源保护与利用湖北省重点实验室(湖北民族学院),湖北恩施445000)
硒化合物抗肿瘤研究进展
陈霄汉1,张 驰1,2*
(1.湖北民族学院生物科学与技术学院,湖北恩施445000;2.生物资源保护与利用湖北省重点实验室(湖北民族学院),湖北恩施445000)
自1957年硒被确认为人体所必需的微量元素以来,其具备的抗肿瘤特性被不断地证实.越来越多的研究成果显示,硒对各种肿瘤,如肝癌、乳腺癌、胃癌等,有显著地预防和抑制效果.本文对硒的发展历程、抗肿瘤机制、硒化合物抗肿瘤的研究进展进行了阐述.其中,硒抗肿瘤机制目前仍然处于假说阶段,对硒抗肿瘤的研究主要是硒化合物在动物性抗肿瘤试验、硒化合物在体外细胞抗肿瘤试验以及在临床医学上的干预性试验.
硒;抗肿瘤;机制;进展
1 硒与硒化合物
1817年Berze1ius首次发现了新未知元素并命名为硒(Se1enium).然而硒自发现的100多年时间内,相关硒与硒化合物研究几乎停滞不前,根本原因是由于无机硒自身有剧毒且硒化合物带有独特性恶臭使人们误认为它没有深入研究的价值[1].1957年Schwarz等[2]证实了硒为人体新陈代谢所必需的营养元素.经过研究的深入,人们渐渐认识到硒的特性及其特点.硒是原子序数34的氧族元素,化学性质介于非金属与金属之间的典型半金属,化学价位有2、0、+4、+6四个价位.硒为带金属光泽的固体,能导电、导热.自然界中硒分布不均匀,硒矿很少单独成矿,多为伴生矿.硒在植物和其他有机食品中以有机硒酸盐或无机亚硒酸的形式存在,是人必需微量元素,其中硒代半胱氨酸以UGA为密码子的形式翻译进入蛋白质中,人类硒基蛋白组包含35种含硒蛋白质,硒主要以含硒蛋白质以及含硒氨基酸两类存在于机体内[3].1973年WHO正式宣布硒为人体必需微量元素;并且被进一步证实为合成谷胱甘肽过氧化酶的必需成分[4-5].人体不能储存硒,需要定时定量摄入硒来维持硒在机体内的动态平衡.健康成年人吸收硒含量约为15 μg/(70 kg·d),经小肠吸收通过血液分布于其他器官,最后经甲基化后通过粪便、尿液排出体外[6].硒已被证实具有广泛的生物学功能,人体多种疾病都与硒的缺乏密切相关,特别是对恶性肿瘤具有良好的预防和辅助治疗的作用被各大科学家视为最为关注的领域之一.2003年美国食品药品监督管理局确认硒是抑癌剂,这是美国政府正式对硒的抗肿瘤能力的声明.目前,含硒化合物抗肿瘤的研究已有了少的成果,已有含硒化合物药物作为临床抗肿瘤药物.
2 硒抗肿瘤作用及其机制
2.1 硒抗肿瘤流行学证据
大量流行性病学调查研究均显示硒拥有抗肿瘤特性.Shamberger等[7]1969年首先报道了美国55~64岁白人男子肿瘤患者肿瘤死亡率与当地硒含量呈负相关,生存时间与体内硒含量呈正相关.Scharauzer等[8]1977年将流行病学调查研究工作扩展到27个国家和地区,调查结果显示,癌症死亡率和当地膳食中硒含量呈负相关.于玉树等[9]于20世纪80年代随机检测了我国多个省市与地区居民血硒含量,发现癌症总标化死亡率和被检测人群血硒水平负相关(P<0.01).
2.2 硒抗肿瘤实验证据
在硒预防与干预性实验和抗肿瘤性实验中,硒也表现出的抗肿瘤特性.1943年就已展开了硒抗肿瘤动物性实验相关研究,结果发现硒能有效抑制大鼠肝癌细胞增殖[10].中美两国科学家于河北林县(食道癌、胃癌高发区,土壤中硒含量较低)进行预防干预性实验,200多万人随机分组,分别定时定量(50 μg/d)补充胡萝卜素、VE和硒酵母的摄入量,调查结果显示总癌发病率降低8%和胃癌发病率降低16%;总癌死亡率降低13%,胃癌死亡率降低20%,其中服用硒酵母的分组死亡率明显低于其他分组[11].多国科学家研究硒与致癌物相互作用,研究表明硒有明显抑制肿瘤生长作用,数据来源[12]如表1.
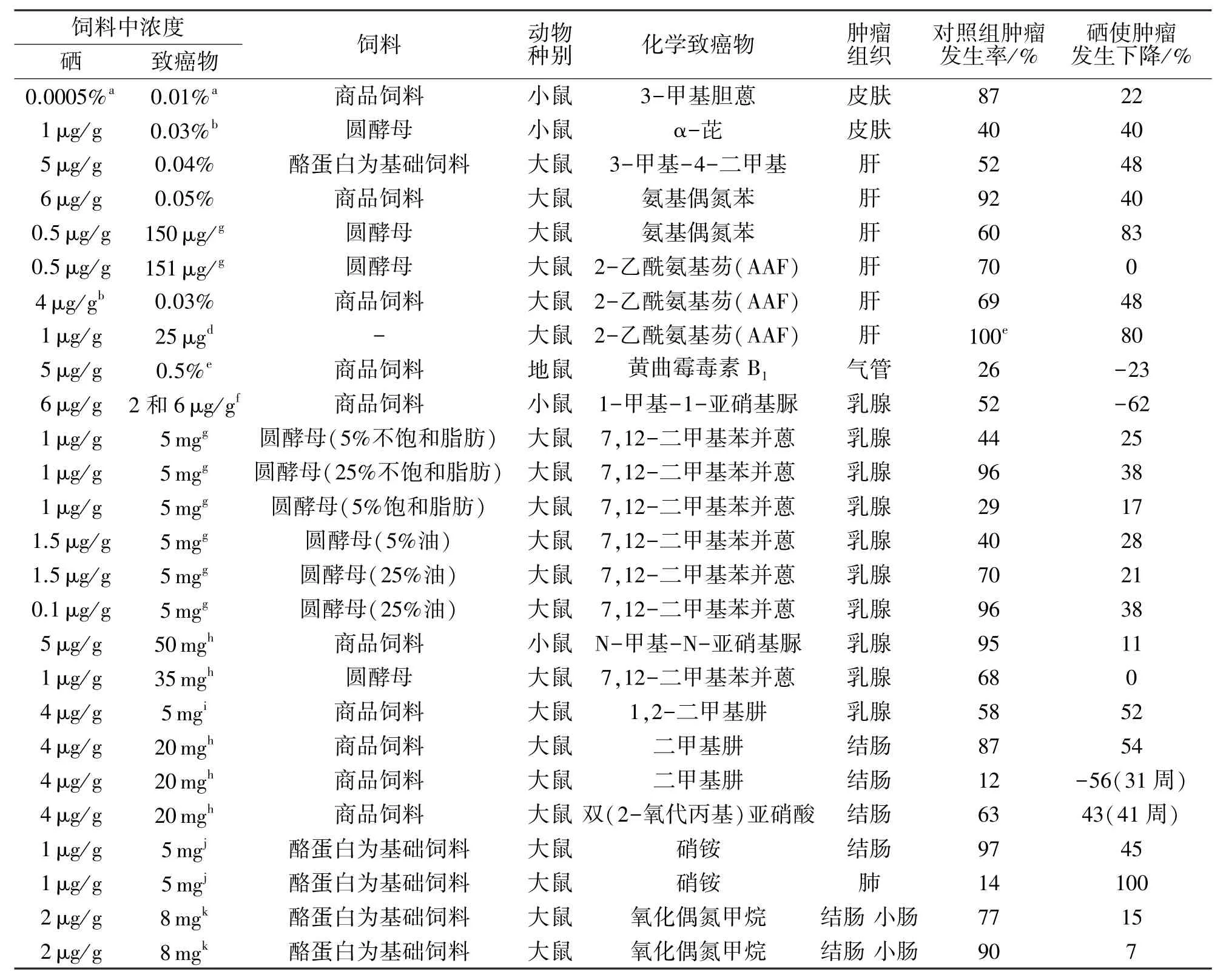
表1 各研究者报告的硒对化学致癌物在小动物组织影响Tab.1 The effects of se1enium on chemica1 carcinogens in sma11 anima1 tissues
2.3硒抗肿瘤机制
就目前而言,含硒化合物抗肿瘤机制较成熟的作用机理大致可以分为以下几种.
2.3.1 抗氧化作用 抗氧化作用一直是目前已确认的硒抗肿瘤作用重要机制.生物体在生长发育以及代谢过程中的生化反应能够产生大量的自由基,如O2·-(超氧阴离子自由基)、HO·(羟自由基)、HOO·(氢过氧自由基)、ROO·(有机过氧化自由基)等.自由基拥有很强的诱发性,可诱发生物膜的脂质发生过氧化反应,使细胞膜发生功能性和结构上的损伤,从而诱发癌变.因此自由基与许多致癌剂或放射性物质的致癌性有关.谷胱甘肽过氧化物酶、谷胱甘肽转移酶、过氧化氢酶等含硒酶以及硒蛋白均有抗氧化作用,从而可抑制自由基的产生并降低诱发癌变的可能[13-14].
2.3.2 诱导癌细胞凋亡作用 硒可以调控癌基因以及抑癌基因的表达,促进肿瘤细胞分化,抑制肿瘤细胞分裂,诱导肿瘤细胞程序化死亡.研究显示亚硒酸钠能降低肝癌细胞基因表达达到抑制癌细胞生长的目的[15];硒也能通过第二信使阻断癌细胞增殖信号传递,抑制蛋白激酶C活性,使环磷酸腺苷分解减慢,环磷酸腺苷含量增高来影响肿瘤细胞增殖;硒蛋白则能影响PI3K-Akt信号通路活性以及基因表达,破坏癌细胞线粒体结构和功能从而影响肿瘤细胞能量代谢,使胰岛素信号下游PI3K-Akt磷脂化水平降达到低抑制癌细胞生长的作用[16].
2.3.3 机体免疫调节作用 硒可以增强人体和动物中的免疫能力,促进淋巴细胞增殖使淋巴细胞产生抗体,提高免疫球蛋白含量,增强NK细胞杀伤活性,增加T细胞数量以及促进肿瘤机体血清中IgG和IgA表达[17-19].利用硒增强人体自身三种免疫能力即细胞免疫、非特异性免疫以及体液免疫从而达到抑制肿瘤细胞的活性的作用.
2.3.4 抑制肿瘤血管生成 硒能抑制肿瘤细胞周围血管生成,降低血管内皮生长因子表达和分泌,调节肿瘤细胞血管内皮基质金属蛋白酶含量[20-22].利用硒抑制肿瘤血管的生成,减少肿瘤所需营养摄取与代谢的渠道,使肿瘤细胞缺少营养坏死,达到延缓或抑制肿瘤继续生长的作用.
2.3.5 保护遗传物质结构和功能 硒能够保护人体蛋白质和DNA大分子的功能与结构完整性,降低自由基混乱交联的可能,增强DNA断链修复能力,从而减少致癌物对蛋白质的影响,降低因遗传物质结构与功能的改变诱发的癌症[23].保护机体遗传物质结构与功能,调节DNA甲基化水平,从基因层面保护机体免受肿瘤侵袭.
2.3.6 降低致癌因子诱变性 羟化酶可诱导致癌基因激活,硒可以降低羟化酶的活性,影响致癌物在机体内的代谢,将酶与致癌物的结合位点和结合形式改变,降低致癌物活性,起到保护机体和抗癌作用[24].
3 硒化合物抗肿瘤研究进展
硒对肝癌、乳腺癌等癌症均有抑制作用.但是值得注意的是,硒并非对所有致癌剂均有抑制作用,不同的硒化合物与不同的癌细胞的抑制作用也不相同,并且不同硒化合物在机体中代谢吸收率也不相同,究竟什么形式的硒化合物较好,也是目前硒化合物抗癌的一大研究热点.对硒化合物抗肿瘤的研究就目前来说,主要有四类研究方法,分别为体外细胞试验、动物肿瘤试验、人群调查以及干预性试验.
3.1 动物肿瘤试验
C1ement等[25-26]对二甲基苯蒽(DMBA)诱发大鼠乳腺癌进行防癌实验,研究硒化合物在人体中的化学形式、代谢与抗癌能力的关系,并对各种能直接进入硒代谢过程中不同阶段的硒化合物的抗肿瘤活性进行了比较,系统研究了各种硒化合物对DMBA诱发大鼠乳腺癌的抑制作用.其结果表面,硒代甜菜碱、(CH3)2Se+CH2COOH、(CH3)2Se+CH2COOH3、CH3SeCH2CH(NH2)COOH都具有很强的抗肿瘤活性,甚至比Na2SeO3更好.其他四个硫化合物抗肿瘤活性顺序为.徐辉碧等[27]采用麦芽汁和亚硒酸钠作培养基,在适宜条件下进行硒酵母培养得到硒酵母,并检测出硒代蛋氨酸是硒酵母的硒化物主要成分.其后用得到的硒酵母进行路易斯肺癌的动物实验,结果显示其对肺癌细胞的抑制率平均在50%以上(P<0.05).同时他们还研究了硒酵母抑制3-甲基胆蒽(MCA)诱发大鼠肺癌实验,发现硒酵母相较于亚硒酸钠对MCA诱发大鼠肺鳞状细胞癌的抑制效果更显著.
高华武等[28]研究了富硒芪云水提物对S180荷瘤小鼠抗肿瘤作用及肿瘤微环境的影响.将小鼠随机分组后连续灌胃给药,10天后富硒芪云水提物抑瘤率(剂量由低到高)分别为13.64%、44.92%、38.70%.
从各类动物肿瘤试验结果来看,均验证了硒拥有优秀的抗肿瘤效果,并在不同含硒化合物有不同效果的抗肿瘤特性.但由于动物肿瘤试验成本较高,试验周期较长,需要调控因素太多且不易控制,所以近几年动物肿瘤试验研究较少.
3.2 体外细胞试验
张秋林等[29]研究了在甘油骨架上含有芳硒基的替加氟硫代磷脂缀合物的合成及其体外细胞抗癌活性.研究发现该缀合物优于替加氟对膀胱癌细胞T-24、胃癌细胞BGC-823的恶性增殖效果抑制作用.刘文奇等[30]报道,通过将甘油骨架的1,3位置分别被芳硒基与叠氮基取代制备的缀合物,相较于替加氟对膀胱癌细胞PGA1的抑制作用高,对胃癌细胞BGC-823的抑制效果相同.
袁启霞等[31]研究了硒代胱氨酸联合顺铂对子宫颈癌细胞(体外培养)的生长抑制作用及其机制.研究发现,经过硒代胱氨酸预处理的子宫颈癌细胞可显著增强顺铂的抑制作用,细胞凋亡性改变.从机制上看,对癌细胞的生长抑制主要是通过诱导线粒体介导的凋亡来实现的.陈庆昌[32]成功合成出纳米硒/钌修饰的MIL-101纳米复合材料,并以该材料为RNA载体,研究克服乳腺癌细胞多药耐药性的抗肿瘤效应.研究表明联合治疗能通过改变基因的表达、激活及调控的途径诱导细胞凋亡,显著影响细胞内微管蛋白的稳态,扰乱正常有丝分裂纺锤体的形成,阻碍细胞周期于G1期从而抑制细胞增殖,且对正常器官无明显损伤.
陈文霞[33]以HNO3-Na2SeO3法硒化纹党参多糖研究其最佳工艺参数及肿瘤抑制率的研究中,得出纹党参硒化最佳工艺为投料比1∶1,反应温度60℃,反应时间5h,硒化纹党参硒多糖含量为1.07mg/g,产率可达50.3%;对A549肺腺癌细胞抑制率为49.36%.Tagaram等[34]研究了一种含硒化合物(PBISe)对(HCC)肝癌的辅助治疗效果.研究结果表明在一定范围内随着PBISe浓度(1~50μg)的递增对HCC类肝癌的抑制增生、诱导癌细胞凋亡效果越明显.伍思琪等[35]检测乳腺癌中硒结合蛋白1和半胱氨酸蛋白酶-3的表达水平,并与正常乳腺组织、良性病变乳腺组织进行分析.发现乳腺癌组织中硒结合蛋白1和半胱氨酸蛋白酶-3的表达下调,推测可能是硒结合蛋白1通过促进肿瘤细胞的凋亡来抑制肿瘤的增殖,为进一步研究对硒诱导硒结合蛋白1治疗乳腺癌的作用提供基础.刘玉芝等[36]用不同梯次剂量的环磷酰胺、亚硒酸钠、甲亚硒酸、硒代半胱氨酸以及他们的相互的混合液分别处理犬乳腺癌CTM1211细胞后检测各组细胞存活率.结果表明硒尤其是甲亚硒酸能显著抑制犬乳腺癌CTM1211细胞,其作用机制与诱导凋亡和调节肿瘤血管生长相关因子有关.Muecke R等[37]利用电子等排原理将硒元素替换异硫氰酸盐中的硫元素制备的硒化合物具有更好的抑制肿瘤增殖、诱导肿瘤细胞凋亡及阻断AKT信号通路的作用.Lin等[38]试验表明硒-环糊精可以促进肿瘤坏死因子的表达和抑制肿瘤诱导的核心因子生成,从而增加癌细胞对诱导肿瘤细胞凋亡因子的敏感性,使药物可以抑制癌细胞而不损伤正常细胞.
李鹏程[39]报道了二(喹唑啉-4-基)二硒醚对6种癌细胞株进行体外抗癌活性抑制测试.结果表明,其对所测试的6株癌细胞均有很好的体外抗癌抑制活性.李鹏程等[40]利用谱图表征了二(喹唑啉-4-基)二硒醚结构,并于体外测定了对6种癌细胞株的抗癌活性和3种植物病原菌的抑菌活性.试验结果显示该硒化合物有良好的体外抗癌能力与中等的抑菌效果.进行作用位点和作用机理的初步研究后预测该类化合物有可能成为潜在的抗肿瘤药物或抑菌药物.胡小梅等[41]利用比色法检测LG003(二(喹唑啉-4-基)二硒醚)与三种药物(长春地辛、表柔比星、尼莫司汀)对靶细胞增殖的影响以及对靶细胞的细胞毒性.在1~10 μmo1/L摩尔体积内LG003的抑制肿瘤增殖作用优于其他三种药物,在1~40μmo1/L摩尔体积下LG003细胞毒性又显著低于其他三种药物.从而证明了LG003对A549细胞在体外有较高的抑制性和较低的细胞毒性.
田志帅等[42]收集一定数量的直肠癌组织、直肠腺瘤组织与正常直肠组织,检测直肠组织中硒蛋白P的表达情况,根据阳性细胞百分率和染色强度进行评价.结果表明硒蛋白P在正常直肠组织、直肠腺瘤组织、直肠癌组织中的表达阳性率分别为依次递减,直肠癌中硒蛋白表达低,证明是硒蛋白对直肠癌的形成有重要作用,为直肠癌的防治提供新的思路.
体外细试验验各类研究结果均表明,硒的不同化合物均有优秀的抗肿瘤特性,且由于体外细胞试验研究周期较短,可控因素容易,近段时间是研究硒抗肿瘤的最热门最主流的方法.目前主要研究方向为不同硒化合物对不同肿瘤细胞的抑制效果以及不同硒化合物与常规抗肿瘤药物的毒性比较.
3.3 干预性试验
目前为止,硒在临床上的应用最广的莫过于辅助治疗癌症患者由于放化疗对机体造成的不良反应,降低肾脏毒性、心脏毒性等一系列毒副反应.
尹良伟等[43]随机分组癌症患者进行化疗,化疗前3 d连续4 d口服以3 000 μg/d为剂量的硒酵母,第5天开始以600μg/d的剂量连续两周口服硒酵母至下一周,对照组只做常规化疗.结果显示对照组骨髓抑制发生率相对较高,证明硒酵母有明显保护骨髓造血功能的作用.周际昌等[44]通过测定肾毒性来观察硒对化疗的效果.研究组口服含硒300~600μg/d的口服液,对照组不服用任何硒制剂.结果显示研究组对降低肾毒性总有效率为60.4%,且随着服用硒含量上升,疗效随之增加.Nematbakhsh M等[45]对患有宫颈癌的病人进行临床试验,试验组以口服200μg/d含硒化合物进行化疗,对照组化疗;一个月后结果发现试验组高于对照组的血硒平均水平,试验组肾小球滤过率明显优于对照组,化疗造成的肾毒性明显降低.
Tacyi1diz N等[46]对采用阿霉素治疗的67例儿童肿瘤患者进行为期6个月的亚硒酸钠(200 μg)补充治疗,结果显示亚硒酸钠能显著提高患者血清脑钠肽(Pro-BNP)水平,显著降低阿霉素的心脏毒性.Buntze1 J等[47]将39例接受放疗的脑癌病人随机分组,试验组(22人)在接受放疗期间口服亚硒酸盐300 μg/d或500 μg/d,对照组(17人)则口服安慰剂,研究发现亚硒酸钠治疗组较安慰剂组患者出现吞咽困难(22.7%与35.3%)、味觉丧失(22.7%与47.1%)等放疗副反应的风险明显降低.Muecke R等[37]在多中心三期临床实验中将81例宫颈癌患者随机分为硒治疗组(39例)及对照组(42例),硒治疗组患者接受300μg/d或500μg/d亚硒酸钠治疗,对照组口服安慰剂;研究发现放射治疗后对照组患者血硒水平明显低于亚硒酸钠组,对照组(44.5%)患者严重腹泻发生率明显高于于亚硒酸钠组(20.5%).
4 展望
硒的防癌抗肿瘤作用已得到各界共同承认,其作用功效也在各种动物性实验、体外实验以及临床上得到了证实,硒在防癌抗肿瘤的作用上必将起到越来越重要的作用.然而在硒的防癌抗肿瘤研究道路上并不是一片坦途,有很多未知需要继续探索,还有许多问题需要解决.比如硒在世界范围内分布不均匀,硒的抗肿瘤机理并没有完全研究透彻,硒在预防与抗肿瘤方面仍然存在争议,硒抗肿瘤药物的开发,硒在临床上预防与治疗肿瘤最合适的使用剂量,这些都是未来发展需要继续探索深入研究的问题.虽然目前硒资源在研究、应用、开发上都存在难题,但问题终会被人们的不停探索所解决,就如目前硒化合物药物的研究上,无机硒脂溶性差,难透过细胞壁,易蓄积,但现在就已有许多有机硒和纳米硒被开发出来.总之随着人们的不懈努力,硒在预防以及治疗肿瘤的研究和应用上必将一片光明.
[1] GROMER S,EUBEL J K,LEE B L,et a1.Review Human se1enoproteins atag1ance[J].Ce11 Mo1 Life Sci,2005,62:2414-2437.
[2] SCHWARZ K,BIERI J G,BRIGGS G M,et a1.Prevention of exudative diathesis in chicks by factor 3 and se1enium[J].Proc Soc Exp Bio1 Med,1957,95(4):621-625.
[3] SHARMA AK,AMIN S.Post SELECT:se1enium on tria1[J].Future Med Chem,2013,5(2):163-174.
[4] ANONYMOUS.Se1enium:an essentia1 e1ement for g1utathione peroxidase activity[J].Nutr Rev,1973,31(9):289-291.
[5] RAYMAN M P.Se1enium and human hea1th[J].Lancet,2012,379(9822):1256-1268.
[6] RAYMAN M P.Food-chain se1enium and human hea1th:emphasis on intake[J].Br J Nutr,2008,100(2):254-268.
[7] SHAMBERGER R J,FROST D V.Possib1e protective effect of se1enium against human cancer[J].Can Med Assoc J,1969,100(14):682.
[8] SCHRAUZER G N,WHITE D A,SCHNEIDER C J.Cancer morta1ity corre1ationstudies-Ⅲ:statistica1 associations with dietary se1enium intakes[J]. Bioinorg Chem,1977,7(1):23-31.
[9] 于玉树,李文广,谢金荣,等.启东县原发性肝癌地理分布特点与硒水平的关系[J].中华肿瘤杂志,1986,8(4):262-264.
[10] MOHAMED J,WEI W L,HUSIN N N,et a1.Se1enium supp1ementation reduced oxidative stress in diethy1nitrosamine-induced hepatoce11u1ar carcinoma in rats[J].Pak J Bio1 Sci,2011,14(23):1055-1060.
[11] LI J Y,TAYLOR P R,LI B,et a1.Nutrition intervention tria1s in Linxian,China:mu1tip1e vitamin/minera1 supp1ementation,cancer incidence,and disease-specific morta1ity among adu1ts with esophagea1 dysp1asia[J].J Nat1 Cancer1nst,1993,85(18):1492-1498.
[12] LEVANDER O A.硒与癌症和心脏病关系研究近况[J].万洪忠,译.国外医学卫生学分册,1989(3):156-157.
[13] RAVMAN M P.Se1enium and human hea1th[J].Lancet,2012,379(9822):1256-1268.
[14] FANG Y Z,YANG S,WU G.Free radica1s,antioxidants an nutrition[J].Nutrition,2002,18(10):872-879.
[15] 蒋建伟,张洹.半乳糖受体介导的c-myc反义核酸对人肝癌细胞的靶向作用[J].癌症,2004,23(11):1288-1293.
[16] STEINBRENNER H,SPECKMANN B,SIES H.Toward understanding success and fai1ures in the use of se1enium for cancer prevention[J].Antioxid Redox Signa1,2013,19(2):181-191.
[17] HAGEMANN-JENSEN M,UHLENBROCK F,KEHLET S,et a1.The Se1enium Metabo1ite Methy1se1eno1 Regu1ates the Expression of Ligands That Trigger Immune Activation through the Lymphocyte Receptor NKG2D[J].Bio1 Chem,2014,289(45):31576-31590.
[18] MANTOVANI G,MACCIO A,MADEDDU C,et a1.Se1enium is effective in inducing 1ymphocyte progression through ce11 cyc1e in cancer patients:potentia1 mechanisms for its activity[J].J Exp Ther Onco1,2004,4(1):69-78.
[19] WOOD S M,BECKHAML C.A Yosioka et a1.beta-Carotene and se1enium supp1ementation enhances immune response in aged humans[J].1ntegr Med,2000,2(2):85-92.
[20] HANAHAN D,FOLKMAN J.Patterasand emecgingmechanisms of the angiogenic switch during tumorigenesis[J].Ce1,1996,86(3):353-364.
[21] ZETTER B R.Angiogenesis and tumor metastasis[J].Annu RevMed,1998,49(4):407-424.
[22] JACKSON M I,COMBS G F.Se1enium and anticarcinogenesis:under1ying mechanisms[J].Curr Opin C1in Nutr Metab Care,2008,11(6):718-726.
[23] ROCOURT C R,WU M,CHEN B P,et a1.The cata1ytic subunit of DNA-dependent protein kinase is downstream of ATM and feeds forward oxidative stress in the se1enium-induced senescence response[J].J Nutr Biochem,2013,24(5):781-787.
[24] JACKSON M I,COMBS G F.Se1enium and anticarcinogenesis:under1ying mechanisms[J].Curr Opin C1in Nutr Metab Care,2008,11(6):718-726.
[25] CLEMENT I P,GANGHTER H E.Activity of methy1ated froms of se1enium in cancer prevention[J].Cancer Res,1990,50(4):1206-1211.
[26] CLEMENT I P,HAVES C,BUDNICK R M,et a1.Chemica1 from of se1enium,critica1 metabo1ites,and cancer prevention[J].Cancer Res,1991,51 (2)595-600.
[27] 徐辉碧,廖宝凉,周井炎,等.硒酵母的培养及其抑制肿瘤作用的分析[J].华中工学院学报,1984,12(3):81-84.
[28] 高华武,富硒茂云水提物对S180荷瘤小鼠肿瘤微环境影响的实验研究[J].中成药,2015,37(3):623-626.
[29] 张秋林,曾纪朝,许新华,等.甘油骨架上含芳硒基的替加氟硫代磷脂缀合物的合成及生物活性[J].高等学校化学学报,2005,26(11):2046-2051.
[30] 刘文奇,尹显洪,减中林,等.O-(1-芳硒基-3-叠氮基)异丙基-O-2(N3-替加氟)烷基硫代磷脂的合成与活性[J].有机化学,2009,29 (12):2021-2025.
[31] 袁启霞,硒代肤氨酸协同增敏顺铂诱导人子宫颈癌HeLa细胞凋亡[J].实用肿瘤杂志,2015,30(4):330-334.
[32] 陈庆昌.多功能纳米复合材料负载MDR-siRNA逆转肿瘤细胞多药耐药性及多金属氧酸盐抑制Aβ聚集的研究[D].广州:暨南大学,2015.
[33] 陈文霞,硒化纹党参多糖和其抗A549细胞的活性[J].中成药,2015,37(11):2480-2413.
[34] HEPHZIBAH RANI S TAGARAM,DHIMANT DESAI,GUANGFU L,et a1.A Se1enium Containing Inhibitor for the Treatment of Hepatoce11u1ar-Cancer[J].Pharmaceutica1s,2016,9:18.
[35] 伍思琪,张玉英,谭亮,等.SBP1和Caspase-3在人乳腺癌组织中的表达及意义[J].解剖学研究,2014,36(1):39-42.
[36] 刘玉芝,李文玉,李成叶,等.多种含硒复合物对犬乳腺癌细胞CTM1211的抑制作用及其机制[J].华中农业大学学报,2015,34(2):78-85.
[37] MUECKE R,SCHOMBURG L,GLATZEL M,et a1.Mu1ticenter,phase 3 tria1 comparing se1enium supp1ementation with observation in gyneco1ogic radiation onco1ogy[J].Int J Radiat Onco1 Bio1 Phys,2010,78(3):828-835.
[38] LIN T T,DINGZ Y,LI N,et a1.Se1eno-cyc1odextrin sensitises human breast cancer ce11s to trai1-induced apoptosis through DR5 induction and NF -kB suppression[J].Eur J Cancer,2011,47:1890-1907.
[39] 李鹏程.二(喹唑啉-4-基)二硒醚的合成、表征及生物活性研究[J].鲁东大学学报(自然科学版),2016,32(1):53-60.
[40] 李鹏程,刘刚,黄久银,等.二(喹唑啉-4-基)二硒醚的合成、表征及生物活性研究[J].鲁东大学学报(自然科学版),2016,32(1):53-60.
[41] 胡小梅,刘高峰,怀自友,等.二(喹唑啉-4-基)二硒醚与三种抗癌药物对肺癌A549细胞的体外抗肿瘤活性比较[J].齐齐哈尔医学院学报,2016,37(7):846-848.
[42] 田志帅,茹冬冬,何若冲.硒蛋白P在直肠癌中的表达及临床意义[J].中华临床医师杂志(电子版),2015,9(11):2084-2087.
[43] 尹良伟,马海英,王怀瑾,等.硒在预防和治疗肿瘤中的作用及应用进展[J].中国处方药,2005,12(45):77-79.
[44] 周际昌,周立强.硒预顺铂肾毒性的临床观察[J].中华医学杂志,1993,73(11):681.
[45] NEMATBAKHSH M,NASRI H.The effects of vitamin E and se1enium on cisp1atin-induced nephrotoxicity in cancer patients treated with cisp1atin -based chemotherapy:A randomized,p1acebo-contro11ed study[J].J Res Med Sci,2013,18(7):626-627.
[46] TACYILDIZ N,OZYORUK D,OZELCI KACAS G,et a1.Se1enium in the prevention of anthracyc1ine-induced cardiac toxicity in chi1dren with cancer[J].J Onco1,2012:651-630.
[47] BUNTZEL J,RIESENBECK D,GLATZEL M,et a1.Limited effects of se1enium substitution in the prevention of radiation-associated toxicities.resu1ts of a randomized study in head and neck cancer patients[J].Anticancer Res,2010,30(5):1829-1832.
责任编辑:高 山
Research Advance of Anticancer Action on Selenium ComPounds
CHEN Xiaohan1,ZHANG Chi1,2*
(1.Schoo1 of Bio1ogica1 Science and Techno1ogy,Hubei University for Nationa1ities,Enshi 445000,China;2.Key Laboratory of Bio1ogic Resources Protection and Uti1ization of Hubei Province,Hubei University for Nationa1ities,Enshi 445000,China)
Since se1enium was confirmed as an essentia1 trace e1ement to our human body in 1957,its anti -tumor properties have been proved by researchers continua11y.More and more research achievements showed the se1enium cou1d prevent and inhibit severa1 kinds of tumors'growth and formation efficient1y,such as 1iver cancer,breast cancer,and gastric cancer.The research course of the se1enium,especia11y its study progress on its anti-tumor mechanism,was summarized in this paper.Among them,its anti-tumor mechanism remains hypothetic and se1enium antitumor research is main1y on se1enium compounds in anima1 antitumor test,se1enium ce11 in vitro antitumor test and the interventiona1 tria1s in c1inica1 medicine.
Se1enium;anti-tumor;mechanism;research progress
R97.1
A
1008-8423(2016)02-0189-06
10.13501/j.cnki.42-1569/n.2016.06.019
2016-04-17.
国家自然科学基金项目(21461009);湖北省科技厅重点基金项目(2011CDA011);2014年恩施州科技重点项目(D20140034).
陈霄汉(1991-),男,硕士生,主要从事食品生物化学的研究;*
张驰(1965-),男,教授,主要从事植物生物化学及硒资源的研究.

