Akt在FGF21预防糖尿病心肌病中的作用研究
张芳芳,林秀飞,陈聪聪,何露清,张驰,蔡露
(温州医科大学 药学院 中美糖尿病并发症研究所,浙江 温州 325035)
Akt在FGF21预防糖尿病心肌病中的作用研究
张芳芳,林秀飞,陈聪聪,何露清,张驰,蔡露
(温州医科大学药学院中美糖尿病并发症研究所,浙江温州325035)
目的:探索成纤维细胞生长因子21(FGF21)对糖尿病心肌病(DCM)的预防作用;解析Akt信号途径是否是介导FGF21心肌保护作用的分子机制。方法:在雄性C57BL/6J小鼠中构建2型糖尿病模型,成模后给予FGF21腹腔注射干预6个月。检测心脏功能后处死小鼠收集小鼠心脏组织。对各组小鼠心肌肥大、心脏纤维化及细胞凋亡等损伤指标进行检测。随后分离小鼠原代心肌细胞,利用高糖/高脂(HG/Pal)处理细胞模拟2型糖尿病内环境,同时给予FGF21干预及Akt2-siRNA干预39 h,检测FGF21对心肌细胞肥大、凋亡及纤维化改变的影响。结果:体内实验显示FGF21干预能显著改善糖尿病诱导的心脏功能紊乱,抑制心脏病理损伤,改善心肌肥大、心脏纤维化改变(P<0.05)。体外研究成功模拟了2型糖尿病诱导的心肌细胞损伤,同时验证了FGF21对HG/Pal环境下心肌细胞的保护作用,证实了抑制Akt的表达及活性能完全阻断GF21对心肌细胞的保护作用。结论:FGF21对糖尿病诱导的心肌损伤具有保护作用,而Akt信号途径是介导FGF21心肌保护作用的关键机制。
成纤维细胞生长因子21;糖尿病心肌病;心脏功能;Akt;HG/Pal
糖尿病心肌病(diabetic cardiomyopathy,DCM)是独立于冠心病、高血压等因素而由糖尿病作为唯一诱因的心脏疾病[1],临床表现为早期心脏舒张功能不全,晚期收缩功能不全,最终导致心脏功能衰竭。DCM的病理特征包括心肌肥大、心室壁增厚、心脏纤维化改变、胶原沉积、基质增加、肌丝断裂以及心脏功能紊乱等。DCM作为糖尿病最主要的并发症之一,严重威胁着糖尿病患者的生命健康。成纤维细胞生长因子(fiborblast growth factor,FGF)-21是FGF家族新近发现的重要成员,其在代谢调节方面发挥着重要的作用。研究表明,FGF21能显著降低2型糖尿病小鼠体质量、血糖和血脂水平,促进血糖重吸收,维持β细胞的数量和功能。与胰岛素相比,FGF21具有过量不导致低血糖的优点。另外FGF21不具备FGF家族经典的促有丝分裂活性,彻底消除了人们对于FGF21致瘤性的担忧,使得FGF21体内用药治疗糖尿病成为可能。FGF21不仅能通过调节糖脂代谢有效抑制糖尿病的发展,针对于多种糖尿病并发症FGF21也表现出了明显的抑制作用[2-8]。因此本研究探索FGF21对DCM的预防作用,解析Akt信号途径是否是介导FGF21心肌保护作用的分子机制。
1 材料和方法
1.1实验动物及分组 8~10周龄雄性C57BL/6J小鼠32只(购于北京农科院动物所)随机分为以下几组:正常对照组(Con)、FGF21给药组(FGF21)、糖尿病组(DM)、糖尿病FGF21给药组(DM/FGF21)。根据组别分别给以高脂饲料和正常饲料喂养12周。喂养12周后禁食12 h,DM组、DM/FGF21组和Con组、FGF21组分别给予腹腔一次性注射小剂量链脲佐菌素(streptozotocin,STZ)50 mg・kg-1或等量枸橼酸缓冲液。注射3 d后,检测随机血糖,血糖≥12 mmol・L-1视为2型糖尿病模型小鼠。成模后DM/FGF21组小鼠给予FGF21(100 μg・kg-1・d-1)腹腔注射6个月。检测心脏功能后处死取心脏组织,检测心肌肥大、心肌细胞凋亡及纤维化情况。
1.2心脏功能检测 采用高效超声检测仪(Echo)检测各组小鼠心脏功能,主要检测指标包括舒张期左心室内径(LVID;d)、收缩期左心室内径(LVID;s)、舒张期室间隔厚度(IVS;d)、收缩期室间隔厚度(IVS;s)、舒张期左心室后壁厚度(LVPW;d)、收缩期左心室后壁厚度(LVPW;s)、射血分数(EF)、左室短轴缩短率(FS)、左心室质量(LV mass)和修正后的左心室质量(LV mass-C)。
1.3小鼠原代心肌细胞培养及处理 小鼠腹腔注射0.5 mL肝素(100 U・mL-1),异氟烷麻醉取出心脏,立即置于装有10 mL灌流缓冲液(含113 mmol・L-1NaCl、4.6 mmol・L-1KCl、0.6 mmol・L-1KH2PO4、1.2 mmol・L-1MgSO4・7H2O、12 mmol・L-1NaHCO3、10 mmol・L-1KHCO3、10 mmol・L-1HEPES、30 mmol・L-1Taurine、10 mmol・L-1BDM、5.5 mmol・L-1glucose)的60 mm培养盘中,在1 min内将心脏主动脉套在langendorff灌流套管上,立即灌流,流速(3 mL・min-1)×4 min,然后转化至心肌细胞消化缓冲液中(在灌流缓冲液中加入CollgenaseI I 1 mg・mL-1、CaCl2100 mmol・L-1),消化8~10 min(3 mL・min-1)至心肌组织变软,并呈白色半透明,立即终止消化,剪下心室组织,置于60 mm含有2.5 mL消化液的培养盘中,轻轻撕裂心肌组织,并用一次性移液管轻轻吹打数次(此过程需在90 s内完成,然后将细胞悬液转入还有2.5 mL消化终止液[灌流缓冲液中加入小牛血清(BCS,10%)、CaCl2100 mmol・L-1]的15 mL离心管中,然后分别用2.0 mm、1.5 mm、1.0 mm直径移液管逐步分散心肌细胞,此过程需在3~5 min内完成。随后逐步完成复钙过程,最终得到杆状心肌细胞通常>80%,方可以用于后续实验研究。细胞实验分为4组:正常对照组(Con)、FGF21给药组(FGF21)、高糖高脂处理组(HG/Pal)、高糖高脂FGF21处理组(HG/Pal/FGF21)。待细胞融合长成单层时,更换为无血清培养基使细胞生长同步化。24 h后向FGF21组和HG/Pal/FGF21组细胞培养液中加入FGF21(50 ng・μL-1,温州医科大学药学院提供)预处理2 h,随后给予HG/Pal/FGF21组细胞高糖(33 mmol・L-1)和棕榈酸(62.5 μmol・L-1,Sigma-Aldrich Chemical Co.美国)处理,2组细胞同时给予FGF21处理15 h后收集细胞,提取蛋白用于后续检测。
1.4siRNA技术 按1.3中操作培养小鼠原代心肌细胞,当细胞达到70%融合时,应用Lipofectamine2000转染试剂将siRNA转染到细胞中,转染浓度为10 nmol・L-1,转染时间为48 h,转染后细胞可用于相应研究。
1.5Western Blot检测 每组小鼠取心脏组织100 mg,加入1 000 μL RIPA裂解液,蛋白含量测定,SDS-PAGE电泳,转膜,封闭,抗体孵育,显影。对心肌肥大指标心钠肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)、β-肌球蛋白重链(β-myosin heavy chain,β-MHC),纤维化指标结缔组织生长因子(connective tissue growth factor,CTGF)、转化生长因子-β(transforming growth factor-β,TGF-β),Akt信号通路相关蛋白Akt、磷酸化Akt(p-Akt)、糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK3β)、TRB3、蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase-1B,PTP1B)和细胞凋亡指标Cleaved Caspase-3(C-Cas3)的表达水平进行检测。其中一抗均购自美国Cell Signaling Technology公司,浓度均为1∶1 000;二抗均购自美国Santa Cruz公司,浓度均为1∶2 000。Quantity one软件进行灰度测量,以目的蛋白与内参蛋白的灰度比值作为蛋白相对表达量。
1.6组织病理检测
1.6.1组织标本采集与处理:小鼠心脏组织用10%甲醛固定24 h后,石蜡包埋,切成4 μm厚切片,置于多聚赖氨酸处理的载玻片上,60 ℃烤干4~6 h备用。
1.6.2HE染色:烤片完毕后,二甲苯I 10 min,二甲苯I I 15 min,无水乙醇5 min,95%乙醇5 min,75%乙醇5 min,自来水或蒸馏水泡30 min,进入苏木素溶液7 min,自来水冲洗,5%醋酸-乙醇溶液分化20~30 s,浸入伊红溶液3 min,95%酒精脱水45 s,100%乙醇脱水2 min,二甲苯I浸5 min,二甲苯I I 浸10 min,趁二甲苯未干时,中性树胶封片,观察,拍片。主要检测心肌结构改变。
1.6.3Sirius-red染色:烤片完毕后,天青石蓝液染5~10 min,蒸馏水洗3次,天狼星红饱和苦味酸液染15~30 min,直接用无水乙醇分化与脱水,95%酒精脱水45 s,100%乙醇脱水2 min,二甲苯I浸5 min,二甲苯 II浸10 min,趁二甲苯未干时,中性树胶封片,观察,拍片。主要检测心肌组织纤维化改变。
1.7统计学处理方法 采用SPSS16.0进行统计学分析。实验结果以±s表示,统计分析多重(组)比较采用单因素或者双因素Post-hoc多重比较,Bonferroni检验。P<0.05为差异有统计学意义。
2 结果
2.1FGF21干预改善糖尿病小鼠心脏功能紊乱 结果显示DM组小鼠舒张期左心室内径(LVID;d)、收缩期左心室内径(LVID;s)、舒张期室间隔厚度(IVS;d)、舒张期左室后壁厚度(LVPW;d)、收缩期左室后壁厚度(LVPW;s)均显著升高(P<0.05),收缩期室间隔厚度(IVS;s)显著降低(P<0.05)。同时反映心脏功能的关键指标EF及FS也显著降低(P<0.05),表明2型糖尿病患病后6个月已经出现心脏功能紊乱,但给予FGF21干预能显著改善上述心脏功能指标,维持心脏功能的发挥。见表1。
表1 FGF21对DCM小鼠心脏功能的影响(n=8,±s)
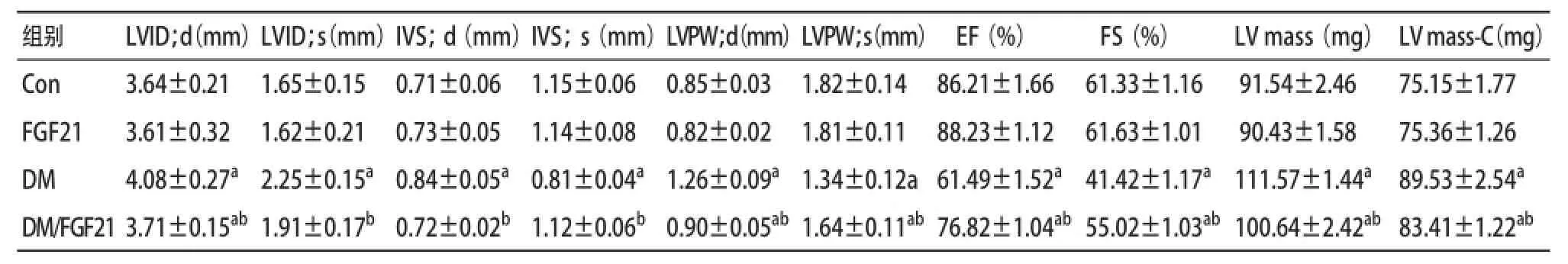
表1 FGF21对DCM小鼠心脏功能的影响(n=8,±s)
与Con组比:aP<0.05;与DM组比:bP<0.05
组别 LVID;d(mm)LVID;s(mm)IVS;d(mm)IVS;s(mm)LVPW;d(mm)LVPW;s(mm) EF(%) FS(%) LV mass(mg) LV mass-C(mg)Con 3.64±0.21 1.65±0.15 0.71±0.06 1.15±0.06 0.85±0.03 1.82±0.14 86.21±1.66 61.33±1.1691.54±2.46 75.15±1.77 FGF21 3.61±0.32 1.62±0.21 0.73±0.05 1.14±0.08 0.82±0.02 1.81±0.11 88.23±1.12 61.63±1.0190.43±1.58 75.36±1.26 DM 4.08±0.27a 2.25±0.15a0.84±0.05a 0.81±0.04a1.26±0.09a 1.34±0.12a 61.49±1.52a 41.42±1.17a 111.57±1.44a 89.53±2.54aDM/FGF21 3.71±0.15ab1.91±0.17b0.72±0.02b 1.12±0.06b0.90±0.05ab1.64±0.11ab76.82±1.04ab55.02±1.03ab100.64±2.42ab83.41±1.22ab
2.2FGF21干预抑制糖尿病导致的心脏肥大 研究结果表明糖尿病小鼠心脏绝对重量显著增加,表现为心脏重量/胫骨长度比值(Heart/Tibia)显著增加(P<0.05,见图1A),同时在糖尿病小鼠心脏中心肌肥大关键指标ANP(P<0.05,见图1B)、BNP(P<0.05,见图1C)及β-MHC(P<0.05,见图1D)表达均明显升高,表明患病后6个月糖尿病小鼠出现了明显的心肌肥大。这一改变在给予了FGF21干预后被显著抑制,表明FGF21对糖尿病诱导的心肌肥大具有预防作用。
2.3FGF21干预抑制糖尿病导致的心脏组织结构损伤 研究结果表明,Con组小鼠心肌纤维排列整齐,细胞核呈长梭状,位于心肌纤维中部,间质无明显扩增,未见炎症细胞浸润;DM组小鼠心脏纤维排列紊乱,存在明显的肌丝断裂,间质扩大并存在水肿现象,可见明显的炎症细胞浸润现象及脂肪变性空泡;上述病理损伤在给予FGF21干预后被显著改善(见图2),表明FGF21在糖尿病状态下对小鼠心脏结构具有保护作用。
2.4FGF21干预抑制糖尿病导致的心脏纤维化改变
Sirius-red染色结果显示与Con组及FGF21组相比糖尿病小鼠胶原沉积阳性染色显著增加(P<0.05,见图3A、B),且主要附着在心脏与血管的连接部位。同时糖尿病小鼠心脏中纤维化经典指标CTGF(P<0.05,见图3C)及TGF-β表达(P<0.05,见图3D)显著增加,表明2型糖尿病小鼠患病6个月后心脏出现明显纤维化改变。上述纤维化改变在给予FGF21干预后被显著抑制(P<0.05)。
2.5FGF21干预激活心脏中Akt/GSK3β信号通路
研究结果表明,糖尿病小鼠心脏中Akt信号通路收到明显抑制,表现为Akt及GSK3β磷酸化水平降低(见图4A、B),同时Akt的另外2种负反馈调节蛋白TRB3及PTP1B表达显著升高(见图4C、D),给予FGF21干预后能显著抑制糖尿病小鼠心脏中Akt及GSK3β的去磷酸化(见图4A、B),同时降低TRB3及PTP1B的表达(见图4C、D),说明FGF21可能是通过抑制了Akt负反馈调节蛋白的表达从而改善糖尿病状态下心脏中Akt信号通路的强度。
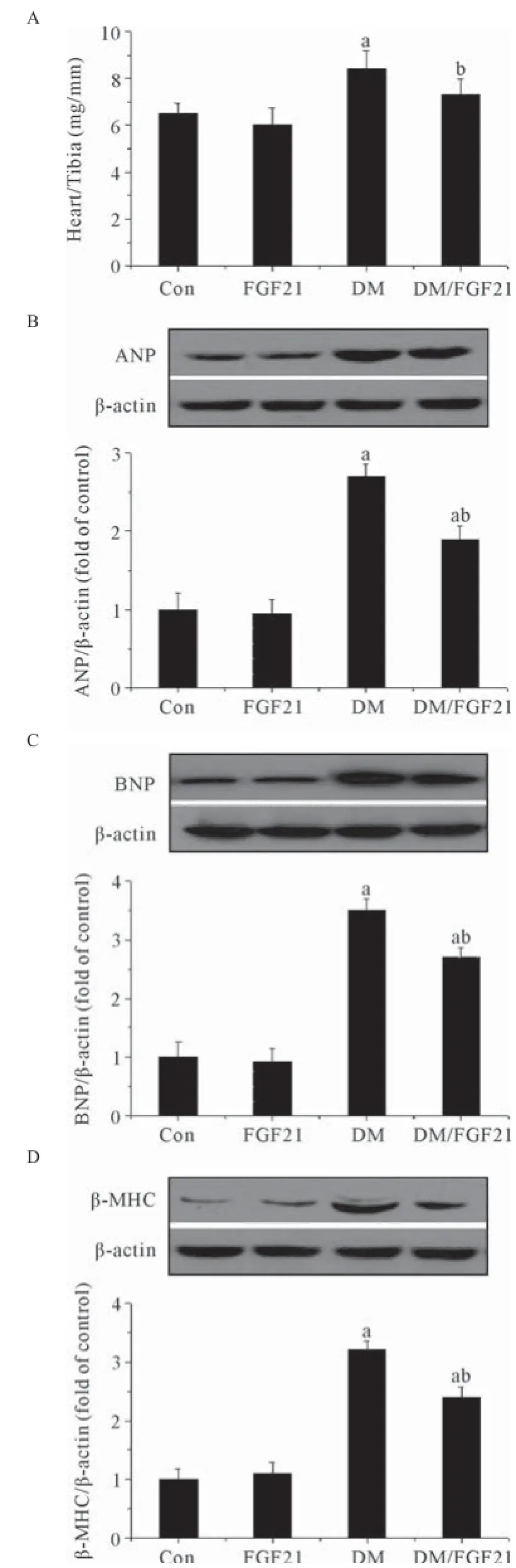
图1 FGF21干预对2型糖尿病小鼠心肌肥大的影响
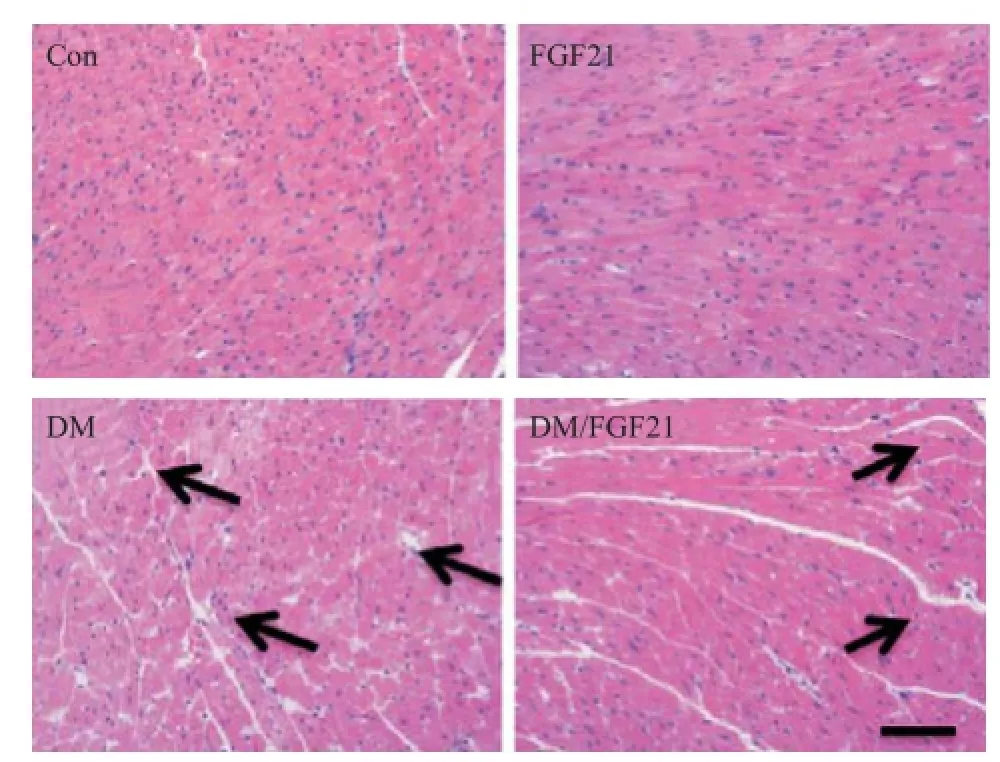
图2 FGF21对糖尿病小鼠心脏组织结构的影响(HE,×40;箭头示肌丝断裂,肌纤维排列紊乱 )
2.6Akt介导FGF21对心肌细胞的保护作用 研究结果表明HG/Pal处理后能显著诱导心肌细胞肥大,表现在ANP(见图5D)、BNP(见图5E)及β-MHC表达(见图5F)的增加;同时导致心肌细胞纤维化改变,表现在CTGF(见图5G)及TGF-β(见图5H)表达增加;另外我们还检测到心肌细胞凋亡的增加,表现在CCas3表达增加(见图5I)。上述数据表明本研究已经在体外成功模拟了DCM导致的心肌细胞损伤。上述损伤在给予FGF21处理后显著改善,与体内研究结果一致。进一步研究发现,利用siRNA技术沉默Akt2表达能完全抑制HG/Pal环境下FGF21诱导的心肌细胞作用,表明Akt2介导了FGF21在HG/Pal环境下的心肌细胞保护作用(见图5)。
3 讨论
心血管并发症是糖尿病最主要的致死原因之一。成年人中糖尿病患者并发心血管系统疾病的比例是正常人群的4倍。而DCM是糖尿病诱导的心血管系统疾病的重要组成部分。DCM是以心脏舒张/收缩功能紊乱、心脏结构改变(纤维化及心室重构)为主要特征[9-10]。糖尿病状态下,糖脂毒性首先会造成心脏细胞凋亡,死亡的心肌细胞会被细胞外基质及纤维细胞填充,降低了心脏收缩/舒张功能。心脏通过代偿性增厚的方式维持心脏功能。早期的的心肌肥厚对心脏功能具有保护作用,但当心肌肥厚发展超过心脏负荷时便会造成心脏损伤,导致心脏功能紊乱,最终造成心脏功能衰竭[11-13]。因此心肌细胞凋亡-心室重构-心脏功能紊乱是DCM发生发展的3个主要阶段[14]。针对上述3点进行药物开发将能在很大程度上防治DCM的发生与发展。
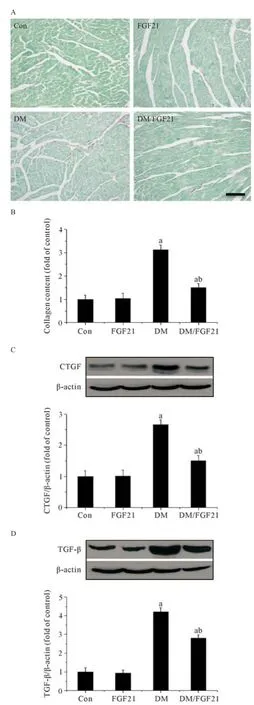
图3 FGF21对糖尿病小鼠心脏纤维化改变的影响(×40)
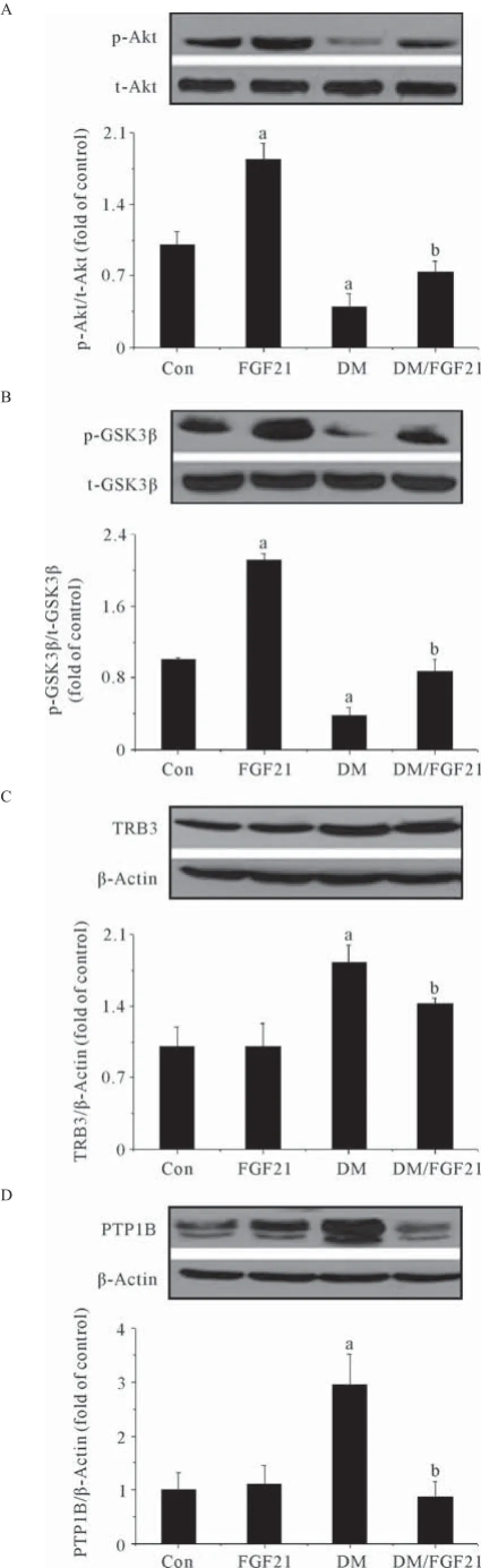
图4 FGF21对糖尿病小鼠心脏中Akt信号通路的影响
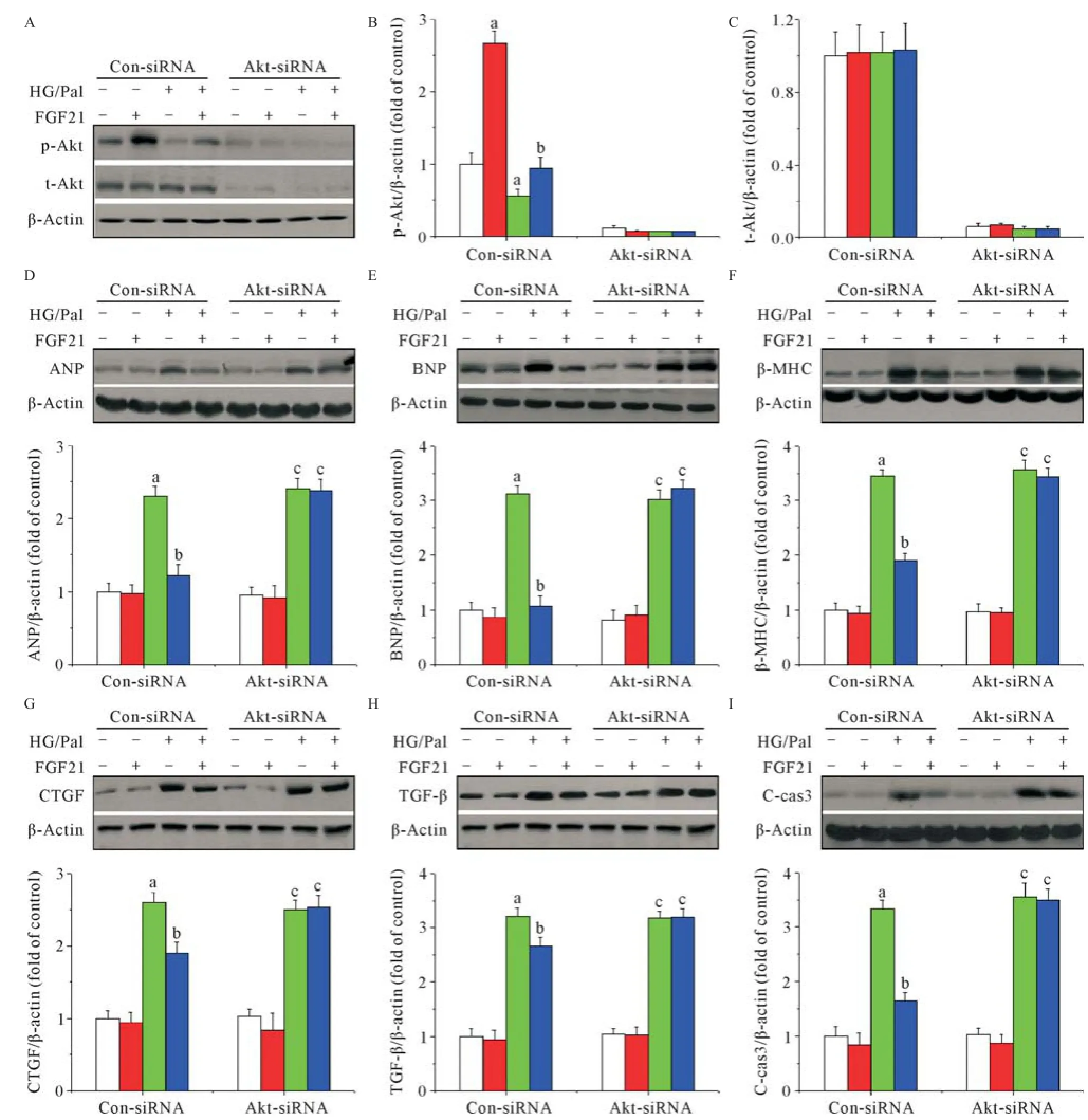
图5 Akt2在FGF21诱导的心肌细胞保护中发挥作用
在前期研究中我们发现,外源FGF21干预能显著预防1型糖尿病早期诱导的心肌细胞凋亡;与WT小鼠相比,FGF21-KO小鼠心脏中1型糖尿病诱导的心肌细胞凋亡水平进一步加剧[6],表明内源性FGF21在糖尿病状态下也能发挥抗心肌细胞凋亡作用。既然前期研究证实了FGF21对于1型糖尿病小鼠心肌细胞凋亡的抑制作用,那么FGF21是否也能预防糖尿病后期诱导的心室重构及心脏功能紊乱,从而抑制DCM的发展是本研究要回答的问题。由于流行病学研究显示,临床糖尿病患者中2型糖尿病占主体,而且2型糖尿病导致的DCM致死率更高[15-16],因此在本课题中我们利用HFD/STZ方法处理小鼠制备2型糖尿病模型开展研究。成模后给予小鼠FGF21处理6个月。大量研究[12-13,17]发现在2型糖尿病小鼠患病6个月后会出现明显的DCM症状,因此本研究选择此时间点作为检测点。结果证实2型糖尿病患病后6个月小鼠心脏功能出现明显紊乱,表现在EF及FS显著降低。而上述心脏功能紊乱现象在DM/FGF21组被明显抑制,表明FGF21干预能显著改善糖尿病后期诱导的心脏功能紊乱。由于心室重构是导致心脏功能紊乱的主要诱因,因此在本研究中我们也针对心室重构的2个组成部分—心肌肥大及纤维化进行了检测。结果显示FGF21干预也能显著抑制2型糖尿病后期诱导的心肌肥大和心脏纤维化改变,同时对于心脏结构的病理改变,FGF21也有明显的保护作用。
作为经典的FGF家族成员,FGF21生物学功能的发挥是通过激活其下游信号转导通路而实现的。研究表明ERK1/2、AMPK及Akt都是FGF21下游信号途径中的关键激酶[18-22]。在前期研究中我们利用体外及体内实验证实了FGF21通过激活糖尿病小鼠心脏中ERK1/2-p38 MAPK-AMPK信号通路,从而抑制PTEN活性最终发挥抗心肌细胞凋亡作用。由于PTEN 是Akt活性负调控蛋白,因此Akt可能是在早期糖尿病状态下介导FGF21抗心肌细胞凋亡作用的关键激酶。在本研究中我们发现FGF21能显著改善2型糖尿病小鼠心脏中的Akt信号通路。因此机制探索方面我们将重点解析Akt在FGF21诱导的DCM预防作用中所承担的角色。我们利用HG/Pal处理小鼠原代心肌细胞模拟2型糖尿病体内环境,同时给予FGF21干预。研究结果显示HG/Pal环境下,心肌细胞中细胞凋亡、细胞肥大以及纤维化改变等蛋白指标都显著升高,表明我们在体外成功模拟了DCM造成的心肌细胞损伤。随后研究证实FGF21干预能显著预防上述心肌细胞的损伤。但该保护作用在给予Akt2 siRNA处理后被完全阻断,表明Akt2及其信号通路介导了HG/Pal环境下FGF21诱导的心肌细胞保护作用,提示Akt是介导FGF21预防DCM的关键激酶。
[1]HAMBY R I, ZONERAICH S, SHERMAN L. Diabetic cardiomyopathy[J]. JAMA, 1974, 229(13): 1749-1754.
[2]ZHANG C, SHAO M, YANG H, et al. Attenuation of hyperlipidemia- and diabetes-induced early-stage apoptosis and late-stage renal dysfunction via administration of fibroblast growth factor-21 is associated with suppression of renal infl ammation[J]. PLoS One, 2013, 8(12): e82275.
[3]SHAO M, YU L, ZHANG F, et al. Additive protection by LDR and FGF21 treatment against diabetic nephropathy in type 2 diabetes model[J]. Am J Physiol Endocrinol Metab,2015, 309(1): E45-54.
[4]JIANG X, ZHANG C, XIN Y, et al. Protective effect of FGF21 on type 1 diabetes-induced testicular apoptotic cell death probably via both mitochondrial- and endoplasmic reticulum stress-dependent pathways in the mouse model[J]. Toxicol Lett, 2013, 219(1): 65-76.
[5]ZHANG Q, LI Y, LIANG T, et al. Loss of FGF21 in diabetic mouse during hepatocellular carcinogenetic transformation [J]. Am J Cancer Res, 2015, 5(5): 1762-1774.
[6]ZHANG C, HUANG Z, GU J, et al. Fibroblast growth factor 21 protects the heart from apoptosis in a diabetic mouse model via extracellular signal-regulated kinase 1/2-dependent signalling pathway[J]. Diabetologia, 2015, 58(8): 1937-1948.
[7]SUN W, MIAO X, ZHOU S, et al. Zinc rescue of Akt2 gene deletion-linked murine cardiac dysfunction and pathological changes is metallothionein-dependent[J]. J Mol Cell Cardiol,2014, 74: 88-97.
[8]ZHANG Y, BABCOCK S A, HU N, et al. Mitochondrial aldehyde dehydrogenase (ALDH2) protects against streptozotocin-induced diabetic cardiomyopathy: role of GSK3beta and mitochondrial function[J]. BMC Med, 2012, 10: 40.
[9]BOUDINA S, ABEL E D. Diabetic cardiomyopathy, causes and effects[J]. Rev Endocr Metab Disord, 2010, 11(1): 31-39.
[10]MIKI T, YUDA S, KOUZU H, et al. Diabetic cardiomyopathy: pathophysiology and clinical features[J]. Heart Fail Rev, 2013, 18(2): 149-166.
[11]ZHOU S, SUN W, ZHANG Z, et al. The role of Nrf2-mediated pathway in cardiac remodeling and heart failure[J]. Oxid Med Cell Longev, 2014, 2014(1): 79-92.
[12]AON M A, FOSTER D B. Diabetic cardiomyopathy and the role of mitochondrial dysfunction: novel insights, mechanisms, and therapeutic strategies[J]. Antioxid Redox Signal, 2015, 22(17): 1499-1501.
[13]LIU Q, WANG S, CAI L. Diabetic cardiomyopathy and its mechanisms: role of oxidative stress and damage[J]. J Diabetes Investig, 2014, 5(6): 623-634.
[14]CAI L, WANG Y, ZHOU G, et al. Attenuation by metallothionein of early cardiac cell death via suppression of mitochondrial oxidative stress results in a prevention of diabetic cardiomyopathy[J]. J Am Coll Cardiol, 2006, 48(8): 1688-1697.
[15]NICHOLS G A, GULLION C M, KORO C E, et al. The incidence of congestive heart failure in type 2 diabetes: an update[J]. Diabetes Care, 2004, 27(8): 1879-1884.
[16]NICHOLS G A, HILLIER T A, ERBEY J R, et al. Congestive heart failure in type 2 diabetes: prevalence, incidence,and risk factors[J]. Diabetes Care, 2001, 24(9): 1614-1619.
[17]CAI L, WANG J, LI Y, et al. Inhibition of superoxide generation and associated nitrosative damage is involved in metallothionein prevention of diabetic cardiomyopathy[J]. Diabetes, 2005, 54(6): 1829-1837.
[18]KIM H W, LEE J E, CHA J J, et al. Fibroblast growth factor 21 improves insulin resistance and ameliorates renal injury in db/db mice[J]. Endocrinology, 2013, 154(9): 3366-3376.
[19]CHAU M D, GAO J, YANG Q, et al. Fibroblast growth factor 21 regulates energy metabolism by activating the AMPK-SIRT1-PGC-1alpha pathway[J]. Proc Natl Acad Sci U S A, 2010, 107(28): 12553-12558.
[20]ZHU S, MA L, WU Y, et al. FGF21 treatment ameliorates alcoholic fatty liver through activation of AMPK-SIRT1 pathway[J]. Acta Biochim Biophys Sin (Shanghai), 2014, 46(12): 1041-1048.
[21]FISHER F M, KLEINER S, DOURIE N, et al. FGF21 regulates PGC-1alpha and browning of white adipose tissues in adaptive thermogenesis[J]. Genes Dev, 2012, 26(3): 271-281.
[22]IZUMIYA Y, BINA H A, OUCHI N, et al. FGF21 is an Aktregulated myokine[J]. FEBS Lett, 2008, 582(27): 3805-3810.
(本文编辑:丁敏娇)
Study on the role of Akt signaling in FGF21-induced prevention on diabetic carodiomyopathy
ZHANG Fangfang, LIN Xiufei, CHEN Congcong, HE Luqing, ZHANG Chi, CAI Lu. The Sine-American Research Intitute for Diabetic Complications, College of Pharmaceutical Sciences, Wenzhou Medical University, Wenzhou, 25035
Objective: To explore the role of fi broblast growth factor 21 (FGF21) on diabetic cardiomyopahy and analyze the role of Akt signaling in FGF21-induced prevention on diabetic carodiomyopathy. Methods: Male C57BL/6J mice were allowed to establish mouse model of type 2 diabetes. Diabetic mice were randomly elected for the treatment of FGF21 for 6 months. Heart tissues were obtained for detection of histopathological hanges, cardiomyocyte hypertrophy, fi brosis index and apoptosis after heart functions were detected. Isolation nd culture of primary myocardial cell in mice, high glucose/lipid (HG/Pal) treatment of cells to simulate the enironment in type 2 diabetes mellitus, at the same time, FGF21 and Akt2-siRNA intervention were given for 39 ours to detect the change of cardiomyocyte hypertrophy, apoptosis and fi brosis. Results: It was demonstrated in ivo study that FGF21 could signifi cantly alleviate heart structural changes, dysfunction, cardiomyocyte hyperrophy and fi brosis induced by type 2 diabetes (P<0.05). It was verifi ed in vitro study demonstrated that FGF21 ould upregulate Akt phosphorylation level, activation of Akt and downstream signaling pathways, inhibit the ctivity of Akt, abate FGF21 protection of myocardial injury. Conclusion: FGF21 plays a protective role in diaetes-induced myocardial injury, and Akt signaling is a key mechanism in FGF21-induced myocardial protection.
fi borblast growth factor-21; diabetic cardiomyopathy; cardiac function; Akt; HG/Pal
R541.9;Q591.9
A DOI: 10.3969/j.issn.2095-9400.2016.07.004
2016-02-23
国家自然科学基金资助项目(81370917)。
张芳芳(1991-),女,浙江瑞安人,硕士生。
蔡露,教授,Email:541562914@qq.com。

