川金丝猴肾的组织结构观察及Bax蛋白的表达
俞诗源,苟陶然, 欧 锐
(1.西北师范大学生命科学学院,甘肃兰州 730070;2.西北师范大学学报编辑部,甘肃兰州 730070)
川金丝猴肾的组织结构观察及Bax蛋白的表达
俞诗源1,2,苟陶然1, 欧锐1
(1.西北师范大学生命科学学院,甘肃兰州730070;2.西北师范大学学报编辑部,甘肃兰州 730070)
为观察川金丝猴肾的组织结构及其相关蛋白Bax的表达,制作石蜡切片,采用H.E染色观察川金丝猴肾的组织结构特征,用免疫组织化学法检测Bax蛋白在肾组织中的表达.结果显示:川金丝猴和多数哺乳类肾的组织结构相似,外观呈蚕豆形,表面包以致密的结缔组织被膜,肾实质由外周的皮质和内部的髓质构成;肾小体数量较多,周围有很多近曲小管和远曲小管,近曲小管管腔不规则,有明显刷状缘,远曲小管则无刷状缘,集合管管腔较大,细胞界限清晰,肾小管和集合管上皮细胞都呈Bax蛋白免疫反应阳性;川金丝猴的肾主要由肾单位和集合管构成,Bax蛋白参与川金丝猴肾小管和集合管上皮细胞的凋亡,调控川金丝猴肾的发育过程.
川金丝猴;肾;组织结构;Bax;免疫组织化学
川金丝猴(Rhinopithecusroxellana)属灵长类动物,是中国特有的珍稀物种,属于国宝级保护动物.研究川金丝猴的生境特点和器官组织结构对于保护生物学、生理学和比较组织学研究都具有重要的科学意义.有关川金丝猴的社会结构[1]、内分泌腺结构[2]、肝内管道分布[3]、雌性生殖器的大体解剖结构[4]、睾酮水平的变化[5]及输卵管和子宫的组织结构[6]、冠状动脉的解剖[7]和脑动脉的供应[8]已有报道.但有关川金丝猴肾组织结构、何种因子参与川金丝猴肾组织细胞的生长发育和调控尚未见文献报道.有研究表明肾组织细胞的凋亡是肾发育过程中的普遍事件,是肾单位结构不均一性形成的基础[9],Bax蛋白的表达产物与Bcl-2蛋白等形成异二聚体,可共同调节细胞的存亡[10].为了解川金丝猴肾的组织结构以及凋亡Bax蛋白的表达情况,本实验用生物显微技术和免疫组织化学法观察了一只因病死亡川金丝猴的肾组织结构和Bax蛋白的表达情况,旨在为动物学及生物学研究提供依据.
1 材料和方法
1.1实验材料
本实验利用动物园因病而死亡的大龄雌性川金丝猴1只,按常规方法解剖取出左右肾,用生理盐水冲洗,固定于10%的福尔马林中作为实验材料,Bax蛋白和DAB显色剂均购于武汉博士德生物工程有限公司.
1.2光镜观察
取上述福尔马林固定的川金丝猴肾组织,石蜡包埋后连续切片(6 μm),H.E染色,中性树胶封固.随机抽取5张切片,在Olympus显微镜下观察,每张切片选取5个视野(10×40)拍照,利用Image-proplus6.0图像分析软件检测分析肾小球直径、肾小管和集合管的管径,并计算平均值[11].
1.3免疫组织化学检测
根据试剂盒方法,将上述石蜡切片经脱蜡、H2O2孵育、微波处理修复、山羊(Capragenus)血清室温孵育封闭,用兔抗(0ryctolaguscuniculus)Bax(工作浓度为1∶100)4 ℃冰箱孵育(空白对照用PBS代替一抗),再滴加生物素标记的二抗(羊抗兔IgG抗血清)室温孵育后,用链霉素抗生物素蛋白-过氧化物酶复合物(StreptAvidin-Biotin Complex)工作液室温孵育,经DAB显色,苏木精复染,脱水、透明、封片,光学显微镜观察并拍照.利用Image-proplus 6.0软件进行定量分析,取5张切片,每张切片选取5个视野(10×40)分析Bax蛋白在川金丝猴肾组织中表达的平均光密度值(已去除本底色).
1.4统计学分析
2 结果
2.1肾的组织结构
川金丝猴的肾位于腹腔后上部,腰椎两侧,左右各一,右肾位置偏前.两肾表面光滑,新鲜时呈红褐色,质地柔软.表面观呈蚕豆形,肾门清楚,血管、神经和输尿管均由此经过.肾表面包以致密的结缔组织被膜,在肾的额状切面上,肾实质分为皮质和髓质两部分.肾皮质主要位于浅层,富有血管,新鲜标本为红褐色.肾髓质位于肾实质的深部,颜色较浅,致密而有条纹.自髓质呈放射状伸入皮质的条纹是髓放线.每条髓放线与其周围的皮质迷路构成一个肾小叶.
川金丝猴的肾主要由肾单位和集合管组成,肾单位由肾小体和与其相连的肾小管构成.
1)肾小体川金丝猴的肾小体由肾小球和肾小囊组成,大小约(157.02±6.51)μm,在肾皮质内多呈均匀分布,或 2~3个相邻,部分肾小球似出现萎缩(图1:A).肾小囊为双层球形囊,由肾小管盲端膨大内陷形成.外层为壁层与近曲小管相连,为单层扁平上皮;内层为脏层紧贴在肾小球毛细血管表面.内、外两层之间形成窄小的肾小囊腔,与肾小管相通;肾小球被包于肾小囊中,是入球小动脉分支(3~5支)形成的许多毛细血管袢迂回盘绕成团状的毛细血管球,其末端各分支再汇合成出球小动脉离开肾小囊.肾小球直径约为(108.30±6.52)μm(图1:A~C,表1).
2)肾小管川金丝猴的肾小管根据细胞形态结构分为近端小管、细段和远端小管.近端小管与肾小囊壁层上皮相连,管腔不规则,直径约为(54.78±5.85)μm,管壁由单层立方上皮组成,各细胞界限不明显,近管腔面有刷状缘,胞质嗜酸性,伊红染色后较深,胞核着色浅,位于细胞基底部(图1:B,表1).细段大部在髓袢降支,管径较小,约为(14.40±1.84)μm,管壁由单层扁平上皮构成,胞核圆形居中,着色浅,无刷状缘(图1:D,表1).远端小管管壁由单层立方上皮构成,管径约为(38.43±2.44)μm,细胞弱嗜酸性,腔面无刷状缘,胞核大而圆(图1:C,表1).另外,肾小管上皮有肿胀和脱落现象.
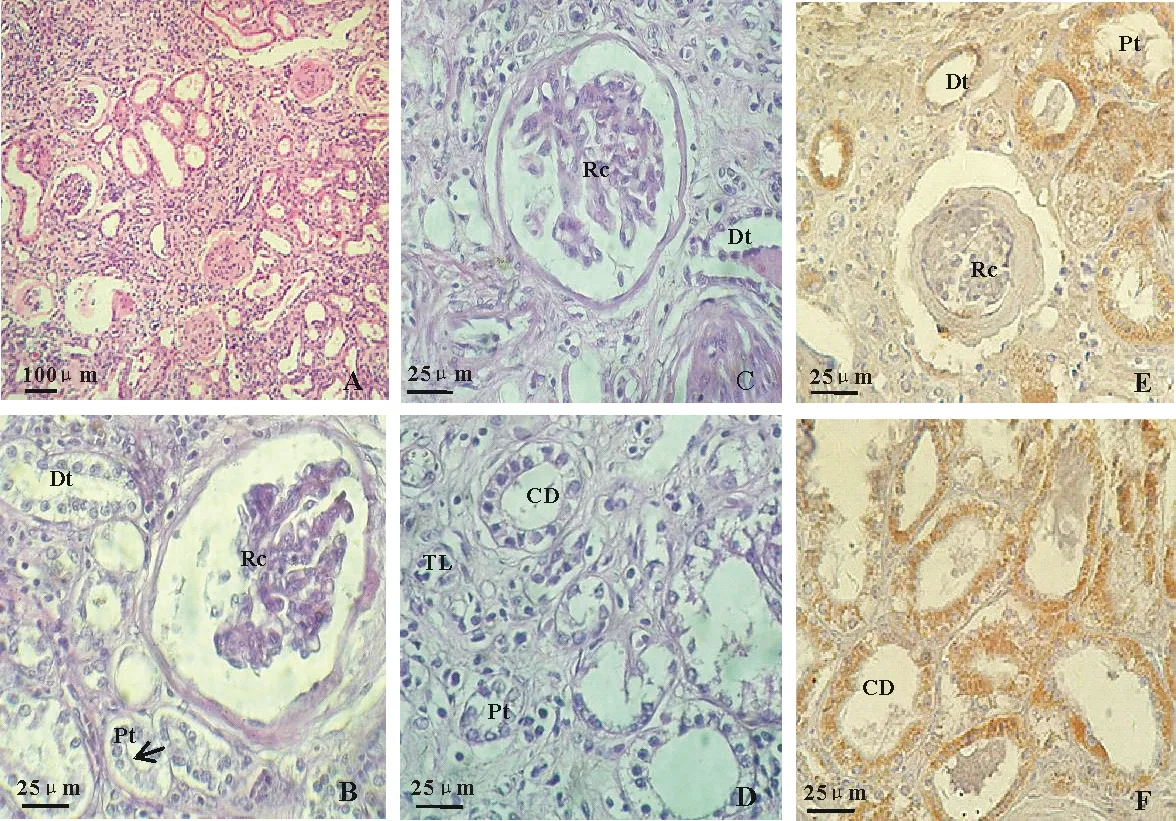
图1 川金丝猴肾的组织结构及Bax蛋白的表达
A.川金丝猴肾组织,标尺=100 μm;B.川金丝猴肾皮质,标尺=25 μm;C.川金丝猴肾皮质,标尺=25 μm;D.川金丝猴肾髓质,标尺=25 μm;E.Bax蛋白在川金丝猴肾皮质中的表达,标尺=25 μm;F.Bax蛋白在川金丝猴肾髓质的表达,标尺=25 μm.
A.The histological section of Sichuan snub-nosed monkeys kidney,bar=100 μm;B.The renal cortex of Sichuan snub-nosed monkeys,bar=25 μm;C.The renal cortex of Sichuan snub-nosed monkeys,bar=25 μm;D.The renal medulla of Sichuan snub-nosed monkeys,bar=25 μm;E.The expression of Bax protein in renal cortex of Sichuan snub-nosed monkeys,bar=25 μm;F.The expression of Bax protein in renal medulla of Sichuan snub-nosed monkeys,bar=25 μm.
CD.集合管;Dt.远曲小管;Pt.近曲小管;Rc.肾小体;TL.细段;↑.刷状缘.
CD.Collecting duct;Dt.Distal tubule;Pt.Proximal tubule;Rc.Renal corpuscle;TL.Thin limb;↑.Brush border.
3)集合管川金丝猴的集合管由远曲小管汇合而成,周围有少量纤维性结缔组织.集合管横截面多为椭圆形,管径较粗,约为(61.73±2.35)μm.集合管上皮细胞排列整齐,分界清晰,胞质透明,呈弱酸性,着色较浅,胞核位于细胞基底部.集合管始段为弓状集合小管,上皮细胞为立方形.末段为乳头管,起始处为单层柱状上皮,在开口处移形为变移上皮(图1:D,表1).
2.2Bax蛋白在肾组织中的表达
川金丝猴肾组织中Bax蛋白的阳性表达部位被染成棕黄色,Bax蛋白主要在细胞质中表达.从图可以看出,Bax蛋白在肾皮质和髓质中均有表达,其中,近端小管、远端小管和集合管上皮细胞有大量表达,肾小体内有少量表达(图1:E~F).川金丝猴肾脏中Bax蛋白表达部位的平均光密度值为(0.165±0.042).

表1 川金丝猴肾单位及集合管的直径(μm)
3 讨论
3.1组织结构特点
肾脏是机体主要的排泄器官,具有排除机体代谢终产物和进入体内的过剩异物,调节水、电解质平衡和酸碱平衡等作用.川金丝猴的肾脏主要由肾单位和集合管组成,其调节功能与肾小体和各段肾小管的结构特点直接相关.川金丝猴肾小体的直径(157.02±6.51 μm)比人(200 μm)[12]肾小体直径小,但比西藏小型猪(Sussalvanius)(156 μm)[13]、比格犬(Canisfamiliaris)(124 μm)[14]、小熊猫(Ailurusfulgens)(108~155 μm)[15]等兽类动物的肾小体直径大.川金丝猴等哺乳动物和人的肾小球是由入球小动脉反复分支盘绕形成的毛细血管球,结构较为复杂,因而滤过面积较大,滤过率较强,通过血管球滤过形成的原尿相对较多[16],而白孔雀(Pavocristatu)[17]和红腹锦鸡(Chrysolophuspictus)[18]等鸟类肾小球的毛细血管则没有复杂的分支和吻合,结构较为简单,其滤过率较弱,但白孔雀和红腹锦鸡等鸟类肾小球的数量多,故鸟类亦能快速排出其代谢废物.川金丝猴和人近端小管腔面刷状缘发达,使小管上皮细胞的表面积明显增加,因而川金丝猴和人近端小管有较强的重吸收作用.川金丝猴和人肾小管细段管腔小、管壁薄,由单层扁平上皮构成,表明它的通透性大,这种结构特点可能对尿的浓缩有重要作用.有研究表明,在非洲雏鸵鸟(Struthiocamelus)的饮水中添加一定剂量的硼后,会对肾小体、肾小管等结构产生直接损伤,出现肾小体结构模糊,近端小管的上皮细胞破裂、管腔内沉积组织碎片等现象,这些形态学损伤进而会影响肾生理功能的发挥[19].本实验发现,川金丝猴肾小体萎缩、肾小管上皮有肿胀和脱落现象,这可能与实验动物的年龄大、器官组织衰退有关.
3.2Bax蛋白的表达
细胞凋亡在多细胞生物组织的稳态和生命过程中起重要作用[20].Bcl-2家族的蛋白质是细胞凋亡的主要参与者[21-23],Bax蛋白是该家族的主要成员,是促凋亡因子,而Bcl-2蛋白是抑制凋亡因子,Bax与Bcl-2蛋白比率直接影响细胞的生长发育和存亡.研究表明,Bcl-2和Bax的表达与线粒体的分布和数量相关,它们通过调节线粒体膜的稳定性来抑制和促进凋亡[24].Bax-Bax形成同源二聚体后,线粒体释放细胞色素C,细胞质释放ATP,从而启动Caspase家族级联反应,出现细胞凋亡[25].
在肾发生发育的过程中,各种结构出现的细胞凋亡是肾发育的一个基本特征[9].肾小体在发育中通过细胞凋亡的形式清除增生过剩的内皮细胞,从而有利于毛细血管管腔的形成,调节毛细血管的增生速度[26].有实验发现,小鼠(Musmusculus)肾脏缺血再灌注后,肾组织中Bax和Bcl-2表达均急剧上升,24 h后达到峰值,Bcl-2达到峰值后开始下降,且部分炎症因子抑制Bcl-2的表达,导致Bcl-2/Bax比值下降,引起细胞凋亡,其机制与上调某些促凋亡基因、下调抑凋亡因子的表达相关[27].生长期膳食缺锌小鼠肾细胞凋亡的增加可能是Bcl-2下调及Bax上调使得Bcl-2/Bax 比值下降所致[28].在已知的细胞凋亡调节途径中,Bcl-2和Bax的比率最具特征,直接决定细胞存亡,影响肾上皮细胞存活、分化、成熟所必需的环境[29].本研究发现,Bax蛋白在川金丝猴肾中的表达部位主要集中在近端小管、远端小管和集合管上皮细胞,表明其分化、成熟已达高峰,其炎性细胞因子增多,p-p38MAPK信号传导通路被激活,导致Bax上调及Caspase-3蛋白表达,肾脏细胞出现凋亡[30],这与上述实验动物年龄大、器官组织衰退的表现一致,进一步表明Bax蛋白参与川金丝猴肾小管和集合管上皮细胞的凋亡,调控川金丝猴肾的发育过程.
[1]张鹏,李保国,和田一雄,等.秦岭川金丝猴一个群的社会结构[J].动物学报,2003,49(6):727.
[2]陈嘉绩,陆桐.川金丝猴内分泌腺的大体解剖[J].四川动物,2004,23(1):49.
[3]陈嘉绩,曹福源,李克东.川金丝猴(Rhinopithecusroxellanae)肝内管道的观察[J].中国兽医学报,2005,25(5):505.
[4]陈嘉绩,陆桐.川金丝猴雌性生殖器官的观察[J].动物学杂志,2004,39(1):64.
[5]高云芳,陈超,李保国,等.川金丝猴尿液中睾酮水平的季节性变化[J].动物学报,2003,49(3):393.
[6]俞诗源,杨晓辉,杨晓军,等.川金丝猴输卵管和子宫的组织学研究[J].西北师范大学学报(自然科学版),2000,36(2):4.
[7]俞诗源,高慧霞.川金丝猴冠状动脉的解剖[J].动物学报,2001,47(3):333.
[8]俞诗源,贾宗平,夏冰芝,等.川金丝猴脑的动脉供应[J].兽类学报,2007,27(1):80.
[9]宋小峰,任昊,陈雪,等.小鼠肾发育中的细胞凋亡[J].解剖学杂志,2012,35(3):306.
[10]丁小明,薛武军,田普训,等.Bcl-2、Bax、Fas、FasL、穿孔素和粒酶B在移植肾急性排斥中的共同表达和意义[J].西安交通大学学报(医学版),2008,29(1):98.
[11]冯红丽,俞诗源,王昱,等.金雕肺的组织结构及KGF、c-Fos和Bax的表达[J].动物学杂志,2009,44(1):33.
[12]高英茂.组织学与胚胎学[M].北京:人民卫生出版社,2005:288.
[13]那顺巴雅尔,陈丽,于娟,等.西藏小型猪肾脏应用组织学特点[J].中国实验动物学报,2009,17(3):232.
[14]黄韧.比格犬描述组织学[M].广州:广东科技出版社,2006:175.
[15]米志平,杨智,李平.小熊猫肾脏和输尿管的组织学研究[J].四川动物,2003,22(4):241.
[16]谭超,刘进辉,王水莲,等.东北虎肾组织形态结构的研究[J].经济动物学报,2003,7(1):35.
[17]俞诗源,王小勇,吴勍.白孔雀肾脏的组织结构及Bax蛋白在肾脏中的表达[J].西北师范大学学报(自然科学版),2012,48(5):89.
[18]陈玉琴,俞诗源,张虎林,等.红腹锦鸡肾的组织结构及EGFR、TGF-β、AQP-2在肾脏中的表达[J].动物学报,2008,54(2):323.
[19]WANG Jing,ZHONG Ju-ming,SUN Peng-peng,et al. Effect of boron administration on the morphology of ostrich chick kidney tissue[J].PakistanVeterinaryJournal,2015,35(4):489.
[20]MEIER P,FINCH A,EVAN G.Apoptosis in development[J].Nature,2000,407(6805):796.
[21]CORY S,HUANG D C,ADAMS J M.The Bcl-2 family:roles in cell survival and oncogenesis[J].Oncogene,2003,22(53):8590.
[22]GROSS A,MCDONNELL J M,KORSMEYER S J.BCL-2 family members and the mitochondria in apoptosis[J].GeneDev,1999,13(15):1899.
[23]DESAGHER S,MARTINOU J C.Mitochondria as the central control point of apoptosis[J].TrendsCellBiol,2000,10(9):369.
[24]AUTRET A,MARTIN S J.Emerging role for members of the Bcl-2 family in mitochondrial morphogenesis[J].MolCell,2009,36(3):355.
[25]KAZI A,SUN J,DOI K,et al.The BH3alpha-helical mimic BH3-M6 disrupts Bcl-X(L),Bcl-2,and MCL-1 protein-protein interactions with Bax,Bak,Bad,or Bim and induces apoptosis in a Bax- and Bim-depenment manner[J].JBiolChem,2011,286(11):9382.
[26]王灵均,郭敏.发育期小鼠肾小体细胞凋亡的研究[J].解剖学报,2005,36(1):103.
[27]王颖,李志辉,邓旭,等.缺血预处理对大鼠缺血再灌注肾损伤诱发凋亡的保护机制[J].中华实用儿科临床杂志,2016,31(5):354.
[28]田娟,郭芳,李晓明.生长期膳食缺锌小鼠肾细胞凋亡及机制研究[J].天津医药,2015,43(11):1281.
[29]GALL J M,WONG V,PIMENTAL D R,et al. Hexokinase regulates Bax-mediated mitochondrial membrane injury following ischemic stress[J].KidneyInt,2011,79(11):1207.
[30]刘钊,李易明,王冀,等.缺氧缺血性脑病新生大鼠肾脏Bax和Caspase-3蛋白的表达与肾细胞凋亡的作用机制[J].河北医药,2014,36(11):1605.
(责任编辑陆泉芳)
Histological structure and Bax proteins expression in Sichuan snub-nosed monkey(Rhinopithecusroxellana) kidney
YU Shi-yuan1,2,GOU Tao-ran1,OU Rui1
(1.College of Life Science,Northwest Normal University,Lanzhou 730070,Gansu,China;2.Editoral Department of the University Journal,Northwest Normal University,Lanzhou 730070,Gansu,China)
To observe the Sichuan snub-nosed monkeys(Rhinopithecusroxellana) kidney histological structure and its related proteins expression of Bax,the paraffin sections and H.E stain are used to observe the histological structure characteristics of Sichuan snub-nosed monkeys kidney,and immunohistochemical method is used to detect Bax protein expression in the Sichuan snub-nosed monkeys kidney.Results show the kidney tissue of Sichuan snub-nosed monkeys is similar to the most mammals,the kidney profile likes broad beans and is wrapped by dense connective tissue in surface.Renal parenchyma is composed of external cortex of kidney and internal medullary of kidney.There are so many renal corpuscles.Proximal tubule and distal tubule located renal corpuscles are numerous.Proximal tubule’s lumen is irregular and the brush border clearly exists while distal tubule hasn’t brush border.The lumen of collecting tubule is big and its cell boundary is clear.Bax is expressed in epithelial cells which are located in renal tubule and collecting tubule. The kidney of Sichuan snub-nosed monkeys are mainly made up of the nephron and collecting tubule.Bax participates cell apoptosis which occurs in renal tubule and collecting tubule to control the development of Sichuan snub-nosed monkeys kidney.Key words:Sichuan snub-nosed monkeys(Rhinopithecusroxellana);kidney;histological structure;Bax;immunohistochemistry
10.16783/j.cnki.nwnuz.2016.05.019
2016-07-15;修改稿收到日期:2016-08-02
甘肃省自然科学基金资助项目(1107RJZA141);兰州市社会发展项目(2013-3-72,2014-1-102)
俞诗源(1957—),男,甘肃兰州人,教授,博士,博士研究生导师.主要研究方向为组织发生.
E-mail:syyu006@nwnu.edu.cn
Q 955
A
1001-988Ⅹ(2016)05-0085-05

