双吡啶氨基甲酸酯受体的阴离子结合性质
郝勇静,谢 娟,殷晓茹
(河北工程大学理学院,河北邯郸 056038)
双吡啶氨基甲酸酯受体的阴离子结合性质
郝勇静,谢娟,殷晓茹
(河北工程大学理学院,河北邯郸056038)
设计合成了一例柔性吡啶氨基甲酸酯受体L,并应用该受体分别与3种无机酸(H2SO4,HCl和 HNO3)反应制备了3个阴离子复合物(1~3).核磁分析显示,阴离子与受体L通过氢键相互作用,吡啶氮原子被质子化.复合物的红外谱图中均出现相应的阴离子特征峰,并且C=O伸缩振动频率相比受体L均出现了一定的红移.复合物的紫外光谱相比受体L出现了新的吸收峰,这可能是由于溶液状态下阴离子和质子化配体之间的氢键作用和静电作用引起的.
阴离子受体;吡啶;氢键;质子化;紫外-可见吸收光谱
阴离子在生物学、医药科学、催化化学以及环境科学领域扮演着重要的角色,因此,设计和合成阴离子受体分子并研究其阴离子结合和识别性质引起了越来越多科研人员的研究兴趣[1-3].目前,已有大量的中性氨类、酰胺、脲、吡咯、吲哚和咪唑类受体被报道[4-8].在这些研究体系中,氢键通常在阴离子-受体相互作用中占据主要地位.其中,吡啶氨基甲酸酯类配体是一种优良的阴离子受体,因为氨基甲酸酯基团可以作为氢键的给体/受体,吡啶基团的氮原子具有与金属强的配位能力,可以实现金属辅助下的阴离子结合[10-11].此外,与刚性受体相比,由于柔性阴离子受体与阴离子结合时构型可能会发生变化,使得关于柔性阴离子受体的研究更具有挑战性[12].
本文设计合成了一例柔性吡啶氨基甲酸酯类受体,并利用该受体分别与3种无机酸(H2SO4,HCl和HNO3)反应制备了3个阴离子复合物,并通过核磁、紫外和红外光谱研究了其在质子化条件下与不同形状阴离子(四面体硫酸根阴离子、球形氯离子和平面硝酸根阴离子)的结合情况.
1 实验部分
1.1仪器和试剂
异烟酸、无水硫酸镁、叠氮钠、二氯亚砜、二氯甲烷、甲苯、乙二醇、甲醇、乙醚、二甲基亚砜等均为分析纯,由商业途径购得并直接使用.
1HNMR和13CNMR谱图由 Mercury plus-400核磁仪检测,以 TMS为内标.所有1HNMR都在DMSO-d6/0.5% H2O环境下进行.IR 光谱由Avatar 370傅里叶变换红外光谱仪测得.元素分析数据由Elementar Vario EL分析仪测得.熔点由X-4 Digital Vision MP熔点仪测得.UV-vis图谱由TU-1810光谱仪测定.
1.2受体的合成与表征
合成路线见图1.2.0 g(16.26 mmol)异烟酸置于圆底烧瓶,加入15 mL分析纯SOCl2,回流反应1 h后改为蒸馏装置,蒸除SOCl2,得中间产物酰氯.
圆底烧瓶中加入叠氮钠3.0 g(46.15 mmol),加入蒸馏水配置得到饱和溶液,加入15 mL二氯甲烷,冰水浴冷却,然后逐滴加入中间产物酰氯,反应过夜,萃取,收集有机相,加入无水硫酸镁干燥5 h后过滤,旋除溶剂,得到中间产物叠氮1.58 g.
将1.58 g(10.68 mmol)叠氮置于圆底烧瓶,加入分析纯甲苯,回流反应1.5 h后加入乙二醇0.30 mL(5.34 mmol),立刻得到大量沉淀.室温搅拌6 h后抽滤,甲苯和乙醚洗涤得到1.42 g白色目标产物L.产率:88%;m.p.:191~192 ℃;Anal.Calcd for C14H14N4O4(302.3):C 55.63,H 4.67,N 18.53,Found:C 55.71,H 4.51,N 18.35;IR(KBr,ν/cm-1):3 444,3 168,2 906,1 950,1 736(C=O),1 597,1 536,1 343,1 210,1 091,991,832,757,533,457;1HNMR(DMSO-d6,400 MHz)δ:4.39(s,4H,CH2),7.43(d,4H,J=5.0 Hz,Py-H3),8.37(d,4H,J=5.0 Hz,Py-H2),10.22 (s,2H,NH);13CNMR(DMSO-d6)δ:153.1,150.4,146.0,112.5,63.1.
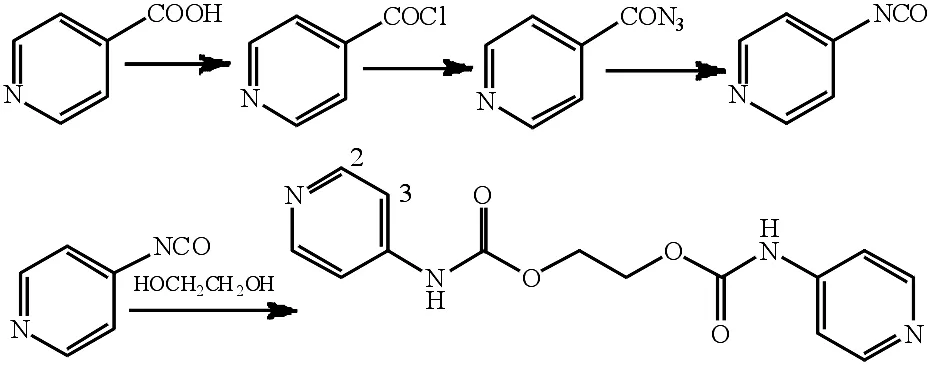
图1 受体L的合成路线
1.3阴离子复合物1~3的合成
复合物1:称取20 mg的L(0.066 mmol),加入5 mL甲醇,再加入66 μL的H2SO4水溶液(1 mol·L-1,0.066 mmol),室温搅拌5 h后停止反应,离心分离,用甲醇乙醚各洗2次,干燥,得到白色产物8.6 mg.产率30%;m.p.:235~236 ℃;Anal.Calcd for C14H20N4O10S:C 38.53,H 4.62,N 12.84,Found:C 38.73,H 4.74,N 12.60;FT-IR(KBr,ν/cm-1):3 388,3 223,2 900,2 807,1 742(C=O),1 626,1 518,1 341,1 223,1 179(S-O),1 076,957,844,622,586;1HNMR(DMSO-d6,400 MHz)δ:4.46(s,4H,CH2),7.70(d,4H,J=5.6 Hz,Py-H3),8.54(d,4H,J=6.0 Hz,Py-H2),10.85(s,2H,NH).
复合物2:称取20 mg的L(0.066 mmol),加入5 mL甲醇中,再加入132 μL的HCl水溶液(1 mol·L-1,0.13 mmol),搅拌5 h后,停止反应,离心分离,用甲醇乙醚各洗2次,干燥,得到白色产物11.6 mg.产率:45%;m.p.:259~261 ℃;Anal.Calcd for C14H18Cl2N4O5:C 42.76,H 4.61,N 14.25,Found:C 42.88,H 4.52,N 14.41;IR(KBr,ν/cm-1):3 435,3 222,1 747(C=O),1 642,1 520,1 195,1 062,830,730,519;1HNMR(DMSO-d6,400 MHz)δ:4.50 (s,4H,CH2),7.92 (d,4H,J=7.2 Hz,Py-H3),8.67 (d,4H,J=6.8 Hz,Py-H2),11.41(s,2H,NH).
复合物3:称取20 mg的L(0.066 mmol),加入5 mL甲醇中,再加入132 μL的HNO3水溶液(1 mol·L-1,0.13 mmol),搅拌5 h后,停止反应,离心分离,用甲醇乙醚各洗2次,干燥,得到白色产物10.2 mg.产率:36%;m.p.:232~233 ℃;Anal.Calcd for C14H16N6O10:C 39.26,H 3.77,N 19.62,Found:C 39.31,H 3.86,N 19.60;IR(KBr,ν/cm-1):3 234,2 834,1 750(C=O),1 588,1 520,1 416(N-O),1 215,1 077,829,522;1HNMR(DMSO-d6,400 MHz)δ:4.51(s,4H,CH2),7.92(d,4H,J=6.8 Hz,Py-H3),8.69(d,4H,J=8.0 Hz,Py-H2),11.38(s,2H,NH).
2 结果与讨论
通过1HNMR手段研究了复合物1~3在浓度为0.01 mol·L-1的DMSO-d6溶剂中的溶液性质,结果见图2.可以看出,所有阴离子复合物上的NH基团以及吡啶环上质子的化学位移与受体L相比都明显的向低场移动.对于NH基团的质子,复合物相对于受体的δ向低场位移了0.63~1.19,推测这可能是由于NH基团与阴离子形成了氢键[11-12].对于吡啶环上质子,复合物相对于受体的δ向低场移动了0.17~0.48,这可能是由于质子化的吡啶氮一方面参与了阴离子的配位,另一方面与阴离子之间还存在着静电作用,最终导致吡啶环上质子的化学位移[11-12].研究结果表明受体L在溶液状态下和阴离子发生了键合作用.
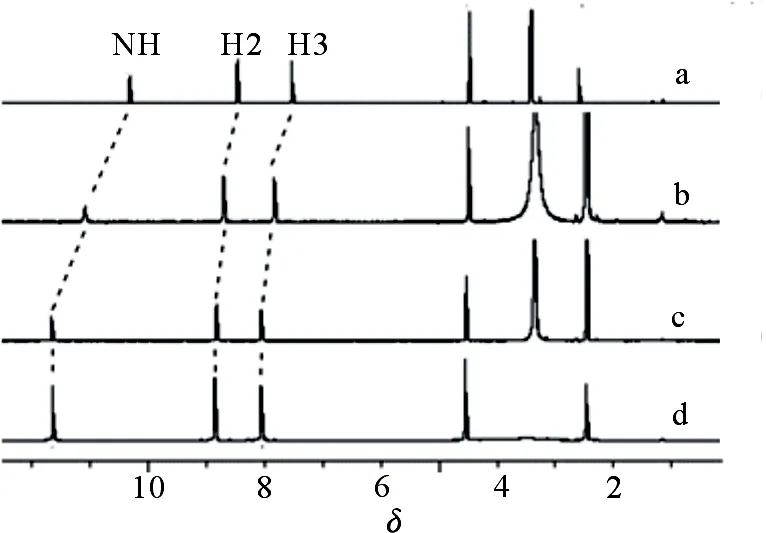
图2 DMSO-d6溶液中受体L(a)和复合物1(b),2(c),3(d)的1HNMR谱图
在浓度为5×10-5mol·L-1的EtOH/DMSO(V/V=9/1)溶剂中,测试受体以及复合物1~3的紫外可见光谱.受体L的UV-vis光谱在247 nm处出现了一个吸收峰(图3),这是由受体自身的π-π*跃迁引起的.相对于受体L,复合物2和3的UV-vis光谱在264 nm位置均出现了一个新的吸收峰,同时247 nm处的吸收峰强度降低,这可能是由溶液状态下阴离子和质子化配体之间的氢键作用和静电作用引起.有趣的是,复合物1并未观察到新的吸收峰出现,推测可能是在该溶剂条件下不利于主客体的结合所致.
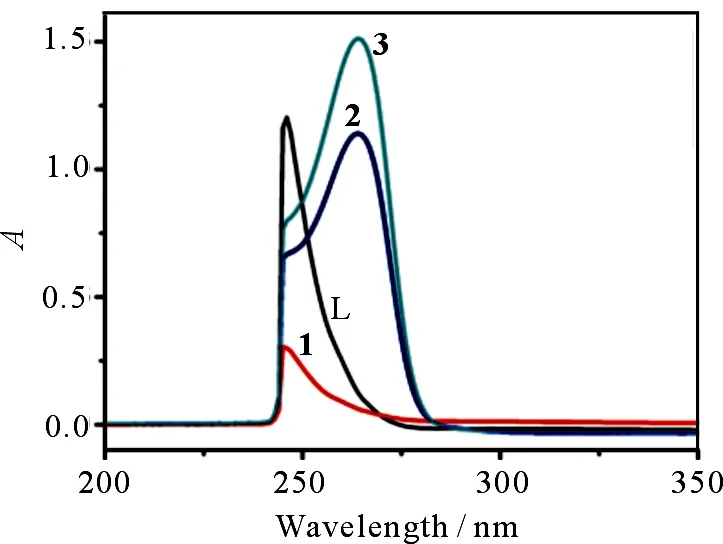
图3 乙醇/DMSO(V/V=9/1)溶液中受体L和复合物1,2,3的紫外可见光谱
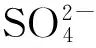
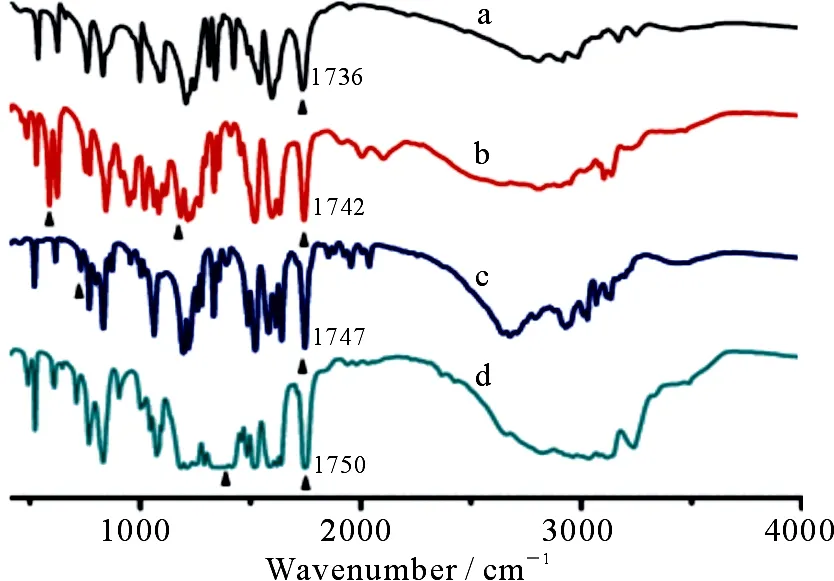
图4 受体L(a)和复合物1(b),2(c)和3(d)的红外谱图
3 结论
设计合成了一个柔性氨基甲酸酯阴离子受体,并应用该受体分别与3种无机酸(H2SO4,HCl和HNO3)反应制备了3例阴离子复合物.通过核磁、紫外和红外手段研究了质子化后的受体与不同形状阴离子结合情况.核磁分析表明,阴离子与受体L通过氢键相互作用,吡啶氮原子被质子化.红外谱图中均出现相应的阴离子特征峰,并且C=O伸缩振动频率相比受体L均出现了一定的红移.复合物的紫外光谱相比受体L出现新的吸收峰.该研究结果可为阴离子配位及识别等领域提供一定的参考价值.
[1]WENZEL M,HISCOCK J R,GALE P A.Anion receptorchemistry:highlights from 2010[J].ChemSocRev,2012,41:480.
[2]AMENDOLA V,FABBRIZZI L,MOSCA L.Anion recognition by hydrogen bonding:urea-based receptors [J].ChemSocRev,2010,39:3889.
[3]GALE P A,BUSSCHAERT N,HAYNES C J,et al.Anion receptor chemistry:highlights from 2011 and 2012 [J].ChemSocRev,2014,43:205.
[4]MATEUS P,BERNIERN,DELGADO R.Recognition of anions by polyammonium macrocyclic and cryptand receptors:influence of the dimensionality on the binding behavior[J].CoorChemRev,2010,254:1726.
[5]ARUNACHALAM M,GHOSH P.Bistripodand amide host for compartmental recognition of multiple oxyanions [J].OrgLett,2010,12:328.
[6]STEED J W.Anion-tuned supramolecular gels:a natural evolution fromurea supramolecular chemistry [J].ChemSocRev,2010,39:3686.
[7]GALE P A.Syntheticindole,carbazole,biindoleand indolocarbazole-based receptors:applications in anion complexation and sensing[J].ChemCommun,2008:4525.
[8]GALE P A,HISCOCKJR,JIE C Z,et al.Acyclic indoleandcarbazole-basedsulfatereceptors [J].ChemSci,2010,1:215.
[9]KATAYEV E A,USTYNYUKY A,SESSLER J L.Receptors for tetrahedral oxyanions[J].CoordChemRev,2006,250:3004.
[11]XIA Ya-na,WU Biao,LIU Yan-yan,et al.A flexible bis(pyridylcarbamate)anion receptor:binding of infinitedouble-stranded phosphate,[-sulfate-(H2O)2-]n,and hydrogen-bridgedhelical perchlorate chain [J].CrystEngComm,2009,11:1849.
[12]XIA Ya-na,WU Biao,LI Shao-guang,et al.Anion binding of abis(pyridylcarbamate)receptor bearing a diethyleneglycol space [J].SupramolChem,2010,22(5):318.
[13]BOIOCCHI M,BOCA L D,GMEZ D E,et al.Nature of urea-fluoride interaction:incipient and definitive proton transfer [J].JAmChemSoc,2004,126:16507.
[14]NAKAMOTO K.InfraredandRamanSpectraofInorganicandCoordinationCompounds[M].6th ed.New York:Wiley Sons,2009.
(责任编辑陆泉芳)
Anion binding properties based on a bis(pyridylcarbamate) receptor
HAO Yong-jing,XIE Juan,YIN Xiao-ru
(College of Science,Hebei University of Engineering,Handan 056038,Hebei,China)
A flexible bis(pyridylcarbamate) receptor,4-pyridinyl-carbamic-acid-1,2-ethanediylester(L) is designed and synthesized.Three anion complexes(1~3) are prepared by reaction of L with a series of inorganic acids(H2SO4,HCl and HNO3).The1HNMR results show that the ligand L can be doubly protonated and bind the anions through hydrogen bonding interactions.Anion characteristic absorption peaks appeare in the IR spectra of the complexes,and the C=O stretching peak of the amide fragment has a red shift compared to the receptor L.The UV-vis shows that the absorption bands of complexes have new band compared to L,which may be due to the hydrogen bond and electrostatic effect between the anion and the protonated L in solution.
anion receptor;pyridine;hydrogen-bond;protonated;UV-vis spectroscopy
10.16783/j.cnki.nwnuz.2016.05.015
2016-05-08;修改稿收到日期:2016-07-21
国家自然科学基金资助项目(51302063);河北省自然科学基金资助项目(B2014402062,QN20131085)
郝勇静(1982—),女,河北保定人,副教授,博士.主要研究方向为超分子阴离子化学.
E-mail:haoyj@hebeu.edu.cn
O 613.3
A
1001-988Ⅹ(2016)05-0064-04

