不同品种油菜响应外源H2O2处理的比较研究
张腾国,刁志宏,郭艳峰,郑 晟,王 娟
(西北师范大学生命科学学院,甘肃兰州 730070)
不同品种油菜响应外源H2O2处理的比较研究
张腾国,刁志宏,郭艳峰,郑晟,王娟
(西北师范大学生命科学学院,甘肃兰州730070)
本实验以陇油6号和天油2号两种油菜为供试材料,研究两种油菜叶片在不同浓度H2O2胁迫后对不同生理指标(叶绿素、MDA、脯氨酸含量和抗氧化酶活性等)的影响.结果显示在不同浓度H2O2胁迫下,两种油菜中MDA含量均大于对照组,游离脯氨酸含量呈先上升后下降的趋势,叶绿素含量在陇油6号中呈现先上升后下降的趋势,在天油2号中呈下降趋势.CAT、SOD活性呈现先上升后下降的趋势;GPX活性呈上升趋势;APX活性在陇油6号中呈先上升后下降的趋势,在天油2号中呈上升趋势;POD活性在陇油6号中为上升趋势,在天油2号为下降趋势.表明外源H2O2不仅影响油菜幼苗膜脂质过氧化和抗氧化酶活性,而且影响其生理生化代谢,通过对两种油菜叶片生理指标的分析,陇油6号表现出更好的抗H2O2胁迫的能力.
油菜;H2O2;生理指标
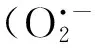
在植物细胞内H2O2可较长时间的存在,并且可以透过细胞膜在细胞之间长距离传递,当受到环境胁迫时能够快速生成,因此关于H2O2在植物生长过程中的作用越来越引起关注[5-6].研究表明低浓度的H2O2可以保护植物细胞,而高浓度的H2O2可毒害细胞.有实验表明,H2O2预处理后的马尼拉草更加耐寒[8].通过H2O2胁迫对菱角叶片叶绿素荧光特性影响的研究表明,H2O2可破坏植物光系统Ⅱ反应中心,且浓度越高破坏作用越明显,这可能与植物吸收H2O2后影响其正常的光合作用酶的合成有关,也可能与其光合作用色素被破坏有关[9].低浓度H2O2预处理能促进小麦幼苗中酶类和非酶类抗氧化剂的产生,从而减少膜质过氧化物的含量并提高小麦幼苗的耐盐性[10].但是,H2O2作为信号分子以及对细胞有毒性且在不同材料间有差异,仍是有待探讨的问题.
本实验以抗寒性较弱的天油2号油菜和超强抗寒的陇油6号油菜为实验材料,研究两种油菜经不同浓度H2O2胁迫后对丙二醛(MDA)、脯氨酸(Pro)、叶绿素含量以及抗氧化酶活性的影响.
1 材料方法
1.1实验材料
甘肃农业大学提供实验所用的“陇油六号”及“天油二号”油菜种子.挑取饱满种子若干,用水浸泡约20 min后种于混合营养土中,每盆约6~8粒,光周期14 h/10 h光照/黑暗,光照强度130 μmol(m2·s)-1,室温培养4周左右用于后续实验.
1.2材料处理
选取生长良好的陇油6号和天油2号油菜幼苗,分别用Hoagland营养液配置的四个浓度(0,5,10,15,20 mmol·L-1)的H2O2胁迫24 h后,剪取两种油菜的叶片用于相关指标测定.
1.3指标测定
1.3.1丙二醛 丙二醛含量的测定参照李合生等方法进行[12],含量用μmol·g-1表示.
1.3.2游离脯氨酸称取上述处理的油菜叶片各0.5 g,在研钵中加入含3%的磺基水杨酸提取液4 mL将叶片研磨至匀浆,转入玻璃试管并在沸水中放置10 min,待室温后15 000 rpm-1离心15 min;取上清液0.5 mL于另一试管中,加入冰醋酸2 mL、2.5%的酸性茚三酮2 mL,95 ℃水浴1 h,取出待室温后加入甲苯4 mL,振荡混匀,静置数秒后,用紫外分光光度计读取OD520处的数值,空白对照为甲苯溶液,脯氨酸含量用μg·g-1表示[12].
1.3.3叶绿素含量称取上述处理的油菜叶片各0.2 g,置于带塞的玻璃试管中,加入预冷的10 mL 80%丙酮溶液,盖紧塞子防止丙酮挥发;放置黑暗处24 h以提取植物叶绿素.用紫外分光光度计在663 nm和645 nm处测定其吸光值[12].叶片中叶绿素含量以mg·g-1表示.
1.3.4抗氧化酶活性APX、GPX、CAT和SOD四种酶的提取参照李忠光等[14]方法,用50 mmol·L-1Tris-HCl缓冲液(含ASA、EDTA、GSH和DTT,均为1 mmol·L-1,5 mmol·L-1MgCl2,20%甘油,pH7.0)提取酶液.APX活性的检测参照Nakano[15]的方法,CAT活性的检测按照Aebi[16]的方法,GPX活性的测定参照Chance和Maehly[17]的方法,SOD活性测定参照Giannopolitis[18]的方法,酶活性单位分别用U·g-1表示.
POD提取时取叶片0.5 g,加5 mL pH 7.8(0.05 M)的磷酸缓冲液,冰浴研磨,10 750 rpm-14 ℃离心20 min,上清液即为酶提取液.用紫外分光光度计测定POD的活性,20 μL酶提取液+3 mL POD反应液(0.125 mL 愈创木酚0.05%+0.255 3 mL 30%H2O2(10 mmol·L-1),磷酸缓冲液(pH7.0)稀释至250 mL),470 nm处比色.每隔1 min读数一次,以每分钟吸光度变化值表示酶活性大小.
1.3.5数据分析以上处理组和对照组分别做3次重复,每次3个平行,取3次重复的平均值,结果用SPSS 17.0分析.
2 结果与分析
2.1对丙二醛含量的影响
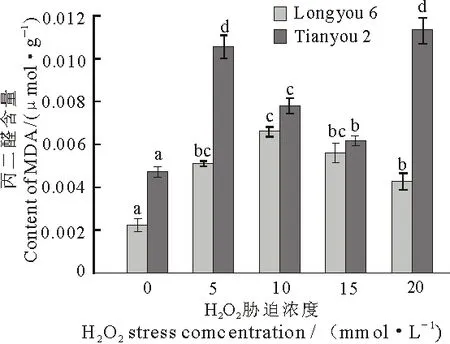
丙二醛(MDA)是细胞膜脂过氧化的产物,其含量的变化与生物体细胞膜的损坏程度存在一定的关系,且能够反映细胞膜的损害程度.所以,测定丙二醛的含量可以反映植物抵抗非生物胁迫的程度.两种油菜经H2O2(5,10,15,20 mml·L-1)的处理与各自未处理组对比显示,丙二醛的含量在两种油菜叶片中均显著升高,达到显著水平(P<0.05).在相同浓度下陇油6号MDA的含量总是低于天油2号,说明陇油6号比天油2号能适应更高浓度的胁迫且陇油6号的膜质过氧化损伤程度低于天油2号(图1).
同色柱形图中不同字母表示差异显著P<0.05(下同)
(Different letters in the same color histogram indicate significant differences)
图1H2O2胁迫对两种油菜叶片丙二醛含量的影响
Fig 1Effects of H2O2stress on MDA content in leaves of two specics of Brassisa
2.2对游离脯氨酸含量的影响
脯氨酸的积累可以使植物免受渗透胁迫造成的伤害,并与植物体内因胁迫而产生的氧自由基发生反应,从而降低活性氧给植物细胞带来的伤害,因此,脯氨酸的积累对于稳定细胞结构,降低细胞脂膜氧化损伤起着重要作用.两种油菜叶片中脯氨酸含量随着H2O2浓度的升高整体呈先升高后下降的趋势.与对照相比,陇油6号处理组脯氨酸含量依次升高了15.3%,3.2%,24%,呈明显上升趋势(P<0.05),天油2号中,脯氨酸的含量表现为先升后降,并且达到显著水平(P<0.05).5 mmol·L-1胁迫浓度时,两种油菜中脯氨酸含量均达到最大值.在15,20 mmol·L-1胁迫下,陇油6号中脯氨酸的含量明显大于天油2号中的脯氨酸含量.说明陇油6号油菜在受到逆境胁迫时,体内能积累更多的渗透调节物质,更有利于植物在逆境中的生长(图2).
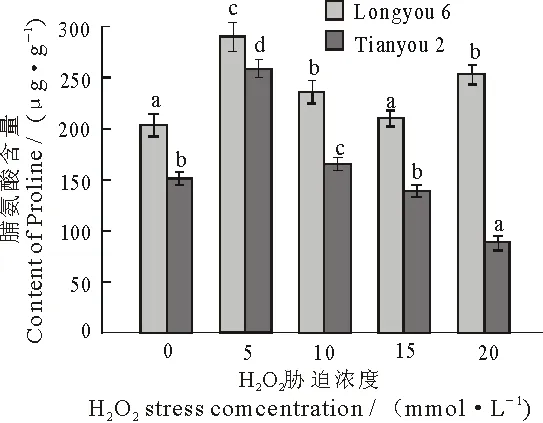
图2 H2O2胁迫对两种油菜叶片脯氨酸含量的影响
2.3对叶绿素含量的影响
植物进行光合作用时叶绿素是其必需成分,其含量直接影响植物叶片光合效率和光合产物的形成[19].两种油菜经不同浓度H2O2胁迫后,叶片内叶绿素含量表现出不同的趋势,陇油6号中叶绿素含量随着H2O2浓度的增加呈先上升后下降的趋势,并在处理浓度为10 mmol·L-1时达到最大,较对照增长了35.3%.天油2号中叶绿素含量随着H2O2浓度的升高呈下降趋势,在20 mmol·L-1胁迫下与对照组相比下降48.5%,均达到显著水平(P<0.05).在单一相同浓度下,叶片中叶绿素的含量陇油6号均高于天油2号(图3).
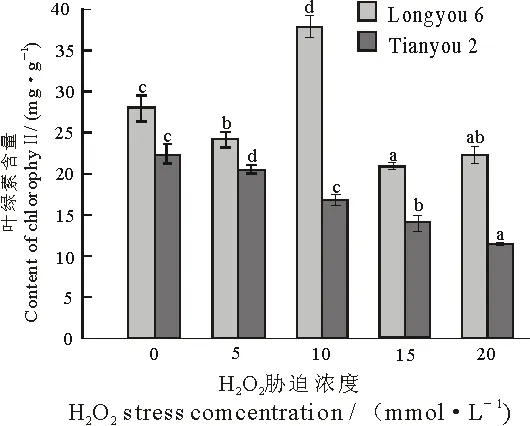
图3 H2O2胁迫对两种油菜叶片叶绿素含量的影响
2.4对两种油菜抗氧化酶活性的影响
APX是植物细胞中抗坏血酸谷胱甘肽循环中的重要酶类组分,以AsA为电子供体将H2O2转换为H2O[22],从而减轻氧化胁迫.两种油菜在不同浓度H2O2胁迫下,随着H2O2浓度的增大,陇油6号油菜中APX的活性呈先升高后下降的趋势,在10 mmol·L-1胁迫时达到最大值,较空白对照增长了5.5倍,天油2号油菜APX的活性呈上升趋势,与对照相比,分别增长1.38,2.53和5.31倍,差异显著(P<0.05).同一胁迫浓度下,陇油6号中APX的活性明显高于天油2号(图4).
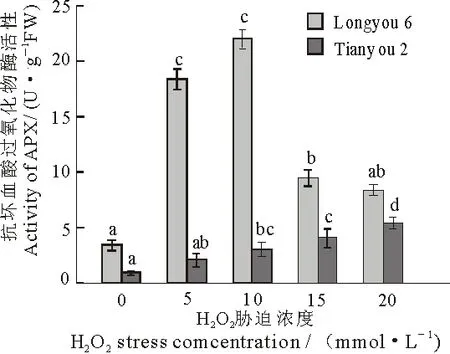
图4 H2O2胁迫对两种油菜叶片APX活性的影响
CAT是植物体内抗氧化防御体系的主要酶类,负责清除植物体内的氧自由基,其活性的升高有助于清除植物体内的H2O2[23].CAT活性随着H2O2浓度的升高呈先上升后下降的趋势,当H2O2浓度为10 mmol·L-1时,陇油6号中CAT活性达到最大值.天油2号中,CAT活性的最大值在H2O2浓度为5 mmol·L-1时,且都达到显著水平(P<0.05).在各个胁迫浓度下,陇油6号的CAT活性比天油2号高(图5).
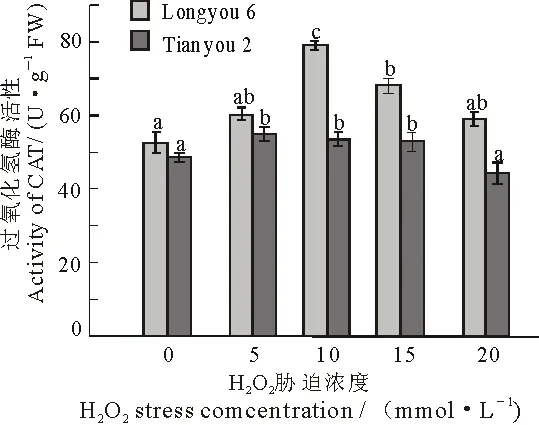
图5 H2O2胁迫对两种油菜叶片CAT活性的影响
GPX作为氧自由基捕获剂的一种是消除生物体氧自由基的主要酶类,其活性的高低可作为植物在非生物胁迫下抵御ROS伤害的标志之一[24].在不同浓度H2O2胁迫下,两种油菜中GPX的活性表现出不同程度的降低,当H2O2胁迫浓度为5 mmol·L-1时,陇油6号和天油2号中GPX活性比对照有所降低,随着胁迫浓度的增加GPX活性略有上升,但都低于对照,均达到显著水平(P<0.05),但是每组之间的活性变化不明显.在各个胁迫浓度下,陇油6号比天油2号表现出更高的GPX活性(图6).
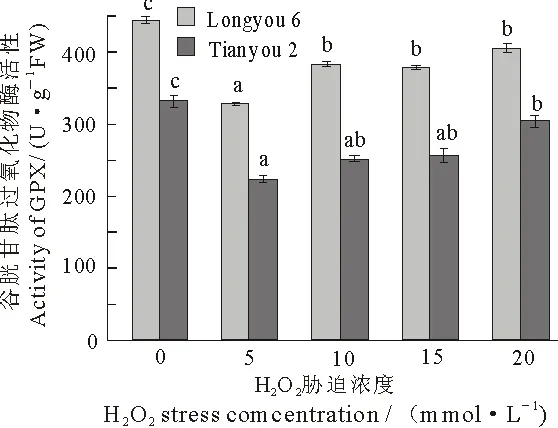
图6 H2O2胁迫对两种油菜叶片GPX活性的影响
过氧化物酶(POD)是存在于动植物和微生物中的氧化还原酶,具有消除过氧化氢和酚类、胺类毒性的双重作用[26],POD含量的高低反应了植物抗胁迫的能力.本实验中,经不同浓度H2O2胁迫,两种油菜叶片中POD活性表现出不同的变化趋势,陇油6号中POD的活性随胁迫浓度的增加持续上升,与对照相比,分别提高了2.12,5.46,6.61和11.12倍.在天油2号中POD活性随H2O2浓度的增加呈下降趋势,与对照相比,分别降低了42.7%,49%,68.8%和74.9%,均达到显著水平(P<0.05).在各个浓度下,陇油6号比天油2号表现出更高的POD活性(图8).
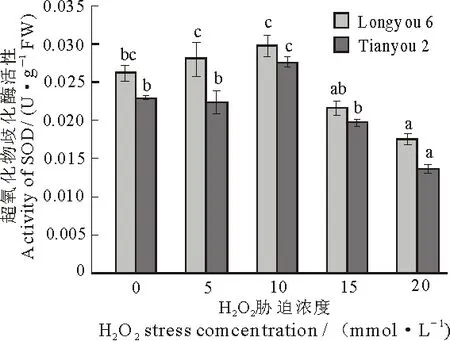
图7 H2O2胁迫对两种油菜叶片SOD活性的影响
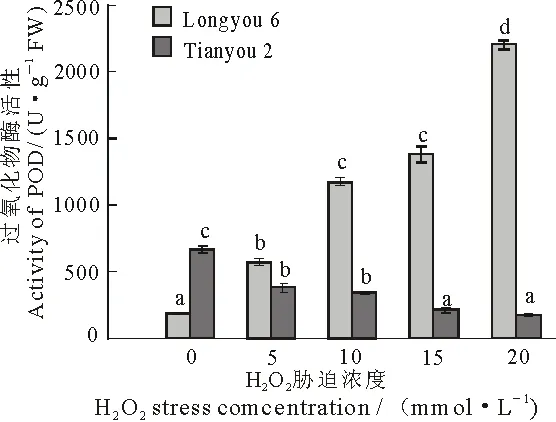
图8 H2O2胁迫对两种油菜叶片POD活性的影响
3 讨论
伴随着生物脂膜理论以及研究技术的不断发展,植物非生物胁迫与生物脂膜过氧化的关系备受关注.当植物在逆境条件下生长时,体内过氧化氢的积累是植物在逆境胁迫下的反应之一.有研究表明,低浓度H2O2作为信号分子,在植物响应生物或非生物胁迫信号通路中起重要作用,高浓度下可引起膜质过氧化,破坏生物大分子进而对细胞产生伤害效应[8].Foyer等(1994)认为,外源H2O2可使植物造成致命的氧化损害.但也有实验报道,经过外源H2O2锻炼的植物抗寒能力比没有锻炼植物抗寒能力高[8].另据报道,外源H2O2能够影响大蒜幼苗脂膜过氧化物、抗氧化酶活性以及抗氧化物质的含量[25].
本研究中,在不同H2O2胁迫浓度下,两种油菜叶片中MDA的含量均高于对照,且在每个浓度胁迫下,天油2号中MDA的含量高于陇油6号,说明天油2号比陇油6号的过氧化程度大.两种油菜中游离脯氨酸的含量随H2O2胁迫浓度的升高,整体呈先升后降的趋势,并且两种油菜的脯氨酸含量均大于对照组,在各个浓度下,陇油6号中脯氨酸含量均大于天油2号,说明陇油6号比天油2号在H2O2胁迫下的细胞稳定性更高.两种油菜中叶绿素含量随H2O2胁迫浓度的升高表现出不同的差异,在陇油6号中整体呈先升后降的趋势,在天油2号中呈下降趋势,在各H2O2胁迫浓度下,陇油6号中叶绿素含量总是高于天油2号,说明陇油6号在不同H2O2浓度的胁迫下的光合作用强于天油2号,且陇油6号比天油2号能更好地在逆境中生长.在陇油6号中,CAT和SOD的活性总体呈先升后降的趋势,且在同一胁迫浓度下,陇油6号中两种酶的活性均大于天油2号.陇油6号中APX的活性呈先升后降的趋势,在10 mmol·L-1时达到最大值,天油2号中呈上升趋势,并且两种油菜与各自对照相比均差异显著.陇油6号中GPX的活性在每个H2O2胁迫浓度下均大于天油2号,说明陇油6号比天油2号清除自由基的能力更强.随着H2O2胁迫浓度的升高,POD在陇油6号中呈上升趋势,在天油2号中呈下降趋势,且在各个H2O2胁迫浓度下,陇油6号中POD的活性均高于天油2号,说明陇油6号比天油2号有更强的清除自由基的能力,与各自的对照相比均差异显著.
综上所述,外源H2O2不但影响油菜膜脂过氧化及抗氧化酶的活性,而且还影响油菜正常物质代谢,随着H2O2胁迫浓度的升高,陇油6号的各项生理指标始终高于天油2号,表明陇油6号比天油2号有更强的抗胁迫能力.
[1]聂石辉,齐军仓,张海禄,等.PEG6000模拟干旱胁迫对大麦幼苗丙二醛含量及保护酶活性的影响[J].新疆农业科学,2011,48(1):11.
[2]FOYER C H,LOPEZ-DELGADO H,DAT J F,et al.Hydrogen peroxide and glutathione-associated mechanisms of acclimatory stress tolerance andsignaling[J].PhysiolPlant,1997,100(2):241.
[3]杜秀敏,殷文璇,赵彦修,等.植物中活性氧的产生及清除机制[J].生物工程学报,2001,17(2):121.
[4]刘会杰,李胜,马绍英,等.H2O2胁迫下豌豆初生根及抗氧化酶系统对外源Ca2+的响应[J].草业学报,2015,23(6):189.
[5]CHENG Y L,SONGC P.Hydrogen peroxide homeostasis andsignaling in plant cells[J].ScienceinChina:SeriesCLifeSciences,2006,49(1):1.
[6]HUANG S H,YU C W,LIN C H.Hydrogen peroxide functionsas a stresssignalin plants[J].BotanyBulletinAcademySinaean,2005,46(1):1.
[7]LI S W,XUE L G,XU S J,et al.Hydrogen peroxide acts as a signal molecule in the adventitious root formation of mung bean seedlings[J].EnvironmentalandExperimentalBotany, 2009,65(9):63.
[8]WANG Y,LI J L,WANG J,et al.Exogenous H2O2improves the chilling tolerance of manilagrassangmascarenegrass by activating the antioxidative system[J].PlantGrowthRegulation,2010,61(2):195.
[9]纪营雪,王风贺,张帆,等.H2O2胁迫下菱角叶片的叶绿素荧光特性研究[J].南京师范大学学报(工程技术版).2013,13(3):67.
[10]李金亭,赵萍萍,邱宗波,等.外源H2O2对盐胁迫下小麦幼苗生理指标的影响[J].西北植物学报,2012,32(9):1796.
[11]刘曼霞,马建祖.逆境胁迫下的亚高山草甸植物脯氨酸积累特点分析[J].西北师范大学学报(自然科学版),2010,46(2):101.
[12]李合生,孙群,赵世杰.植物生理生化实验原理及技术[M].北京:高等教育出版社,2000.
[13]张治安,陈展宇.植物生理学实验技术[J].长春:吉林大学出社,2008:182.
[14]李忠光,李江鸿,杜超昆,等.在单一提取系统中同时测定五种抗氧化酶[J].云南师范大学学报(自然科学版),2002,22(6):44.
[15]NAKANO Y,ASADA K.Hydrogenperoxideis scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].PlantCellPhysilolgy,1980,22(5):867.
[16]AEBI H. Catalase in vitro[J].MethodsinEnzymology,1984,105(3):121.
[17]CHANCE B,MAEHLY A C.Assay of catalase and peroxidase[J].MethodsinEnzymology,1955,2(55):764.
[18]GIANNOPOLITIS C N,RIES S K.Superoxide dismutase occurrence in high plants[J].PlantPhysiology,1977,59(2):309.
[19]牟建梅,张国芹,刘凤军,等.白菜叶绿素含量的测定方法筛选[J].江苏农业科学,2014,42(9):289.
[20]杨巍,刘晶,吕春晶,等.氯化钙和抗坏血酸处理对鲜切苹果品质和褐变的影响[J].中国农业科学,2010,43(16):3402.
[21]APEL K,HIRT H.Reactive oxygen species:metabolism,oxidativestress,and signal transdu-ction[J].AnnualReviewofplantBiology,2004,55(1):373.
[22]AJMAD P,JALEEL C A,SALEM M A,et al.Roles of enzymatic and nonenzymatic antioxidants in plant during abiotic stress [J].CritRevBiotechnol,2010,30(3):161.
[23]李汝佳,李雪梅.水杨酸、脱落酸和过氧化氢对镉胁迫小麦幼苗光合及抗氧化酶活性的影响[J].生态学杂志,2007,26(12):2096.
[24]陈义挺,赖钟雄,李焕苓,等.NaCl、光和温度胁迫对龙眼胚性愈伤组织GPX酶活性的影响[J].中国农学通报,2009,25(7):149.
[25]杨芸,吴震,李翠花,等.外源H2O2胁迫对大蒜试管苗玻璃化的影响[J].西北植物学报,2007,27(8):1637.
[26]何文亮,黄承红 ,杨颖丽,等.盐胁迫过程中抗坏血酸对植物的保护功能[J].西北植物学报,2004,24(12):2196.
[27]李金亭,赵萍萍,邱宗波,等.外源H2O2对盐胁迫下小麦幼苗生理指标的影响[J].西北植物学报,2012,32(9):1796.
[28]蒋景龙,李丽,徐皓,等.山黧豆根系对H2O2诱导氧化胁迫的生理应答[J].西北植物学报,2014,34(9):1795.
[29]陈新华,郭宝林,赵静,等.休眠期内甜樱桃不同品种枝条的抗寒性[J].河北农业大学学报,2009,32(6):37.
[30]张腾国,寇明刚,王圆圆,等.盐胁迫对两种油菜叶片生理指标的影响[J].西北师范大学学报(自然科学版),2014,50(5):85.
[31]GILL S S,TUTEJA N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].PlantPhysiolBiochem,2010,48(12):909.
(责任编辑俞诗源)
Effect of exogenous H2O2on the antioxidant system of two kinds ofBrassicacampestris
ZHANG Teng-guo,DIAO Zhi-hong,GUO Yan-feng,ZHENG Sheng,WANG Juan
(College of Life Science,Northwest Normal University,Lanzhou 730070,Gansu,China)
In this article,two kinds of oilseed rape Longyou 6 and Tianyou 2 as the test materials to study the influence of the physiological indicators(chlorophyll content,MDA content,free proline content and antioxidant enzyme activity,ect)under H2O2stress.The results show that under H2O2stress at different concentrations,the content of MDA in two kinds of rape is higher than that of control group,the free proline content show a trend of first increasing and then decreasing.The chlorophyll content show a downward trend after the first rise in Longyou 6,a downward trend in the number of Tianyou 2.The activity of SOD and CAT show the trend of first increasing and then decreasing;GPX activity show an upward trend;APX activity is first increase and then decrease in Longyou 6,and is increase in Tianyou 2.The activity of POD in Longyou 6 is an upward trend,but is an downward trend in Tianyou 2.Results show exogenous H2O2not only affect the membrane lipid peroxidation and antioxidant enzyme activities of rape seedlings,but also affect their physiological and biochemical metabolism.Through the analysis of the physiological indexes of two kinds of rape leaves,Longyou 6 show the better ability of antistress H2O2.
Brassicacampestris;H2O2;physiological index
10.16783/j.cnki.nwnuz.2016.05.017
2016-02-25;修改稿收到日期:2016-04-13
国家自然科学基金资助项目(31160089,30960065);甘肃省高等学校基本科研业务费项目;甘肃省自然科学基金资助项目(1208RJZA268)
张腾国(1971—),男,甘肃会宁人,教授,博士.主要研究方向为抗逆生理及分子生物学.
E-mail:zhangtg@nwnu.edu.cn
Q 945.78
A
1001-988Ⅹ(2016)05-0073-06

