大蒜素水溶液稳定性及分解产物组成研究
李文清, 周 华, 胡兴鹏, 晏日安, 欧仕益, 黄雪松
(暨南大学 理工学院,广东 广州510632)
大蒜素水溶液稳定性及分解产物组成研究
李文清, 周 华*, 胡兴鹏, 晏日安, 欧仕益, 黄雪松
(暨南大学 理工学院,广东 广州510632)
大蒜素水溶液的稳定性对大蒜制品的加工极其重要。作者研究了体系温度、浓度、pH值对大蒜素水溶液稳定性以及分解产物组成的影响。研究结果显示:温度或浓度越高,大蒜素水溶液的稳定性越低;温度相对较低或大蒜素浓度较高时,大蒜素的分解产物越趋向于以3-乙烯基-1,2-二硫环己-4-烯和3-乙烯基-1,2-二硫环己-5-烯为主的环状物;反之,产物以二烯丙基二硫醚等直链化合物为主。溶液的酸性越强,大蒜素越稳定。采用氢谱表征了大蒜素与氘代乙酸的氢键作用,采用理论计算,发现大蒜素在酸性溶液中发生质子化后,O(13)与H(5)的键长变长,分子的能量降低,初步揭示大蒜素在酸性溶剂中稳定性更高的原因。
大蒜素;水溶液;稳定性;机理
大蒜素(二烯丙基硫代亚磺酸酯,Allicin)是大蒜内所有化合物中最具有代表性的一种含硫化合物。从风味上来说,大蒜素对比于大蒜中其他含硫化合物,其更接近于新鲜大蒜的味道[1];并且在生物活性方面,特别是其抗氧化活性均远胜于大蒜中的其他化学成分[2-4]。
大蒜素有其非常突出的生物活性,但却至今未得到很好的实际利用,探究其原因主要是大蒜素极易分解,不稳定。据文献报道,在80℃下,大蒜素只需30 min即可接近完全分解[5-8];而对于新切的大蒜,其半衰期仅2.5 d[9]。至于大蒜素的分解机理,加拿大学者Vaidya 2009年提出,大蒜素可能经历一个先常温下发生Cope消除反应,而后再生成次磺酸中间体这样一个分解过程。也就是说大蒜素先生成一个五元环的过渡态结构,而后再分解成两个主要产物(如化学反应方程式1)。BlockE等2010年采用新的实时直接分析-质谱技术 (DART-MS)[11-12],第一次成功检测到次磺酸中间体的存在,于是Vaidya提出的机理得到了进一步的确认。
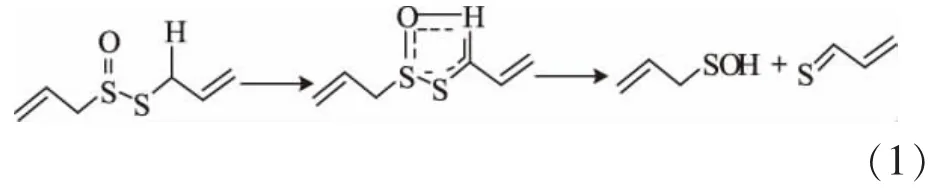
在反应方程式(1)中,显而易见可知大蒜素的本身结构特征就决定了它的分解特性。当然,大蒜素存放的温度、溶剂等条件也密切影响着大蒜素的分解。温度越高,大蒜素就越容易分解[8]。溶剂的影响比温度更加复杂:大蒜素在乙醇水溶液(或乙醇[13])等溶剂中的稳定性质明显强于其在油脂溶液中的稳定性质(在油脂溶液中的半衰期为0.8 h[13])。作者发现了大蒜素在乙醇、正戊烷两种溶剂中所具有不一样的动力学特征,并通过结合理论计算初步揭示了其可能的原因。但是,从安全性、经济性方面考虑,乙醇、正己烷等溶剂都称不上是大蒜素的最佳载体,而水才算得上是大蒜素加工处理过程中最安全、最实用,也是最廉价的溶剂,虽然此前有文献报道了大蒜素在水中表现出较差的稳定性,但并没有考虑大蒜素浓度、温度、酸度等对大蒜素水溶液中分解产物的分布或组成的影响。因此,作者拟从详细考察上述关键因素对大蒜素的稳定性着手,并探讨水对大蒜素稳定性的影响机制,从而为优化大蒜素的提取工艺提供理论支持,进一步为大蒜素的储存(或分散)提供理论参考。
1 材料与方法
1.1 实验材料与仪器原料
1.1.1 原料 二烯丙基二硫醚、乙醇、正戊烷、双氧水等试剂均购自于阿拉丁试剂(上海)有限公司。
1.1.2 主要仪器设备 电子天平Acculab ALC210:德国Sarto rius公司产品;UV3600紫外-可见分光光度计:日本SH IMADZU公司产品;高效液相色谱:美国安捷伦公司产品。
1.2 试验方法
1.2.1 大蒜素的合成 大蒜素的合成参考相关文献[8]。分别将1.46 g二烯丙基二硫醚溶解在30 mL氯仿中,间氯过氧苯甲酸溶解于5 mL氯仿中。在0℃下,缓慢地将间氯过氧苯甲酸溶液滴加到二烯丙基二硫醚溶液中,在此温度下继续搅拌1 h。然后边剧烈搅拌边分多次加入8.0 g碳酸钠,0℃下再继续搅拌1 h。反应完后滤去残渣,经减压蒸去溶剂,得到大蒜素粗品。粗品用柱层析法(V(石油醚)∶V(乙酸乙酯)=20∶1)纯化,得到的大蒜素成品保存于冰箱中。经核磁测定其结构,氢谱、碳谱数据为1H-NMR (400 MHz,CD3COOD):δ 3.72×10-6~3.92×10-6(m,4H),5.20×10-6~5.56×10-6(m,4H),5.88×10-6~5.99×10-6(m,2H);13C-NMR (75 MHz,CD3COOD):δ 35.02×10-6、59.90×10-6、119.10×10-6、124.00×10-6、125.80×10-6、132.90×10-6,与文献数据一致[10]。
1.2.2 大蒜素的含量检测与分析 大蒜素的含量分析也参见文献[8]。样品中大蒜素采用HPLC、紫外分光光度法分析 (50%H2O:MeOH,0-15分钟流速为0.3 mL/min,16~50 min流量为1 mL/min,柱子C18,3.9nm×150mmcolumn,UVdetectionat254nm)。
1.2.3 大蒜素产物的分布 Aglient GC-MS7890A/ 5975E气质联用仪。毛细管柱 (HP-5MS):30 m×0.25 mm;膜厚度0.25 μm,以7℃/min升温至250℃,保持5 min。进样口温度:200℃,载气:氦气,流量5.8 mL/min。
质谱条件:电子轰击离子源,电子能量为70 eV,离子源温度250℃,传导线温度250℃,四级杆温度180℃;质量扫描范围35~400(m/z)。
1.2.4 大蒜素水溶液稳定性测试 将大蒜素成品按一定浓度配成水溶液,置于恒温水浴锅中一定时间,然后测定大蒜素的浓度及产物组成,每个试验点重复做3次。
1.2.5 计算方法 采用B3LYP方法,在6-31+G基组下,用能量梯度法分别对几何构型进行了全参数优化。
1.3 数据分析
用 Excell软件对数据进行统计、分析,所有数据取3次重复的平均值;用Origin 8.0软件对数据进行拟合以及图形化处理。
2 结果与讨论
2.1 温度对大蒜素稳定性以及产物分布的影响
温度是影响大蒜素稳定性的重要因素。考察了温度对浓度为0.05 mol/L大蒜素水溶液稳定性的影响(在设定温度下放置6 h),结果见图1所示。在0℃,大蒜素的分解速度比较缓慢,6 h后约有40%大蒜素发生分解;在60℃放置6 h,约有80%的大蒜素已经分解,3-乙烯基-1,2-二硫环己-4-烯(4X)和3-乙烯基-1,2-二硫环己-5-烯(5X)为主要的分解产物。随着温度的进一步升高,分解产物中二烯丙基硫醚(DAS)、二烯丙基二硫醚(DADS)和二烯丙基三硫醚(DATS)的相对含量都有所增加(结果见图2)。让人惊讶的是,100℃沸水与100℃水蒸汽中大蒜素的分解产物有着明显的差异,从图2中看出,大蒜素在100℃沸水中的分解产物以3-乙烯基-1,2-二硫环己-4-烯(4X)和3-乙烯基-1,2-二硫环己-5-烯(5X)为主,二者之和占含硫化合物总量的60%以上;而100℃水蒸汽中,其分解产物则以二烯丙基二硫醚(DADS)与二烯丙基三硫醚(DATS)为主。其原因可以推测为:相对沸水来说,大蒜素在水蒸汽中的分散性要好很多,所以大蒜素在水蒸汽中易受到水分子的进攻,生成二烯丙基二硫醚等链状化合物。而在沸水中大蒜素先分解为烯丙基硫醛,而后发生两分子间的D-A反应产生3-乙烯基-1,2-二硫环己-4-烯(4X)和3-乙烯基-1,2-二硫环己-5-烯(5X)。
2.2 浓度对大蒜素稳定性以及产物分布的影响
将大蒜素成品配制成一定浓度的大蒜素水溶液或悬浮液,30℃下放置6 h后,测定大蒜素的含量(见图3)和产物组成(见图4)。在浓度较低时,大蒜素稳定性较好,分解速度较慢;随着浓度的增加,大蒜素分解趋势明显,当浓度为0.1 mol/L时,大蒜素的分解率达到了90%以上(见图3)。大蒜素的分解产物组成也随浓度大小而有所不同。大蒜素水溶液浓度较小时,主要产物为二烯丙基二硫醚,亦有少量二烯丙基硫醚与二烯丙基三硫醚存在;而浓度较大时,大蒜素的分解产物则主要为3-乙烯基-1,2-二硫环己-4-烯(4X)和3-乙烯基-1,2-二硫环己-5-烯(5X)等环状物。
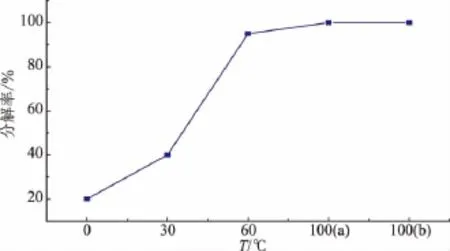
图1 温度对大蒜素水溶液稳定性的影响Fig.1 Effect of temperature on the stability of allicin aqueous solution
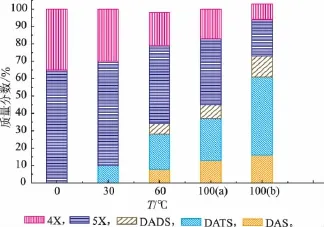
图2 温度对大蒜素分解产物的影响Fig.2 Effectoftemperatureon thedecomposition products of allicin

图3 浓度对大蒜素水溶液稳定性的影响Fig.3 Effect of concentration on the stability of allicin aqueous solution
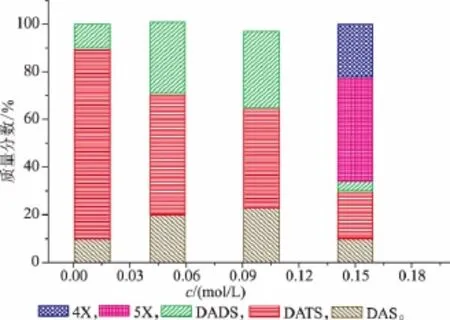
图4 浓度对大蒜素分解产物组成的影响Fig.4 Effect of concentration on the decomposition products of allicin
2.3 pH的影响
2.3.1 大蒜素在不同pH溶液中的稳定性 将浓度0.05 mol/L的大蒜素在一定的pH溶液中 (用乙酸、氢氧化钠调节pH值)放置6 h后,测定其稳定性,结果如图5所示。从图5中得出,pH为2时,大蒜素相对稳定、基本上没有分解,随着体系pH值增大,大蒜素的分解程度越高;而pH为10时,大蒜素基本接近完全分解。因此可知,溶液酸性越强,大蒜素的稳定性越好。
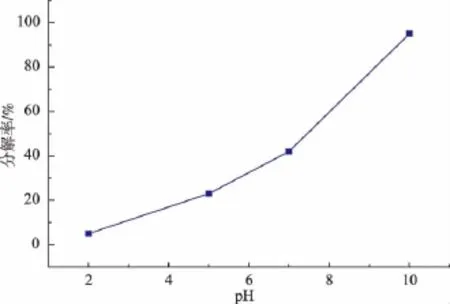
图5 pH值对大蒜素水溶液稳定性的影响Fig.5 Effect of pH on the stability of allicin aqueous solution
2.3.2 氢键分析 图6为大蒜素在氘代乙酸中的氢谱图。从图6中可知大蒜素溶于氘代乙酸后,氘代乙酸活泼氢的化学位移值向低场移动,从11.091×10-6变为11.410×10-6,说明活泼氢可能受到电负性原子的静电作用,从而形成了较强的氢键。
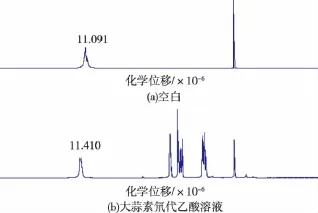
图6 大蒜素氘代乙酸溶液的氢谱图Fig.6 Hydrogen spectrum of allicin in the deuterated acetic acid solution
2.3.3 大蒜素质子化的理论计算
1)结构优化及键长变化 采用B3LYP方法,在6-31+G基组下对大蒜素质子化前后的结构进行逐步优化,获得大蒜素质子化的优化结构如图7所示,计算了大蒜素质子化前后的电荷与键长以及能量的变化。从图7可以看出,大蒜素质子化前后键长发生了显著的变化,其中O(13)与H(5)之间的距离由2.012×10-10m变成2.974×10-10m,此意味着大蒜素质子化后发生分子内cope反应的难度将大幅提高,也间接说明质子化后大蒜素的稳定性得到改善的原因。
2)大蒜素质子化前后能量变化 采用密度泛函方法计算了大蒜素发生质子化前后的能量变化(见反应式2),发现大蒜素经质子化后,大蒜素的能量降低了22.02 kJ/mol,说明了大蒜素经质子化后可以更加稳定的存在。

3 结语
1)研究了体系温度、浓度、pH值对大蒜素水溶液稳定性以及分解产物的影响。温度较低时,大蒜素水溶液的稳定性较高,分解产物以3-乙烯基-1,2-二硫环己-4-烯和3-乙烯基-1,2-二硫环己-5-烯为主;温度越高,大蒜素水溶液的稳定性越差,100℃沸水与水蒸气中大蒜素的分解产物差异明显,可能与大蒜素在沸水或水蒸汽中的分散性有关;大蒜素水溶液的稳定性受其浓度的影响非常明显,浓度越大,稳定性越差,分解产物中3-乙烯基-1,2-二硫环己-4-烯和3-乙烯基-1,2-二硫环己-5-烯所占比例越大;pH值是影响大蒜素稳定性的另一重要因素,pH越小,大蒜素的稳定性越好。
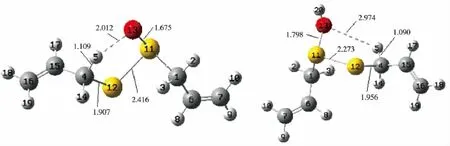
图7 大蒜素质子化前后的优化构型、重要键长、原子编号Fig.7 Optimized geometries,atomic numbering and bond distances of allicin
2)针对pH对大蒜素稳定性的影响,采用核磁共振方法研究了大蒜素溶于氘代乙酸的化学位移,其位移值明显向低场移动,说明大蒜素与氘代乙酸中的活泼氢形成了较强烈的氢键。通过对大蒜素质子化前后键长、能量变化的理论计算,初步解释了大蒜素质子化后稳定性提升的原因。
[1]孙君社,高孔荣.大蒜和洋葱风味物及其萃取[J].中国调味品,1995,10:9-13. SUN Junshe,GAO Kongrong.Garlic and onion flavors and extracts[J].China Condiment,1995,10:9-13.(in Chinese)
[2]HIRSCH K,DANILENKO M,Giat J,et al.Effect of purified allicin,the major ingredient of freshly crushed garlic,on cancer cell proliferation[J].Nutr Cancer,2000,38(2):245-254.
[3]OKADA Y,TANAKA K,FUJITA I,et al.Antioxidant activity of thiosulfinates derived from garlic[J].Redox Rep,2005,10(2):96-102.
[4]OKADA Y,TANAKA K,SATO E,et al.Antioxidant activity of the new thiosulfinate derivative,S-benzyl phenylmethanethiosulfinate,from Petiveria alliacea L[J].Org Biomol Chem,2008,6(6):1097-1102.
[5]FUJISAWA H,SUMA K,ORIGUCHI K,et al.Thermostability of allicin determined by chemical and biological assays[J]. Biosci,Biotechnol,Biochem,2008,72(11):2877-2883.
[6]LAWSON L D,GARDNER C D.Composition,Stability,and Bioavailability of Garlic Products Used in a Clinical Trial[J].J Agric Food Chem,2005,53(16):6254-6261.
[7]NISHIMURA H,TAKAHASHI T,WIJAYA C H,et al.Thermochemical transformation of sulfur compounds in Japanese domestic Allium,Allium victorialis L[J].BioFactors,2000,13(1-4):257-263.
[8]ILIC D P,NIKOKLIC V D,NIKOLIC L B,et al.Thermal degradation,antioxidant and antimicrobial activity of the synthesized allicin and allicin incorporated in gel[J].Hem Ind,2010,64(2):85-91.
[9]LAWSON L D,BAUER R.Garlic:a review of its medicinal effects and indicated active compounds.In Phytomedicines of Europe:Chemistry and Biological Activity.Eds.;ACS Symposium Series;American Chemical Society:Washington,DC,1998,691:176-209
[10]VAIDYA V,UNGOLD K U,PRATT D A.Garlic:source of the ultimate antioxidants-sulfenic acids[J].Angew Chem,Int Ed,2009,48(1):157-160.
[11]KUBEC R,CODY R B,DANE A J,et al.Applications of direct analysis in real time-mass spectrometry(DART-MS)in allium chemistry.(Z)-butanethial S-oxide and 1-butenyl thiosulfinates and their S-(E)-1-butenylcysteine S-oxide precursor from Allium siculum[J].J Agric Food Chem,2010,58(2):1121-1128.
[12]BLOCK E,DANE A J,THOMAS S,et al.Applications of Direct Analysis in Real Time Mass Spectrometry(DART-MS)in Allium Chemistry.2-Propenesulfenic and 2-Propenesulfinic Acids,Diallyl Trisulfane S-Oxide,and Other Reactive Sulfur Compounds from Crushed Garlic and Other Alliums[J].J Agric Food Chem,2010,58(8):4617-4625.
[13]FUJISAWA H,SUMA K,ORIGUCHI K,et al.Biological and chemical stability of garlic-derived allicin[J].J Agric Food Chem,2008,56(11):4229-4235.
Stability and Decomposition Products of Allicin in the Aqueous Solution
LI Wenqing, ZHOU Hua*, HU Xingpeng, YAN Rian, OU Shiyi, HUANG Xuesong
(College of Science and Engineering,Jinan University,Guangzhou 510632,China)
The stability of allicin in an aqueous solution is extremely important for the processing of garlic products.In this paper,the effects of temperature,concentration and pH value on the stability of allicin were investigated.Results show that the higher the temperature and concentration,the lower the stability of allicin in the aqueous solution.When temperature was relatively low or allicin concentration was high,decomposition products of allicin tended to be ring compounds such as 3-vinyl 1,2-disulfide cyclohex-4-ene and 3-vinyl 1,2-disulfide cyclohex-5-ene;conversely,the products primarily contained straight-chain compounds such as diallyl disulfide.The stronger the solution acidity was,the more stable allicin became.For this phenomenon,hydrogen bonding interaction of allicin with deuterated acetic acid was characterized by NMR.Theoretical calculations found that the main bond length between O(13)and H(5)of allicin obviously elongated and the molecular energy decreased in the protonated acid solution,which revealed the mechanism for the higher stability of allicin in an acidic solvent.
allicin,aqueous solution,stability,mechanism
S 573
A
1673—1689(2016)07—0699—05
2014-12-12
国家自然科学基金项目(31101323)。
周 华(1976—),男,湖南湘潭人,理学博士,副教授,主要从事食品化学研究。Email:zhouhua5460@jnu.edu.cn

