3α-羟类固醇脱氢酶的亲和纯化及化学修饰提高酶稳定性
方亚男, 段敬霞, 张 玲, 杨海麟
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
3α-羟类固醇脱氢酶的亲和纯化及化学修饰提高酶稳定性
方亚男, 段敬霞, 张 玲, 杨海麟*
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
研究了3α-羟类固醇脱氢酶(3α-HSD)经化学修饰后的稳定性变化。已构建的基因工程菌E.coli BL21(DE3)/pET28a-hsd经诱导表达、镍柱亲和纯化得到电泳纯的3α-HSD酶,酶蛋白得率是16.5%,活性回收率为64.7%,纯化倍数约为3.8,15%SDS-PAGE结果显示3α-HSD酶为单一条带,相对分子质量在28 000左右。采用邻苯二甲酸酐(PA)作为修饰剂,对3α-HSD纯酶进行化学修饰,与对照组相比,修饰酶抵抗pH波动的能力有所增强,50℃水浴10 min后酶的热稳定性明显提高,37℃贮藏40 h后修饰酶的贮藏稳定性比原酶提高9倍。
3α-羟类固醇脱氢酶;亲和纯化;邻苯二甲酸酐;化学修饰;稳定性
3α-羟类固醇脱氢酶 (3α-Hydroxysteroid dehydrogenase,3α-HSD,EC 1.1.1.50),可作用于多种类固醇基质,可逆地催化C19~27类固醇3位羟基/酮基的氧化还原[1]。临床上用3α-HSD作为工具酶来测定人血清中的总胆汁酸 (Total bile acids,TBA)浓度[2]。目前,TBA测定中所用的工具酶3α-HSD均从睾酮丛毛单胞菌中直接提取,但提取过程复杂、酶蛋白得率低,酶的稳定性低,在一定程度上限制了TBA测定的临床推广[3]。因此,要使3α-HSD广泛应用于临床医学中,一方面需要寻求更简单高效的提取纯化方法,另一方面必须要提高3α-HSD酶的催化活性、稳定性。
目前,已有文献报道木瓜蛋白酶、脂肪酶、辣根过氧化物酶(HRP)等多种酶经小分子酸酐修饰后,其催化活性或稳定性得到不同程度的提高[4-7]。邻苯二甲酸酐是赖氨酸Lys的专一修饰剂,PA的羧基能与Lys残基末端的ε-NH2生成酰胺键,能够有效改善酶的性能。
利用重组菌株E.coli BL21(DE3)/pET28a-hsd表达纯化得到融合蛋白,采用邻苯二甲酸酐修饰对3α-HSD的Lys残基进行化学修饰,并对pH稳定性、热稳定性及贮藏稳定性等进行研究,并对修饰效果提出合理的解释。
1 材料与方法
1.1 材料
重组菌株E.coli BL21(DE3)/pET28a-hsd:作者所在实验室保藏。邻苯二甲酸酐购自国药化学试剂有限公司;卡那霉素、异丙基硫代-β-半乳糖苷(IPTG)、咪唑、牛血清蛋白、透析袋:均购自上海生工;所有试剂均是分析纯。
1.2 主要仪器
3 K-15台式高速离心机:SIGMA公司产品;754UV紫外-可见分光光度计:上海精密科学仪器有限公司产品;电热恒温水浴锅:上海医疗器械五厂制造;蛋白电泳仪:美国BIO-RAD公司制造。
1.3 实验方法
1.3.1 融合蛋白 3α-HSD的表达 菌种发酵培养及融合蛋白3α-HSD的诱导表达见文献[3]。离心收集细菌沉淀,超声破碎后离心收集上清液,即获得粗酶液。
1.3.2 融合蛋白3α-HSD的亲和纯化 将Ni-IDA琼脂糖作为亲和介质装柱后,用软管与紫外检测仪相连,先用平衡缓冲液(20 mmol/L,pH 7.5磷酸盐缓冲液)以1 mL/min的流速平衡,将30 mL的粗酶液上样,平衡缓冲液流洗至A280 nm处的吸光值不再变化,用100、200、300、400 mmol/L不同浓度的咪唑进行洗脱,收集有酶活性的洗脱液,脱盐后制样品进行质量分数15%SDS-PAGE电泳分离,检测融合蛋白的纯度[8-9]。
1.3.3 酶活性的测定 按Boyer等人的方法测定酶活性[1]。
1.3.4 蛋白质浓度的测定 采用Bradford法进行蛋白质浓度的测定,以牛血清蛋白为标准蛋白质[10]。
1.3.5 3α-HSD酶的化学修饰 取10 mL,10 mmol/ L预先配制好的邻苯二甲酸酐溶液,与10 mL,1 mg/ mL 3α-HSD酶混合,在4℃下恒温磁力搅拌1 h,反应结束后,将反应液转入预先处理好的透析袋中,在4℃下,用20 mmol/L pH 7.5的磷酸缓冲液透析若干小时,以除去未参加反应的修饰剂[6]。
1.3.6 酶稳定性测定 将修饰酶和原酶分别与不同pH范围6.0~11.0磷酸缓冲液混合,25℃水浴30 min。将修饰酶和原酶分别在25、30、35、40、45、50、55、60℃水浴中保温10 min后测酶活。同时将修饰酶和原酶分别在37℃水浴中放置40 h,每隔一段时间取样,按1.3.3方法测酶活,计算相对残余酶活。以上每个样品的稳定性测定均做3次平行试验取平均值,并计算相对残余酶活[11]。
2 结果与讨论
2.1 融合蛋白3α-HSD的亲和纯化
pET28a作为载体所表达的重组蛋白在其N端有一个6个His组成的“标签”。故利用Ni2+-IDA琼脂糖作为亲和介质,组氨酸与Ni2+之间形成配位相互作用,选择性地将融合蛋白3α-HSD吸附在镍柱上,再用0.1~0.4 mol/L不同浓度咪唑进行洗脱,最终分离纯化出3α-HSD纯酶。
将Ni-IDA琼脂糖作为亲和介质装柱,平衡缓冲液平衡柱床,粗酶液上样后平衡缓冲液流洗至A280处吸光值为定值。用100、200、300、400 mmol/L不同浓度咪唑进行洗脱,蛋白洗脱曲线如图1所示。在0~50 min时间内,大部分杂蛋白没有吸附到亲和层析柱上,其他杂蛋白在51~90 min时间段随着低浓度咪唑的洗脱而被分离出来,而含有酶活的3α-HSD酶在90~104 min内被300 mmol/L浓度的咪唑洗脱下来。
收集3α-HSD纯化过程中的洗脱峰,测定3α-HSD酶活力及蛋白含量,计算比酶活及蛋白回收率,结果如表1所示:亲和纯化后3α-HSD酶蛋白得率是16.5%,活性回收率为64.7%,纯化倍数约为3.8。
取适量粗酶液经镍柱纯化后,将收集到纯酶制备样品,考马斯亮蓝染色后,进行质量分数15% SDS-PAGE凝胶电泳,结果如图2所示。从图中可以看出,300 mmol/L咪唑洗脱下来的3α-HSD为单一条带,相对分子质量在28 000左右,与文献[8]中报道一致。
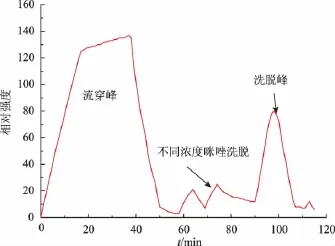
图1 3α-HSD酶的亲和纯化洗脱曲线Fig.1 Elution curve of affinity purification of 3α-HSD
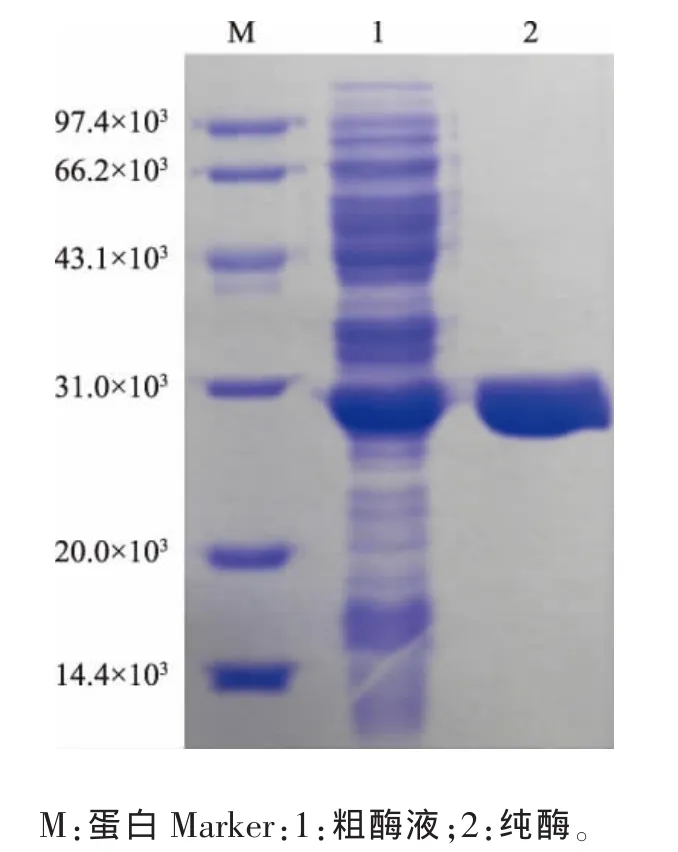
图2 纯酶的质量分数15%SDS-PAGE分析Fig.2 15%SDS-PAGE analysis of purified 3α-HSD
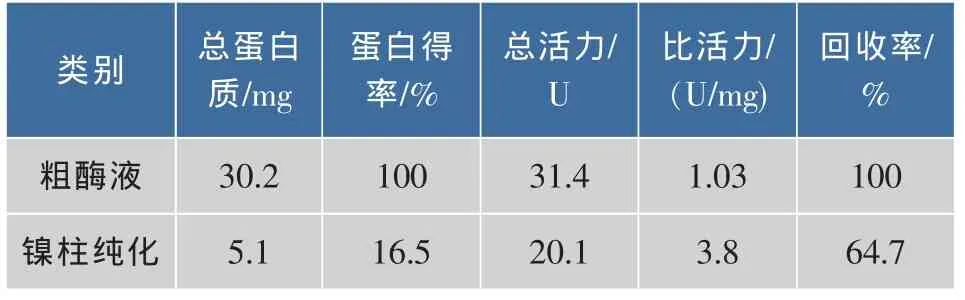
表1 3α-HSD酶的分离纯化结果Table1 Purification results of 3α-HSD
2.2 原酶与修饰酶的pH稳定性比较
通常,酶分子经过小分子化学修饰后,其耐酸耐碱能力会发生变化。图3显示化学修饰对3α-HSD的pH稳定性影响。与原酶相比较,修饰酶对pH波动表现了更好的抵抗能力。在pH=6和pH=7时,原酶的相对残余酶活低于20%,而在pH 6.0~11.0的范围内,修饰酶的相对残余酶活都大于50%。3α-HSD经邻苯二甲酸酐修饰后pH稳定性得到一定提高。
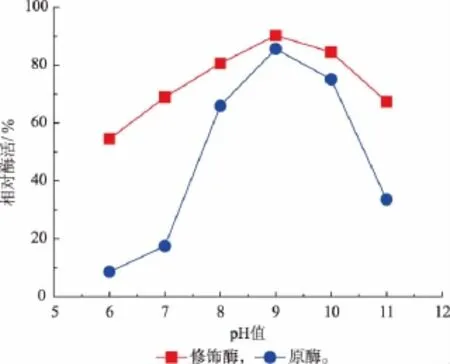
图3 3α-HSD原酶与修饰酶的pH稳定性比较Fig.3 pH stability comparison of native and PA modified 3α-HSD
2.3 原酶与修饰酶的热稳定性比较
由图4可知,在温度超过45℃时,修饰酶与原酶的相对残余酶活显著的降低。50℃水浴10 min后,原酶的相对残余酶活仅仅15.4%,而修饰酶的相对酶活值高达64.5%。60℃水浴10 min后,原酶完全失活,修饰酶有少量酶活。这与其他研究者报道的结果一致。如刘建忠[6]等人用邻苯二甲酸酐修饰辣根过氧化物酶(HRP)后热稳定性比原酶提高10倍。仝艳军[11]等人曾用EDC活化后的聚赖氨酸修饰肌氨酸氧化酶表面的羧基,能有效的提高该酶的热稳定性。
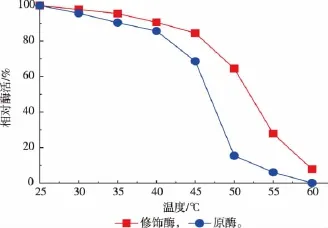
图4 3α-HSD原酶与修饰酶的热稳定性比较Fig.4 Thermal stability comparison of native and PA modified 3α-HSD
2.4 原酶与修饰酶的贮藏稳定性比较
原酶与修饰酶在37℃水浴中放置40 h,每隔一定时间取样测酶活。由图5可知,随着时间的延长,酶的活性呈下降趋势,但与原酶相比,修饰酶的酶活降低幅度小。当放置40 h时,修饰酶的酶活约是原酶酶活的9倍。
经邻苯二甲酸酐修饰后,3α-HSD的pH稳定性、热稳定性及贮藏稳定性得到不同程度的提高。这种现象可能是:邻苯二甲酸酐与酶表面赖氨酸Lys的氨基反应生成稳定的酰胺键,中和部分3α-HSD酶表面的电荷,使酶在水溶液中的稳定性提高。同时,中和部分电荷也减少酶分子内同种电荷间的排斥,使得酶分子形成更紧密的结构,对酶在酸碱条件下的稳定性有积极作用[12-13]。关于化学修饰提高酶稳定性的原因,也可能是酶分子与修饰剂之间共价连接后,使酶分子结构产生一定的“刚性”,而变得更加有序和致密,从而提高酶的稳定性[14]。
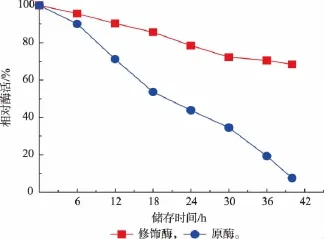
图5 3α-HSD原酶与修饰酶的贮藏稳定性比较Fig.5 Storage stability comparison of native and PA modified 3α-HSD
3 结语
重组菌株发酵培养、诱导表达后,镍柱亲和纯化分离得到3α-HSD纯酶。酶蛋白得率是16.5%,活性回收率为64.7%,纯化倍数约为3.8。采用邻苯二甲酸酐对纯酶进行化学修饰,稳定性试验结果表明,酶的pH稳定性、热稳定性及贮藏稳定性得到不同程度的提高。如修饰酶对pH波动表现了更好的抵抗能力。由此可见,邻苯二甲酸酐修饰是改善3α-HSD酶性质的一种温和、有效的方法。改善的酶学性质对3α-HSD酶在医药,环保等行业的应用有一定的促进作用。
[1]BOYER J,BARON D N,TALALY P.Purification and properties of a 3α-hydroxysteriod dehydrogenase from Pseudomnas testosteroni[J].Biochemistry,1965,4(19):1825-1833.
[2]张国华,丛爱日,徐国宾,等.3α-羟类固醇脱氢酶的表达、纯化和酶学性质研究[J].微生物学报,2004,44(4):496-499. ZHONG Guohua,CONG Airi,XU GuoBin,et al.Overexpression,purification and characterization of 3α-hydroxysteriod dehydrogenase in Escherichia coli[J].Acta Microbiologica Sinica,2004,44(4):496-499.(in Chinese)
[3]张国华,徐国宾,刘英民,等.睾酮丛毛单胞菌3α-羟类固醇脱氢酶基因的质粒载体构建及表达[J].生物化学与生物物理进展,2002,29(6):966-969. ZhANG Guohua,XU Guobin,LIU Yingmin,et al.Construction and overexpression of the plasmid vetor of 3α-hydroxysteriod dehydrogenase from Comamonas testosteroni[J].Prog Biochem and biophys,2002,29(6):966-969.(in Chinese)
[4]宋海燕,尹友谊.邻苯二甲酸酐化学修饰对辣根过氧化物酶催化活性的影响[J].分子催化,2009,23(5):465-469. SONG Haiyan,YIN Youyi.Effects of phthalic anhydride modification on horseradish peroxidase properties[J].Journal of Molecular Catalysis B:Enzymatic,2009,23(5):465-469.(in Chinese)
[5]HASSANI L.Chemical modification of horseradish peroxidase with caroxylic anhydrides:Effect of negative charge and hydrophilicity of the modifiers on thermal stability[J].Journal of Molecular Catalysis B:Enzymatic,2012,80:15-19.
[6]LIU J Z,SONG H Y,WENG L P,et al.Increased thermostability and phenol removal efficiency by chemical modified horseradish peroxidase[J].Journal of Molecular Catalysis B:Enzymatic,2002,18:225-232.
[7]张静,田亚平.丁二酸酐修饰对枯草芽孢杆菌氨肽酶结构及酶学特性的影响[J].食品与生物技术学报,2013,32(6):622-627. ZHANG Jing,TIAN Yaping.Chemical modification of the Bacillus subtilis aminopeptidase by succinic anhydride and its enzyme properties[J].Journal of Food Science and Biotechnology,2013,32(6):622-627.(in Chinese)
[8]MASTER E,XIONG G M.Functional expression,purification and characterization of 3α-hydroxy-steriod dehydrogenase/carbonyl reductase from Comamonastestosteroni[J].Biochemical and Biophysical research communications,2000,272:622-628.
[9]王亚,崔文璟,周丽,等.粘质沙雷氏菌马来酸顺反异构酶表达纯化及酶学性质 [J].食品与生物技术学报,2014,33(11):1204-1209 WANG Ya,CUI Wenjing,ZHOU Li,et al.Purification and characterization of maleate cis-trans isomerase from Serratia marcescens[J].Journal of Food Science and Biotechnology,2014,33(11):1204-1209.(in Chinese)
[10]BRAFORD M M.A rapid and sensitive method for the quantitation of mocrogram quatities of protein utilizing the principle of protein gye binding[J].Analytical Biochemistry,1976,72:248-254.
[11]TONG Y J,XIN Y,YANG H L,et al.Efficient improvement on stability of sarcosine oxidase via poly-lysine modification on enzyme surface[J].International Journal of Biological Macromoleculars,2014,67:140-146.
[12]SONG H Y,YAO J H,LIU J Z,et al.Effects of phthalic anhydride modification on horseradish peroxidase stability and structure [J].Enzyme and Microbial Technology,2005,36:605-611.
[13]XUE Y,WU C Y,NING X,et al.Chemical modification of stem bromelain with anhydride groups to enhance its stability and catalytic activity[J].Journal of Molecular Catalysis B:Enzymatic,2010,63(3-4):188-193.
[14]VILLALONGA R,TACHIBANA S,ASNA Y,et al.Increased conformational and thermal stability properties for phenylalanine dehydrogenase by chemical glycosidation with end-group activated dextran [J].Biotechnology Letters,2005,27(17):1311-1317.
Affinity Purification of 3α-Hydroxysteriod Dehydrogenase and Enzyme Stability Improvement by Chemical Modification
FANG Yanan, DUAN Jingxia, ZhANG Ling, YANG Hailin*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
The stability change of 3α-hydroxysteroid dehydrogenase(3α-HSD)after chemical modification was studied.The purified 3α-HSD was obtained by a induced expression of constructed genetic engineering bacteria E.coli BL21 (DE3)/pET28a-hsd at first and then by an affinity purification using Ni2+-Sepharose column with 16.5%of protein yield,64.5%of recovery yield and 3.8 times of specific activity.The SDS-PAGE (15%,reducing conditions)analysis showed that 3α-HSD was composed of a single polypeptide of~28 kDa.The chemical modification of 3α-HSD was done using phthalic anhydride(PA).After modification,the pH stability of 3α-HSD increased within pH 6.0~pH 11.0 compared with the control group and its heat stability significantly increased after incubation at 50℃for 10 min.When stored at 37℃for 40 h,the storage stability of modified 3α-HSD was improved about 9-fold than that of native enzyme.
3α-hydroxysteroid dehydrogenase,affinity purification,phthalic anhydride,chemical modification,stability
Q 55
A
1673—1689(2016)07—0747—05
2015-01-08
国家自然科学基金项目 (31301540;21306064);江苏省科技支撑计划项目 (BE2011625);江苏省自然科学基金项目(BK2012119)。
杨海麟(1971—),男,江苏无锡人,工学博士,副教授,主要从事发酵工程和酶工程研究。E-mail:673179850@qq.com

