榛子壳棕色素的分离纯化及其理化性质的研究
王金玲, 姚丽敏, 旷 慧
(东北林业大学 林学院,黑龙江 哈尔滨150040)
榛子壳棕色素的分离纯化及其理化性质的研究
王金玲, 姚丽敏, 旷 慧
(东北林业大学 林学院,黑龙江 哈尔滨150040)
在大孔树脂一次分离纯化榛子壳棕色素粗提液的基础上,选用D101大孔树脂对榛子壳棕色素进行二次分离纯化,通过单因素试验及正交试验优化大孔树脂二次分离纯化榛子壳棕色素的工艺,试验结果表明,上样质量浓度为22 mg/mL,上样流量为1.5 mL/min,洗脱剂(乙醇)体积分数为80%,洗脱流量为2.5 mL/min为最佳纯化条件。经D101二次分离纯化的榛子壳棕色素,色价从44提高到了82.6。对纯化后的榛子壳棕色素的理化性质进行研究,结果表明,该色素耐光性好,高温、色素溶液的pH对该色素的稳定性有一定的影响;Na+、Mg2+、K+、Ca2+对其稳定性影响小,Fe3+、Cu2+、Al3+、Zn2+对其稳定性有破坏作用;该色素对淀粉类、禽蛋类、肉类食品的着色性良好。
榛子壳;棕色素;纯化;理化性质
食用色素是使食品着色或改善食品色调和色泽的食品添加剂。尽管食品中色素含量甚微,但对食品质量品质的影响却非常大。随着对食品安全问题的重视,消费者对合成色素的安全性问题越来越担心,因而天然色素的研究、开发和应用成为持续热点。榛子壳中富含类黄酮棕色素[1],具有抗衰老、降脂、美容、养颜、减肥等重要的生理活性功能,可应用于食品、药品、化妆品等行业[2-5]。榛子壳是榛子加工后的主要下脚料,由于其具有坚硬、难溶于水等特性,处理起来很困难,作为废物丢弃,因此,应该加强对榛子壳的利用,增加其经济价值,将其变废为宝,不仅避免了资源的浪费,也避免了污染环境等问题。近年来,对榛子壳棕色素的提取已有报道[6-7],但对于榛子壳棕色素的纯化工艺及理化性质方面研究较少。
作者旨在经大孔树脂对榛子壳棕色素进行进一步的分离纯化,得到最佳纯化工艺及纯度较高的榛子壳棕色素,并对其理化性质进行研究,以期为榛子壳棕色素的工业化生产提供理论指导。
1 材料与方法
1.1 材料、试剂及仪器
材料:毛榛子(Corylus mandshurica Maxim.),购自伊春市五营林业局。手工去仁,榛子壳烘干粉碎,备用。
试剂:无水乙醇、氢氧化钠、盐酸、氯化钠、氯化钾、氯化钙等均为国产分析纯。
试验设备:ALC-1104分析天平:北京赛多利斯仪器系统有限公司产品;RE-52A旋转蒸发仪:上海亚荣生化仪器厂产品;UV-1200紫外可见分光光度计:上海精密科学仪器有限公司产品;DFC-6053型真空干燥箱:上海一恒科技有限公司产品;DK-S12型电热恒温水浴锅:上海森信实验仪器有限公司产品;DL-6M低速离心机:湖南星科科学仪器有限公司产品;PHS-3C型pH计:上海伟业仪器厂产品。
1.2 试验方法
1.2.1 榛子壳棕色素粗提液的制备 参照文献制得榛子壳棕色素粗提液[8]。
1.2.2 榛子壳棕色素的制备 将充分活化的D101树脂装于柱中(3 cm×50 cm),在样液pH=4.0,上样质量浓度为30 mg/mL,饱和吸附量为12.23 mg/mL(树脂),上样流量为1.5~2.0 mL/min,洗脱剂为体积分数70%的乙醇,洗脱流量为1.5~2.0 mL/min条件下,进行大孔树脂对榛子壳棕色素粗提液的一次纯化,制得榛子壳棕色素纯物,测定其色价,计算公式如下[9]:E=A×R/m
式中,A为吸光度;m为100 mL被测溶液中所含样品的质量(g);R为100 mL溶液稀释至上机测试的稀释倍数;E表示样品质量分数为1%,1 cm比色皿测得的色价值。
1.2.3 榛子壳棕色素最大吸收波长的确定 根据分光光度法,将榛子壳棕色素纯物溶液在200~500 nm区间进行扫描,确定色素吸收波长。
1.2.4 大孔树脂对榛子壳棕色素的二次纯化
1)分离柱的准备 将充分活化的150 mL大孔树脂湿法装于分离柱(3 cm×50 cm)中,在不同的上样条件下,使榛子壳棕色素纯物溶液通过分离柱,直至样液全部流出后,用蒸馏水冲洗树脂至流出液为无色,随后在相应的洗脱条件下进行洗脱,收集富集了榛子壳棕色素的洗脱液。
2)单因素试验 选择上样浓度、上样流量、洗脱剂(乙醇)体积分数、洗脱流量为试验的单因素,单因素试验水平见表1。采用渐变式优化法,初始大孔树脂二次纯化榛子壳棕色素的条件为上样质量浓度为20 mg/mL(吸光值为1.573),上样体积为200 mL,上样流量为2.0 mL/min,洗脱剂(乙醇)体积分数为65%,洗脱流量为2.0 mL/min,收集流出液,每5mL一管,以大孔树脂在不同纯化条件下的饱和吸附量确定最佳上样质量浓度,以树脂在不同纯化条件下的吸附曲线确定最佳上样浓度,以树脂在不同纯化条件下的解吸曲线确定最佳洗脱剂 (乙醇)体积分数、洗脱流量。饱和吸附量计算公式如下:饱和吸附量=色素质量(mg)/湿树脂体积(mL)[10]。
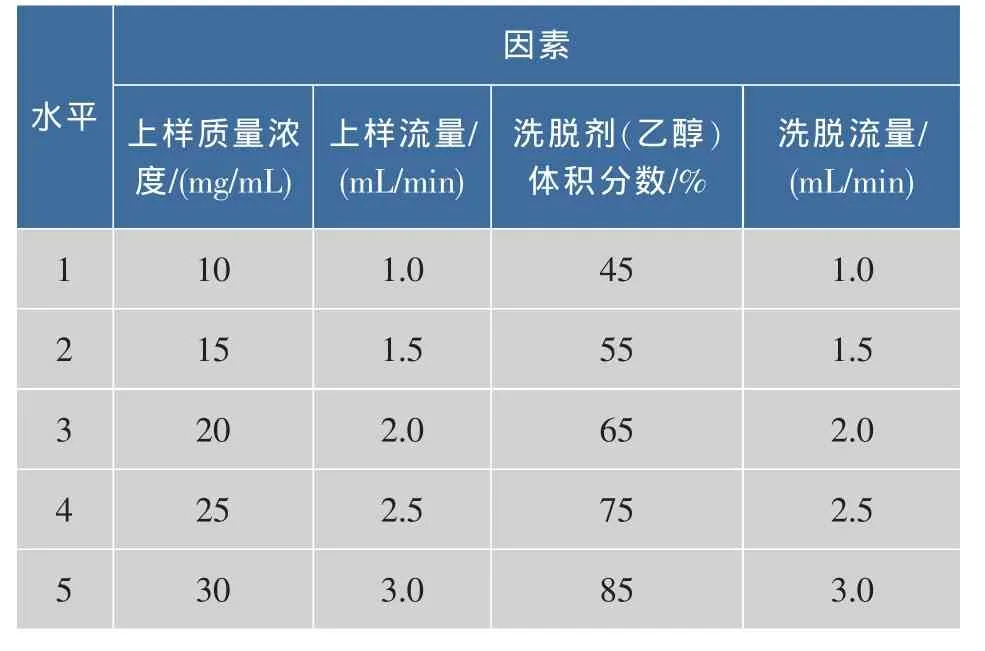
表1 单因素试验因素及水平表Table1 Factors and levels of single-factor experiments
3)正交试验 在单因素试验的基础上,对D101树脂二次纯化榛子壳棕色素的工艺进行优化。以上样质量浓度,上样流量,洗脱剂(乙醇)体积分数,洗脱流量为因素,进行4因素3水平正交试验,以纯化后的色价为指标,确定大孔树脂二次纯化榛子壳棕色素的工艺条件,优化D101树脂二次纯化榛子壳棕色素的工艺条件的因素水平见表2。
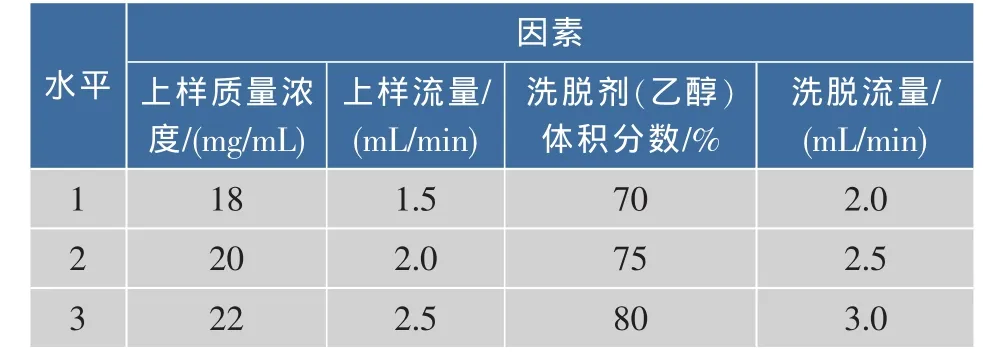
表2 正交试验因素及水平表Table2 Factors and levels of orthogonal tests
1.2.5 纯化后的榛子壳棕色素的理化性质的研究
1)色素的耐光、耐热性试验 将50 mL质量浓度为5 mg/mL的榛子壳棕色素水溶液分别在避光、室内散射光、室外自然光条件下处理4 d,每隔12 h测定其吸光值;在不同温度(50、70、90℃)下处理24 h,观察颜色变化[11],每隔4 h测定色素溶液的吸光值。
2)色素的耐酸碱性试验 采用柠檬酸、磷酸氢二钠等溶液配制不同pH的缓冲溶液,作为色素pH稳定性试验的缓冲液。分别量取1 mL质量浓度为50 mg/mL的色素水溶液和10 mL对应pH的缓冲液,充分混合,每隔12 h测定色素溶液的吸光值。
3)金属离子对色素的稳定性的影响试验 配制质量浓度为5 mg/mL的榛子壳棕色素水溶液,向50 mL的色素溶液中分别加入5 mL的200 mg/L的NaCl、KCl、CaCl2、FeCl3、CuSO4、MgSO4、Al2(SO4)3、ZnSO4水溶液,放置4 d,考察金属离子对色素稳定性的影响[12]。
4)色素的着色力试验 将相同质量的米饭和白面馒头、鸡蛋蛋白,黄豆、鸡脯肉、花生分别置于200 mL浓度为5 mg/mL的榛子壳棕色素溶液中,于室温下浸泡2 d,观察榛子壳棕色素的着色效果[13],同时,测定残留液的吸光值。
1.3 数据处理与分析
每个试验3次重复,数据以平均值±标准误差显示数,据采用Excel软件进行分析处理并作图。
2 结果与分析
2.1 榛子壳棕色素一纯物吸收波长的测定
在200~500 nm的波长范围内对提取液进行扫描,在235 nm处有最大吸收,因此选择235 nm为测定波长。
2.2 大孔树脂对榛子壳棕色素的二次纯化
2.2.1 上样质量浓度对纯化效果的影响 上样质量浓度对纯化效果的影响如图1。
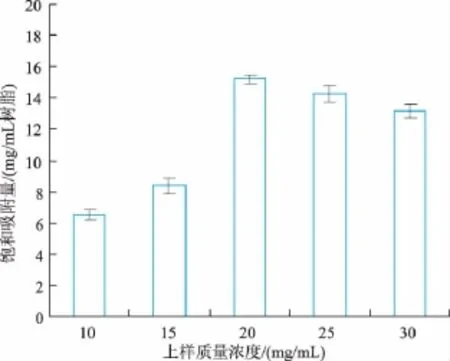
图1 不同上样质量浓度时的饱和吸附量Fig.1 Adsorption capacity at different sample concentrations
由图1可知,树脂饱和吸附量随着上样质量浓度的增加而增加,当上样质量浓度增加到20 mg/mL时,饱和吸附量达到最大值;但在上样量继续增大时,树脂的饱和吸附量呈降低趋势,其原因可能是随着料液浓度的提高,与色素竞争吸附的杂质量也随之增加,影响了色素等物质在树脂内部的扩散[14],作者认为最佳上样质量浓度为20 mg/mL。
2.2.2 上样流速对纯化效果的影响 上样流量对纯化效果的影响如图2所示。
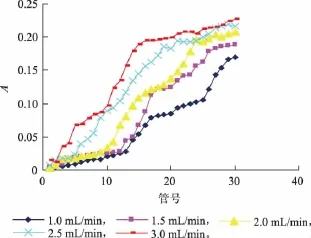
图2 不同上样流量对纯化效果的影响Fig.2 Effect of different flowing velocities on purification
由图2可知,当上样流量为2.5~3.0 mL/min时,当管号为15时就已经到达泄露点,色素溶液与树脂接触时间短,这不利于树脂很好地吸附色素,吸附效率大大下降,也造成了物料的浪费;流速过慢,操作时间长,也降低了工作效率。由图可见,样液上样流量控制在1.5~2.0 mL/min效果最佳,考虑到树脂的工作效率,最佳上样流量为2.0 mL/min。
2.2.3 洗脱剂(乙醇)体积分数对纯化效果的影响洗脱剂(乙醇)体积分数对纯化效果的影响如图3所示。
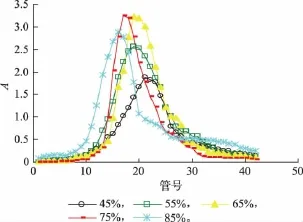
图3 洗脱剂(乙醇)体积分数对纯化效果的影响Fig.3 Effect of different ethanol concentrations on purification
由图3可知,随着乙醇体积分数的增加,解吸效果逐渐变好,当乙醇体积分数达到75%时,解吸曲线不仅峰形窄,对榛子壳棕色素的富集效果好,而且,无拖尾现象;体积分数太高的乙醇,解吸能力太强,会将非色素成分解吸下来[15],影响纯度,从而影响后续试验的进行。因此,作者认为75%为最佳洗脱剂体积分数。
2.2.4 洗脱流量对纯化效果的影响 洗脱流量对纯化效果的影响如图4所示。
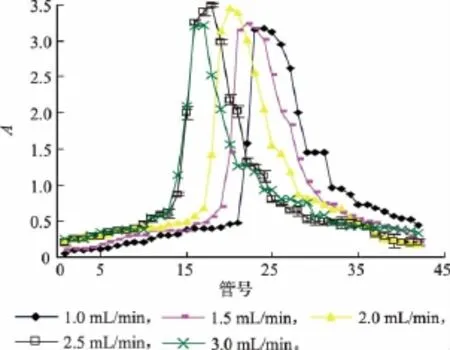
图4 洗脱流量对纯化效果的影响Fig.4 Effect of different eluting velocities on purification
由图4可知,随着洗脱的进行,流出液中榛子壳棕色素的质量浓度升高到最大以后,又迅速降低,此时已收集到大部分色素,当流出液为无色时,说明洗脱已完成。当洗脱流速较大时,如2.5~3.0 mL/min,对洗脱出的色素溶液富集效果较好,但是当流量达到3.0 mL/min时,对榛子壳棕色素的纯化效果有所降低;当流量过低时,有一定的拖尾现象,不利于榛子壳棕色素的富集。当洗脱流量为2.5 mL/ min时,不仅对榛子壳棕色素有富集效果,并且榛子壳棕色素的吸光值明显提高,因此,洗脱流量为2.5 mL/min时,洗脱效果最佳。
2.2.5 正交试验优化大孔树脂二次纯化榛子壳棕色素的工艺条件 将大孔树脂一纯后色价为44的榛子壳棕色素进行二次纯化,大孔树脂二次分离纯化榛子壳棕色素的正交试验的结果及极差分析如表3所示。
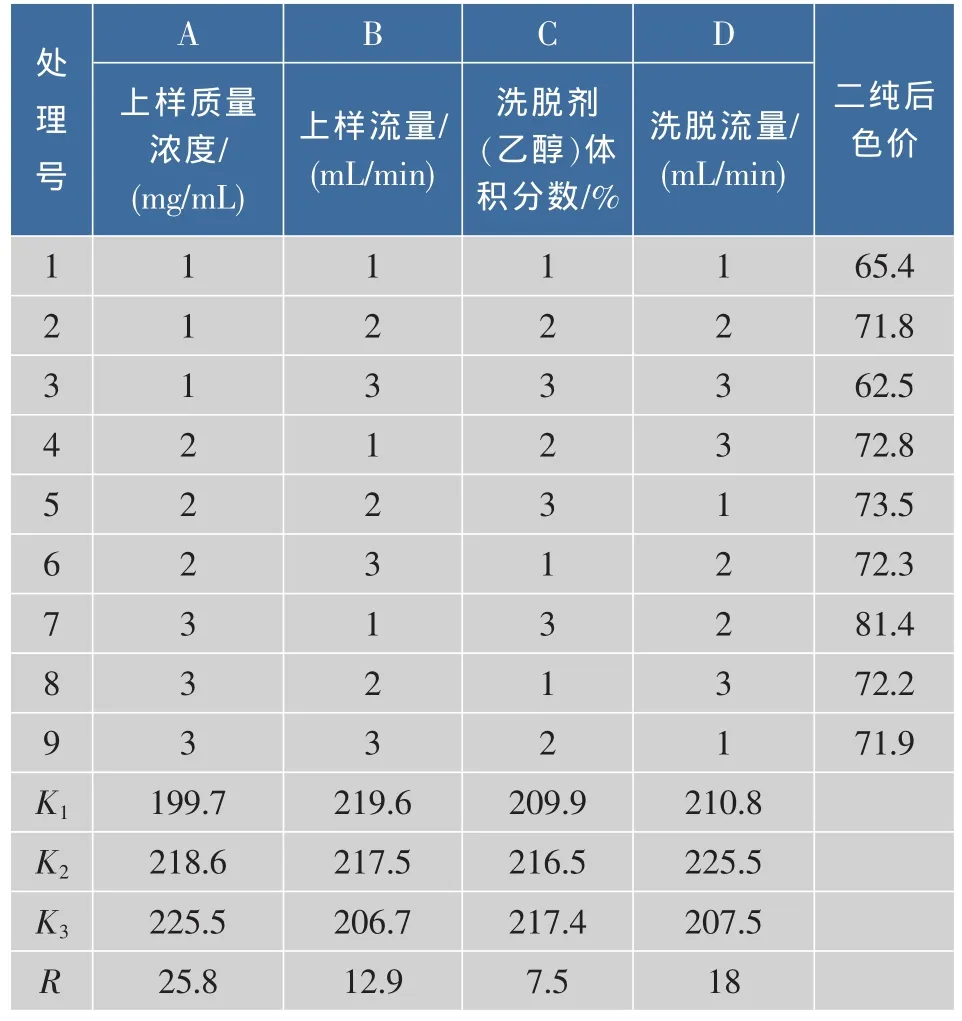
表3 正交试验设计及结果Table3 Design and results of orthogonal tests
根据试验结果中的R值可知上样质量浓度对大孔树脂纯化榛子壳棕色素的影响最大,其次为洗脱流量,洗脱剂(乙醇)体积分数的影响最小,因此,上样质量浓度为主要因素,洗脱剂(乙醇)体积分数为次要因素。根据分析结果,作者认为最佳因素水平为A3B1C3D2即上样质量浓度为22 mg/mL,上样流量为1.5 mL/min,洗脱剂(乙醇)体积分数为80%,洗脱流量为2.5 mL/min。在此正交试验结果的基础上进行了验证试验,证明了该条件下榛子棕色素的色价明显提高,可达82.6,与试验中第7个处理的试验结果相符。
2.3 纯化后的榛子壳棕色素的理化性质的研究
2.3.1 二次纯化后榛子壳棕色素吸收波长的测定榛子壳中棕色素的含量较为丰富,用上述试验所确定的最佳纯化条件对榛子壳棕色素进行分离纯化,进行纯化前后光谱扫描,结果如图5所示。
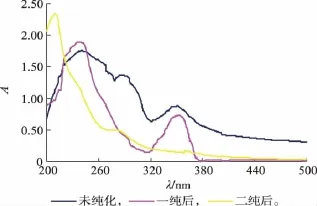
图5 光谱扫描曲线Fig.5 Spectral scanning curves
由图5可知,二次纯化后的色素溶液在220~380 nm的范围内吸收大大降低,纯化后的榛子壳棕色素的纯度有了一定程度的提高,但是其最大吸收峰前移,为208 nm,可能是榛子壳棕色素的主要成分被杂质覆盖,在二次纯化中去除了榛子壳棕色素一纯物中的大量杂质,因此其最大吸收峰前移,具体原因有待下一步试验的研究。
2.3.2 色素的耐光性试验 榛子壳棕色素耐光性的试验结果见图6。
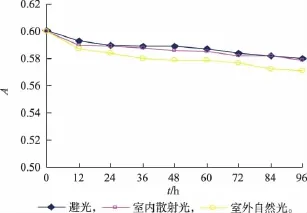
图6 光照对色素稳定性的影响Fig.6 Effect of light on stability of pigment
由图6可知,光照对榛子壳棕色素水溶液影响比较小。通过在室内散射光、避光处理4 d的榛子壳棕色素,肉眼观察到色素水溶液颜色没有发生改变,在室外自然光处理了4 d的榛子壳棕色素,吸光值略有降低,因此初步判断榛子壳棕色素具有一定的耐光性,但考虑到榛子壳棕色素的最佳储存稳定性,最好避光保存。
2.3.3 色素的耐热性试验 榛子壳棕色素的耐热性试验结果见图7。
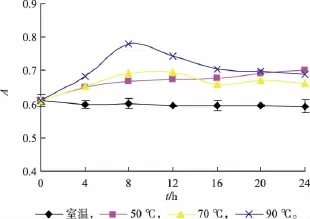
图7 温度对色素稳定性的影响Fig.7 Effect of temperature on stability of pigment
由图7可知,温度对榛子壳棕色素的稳定性有一定的影响。随着加热温度的提高和加热时间的延长,色素水溶液的颜色略有加深,但溶液均一稳定,无沉淀产生。随着温度的升高,色素水溶液的吸光值逐渐提高,但是随着时间的延长,其吸光值又呈下降趋势,可能是色素的内部结构发生了变化[16]。因此,高温对榛子壳棕色素的稳定性有一定的影响。
2.3.4 色素的耐酸碱性试验 榛子壳棕色素的耐酸碱性试验结果见图8。
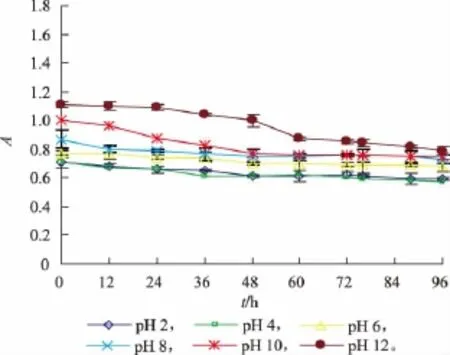
图8 色素溶液pH值对其稳定性的影响Fig.8 Effect of pH on stability of pigment
由图8可知,色素溶液的pH对榛子壳棕色素的稳定性有一定的影响。随着色素溶液pH的增加,色素溶液的吸光值呈增大趋势,且颜色逐渐加深,但是随着处理时间的延长,其吸光值有所下降;在酸性条件下,其吸光值比较稳定,但是其颜色略微变浅,呈浅褐色,可能是因为pH的变化,造成了色素的分解[17-18],进而影响色素溶液的颜色及其吸光值,因此色素溶液的pH对其稳定性有一定的影响,至于色素溶液的pH对色素稳定性的影响机制,需进一步试验的研究。
2.3.5 金属离子对色素的稳定性的影响试验 金属离子对色素稳定性的影响试验结果如表4所示。
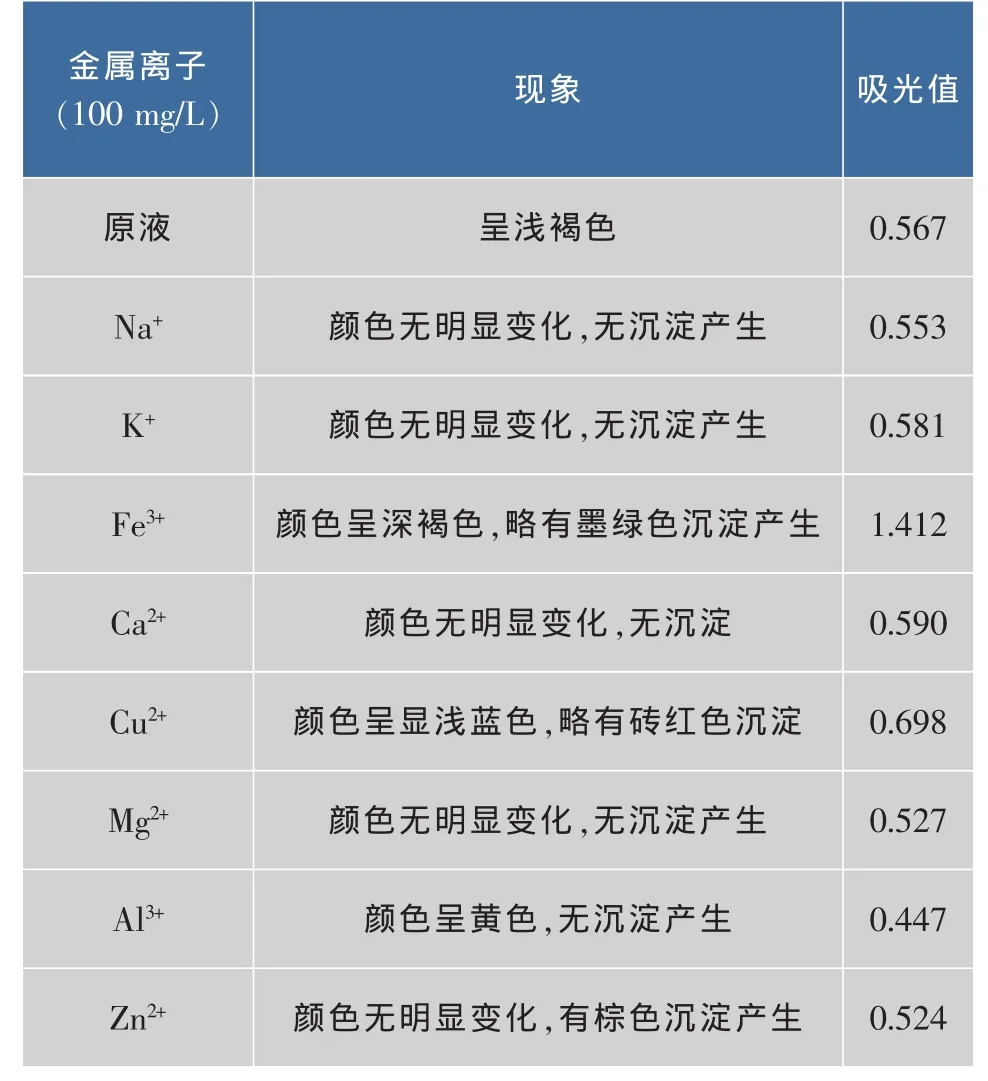
表4 金属离子对色素稳定性的影响Table4 Effect of metal ions on stability of pigment
由表4可知,榛子壳棕色素对试验中的部分金属离子比较稳定,但是对Fe3+,Cu2+,Al3+,Zn2+比较敏感,尤其是 Fe3+,使榛子壳棕色素的吸光值明显增加,同时有沉淀产生,因此,在使用及保存榛子壳棕色素的过程中,应避免与铁制品,铜制品,铝制品,锌制品接触。
2.3.6 色素的着色力试验 色素的着色力试验结果如表5所示。榛子壳棕色素对淀粉类有良好的着色力,对禽蛋类,肉类,豆类也有较好的着色力,但是对油料类的着色力较差,对残留液测定吸光值,其结果与感官结果相符合,因此,榛子壳棕色素更适用于淀粉类,禽蛋类及肉类食品的着色。

表5 色素对不同种类的食物的着色力Table5 Coloring power of pigment on different types of food
3 讨论与结论
经试验可知,用D101大孔树脂对榛子壳棕色素进行二次分离纯化的最佳工艺条件为:上样质量浓度为22 mg/mL,上样流量为1.5 mL/min,洗脱剂(乙醇)体积分数为80%,洗脱流量为2.5 mL/min。经D101二次分离纯化的榛子壳棕色素,色价从44.0提高到了82.6。试验中发现,当上样浓度小时,树脂的饱和吸附量低,影响了树脂的工作效率,但是上样浓度过大时,树脂的饱和吸附量会下降,因此,应该通过试验选择最佳的上样质量浓度;但是对于质量浓度对吸附的影响,文献报道不尽相同,尹忠平等[10,19]认为浓度越大对吸附越有利;而陈守江等[20]认为浓度的影响不大;上官新晨等认为质量浓度越低越好,这可能是各个试验的条件和色素性质不同引起的[21]。
对纯化后的榛子壳棕色素的理化性质进行研究,该色素耐光性好,高温、色素溶液的pH对该色素的稳定性有一定的影响;Na+、Mg2+、K+、Ca2+对其稳定性影响小,Fe3+、Cu2+、Al3+、Zn2+对其稳定性有破坏作用;该色素对淀粉类、禽蛋类、肉类食品的着色性良好。除此之外,试验中发现,榛子壳棕色素对低浓度的H2O2有一定的耐受性,但是对亚硫酸氢钠的耐受性较差。
温度对色素稳定性的影响的研究中,大部分试验结果表明,温度的升高增加了色素的降解作用,色素的吸光值呈现降低趋势[22-24],作者试验中发现,榛子壳棕色素的吸光值随着温度的升高呈现了增大的趋势,并且对榛子壳棕色素有一定的增色作用,更有利于其在食品加工中的应用,关于其增色的机理,尚需进一步研究。
对于溶液pH对色素稳定性的影响,大部分试验结果表明,棕色素在碱性条件下颜色加深,且吸光值有所波动,在酸性条件下,吸光值更加稳定;如周萍等[25]对泡核桃壳棕色素的研究发现,溶液pH小于6.0时,色素吸光值保持稳定,溶液pH大于6.0时,色素的吸光值随pH的增大而增大;肖凯军等[26]对金樱子棕色素的研究发现,色素溶液吸光值随色素溶液的pH增大而升高,这与作者研究结果相似;也有一部分试验的结果表明,棕色素在碱性条件下的吸光值更加稳定[27];如李莉对板栗壳棕色素的稳定性的研究发现,色素溶液在pH为3~7时,其吸光值变化很大,在pH为7~10时,其吸光值比较稳定;但是关于pH对色素稳定性影响的机理研究未见报道。
在色素溶液中添加了FeCl3、CuSO4水溶液后,分别生成了墨绿色及砖红色的沉淀,说明该色素有较强的还原能力,因此在食品加工过程中,可以与抗氧化剂协同,或者可以作为天然抗氧化剂,利于其在食品加工中的应用。
目前,对于棕色素对不同种类的食物的着色力的研究鲜有报道,作者试验中发现,榛子壳棕色素对淀粉类、肉类等有良好的着色力,因此,可以将该色素揉进面团里,制作棕色馒头,也可以用榛子壳棕色素溶液浸泡大米,肉类等,对其着色,增加人们的食欲的同时还有保健作用。
目前已有人在研究榛子壳棕色素的稳定性及其抗氧化性[28],这说明纯化后的榛子壳棕色素不仅可以作为天然色素使用,还有可能在医学,食品,化妆品行业发挥广泛作用。
[1]王静.榛子壳色素提取、纯化及性质研究[D].哈尔滨:东北林业大学,2010.
[2]李德海,刘荣,孙常雁,等.提取条件对榛子壳提取物抗氧化活性的影响[J].中国酿造,2011(12):126-129. LI Dehai,LIU Rong,SUN Changyan,et al.Effects of extraction conditions on antioxidant activity of hazelnut shell extract[J]. China Brewing,2011(12):126-129.(in Chinese)
[3]付学军.洋葱功能成分及其应用研究[D].济南:山东大学,2006.
[4]MIDDLETON Jr E,KANDASWAMI C.Effects of flavonoids on immune and inflammatory cell functions[J].Biochemical Pharmacology,1992,43(6):1167-1179.
[5]SINGH S,KAUR R,SSHARMA S K.An updated review on the Oenothera genus[J].Journal of Chinese Integrative Medicine,2012,10(7):717-720.
[6]赵玉红,王静,金秀明.超声波辅助酶法提取榛子壳色素工艺条件的研究[J].中国调味品,2010,35(4):110-113. ZHAO Yuhong,WANG Jing,JIN Xiuming.Study on optimization of ultrasonic-assisted enzymatic extraction of hazelnut shells pigment[J].China Condiment,2010,35(4):110-113.(in Chinese)
[7]王金玲,傅伟,王振宇,等.化学预处理法提取榛壳棕色素条件的响应面优化[J].东北农业大学学报,2010,41(8):110-114. WANG Jinling,FU Wei,WANG Zhenyu,et al.Optimization of pre-treatment conditions of hazelnut shell to extract brown pigment using response surface methodoIoy[J].Journal of Northegst Agricultural University,2010,41(8):110-114.(in Chinese)
[8]王振宇,王金玲.一种榛子壳棕色素的制备方法:中国,201010102780.2[P].2010-08-11.
[9]李颖畅,郑凤娥,孟宪军.大孔树脂纯化蓝莓果中花色苷的研究[J].食品与生物技术学报,2009,28(4):497-498. LI Yingchang,ZHENG Fenge,MENG Xianjun.Studies on purification of anthocyanins from blueberry fruits by macroporous resins[J].Journal of Food Science and Biotechnology,2009,28(4):497-498.(in Chinese)
[10]邹阳,张秀玲,石岳.AB-8大孔吸附树脂对蓝莓色素吸附和分离的特性研究[J].中国食品添加剂,2007(1):80-82. ZOU Yang,ZHANG Xiuling,SHI Yue.Adsorption and separation properties of blueberry pigment on AB-8 resin[J].China Food Additives,2007(1):80-82.(in Chinese)
[11]李永强,张玉娜,王明珍,等.白刺果实色素的提取及理化性质研究[J].山东农业大学学报:自然科学版,2005,36(1):65-81. LI Yongqiang,ZHANG Yuna,WANG Mingzhen,et al.Pigment extraction from fruits of Nitraria sibirica fruit and its physical and chemical properties[J].Journal of Shandong Agricultural University:Natural Science,2005,36(1):65-81.(in Chinese)
[12]李文鹏.黑加仑果渣中花青素的提取及特性研究[D].哈尔滨:东北农业大学,2008.
[13]许磊.乌饭树色素的提取及理化性质研究[D].郑州:河南工业大学,2006.
[14]陈美红,徐玉娟,李春美.NKA大孔树脂分离纯化桑椹红色素的研究[J].食品科技,2007,32(10):178-182. CHEN Meihong,XU Yujuan,LI Chunmei.Separation and purification of mulberry red pigment by NKA macroporous resin[J]. Food Science and Technology,2007,32(10):178-182.(in Chinese)
[15]高丽,邓青云,姜益泉,等.HPD-400大孔吸附树脂分离纯化栀子黄色素的研究[J].中国调味品,2011,36(8):111-113. GAO Li,DENG Qingyun,JIANG Yiquan,et al.Study on the absorption and purification of gardenia yellow pigment by macro-porous resin HPD-400[J].China Condiment,2011,36(8):111-113.(in Chinese)
[16]胥秀英,王阿丽,郑一敏,等.山竹果壳中红色素的提取及其应用研究[J].现代食品科技,2006,22(3):173-174. XU Xiuying,WANG Ali,ZHENG Yimin,et al.The extraction of red pigment from garcinia mangostana and its application[J]. Modern Food Science and Technology,2006,22(3):173-174.(in Chinese)
[17]KOCA N,KARADENIZ F,BURDURLU H S.Effect of pH on chlorophyll degradation and colour loss in blanched green peas[J]. Food Chemistry,2007,100(2):609-615.
[18]FRANCIELO V,BRUNA L M,DENISE E M,et al.Thermal stability of natural pigments produced by Monascus ruber in submerged fermentation[J].Biocatalysis and Agricultural Biotechnology,2013,1(2):278-284.
[19]尹忠平,洪艳平,徐明生.大孔树脂吸附纯化粗提玫瑰茄红色素研究[J].江西农业大学学报,2007,29(6):1028-1029. YIN Zhongping,HONG Yanping,XU Mingsheng.A study on refining of crude extraction of roselle calyx red pigment by Macroporous Resin[J].Acta Agriculturae Universitatis Jiangxiensis,2007,29(6):1028-1029.(in Chinese)
[20]陈守江,姜松.果蔬中的酚类化合物及其抗氧化作用[J].安徽技术师范学院学报,2003,17(2):144-148. CHEN Shoujiang,JIANG Song.Phenolic compounds and their antioxidant activity in fruits and vegetables[J].Journal of Anhui Technical Teachers College,2003,17(2):144-148.(in Chinese)
[21]上官新晨,沈勇根,徐明生,等.大孔树脂对紫红薯色素吸附和解吸的特性研究[J].食品科技,2006,31(7):119-120. SHANGGUAN Xincheng,SHEN Yonggen,XU Mingsheng,et al.Adsorption and desorption properties of purple ipomoea batatas on macroporous resin[J].Food Science and Technology,2006,31(7):119-120.(in Chinese)
[22]李昌伟,蔡宇杰,廖祥儒,等.镰刀霉菌(Fusarium sp)JN158紫色素的提取及理化性质[J].食品与生物技术学报,2011,30 (1):139-141. LI Changwei,CAI Yujie,LIAO Xiangru,et al.Study on extraction and the physicochemical property of purple pigment from Fusarium sp.JN158[J].Journal of Food Science and Biotechnology,2011,30(1):139-141.(in Chinese)
[23]MOHAMMAD N K,MURIEL R,STEPHEN G Y,et al.Surface chemical analysis of the effect of curing conditions on the properties of thermally-cured pigment printed poly(lactic acid)fabrics[J].Dyes and Pigments,2013,103:168-173.
[24]MATHILDE M,SEBASTIEN J,ALVA W,et al.Physicochemical factors affecting the stability of two pigments:R-phycoerythrin of Grateloupia turuturu and B-phycoerythrin of Porphyridium cruentum[J].Food Chemistry,2014,150(1):400-407.
[25]周萍,许兴景,王敏,等.泡核桃壳棕色素的提取和稳定性研究[J].安徽农业科学,2011,39(7):3912-3913. ZHOU Ping,XU Xingjing,WANG Min,et al.Study on the extraction and stability of brown Pigment from the shell of Juglans sigillata[J].Journal of Anhui Agricultural Sciences,2011,39(7):3912-3913.(in Chinese)
[26]肖凯军,熊璞.金樱子棕色素的提取纯化新工艺的研究[J].食品工业科技,2010(1):242-243. XIAO Kaijun,XIONG Pu.Study of new technology of extraction and purification of brown pigment from Rosa laevigata Michx [J].Science and Technology of Food Industry,2010(1):242-243.(in Chinese)
[27]李莉.板栗壳棕色素提取及相关性质研究[D].北京:北京林业大学,2011.
[28]陶希婧,苏明升,刘言佳,等.榛子壳棕色素的提取及抗氧化活性和抑菌性的研究[J].中国食品添加剂,2013(2):116-120. TAO Xijing,SU Mingsheng,LIU Yanjia,et al.The extraction of brown pigment from hazelnut shells and its antioxidation and antibacterial activities[J].China Food Additives,2013(2):116-120.(in Chinese)
Purification and Characterization of Brown Pigment from Hazelnut Shells
WANG Jinling, YAO Limin, KUANG Hui
(School of Forestry,Northeast Forestry University,Harbin 150040,China)
On the basis of the preparatory purification of brown pigment from hazelnut shells with macroporous resin,the further purification with D101 resin was studied through single-factor and orthogonal experiments.The optimal parameters were found to be sample concentration of 22 mg/mL,velocity of 1.5 mL/min,eluting ethanol of 80%and velocity of 2.5 mL/min,which resulted in an increase of color value of the pigment from 44 to 82.6.The high temperature and the solution pH affected the stability of obtained brown pigment but light had no effect;fetal ions Fe3+,Cu2+,Al3+and Zn2+decreased its stability but Na+,Mg2+,Ca2+and K+had no effects;it efficiently colored starchy foods,eggs and meet.
hazelnut shells,brown pigment,purification,physicochemical properties
TS 202.3
A
1673—1689(2016)07—0770—08
2015-01-12
黑龙江省青年科学基金项目(QC2012C118)。
王金玲(1975—),女,黑龙江绥化人,工学博士,副教授,主要从事天然活性物质研究。E-mail:wangjinling08@163.com

