3种方法测定替加环素对鲍曼不动杆菌的体外药敏结果比较
郑 薇, 许 颖, 凌保东
(1.成都医学院 结构特异性小分子药物研究实验室,四川 成都 610500;2.成都医学院 第一附属医院,四川 成都610513;3.四川省疾病预防控制中心,四川 成都610041)
3种方法测定替加环素对鲍曼不动杆菌的体外药敏结果比较
郑 薇1,3, 许 颖2, 凌保东*1
(1.成都医学院 结构特异性小分子药物研究实验室,四川 成都 610500;2.成都医学院 第一附属医院,四川 成都610513;3.四川省疾病预防控制中心,四川 成都610041)
比较替加环素对鲍曼不动杆菌的体外药敏试验不同方法之间的差异。分别采用微量肉汤稀释法、琼脂稀释法和K-B法测定119株临床分离鲍曼不动杆菌对替加环素的敏感性,比较不同检测方法结果的差异。微量肉汤稀释法MIC500.5 μg/mL、MIC901 μg/mL,FDA/EUCAST的耐药率0.0%(0/119)/0.0%(0/119),中介率0.0%(0/119)/5.0%(6/119),敏感率100%(119/119)/95.0% (113/119);琼脂稀释法MIC501 μg/mL、MIC904 μg/mL,FDA/EUCAST耐药率 11.7%(14/119)/ 45.4%(54/119),中介率33.6%(40/119)/21.0%(25/119),敏感率54.7%(65/119)/33.6%(40/119);K-B法Jone/EUCAST的敏感率47.1%(56/119)/31.9%(38/119)、中介率48.74%(58/119)/31.9% (38/119),耐药率4.2%(5/119)/36.2%(43/119)。替加环素对鲍曼不动杆菌体的外药敏实验中,微量肉汤稀释法、琼脂稀释法和K-B法之间存在差异。以微量肉汤稀释法为参考方法,MH琼脂稀释法总误差41.2%~60.5%,K-B法总误差47.9%~63.9%。
鲍曼不动杆菌;最低抑菌浓度;纸片扩散法;替加环素
近年来替加环素治疗多重耐药 (Multi-drug resistance,MDR)革兰阴性菌感染特别是对碳氢酶烯类耐药的鲍曼不动杆菌的感染取得了较好的疗效。替加环素2012年在中国批准上市后迅速成为临床和科研关注的焦点。替加环素(Tigecycline,TGC)是半合成米诺环素的衍生物,属于甘酰胺环素(Glycylcycline)类抗生素。随着替加环素在临床使用的不断增加,检验科室需要提供更加准确的药敏结果指导临床用药。选择美国临床和实验室标准协会(CLSI)[1]药敏检测推荐的方法:微量肉汤稀释法(BDM)、琼脂稀释法(ADM)和K-B法,检测鲍曼不动杆菌对替加环素的敏感性,为TGC对鲍曼不动杆菌药敏实验的选择和结果解释提供参考。
1 材料与方法
1.1 菌种
1.1.1 标准株 铜绿假单胞菌ATCC27853,大肠埃希菌ATCC25922,购自卫生部临床检验中心;鲍曼不动杆菌ATCC19606购自美国ATCC菌种库。
1.1.2 临床分离株 119株鲍曼不动杆菌,2012年9月至2013年9月分离于成都医学院第一附属医院痰液、灌洗液、脑脊液、胸水和咽拭子等不同患者的临床标本,所有菌株经法国生物-梅里埃ATB测试仪鉴定为鲍曼不动杆菌。
1.2 抗菌药物
注射用替加环素(粉剂,批号:H20110568),购自美国惠氏制药有限公司。替加环素药敏纸片(15 μg/片)购自英国OXOID公司。
1.3 培养基、仪器及耗材
Mueller-Hinton agar(OXOID),Mueller-Hinton broth(OXOID),多点接种仪SAKUMA MIT-P型:日本佐久间公司产品;电子天平:北京赛多利斯仪器系统有限公司公司产品;隔水式恒温培养箱:上海一恒科技有限公司公司产品;一次性使用培养皿,无菌96孔板:江苏康健公司产品。
1.4 实验方法
1.4.1 96-孔板微量肉汤稀释法测定替加环素对鲍曼不动杆菌的敏感性 新鲜配制12.8 mg/mL的替加环素母液,TGC终质量浓度从64 μg/mL倍比稀释到0.062 5 μg/mL共11个质量浓度梯度。采用96-孔板微量稀释法测定替加环素对受试菌株的MIC,具体方法参考CLSI文献[1]。
1.4.2 琼脂稀释法测定替加环素对株鲍曼不动杆菌的敏感性 新鲜配置含不同药物浓度的琼脂平板,TGC终质量浓度从 128 μg/mL倍比稀释到0.031 25 μg/mL共13个质量浓度梯度。采用琼脂稀释法测定替加环素对受试菌株的MIC,具体方法参考CLSI文献[1]。
1.4.3 K-B法测定替加环素对株鲍曼不动杆菌的敏感性 参考文献[1-2]中K-B法的标准操作,测定替加环素对鲍曼不动杆菌药物的体外抑菌活性,用精密度为l mm的游标卡尺量取抑菌圈直径 (抑菌圈的边缘应是无明显细菌生长的区域)。
1.5 数据分析
1.5.1 敏感性分析 微量肉汤稀释法和琼脂稀释法的判定标准参考美国食品药品监督局 (Food and Drug Administration,FDA)肠杆菌科标准和欧洲药敏试验委员会(European Committee on Antimicrobial susceptibility testing,EUCAST)标准;K-B法的判定标准参考Jones标准[3]和EUCAST标准[4],分析鲍曼不动杆菌对替加环素的敏感性。
1.5.2 数据统计分析 以微量肉汤稀释法为参考,评估与其它方法的一致性[5-7],用软件WHONET5.6中分类一致率(categorical agreement,CA)、基本一致率(essential agreement,EA)、极严重错误(very major error,VME)、严重错误(major error,ME)、一般错误(minor error,mE)、总误差(total errors,TE)等指标对不同药敏方法进行统计学分析。当VME<1.5%、ME<3%和TE<10%时认为结果可以接受。
用软件SPSS13.0对不同判定标准的耐药率进行χ2检验,其中P<0.05表示差异具有统计学意义,P<0.01表示差异具有显著统计学意义。
2 结果
2.1 ADM和BMD法检测替加环素对119株鲍曼不动杆菌的MIC比较与分析
采用琼脂稀释法和微量肉汤稀释法测定鲍曼不动杆菌对TGC的MIC,分析其MIC50和MIC90,结果见表1。

表1 两种方法测得替加环素对鲍曼不动杆菌的MICTable1 Tigecyclin MICs for A.baumannii with two test methods
由表1可知,微量肉汤稀释法和琼脂稀释法检测替加环素对临床分离的119株鲍曼不动杆菌的MIC明显不同,微量肉汤稀释法MIC50和MIC90分别是0.5和1 μg/mL,而琼脂稀释法的MIC50和MIC90分别是2和4 μg/mL。说明微量肉汤稀释法测定的MIC50和MIC90约为琼脂稀释法对应值的1/4,即琼脂稀释法的MIC高于微量肉汤稀释法的MIC 2个稀释梯度。
2.2 3种方法检测替加环素的敏感性结果
分别参考FDA/EUCAST标准,分析ADM法和BDM法检测替加环素对临床119株鲍曼不动杆菌的耐药率;参考Jone/EUCAST标准,分析K-B法检测替加环素对临床119株鲍曼不动杆菌的耐药率,结果见表2。
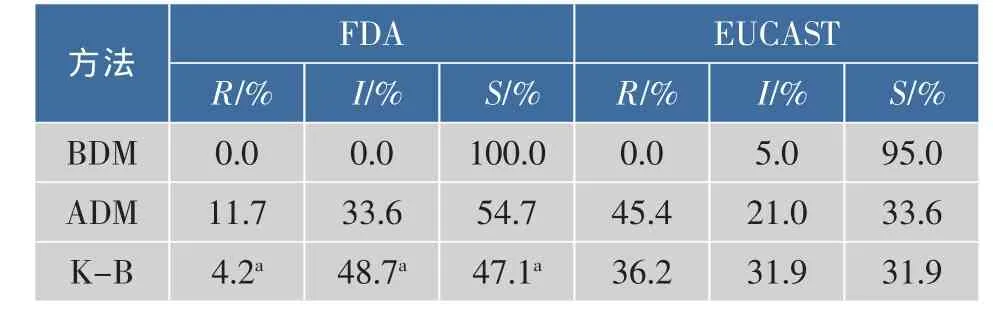
表2 BDM法、ADM法、K-B法测定鲍曼不动杆菌对替加环素的敏感性Table2 Tigecycline Susceptibility test by broth microdilution,agar dilution and disk diffusion for A. baumannii
由上表可知,采用美国临床实验室标准化协会(CLSI)推荐的琼脂稀释法、微量肉汤稀释法和K-B 法3种检测方法,测得的临床分离鲍曼不动杆菌对替加环素的敏感性明显不同。其中微量肉汤稀释法检测(FDA/EUCAST)的耐药率为0.0%(0/119)/0.0% (0/119),中介率0.0%(0/119)/5.0%(6/119),敏感率100%(119/119)/95.0%(113/119);琼脂稀释法检测(FDA/EUCAST)的耐药率 11.7%(14/119)/45.4% (54/119),中介率33.6%(40/119)/21.0%(25/119),敏感率54.7%(65/119)/33.6%(40/119);K-B法检测(Jone/EUCAST)的敏感率47.1%(56/119)/31.9%(38/ 119),中介率48.74%(58/119)/31.9%(38/119),耐药率4.2%(5/119)/36.2%(43/119)。
2.3 参考FDA(Jone)和EUCAST标准鲍曼不动杆菌对替加环素耐药率的差异
以119株鲍曼不动杆菌对TGC的耐药率为指标,采用配对卡方检验,比较分析3种检测方法的结果参考不同判定标准耐药率的统计学差异,分析结果见表3。
由上表可知,119株菌采用3种方法进行检测,分别用FDA(Jone)/EUCAST标准进行判定,鲍曼不动杆菌对替加环素的敏感性亦存在明显差异。其中微量肉汤稀释法(FDA和EUCAST)的耐药率均为0%(0/119),符合率较高,无明显统计学差异(P>0.05);而琼脂稀释法(FDA和EUCAST)的耐药率分别为11.7%(14/119)和45.4%(54/119),有显著的统计学意义(P<0.01)。K-B法(Jone和EUCAST)的耐药率分别为4.2%(5/119)和36.2%(43/119),有显著的统计学意义(P<0.01)。
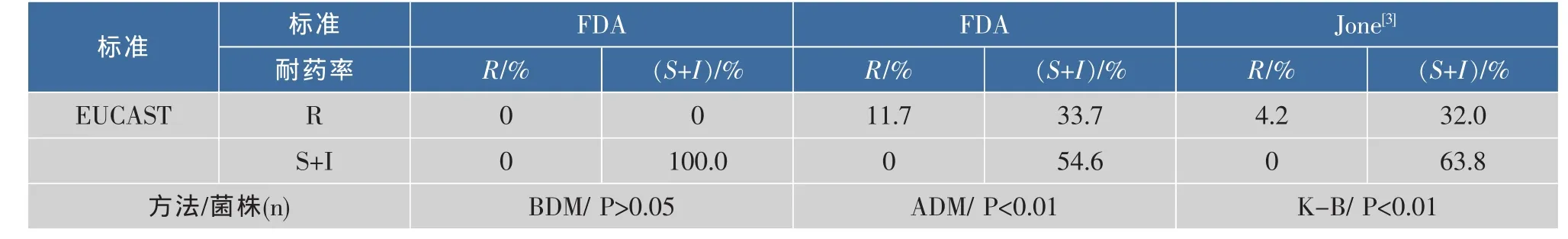
表3 参考不同判定标准鲍曼不动杆菌对替加环素的耐药率差异Table3 Difference in A.baumannii to tigecycline resistance rates reference to two standards
2.4 3种方法检测药物敏感性差异的比较
基于上述BDM法受到不同药敏折点的影响最小,作者以BDM法为参考,分析ADM和K-B法检测方法的总误差,比较分析不同检测方法的统计学差异,结果见表4。

表4 两种方法与BDM法之间比较结果Table4 Comparsion between broth microdilution with other two test methods
由上表可知,以BDM法为参考,统计分析ADM 的EA为20.2%(24/119),FDA标准的CA为53.8% (64/119),EUCAST标准的 CA为 42.9%(51/119);K-B法的 Jone标准的 CA为 47.1%(56/119);EUCAST标准的CA为31.1%(37/119)。
琼脂稀释法FDA总误差为41.2%;琼脂稀释法EUCAST总误差为60.5%,K-B法Jone总误差为47.9%,EUCAST总误差为63.9%,两种方法虽未出现(VEM)极大误差,但ME和mE均超过误差可接受范围。
3 讨论
目前CLSI尚未给出关于鲍曼不动杆菌对TGC的标准药敏测定方法和药敏判读标准,选择CLSI推荐的微量肉汤稀释法、琼脂稀释法和K-B法3种药敏试验方法检测TGC对119株临床分离的鲍曼不动杆菌的敏感性,结果显示不同方法差异性大,与文献报道[3-5]一致。分析差异主要有3个方面。
1)方法学差异 微量肉汤稀释法检测鲍曼不动杆菌对替加环素的MIC50和MIC90分别是0.5 μg/ mL和1 μg/mL,与文献报道结果[11]一致。以微量肉汤稀释法为参考方法,琼脂稀释法和K-B法的误差率均较高。其中琼脂稀释法总误差为 41.2%~60.5%,分类一致率42.9%~53.8%;K-B法总误差为47.9%~63.9%,分类一致率31.1%~47.1%。琼脂稀释法比肉汤稀释法平均高2个稀释度引起mE偏高,从而引起总误差(TE)偏高。而K-B法的mE也达到了45.4%~46.2%。一直以来,K-B法都因药敏折点复杂(FDA、Jones[2]、Kulah[6]、EUCAST和Thamlikitkul[7]等)存在争议,而本实验也显示琼脂稀释法和K-B法均与肉汤稀释法符合性不好[8-9]。
2)参考标准差异 因FDA和EUCAST两套标准差异较大,导致同一药敏检测方法分析的结果差异较大,在解释替加环素对鲍曼不动杆菌的药敏结果时,测定方法和判定标准都十分关键。实验结果表明,采用FDA和EUCAST两套标准,肉汤稀释法耐药率无差异(P>0.05),而琼脂稀释法检测的鲍曼不动杆菌对替加环素的耐药率11.7%~45.4%、K-B法检测的鲍曼不动杆菌对替加环素的耐药率为4.2%~46.2%,两者均有显著统计学差异(P<0.01)。基于此,在比较3种不同检测方法的差异时,作者选择了肉汤稀释法作为参考方法,以提高分析的准确性。
3)药物的不稳定性 据报道,替加环素理化性质活泼,在光线或空气中久置会导致抗菌活性降低[10]。此外,培养基中的离子如锰离子因与抗菌药物形成螯合物是影响实验结果的重要因素[11]。因此,为缩短替加环素在空气和光线中的暴露时间,药物采用现配现用的原则,同时选用OXOID公司生产的锰离子含量较低的MH培养基,避免外界环境因素对实验结果的影响,确保了实验结果的科学性。
结果表明,在微量肉汤稀释法、琼脂稀释法和K-B法中,微量肉汤稀释法受不同判定标准的影响最小,该方法本身也是目前替加环素药敏试验的参考方法。目前关于鲍曼不动杆菌对替加环素的报道较多,但因方法和判定标准各异,导致不同研究者的报道结果不具有可比性。因此,建议进一步规范肉汤稀释法操作,制定详细规程和统一药敏判定标准,为临床鲍曼不动杆菌对替加环素敏感性试验和合理运用替加环素治疗感染性疾病提供科学依据。
[1]王辉,俞云松,王明贵,等.替加环素体外药敏试验操作规程专家共识[J].中华检验医学杂志,2013,26(7):584-587. WANG Hui,YU Yunsong,WANG Minggui,et al.Expert consensus on the operation of in vitro drug sensitivity test[J].Chinese Journal of Laboratory Medicine,2013,26(7):584-587.(in Chinese)
[2]JONES R N,FERRARO M J,RELLER L B.Multicenter studies of tigecycline disk diffusion susceptibility results for Acinetobacter spp.[J].Clinical Microbiology,2007,45:227-230.
[3]杜小幸,王海萍,俞云松,等.不同药敏方法检测替加环素对鲍曼不动杆菌敏感性的比较[J].中国检验医学杂志,2013,36 (7):598-603. DU Xiaoxing,WANG Haiping,YU Yunsong,et al.Evalution of different tigecycline susceptibility testing methods for Acinetobacter baumannii[J].Chinese Journal of Laboratory Medicine,2013,36(7):598-603.(in Chinese)
[4]LIU J W,JANG T N,CHENG Y J,et al.Comparison of the Etest and broth microdilution method for tigecycline susceptibility testing against clinical isolates of Acinetobacter baumannii from Taiwan[J].Int J Antimicrob Agents,2010,35(2):201-202.
[5]LIU J W,KO W C,HUANG C H,et al.Agreement assessment of tigecycline susceptibilities determined by the disk diffusion and broth microdilution methods among commonly encountered resistant bacterial isolates:results from the Tigecycline In Vitro Surveillance in Taiwan(TIST)study,2008 to 2010[J].Antimicrob Agents Chemother,2012,56(3):1414-1417.
[6]KULAH C,CELEBI G,AKTAS E,et al.Unexpected tigecycline resistance among Acinetobacter baumannii Isolates:high minor error rate by Etest[J].J Chemother,2009,21(4):390-395.
[7]THAMLIKITKUL V,TIENGRIM S,TRIBUDDHARAT C.Comment on:High tigecycline resistance in multidrug-resistant Acinetobacter baumannii[J].J Antimicrob Chemother,2007,60(1):177-178.
[8]NAVON Venezia S,LEAVITT A,CARMELI Y.High tigecycline resistance in multidrug-resistant Acinetobacter baumannii[J].J Antimicrob Chemother,2007,59(4):772-774.
[9]RAYO Morfin-Otero,MICHAEL J.Dowzicky.Changes in MIC Within a Global Collection of Acinetobacter baumannii collected as Part of the Tigecycline Evaluation and Surveillance Trial,2004 to 2009[J].Clinical Therapeutics,2012,34(1)101-112.
[10]PATRICIA A,Bradford,Peter J.Petersen,Mairead Young,et al.Tigecycline MIC testing by broth dilution requires use of fresh medium or addition of the biocatalytic oxygen-reducing reagent oxyrase to standardize the test method[J].Antimicrobial Agents and Chemotherapy,2005,49(9):3903-3909.
[11]CARLOS Fernández-Mazarrasa.High concentrations of manganese in mueller-Hinton agar increase MICs of tigecycline determined by Etest[J].Clinical Microbiol,2009,47(3):827-829.
Comparison of Three Methods in Vitro Susceptibility Test of Tigecycline Against Acinetobacter baumannii
ZHENG Wei1,3, XU Ying2, LING Baodong*1
(1.Small Molecule Drugs Sichuan Key Laboratory,Chengdu Medical College,Chengdu 610500,China;2.The First Affiliated Hospital of Chengdu Medical College,Chengdu 610513,China;3.Sichuan Provincial Center for Disease Control and Prevention,Chengdu 610041,China)
To evaluate different tigecyclin susceptibility testing methods for Acinetobacter baumannii.A total of 119 clinical A.baumannii isolates were collected and tigecycline susceptibilities were tested by the broth microdilution,agar dilution and disk diffusion.The results of three test methods were compared.The MIC50and MIC90values obtained by broth microdilution method were 0.5 μg/mL,1 μg/mL respectively,the(FDA/EUCAST breakpoint)susceptible rates were 100% (119/119)/95.0%(113/119),intermediate rates were 0.0%(0/119)/5.0%(6/119)and resistant rateswere 0.0%(0/119)/0.0%(0/119).The MIC50and MIC90values obtained by agar dilution method were 2 μg/mL,4 μg/mL respectively,the(FDA/EUCAST breakpoint)susceptible rates were 54.7% (65/119)/33.6%(40/119),intermediate rates were 33.6%(40/119)/21.0%(25/119)and resistant rates were 11.7%(14/119)/45.4%(54/119).The disk diffusion method(FDA/EUCAST breakpoint)resistant rates were 4.2%(5/119)/36.2%(43/119),intermediate rates were 48.74%(58/119)/31.9% (38/119)and susceptible rates were 47.1%(56/119)/31.9%(38/119).There were significant differences on susceptible rates among broth microdilution(BDM),agar dilution(ADM)and disk diffusion.As broth microdilution method was reference method,the total error rates of agar dilution method were 41.2%~60.5%and the total error rates of disk diffusion were 47.9%~63.9%.
Acinetobacter baumannii,minimal inhibitory concentration (MIC),disk diffusion,tigecycline
R 446.5;R 978.1
A
1673—1689(2016)07—0734—05
2014-06-21
国家自然科学基金项目(81373454);四川省科技厅重点科技项目(2013jy0065)。
凌保东(1956—),男,重庆万州人,医学硕士,教授,主要从事抗生素耐药机制研究。E-mail:lingbaodong@cmc.edu.cn

