赤芍水提物对金黄色葡萄球菌肠毒素及蛋白A表达的影响
张鹏鹏,李增顺,汤 鹏,段慧琴,孙英健,穆 祥
(北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室,北京 102206)
赤芍水提物对金黄色葡萄球菌肠毒素及蛋白A表达的影响
张鹏鹏,李增顺,汤鹏,段慧琴,孙英健*,穆祥
(北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室,北京 102206)
探讨了赤芍水提物在体外对金黄色葡萄球菌肠毒素A、B及蛋白A分泌及mRNA转录的影响。试验中采用微量倍比稀释法测定赤芍对金黄色葡萄球菌ATCC29213的最小抑菌浓度(MIC);采用Western blot和实时荧光定量PCR检测亚抑菌浓度下赤芍水提物对金黄色葡萄球菌肠毒素A、B及蛋白A在mRNA转录和毒素蛋白分泌表达的影响。结果表明,赤芍水提物对金黄色葡萄球菌ATCC29213的MIC值为6.3 mg/mL;在亚抑菌浓度下,赤芍水提物可以明显抑制肠毒素A、B及蛋白A在蛋白水平和转录水平的表达,且呈现明显的浓度依赖性。
赤芍;金黄色葡萄球菌;肠毒素;蛋白A
金黄色葡萄球菌(Staphylococcusaureus)能引起多种动物和人的疾病,其致病性主要依靠菌体分泌的多种毒力因子的作用,包括菌体表面蛋白和胞外蛋白[1],如纤连蛋白结合蛋白(fibronectin-binding protein)[2]、蛋白A(Staphylococcusaureusprotein A,SPA)[3]、肠毒素(Staphylococcusaureusenterotoxins,SEs)[4]、溶血素(hemolysin)[5]、毒性休克综合征毒素-1(toxic shock syndrome toxin 1,TSST-1)[6]等。其中SPA是金黄色葡萄球菌壁表面的一种锚定蛋白,在细菌感染初期能抑制机体的免疫反应[3],促进细菌在宿主细胞上的定殖,是一些包括肺炎、败血症等炎症的直接致病因子,在金黄色葡萄球菌致病过程中起着重要的作用[7]。研究表明将SPA突变型金黄色葡萄球菌静脉注入小鼠后,小鼠关节炎的发生率、小鼠病死率等都明显降低[8]。SEs是金黄色葡萄球菌所产生的一类结构相似、毒力相似、抗原性各异的胞外单链小分子蛋白质,分A、B、C1、C2、C3、D、E、G和H 9个血清型,具有很高的热稳定性,经100℃高温煮沸30 min仍可保持其生物活性和免疫活性[9]。临床分离的金黄色葡萄球菌约1/3可产生肠毒素,一般认为摄入约1 μg/kg金黄色葡萄球菌肠毒素即可引起人的中毒,其作用机制可能是到达中枢神经系统后刺激呕吐中枢而导致以呕吐为主要症状的食物中毒[10-11]。中药在治疗细菌性感染方面具有良好的疗效,但其作用机制尚不完全清楚。
赤芍(Radix Paeoniae Rubra,RPR)为毛茛科植物芍药的干燥根,其作为中医治疗“血瘀症”的主要药物,历年来广泛应用于临床治疗中。赤芍味苦,性凉,具有行瘀止痛、凉血消肿的功效;主治瘀滞经闭、疝瘕积聚、腹痛胁痛、衄血血痢、肠风下血、目赤痈肿[12]。现代药理学研究表明,赤芍具有抗过敏、抗炎、抗氧化和免疫调节作用,对痢疾杆菌、葡萄球菌等有抑制作用[13]。本文主要研究赤芍水提物对金黄色葡萄球菌毒力因子SPA、SEA和SEB分泌的影响。
1 材料与方法
1.1材料
1.1.1菌株金黄色葡萄球菌ATCC29213,鼎国生物科技有限公司产品。
1.1.2试剂赤芍,北京同仁堂药店前门店产品;MHB培养基,北京奥博星生物技术有限责任公司产品;HiFi-MMLV cDNA kit试剂盒和HRP标记的二抗,康为世纪生物技术有限公司产品;SPA和肠毒素A、B抗体,Sigma公司产品;SYBR Premix ExTaqTM试剂盒为宝生物工程(大连)有限公司产品;ECL发光液,碧云天生物技术有限公司产品。
1.2方法
1.2.1赤芍水提物制备称取100 g赤芍研磨粉,水煮至沸25 min,过滤,将药液浓缩至终浓度为0.2 g/mL。
1.2.2最小抑菌浓度(MIC)的测定采用CLSI(Clinical and Laboratory Stands Institute)推荐的微量稀释法测定赤芍水提物对金黄色葡萄球菌株的MIC值。
1.2.3实时荧光定量PCR从培养皿中挑取ATCC29213菌落于100 mL MHB培养基中37℃、150 r/min培养至OD 600 nm为0.3,然后给予不同浓度的赤芍水提物继续培养6 h。离心收集菌体,菌体经金黄色葡萄球菌溶菌酶及溶菌素裂解后采用Trizol法提取细菌总RNA,用HiFi-MMLV cDNA kit试剂盒将RNA反转录成cDNA并置于-20℃备用。实时荧光定量PCR所用引物如表1所示。用SYBR Premix ExTaqTM试剂盒进行real-time PCR 扩增反应。反应体系为20 μL,退火温度为55 ℃,其他反应条件依据说明书推荐进行。所有样品均为3个平行,并以16 S作为内参。采用2-△△Ct法分析基因的相对表达水平。
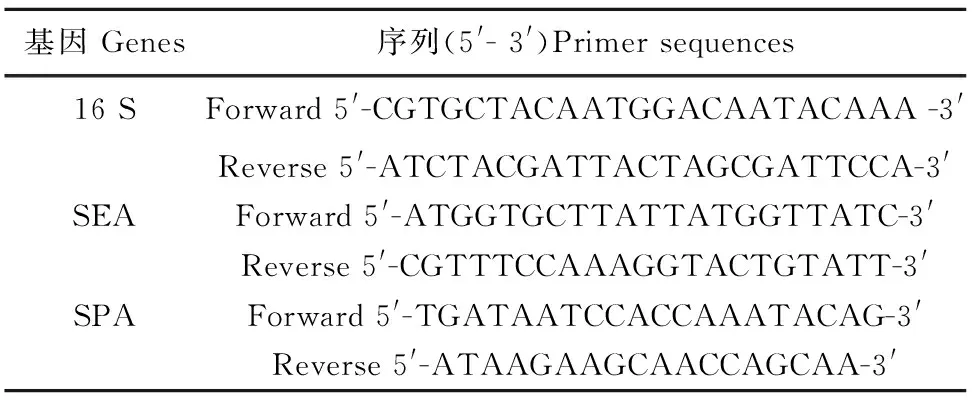
表1 实时荧光定量PCR引物序列
1.2.4Western blot分析分别取经离心和滤膜过滤的细菌培养液上清100 μL,加入25 μL 5×Loading buffer,100℃ 10min,取25 μL上样,进行SDS-PAGE(120 g/L分离胶),将蛋白转印至PVDF膜上,用50 g/L脱脂牛奶封闭2 h,PBST洗3次每次15 min,分别与金黄色葡萄球菌蛋白A(SPA)抗体(Sigma)(1∶10 000稀释)、金黄色葡萄球菌肠毒素A(SEA)抗体(Sigma),(1∶10 000稀释)、金黄色葡萄球菌肠毒素B(SEB)抗体(Sigma)(1∶10 000稀释)孵育,4℃过夜,PBST洗3次,每次15 min,用HRP标记的二抗(1∶5 000稀释)室温孵育1 h,PBST洗3次,加入ECL发光液检测。
2 结果
2.1赤芍水提物对金黄色葡萄球菌ATCC29213的抑菌活性及其增殖的影响
通过微量倍比稀释法测定,赤芍水提物对金黄色葡萄球菌ATCC29213的最小抑菌浓度(MIC)为6.3 mg/mL。
我们以1/6、1/5、1/4、1/3、1/2、1、2、3倍的MIC为给药浓度,测定其对细菌的生长的影响,每2 h记1次细菌悬液的OD 600 nm值。结果如图1所示,当赤芍浓度小于MIC值时(6.3 mg/mL),对细菌的增殖几乎没有影响,当赤芍浓度大于MIC值,则明显抑制细菌的增殖。

图1 赤芍水提物对金黄色葡萄球菌增殖的影响Fig.1 Effect of water extracts of Radix Paeoniae Rubra on the proliferation of S.aureus
2.2亚抑菌浓度的赤芍水提物降低金黄色葡萄球菌SPA、SEA、SEB的表达
用含有不同浓度的赤芍水提物的培养基培养金黄色葡萄球菌6 h后,用Western blot检测细菌培养物上清中金黄色葡萄球菌所分泌的SPA、SEA、SEB的含量,结果显示,当培养基中赤芍水提物的含量为1 mg/mL时,与不给药的对照组相比3种毒素的表达量均受到明显的抑制,当赤芍含量为2、4 mg/mL时,其抑制作用进一步加强,呈现明显的浓度依赖性(图2)。经蛋白条带灰度分析与不给药组相比,含赤芍的金葡菌培养物中SPA、SEA和SEB的表达显著下降(图2)。
2.3亚抑菌浓度的赤芍水提物抑制金黄色葡萄球菌SPA、SEA基因的转录
应用实时荧光定量PCR检测技术检测不同浓度的赤芍水提物对金黄色葡萄球菌ATCC29213 SPA和肠毒素A的编码基因转录的影响,结果显示,在亚抑菌浓度下,SPA、SEA的mRNA表达量均随药物浓度的升高而降低(图3和图4)。
3 讨论
关于赤芍提取物对金黄色葡萄球菌增殖的影响研究较多,由于中药具有独特的道地性,不同实验室关于赤芍对金黄色葡萄球菌最小抑菌浓度的测定差异也比较大。在本研究中,赤芍水提物的最小抑菌浓度(MIC)为6.3 mg/mL,与张显忠等[14]研究的川赤芍水提物对金黄色葡萄球菌的最小抑菌浓度相近(MIC为3.9 mg/mL);而新疆赤芍水提物对于金黄色葡萄球菌的最小抑菌浓度则为250 mg/mL[15]。这可能与不同产地的中药药效的差异有关。

A.SPA、SEA和SEB蛋白Western blot检测结果;B.SPA、SEA和SEB蛋白灰度分析结果
A.Western blot analysis of SPA,SEA and SEB;B.The relative density of the bands in the figure A
图2赤芍水提物对金黄色葡萄球菌的SPA、SEA和SEB表达的影响
Fig.2Effects of Radix Paeoniae Rubra water extracts on the expressions of SPA,SEA,and SEB ofS.aureus

图3 金黄色葡萄球菌在赤芍水提物作用后 其SPA的mRNA表达水平Fig.3 Effects of Radix Paeoniae Rubra water extracts on SPA mRNA expression of S.aureus

图4 金黄色葡萄球菌在赤芍水提物作用后 其SEA的mRNA表达水平Fig.4 Effects of Radix Paeoniae Rubra water extracts on the SEA mRNA expression of S.aureus
目前的研究发现许多中药都有良好的抗感染效果[16],部分中药提取物在亚抑菌浓度下具有抑制细菌毒素表达的作用,例如连翘提取物[17]、厚朴酚[18]、紫苏油[19]、蜂胶[20]、异土木香内酯[21]、甘草茶尔酮E[22]等在亚抑菌浓度能明显抑制α-溶血素、SEA、SEB、TSST-1等毒素的分泌。本研究发现赤芍水提物在亚抑菌浓度下可抑制金黄色葡萄球菌毒力因子SPA、SEA、SEB蛋白的表达,同时也可抑制相应毒力因子mRNA的转录,因此推测,赤芍水提物抑制金黄色葡萄球菌毒力因子蛋白的表达是通过抑制相关毒力因子mRNA转录来实现的。众所周知,金黄色葡萄球菌的致病作用主要是依赖分泌的毒力因子,SPA是金黄色葡萄球菌在对数生长期时分泌的毒力因子,在呼吸道上皮细胞中广泛存在TNF-α的受体TNFR-1也是SPA的受体,细菌在增殖的同时SPA的分泌表达增加,其与宿主体内的肿瘤坏死因子受体(tumor necrosis factor receptor-1,TNFR-1)结合,首先在细胞表面通过其胞内区的死亡结构域直接募集肿瘤坏死因子受体相关死亡域(TNF receptor-associated death domain,TRADD),TRADD再募集RIP-1和TRAF-2,在细胞膜上形成信号复合物,进而激活NF-κB信号通路,调节多种因子表达,介导炎性反应[23-24],促进肺部炎症不断扩大;当用SPA突变菌株感染小鼠时,小鼠患肺炎率则明显降低[25]。SEA和SEB等肠毒素是金黄色葡萄球菌在增殖的平台期开始分泌的毒素之一,可干扰肠道的正常功能,从而引起肠胃炎或食物中毒[26]。根据本研究发现,亚抑菌浓度下的赤芍水提物在体外可分别抑制对数生长期的毒力因子SPA和平台期的毒力因子SEA、SEB的表达,这提示赤芍在感染初期抑制了细菌SPA蛋白的表达、从而降低SPA与TNFR-1的结合,抑制了下游信号通路的激活,从而降低炎症反应。
本研究提示,赤芍水提物在亚抑菌浓度下能显著抑制细菌不同时期毒力因子的分泌表达,这可能正是赤芍抗细菌感染的主要机制。赤芍水提物在亚抑菌浓度下对金黄色葡萄球菌ATCC29213菌株毒力因子蛋白A、肠毒素A、肠毒素B的分泌表达有抑制作用,且呈现明显的浓度依赖性。赤芍在体内的的药理作用仍需进一步的研究。
[1]Majerczyk C D,Sadykov M R,Luong T T,et al.StaphylococcusaureusCodY negatively regulates virulence gene expression[J].J Bacteriol,2008,190(7):2257-2265.
[2]Foster T J,Hook M.Surface protein adhesins ofStaphylococcusaureus[J].Trend Microbiol,1998,6(12):484-488.
[3]Becker S,Frankel M B,Schneewind O,et al.Release of protein A from the cell wall ofStaphylococcusaureus[J].PNAS,2014,111(4):1574-1579.
[4]Yu F L,Liu T T,Zhu X,et al.Staphylococcal enterotoxin B and α-toxin induce the apoptosis of ECV304 cells via similar mechanisms[J].Mol Med Rep,2013,8(2):591-596.
[5]Bhakdi S,Jensen T J.Alpha-toxin ofStaphylococcusaureus[J].Microbiol Mol Biol Rev,1991,55(4):733-751.
[6]Macphee R A,Miller W L,Gloor G B,et al.Influence of the vaginal microbiota on toxic shock syndrome toxin 1 production byStaphylococcusaureus[J]. Appl Environ Microbiol,2013,79(6):1835-1842.
[7]Niklas P,Timothy F,Andrzej T,et al.Protein A is a virulence factor inStaphylococcusaureusarthritis and septic death[J].Microbial Pathog,2002,33(5):239-249.
[8]Ashok K,Mark T A,Li Q,et al.Staphylococcusaureusprotein A induced inflammatory response in human corneal epithelial cells[J].Biochem Biophys Res Commun,2007,354(4):955-961.
[9]徐振波,刘晓晨,李琳,等.金黄色葡萄球菌肠毒素在食源性微生物中的研究进展[J].现代食品科技,2013,29(9):2317-2324.
[10]Lyra D G,Sousa F G,Borges M F,et al.Enterotoxin-encoding genes inStaphylococcusspp.from bulk goat milk[J].Foodborne Pathog Dis,2013,10(2):126-130.
[11]Hennekinne J A,De Buyser M L,Dragacci S.Staphylococcusaureusand its food poisoning toxins: characterization and outbreak investigation[J].FEMS Microbiol Rev,2012,36(4):815-836.
[12]国家药典委员会.中华人民共和国药典:一部[Z].北京:化学工业出版社,2005:109.
[13]阮金兰,赵钟祥,曾庆忠,等.赤芍化学成分和药理作用的研究进展[J].中国药理学通报,2003(9):965-970.
[14]张显忠,郭爱军,李艳玲,等.中草药提取物的体外抑菌活性研究[J]. 中华医院感染学杂志,2006(16):563-565.
[15]武新华,马秀敏,丁剑冰,等.新疆赤芍抑菌实验研究[J].中国民族医药杂志,2005(9):30-31.
[16]张仲林,钟玲,臧志和,等.抗感染中药作用机理研究方法概况[J].四川生理科学杂志,2008,30(1):26-28.
[17]李晔,戴小寒,田武林,等.中草药连翘提取物抑制金黄色葡萄球菌α-溶血素分泌活性研究[J].中国兽医学报,2013,33(3):404-408.
[18]Xiang H,Qiu J Z,Wang D C,et al.Influence of magnolol on the secretion of α-toxin byStaphylococcusaureus[J].Molecules,2010,15:1679-1689.
[19]Qiu J Z,Zhang X R,Luo M J,et al.Sub-inhibitory concentrations of perilla oil affect the expression of secreted virulence factor genes inStaphylococcusaureus[J].PLoS One,2011,6(1):1-8.
[20]陈志宝,姜游帅,夏礼杰,等.蜂胶对金黄色葡萄球菌毒力因子的抑制作用[J].中国兽医杂志,2010,46(11):23-25.
[21]吴金梅,邱家章,邓旭明.异土木香内酯对金黄色葡萄球菌肠毒素表达的影响[J].中国农学通报,2012,28(8):51-55.
[22]邱家章,邓旭明,罗永煌.甘草查尔酮E对金黄色葡萄球菌的抗菌活性[J].中国兽医学报,2012,32(8):1194-1198.
[23]Grell M,Zimmermann G,Hülser D,et al.TNF receptors TR60 and TR80 can mediate apoptosis via induction of distinct signal pathways[J].J Immunol,1994,153(5):1963-1972.
[24]Hsu H,Shu H B,Pan M G,et al.TRADD-TRAF2 and TRADD-FADD interactions define two distinct receptor 1 signal transduction pathways[J].Cell,1996,84(2):299-308.
[25]Gómez M I,Lee A,Reddy B,et al.Staphylococcusaureusprotein A induces airway epithelial inflammatory responses by activating TNFR1[J].Nature Med,2004,10(8):842-848.
[26]Otto M.Staphylococcusaureustoxins[J].Cur Opin Microbiol,2014,17:32-37.
Influence of Radix Paeoniae Rubra Water Extract on Expression of Enterotoxins and Protein A ofStaphylococcusaureus
ZHANG Peng-peng,LI Zeng-shun,TANG Peng,DUAN Hui-qin,SUN Ying-jian,MU Xiang
(Beijing Key Laboratory of Traditional Chinese Veterinary Medicine,College of Animal Science and Veterinary Medicine,BeijingUniversityofAgriculture,Beijing,102206,China)
In the study,we investigated the influence of Radix Paeoniae Rubra water extract on the expression of enterotoxins(SEA,SEB) and SPA ofS.aureus. A broth micro-dilution method was used to determine the minimal inhibitory concentrations (MICs) of Paeoniae Rubra extract toS.aureusstrains (ATCC29213).Western blot and real-time RT-PCR assays were performed to assess the effects of Radix Paeoniae Rubra extract onS.aureusSEA,SEB and SPA expressions.The results showed that the MICs of Radix Paeoniae Rubra extract againstS.aureusstrains were 6.3 mg/mL,Radix Paeoniae Rubra extract can dose-dependently reduce the secretion and transcription of SEA, SEB and SPAS.aureuson the subinhibitory concentrations.
Radix Paeoniae Rubra;Staphylococcusaureus;enterotoxin;protein A
2016-01-06
国家自然科学青年基金项目(31302137);北京市自然科学基金项目(6162006);2015年北京农学院研究生创新科研项目-自然科学类(2015YJS045);北京农学院与北京市农委对接项目(2033217008);北京农学院科技创新团队科研能力提升工程项目(KCT2014012)
张鹏鹏(1989-),男,山西人,硕士研究生,主要从事药理学研究。*通讯作者
S853.74
A
1007-5038(2016)09-0075-04

