山豆根多糖对感染PRRSV小鼠脾脏细胞因子水平的影响
李 飞,韦英益,杨 剑,陆晶莹,谭红连,胡庭俊
(广西大学动物科学技术学院,广西南宁 530005)
山豆根多糖对感染PRRSV小鼠脾脏细胞因子水平的影响
李飞,韦英益,杨剑,陆晶莹,谭红连,胡庭俊*
(广西大学动物科学技术学院,广西南宁 530005)
探讨山豆根多糖对PRRSV感染小鼠脾淋巴细胞分泌细胞因子水平的影响。将 70只昆明种小鼠随机分为7组(A组、B组、C组、D组、E组、F组、G组),每组10只,雌雄各半,依据前期已经建立氧化应激模型的感染条件,D组、E组、F组、G组小鼠于试验第 1、2、3天分别采用口服、滴鼻和腹腔注射3种途径联合感染PRRSV病毒原液1.0 mL/只,A组、B组、C组给予生理盐水1.0 mL/只。第 4、5、6天,A、D组小鼠分别腹腔注射生理盐水,0.2 mL/10 g。B组小鼠腹腔注射5.0 mg/kg的脂多糖(LPS)溶液,C组、E组、F组、G组小鼠分别腹腔注射不同剂量的山豆根多糖(200、50、100、200 mg/kg)。供试小鼠均于第14天处死,并取其脾脏制备匀浆。采用ELISA检测脾匀浆中TNF-α、IL-1β、IL-6、IL-8、IL-10和MCP-1等细胞因子的水平。结果显示,PRRSV感染小鼠后能升高小鼠脾脏匀浆内TNF-α、IL-1β、IL-6、IL-8、IL-10和MCP-1水平,50 mg/kg~100 mg/kg剂量的山豆根多糖能降低上述细胞因子的水平。结果表明,山豆根多糖能有效降低PRRSV感染小鼠脾脏细胞因子的水平。
山豆根多糖;猪繁殖与呼吸综合征病毒;小鼠;细胞因子
氧化应激是病毒感染引起的病理过程中非常重要的一环。病毒感染常导致动物机体处于氧化应激状态,病毒感染不仅可以引起活性氧自由基释放;同时也导致产生过量的促炎细胞因子[1]。有大量研究证实,PRRSV感染免疫细胞后可使免疫细胞分泌高水平的促炎细胞因子,如TNF-α、IL-1β、IL-6、IL-8、IL-10、MCP-1[2-3]。同时,氧化应激可以通过不同的机制来增加细胞因子的产生,氧化应激诱导细胞因子的产生很可能会进一步增加氧化应激水平,从而形成了一个恶性循环。前期研究表明多糖类药物可从多方面对免疫系统发挥调节作用,从而提高机体免疫力,还能提高机体抗炎、抗氧化能力[4]。本文在前期建立的猪繁殖与呼吸综合征病毒(Porcinereproductive and respiratory syndrome virus,PRRSV)感染小鼠脾淋巴细胞氧化应激病理模型基础上[5],进行山豆根多糖(Sophorasubprostratepolysaccharide,SSP)对PRRSV感染小鼠脾淋巴细胞分泌细胞因子水平的研究,旨在探讨病毒感染免疫细胞所产生的氧化应激与中药活性多糖对PRRSV感染免疫细胞分泌细胞因子水平的关系。
1 材料与方法
1.1材料
1.1.1药物山豆根多糖(SSP),广西大学动物科学技术学院药理实验室采用水提醇沉法提取并精制得到,经苯酚硫酸法测得总糖含量为88.48%。
1.1.2病毒、细胞和实验动物PRRSV-GXA株毒株,广西大学动物科学技术学院基础药理实验室保存,经Marc-145细胞增殖后测得病毒滴度为10-5.6TCID50/0.1 mL;非洲绿猴肾传代细胞(Marc-145) ,广西大学动物科学技术学院药理实验室保存;昆明系小鼠,SPF级,雌雄各半,体重20 g±2 g,购自广西医科大学实验动物中心。
1.1.3主要仪器和试剂Multimode Plate Reader多功能酶标仪,Perkin Elmer公司产品;JY92-ⅡD细胞超声破碎仪,宁波新芝生物科技股份有限公司产品;小鼠TNF-α、IL-1β、IL-6、IL-8、IL-10、MCP-1 ELISA检测试剂盒,深圳欣博盛生物科技有限公司产品;脂多糖(LPS),美国Sigma公司产品。
1.2方法
1.2.1PRRSV感染昆明系小鼠、给药方案及样品采集时间将 70只昆明系小鼠随机分为 7组(A组、B组、C组、D组、E组、F组、G组),每组 10 只,雌雄各半,根据本课题组前期试验结果选择建立氧化应激病理模型的感染方案及最佳感染时间,D组、E组、F组、G组小鼠于试验第 1、2、3天分别采用口服、滴鼻和腹腔注射3种途径联合感染PRRSV病毒原液 1.0 mL/只,A组、B组、C组给予生理盐水1.0 mL/只。第 4、5、6天,A组、D 组小鼠分别腹腔注射生理盐水,0.2 mL/10 g,B组小鼠腹腔注射5.0 mg/kg的LPS(脂多糖)溶液[6-8], C组、E组、F组、G组小鼠分别腹腔注射不同剂量的山豆根多糖(200、50、100、200 mg/kg)[9],具体处理如表1所示。PRRSV感染前停食12 h,停水6 h,感染后按常规饲养,于感染后第14天处死进行相关指标测定。
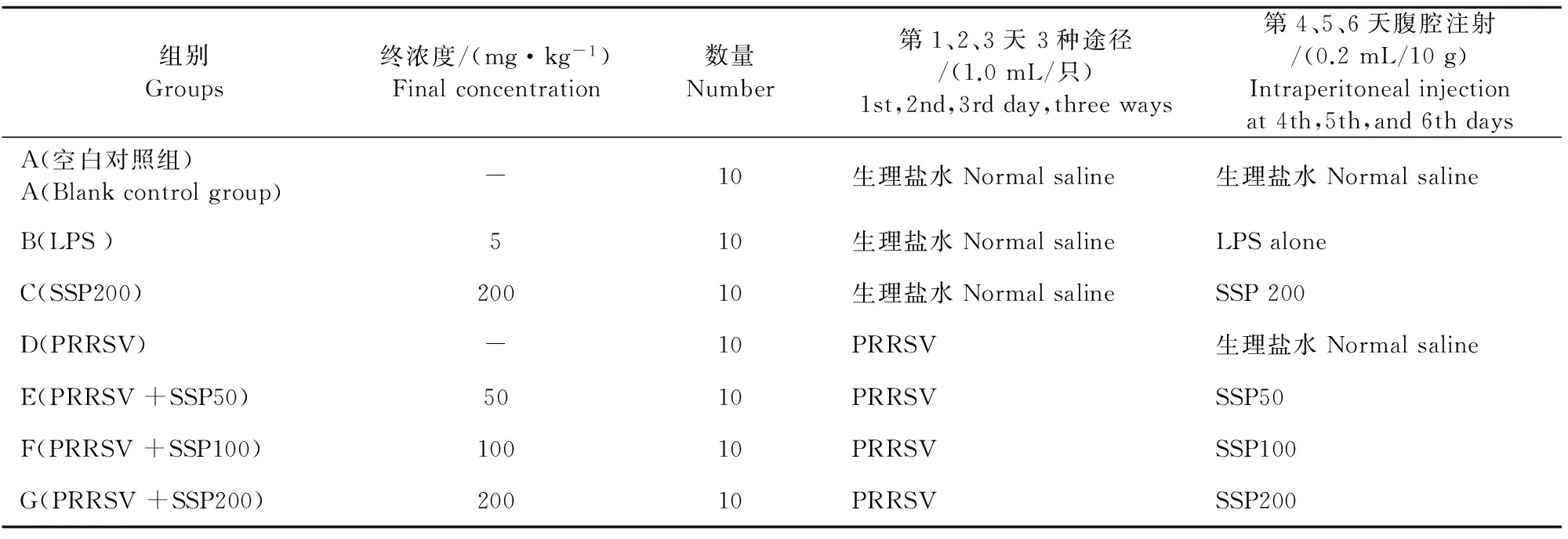
表1 试验小鼠的分组及处理
1.2.2样品处理每组10只小鼠脾脏分离后,灭菌生理盐水洗净表面血渍,用滤纸吸干液体,准确称取各样品重量,按脾脏重(g)∶灭菌生理盐水(mL)=1∶9的比例加入生理盐水,制备100 g/L组织匀浆。5 000 r/min离心10 min,取上清分装,保存于-80℃,以备ELISA检测小鼠脾脏匀浆TNF-α、IL-6、IL-1β、IL-8、IL-10、MCP-1水平,并根据标准曲线计算含量。
1.2.3统计分析数据采用SPSS 22.0统计软件进行单因素方差分析(One-Way ANOVA),Duncan组间比较,结果以平均值±标准差表示。*表示与空白对照组相比差异显著(P<0.05),**表示与空白对照组相比差异极显著(P<0.01)。#表示与病毒对照组相比差异显著(P<0.05),##表示与病毒对照组相比差异极显著(P<0.01)。
2 结果
2.1山豆根多糖对PRRSV感染小鼠脾淋巴细胞分泌TNF-α水平的影响
PRRSV感染小鼠脾淋巴细胞14 d可明显升高细胞分泌TNF-α水平,与空白对照组相比差异极显著(P<0.01)。用不同浓度山豆根多糖处理后,50 mg/kg和100 mg/kg的山豆根多糖能明显降低PRRSV感染小鼠脾淋巴细胞分泌TNF-α水平,与病毒对照组相比差异极显著(P<0.01),但是200 mg/kg的山豆根多糖能显著升高PRRSV感染小鼠脾淋巴细胞分泌TNF-α水平,与病毒对照组相比差异显著(P<0.05),且200 mg/kg的山豆根多糖能明显升高小鼠脾淋巴细胞分泌TNF-α水平,与空白对照组相比差异极显著(P<0.01)(表2)。结果表明50 mg/kg和100 mg/kg的山豆根多糖作用PRRSV感染小鼠脾淋巴细胞14 d可以明显降低小鼠脾淋巴细胞分泌TNF-α水平。
2.2山豆根多糖对PRRSV感染小鼠脾淋巴细胞分泌IL-1β水平的影响
PRRSV感染小鼠脾淋巴细胞14 d对细胞分泌IL-1β水平无显著影响,与空白对照组相比差异不显著(P>0.05)。用不同浓度山豆根多糖处理后,100 mg/kg山豆根多糖能显著降低PRRSV感染小鼠脾淋巴细胞分泌IL-1β水平,与病毒对照组相比差异显著(P<0.05)(表2)。结果表明,100 mg/kg山豆根多糖作用PRRSV感染小鼠脾淋巴细胞14 d可以显著降低小鼠脾淋巴细胞分泌IL-1β水平。
2.3山豆根多糖对PRRSV感染小鼠脾淋巴细胞分泌IL-6水平的影响
PRRSV感染小鼠脾淋巴细胞14 d可在一定程度上升高细胞分泌IL-6水平,但与空白对照组相比差异不显著(P>0.05)。用不同浓度山豆根多糖处理后,50 mg/kg和100 mg/kg的山豆根多糖能明显降低PRRSV感染小鼠脾淋巴细胞分泌IL-6水平,与病毒对照组相比差异极显著(P<0.01)。200 mg/kg的山豆根多糖在一定程度上能升高PRRSV感染小鼠脾淋巴细胞分泌IL-6水平,但与病毒对照组相比差异不显著(P>0.05),且200 mg/kg的山豆根多糖在一定程度上也能升高小鼠脾淋巴细胞分泌IL-6水平,与空白对照组相比差异极显著(P<0.01)(表2)。结果表明50 mg/kg和100 mg/kg的山豆根多糖作用PRRSV感染小鼠脾淋巴细胞14 d可以明显降低小鼠脾淋巴细胞分泌IL-6水平。

表2 山豆根多糖对PRRSV感染小鼠脾淋巴细胞分泌细胞因子水平的影响
注:与空白对照组相比,*表示P<0.05,**表示P<0.01;与病毒对照组相比,#表示P<0.05,##表示P<0.01。
Note:Compared with blank control group,*P<0.05,**P<0.01;Compared with virus control group,#P<0.05,##P<0.01.
2.4山豆根多糖对PRRSV感染小鼠脾淋巴细胞分泌IL-8水平的影响
PRRSV感染小鼠脾淋巴细胞14 d可在一定程度上升高细胞分泌IL-8水平,但与空白对照组相比差异不显著(P>0.05)。用不同浓度山豆根多糖处理后,50 mg/kg和100 mg/kg的山豆根多糖能明显降低PRRSV感染小鼠脾淋巴细胞分泌IL-8水平,与病毒对照组相比差异极显著(P<0.01)。200 mg/kg的山豆根多糖在一定程度上能升高PRRSV感染小鼠脾淋巴细胞分泌IL-8水平,但与病毒对照组相比差异不显著(P>0.05),且200 mg/kg的山豆根多糖在一定程度上也能升高小鼠脾淋巴细胞分泌IL-8水平,与空白对照组相比差异极显著(P>0.05)(表2)。结果表明50 mg/kg和100 mg/kg的山豆根多糖作用PRRSV感染小鼠脾淋巴细胞14 d可以明显降低小鼠脾淋巴细胞分泌IL-8水平。
2.5山豆根多糖对PRRSV感染小鼠脾淋巴细胞分泌IL-10水平的影响
PRRSV感染小鼠脾淋巴细胞14 d可明显升高细胞分泌IL-10水平,与空白对照组相比差异极显著(P<0.01)。用不同浓度山豆根多糖处理后,50 mg/kg和100 mg/kg的山豆根多糖能明显降低PRRSV感染小鼠脾淋巴细胞分泌IL-10水平,与病毒对照组相比差异极显著(P<0.01),但是200 mg/kg的山豆根多糖能明显升高PRRSV感染小鼠脾淋巴细胞分泌IL-10水平,与病毒对照组相比差异极显著(P<0.01),且200 mg/kg的山豆根多糖能明显升高小鼠脾淋巴细胞分泌IL-10水平,与空白对照组相比差异极显著(P<0.01)(表2)。结果表明50 mg/kg和100 mg/kg的山豆根多糖作用PRRSV感染小鼠脾淋巴细胞14 d可以明显降低小鼠脾淋巴细胞分泌IL-10水平。
2.6山豆根多糖对PRRSV感染小鼠脾淋巴细胞分泌MCP-1水平的影响
PRRSV感染小鼠脾淋巴细胞14 d可明显升高细胞分泌MCP-1水平,与空白对照组相比差异极显著(P<0.01)。用不同浓度山豆根多糖处理后,50 mg/kg和100 mg/kg的山豆根多糖能明显降低PRRSV感染小鼠脾淋巴细胞分泌MCP-1水平,与病毒对照组相比差异极显著(P<0.01),但是200 mg/kg的山豆根多糖能明显升高PRRSV感染小鼠脾淋巴细胞分泌MCP-1水平,与病毒对照组相比差异极显著(P<0.01),且200 mg/kg的山豆根多糖能明显升高小鼠脾淋巴细胞分泌MCP-1水平,与空白对照组相比差异极显著(P<0.01)(表2)。结果表明50 mg/kg和100 mg/kg的山豆根多糖作用PRRSV感染小鼠脾淋巴细胞14 d可以明显降低小鼠脾淋巴细胞分泌MCP-1水平。
3 讨论
猪繁殖与呼吸综合征发生过程中,氧化应激和一些炎性细胞因子之间有着紧密的联系,氧化应激水平的增加促进了炎性细胞因子分泌可能是猪繁殖与呼吸综合征发生发展的主要机制之一[10-11]。本研究PRRSV感染小鼠14 d极显著升高小鼠脾淋巴细胞分泌TNF-α、IL-10、MCP-1水平,用不同浓度山豆根多糖处理后,50 mg/kg和100 mg/kg的山豆根多糖能极显著降低PRRSV感染小鼠脾淋巴细胞分泌TNF-α、IL-6、IL-8、IL-10、MCP-1水平。表明一定浓度的山豆根多糖通过抑制PRRSV感染小鼠脾淋巴细胞分泌细胞因水平达到干预PRRSV感染小鼠脾淋巴细胞氧化应激的目的。
天然多糖具有复杂的结构并表现出免疫调节、抗肿瘤、抗菌、抗病毒、抗氧化等多种功能活性[12-13]。多糖能够增强巨噬细胞的增殖活性,调节NO、H2O2等活性因子的产生,以及MCP-1、TNF-α、IL-1、IL-6、IL-8、IL-10等细胞因子的释放,从而调节巨噬细胞的免疫功能[14]。本研究依据课题组前期成功建立的PRRSV感染小鼠脾淋巴细胞氧化应激病理模型,采用不同浓度的山豆根多糖对PRRSV感染小鼠,结果发现50 mg/kg~100 mg/kg的山豆根多糖作用PRRSV感染小鼠脾淋巴细胞14 d,可以有效降低小鼠脾淋巴细胞分泌TNF-α、IL-1β、IL-6、IL-8、IL-10和MCP-1水平。提示山豆根多糖通过降低炎性因子的水平有效干预PRRSV感染小鼠脾淋巴细胞的氧化应激。
[1]刘倩,严玉霖,高洪,等.病毒感染与自由基的相互作用[J].动物医学进展,2011,32(6):167-170.
[2]宋爽.PRRSV 诱导炎症反应及其调控机制[D].湖北武汉:华中农业大学,2013.
[3]郭雅玮,宋杰,赵宝华.猪繁殖与呼吸综合征病毒对动物机体免疫机制的挑战[J].动物医学进展,2009,30(12):94-99.
[4]Leivas C L,Nascimento L F,Barros W M,et al.Substituted galacturonan from starfruit:chemical structure and antinociceptive and anti-inflammatory effects[J].Int J Biol Macromol,2016,84:295-300.
[5]郝祝兵.PRRSV感染诱导免疫细胞氧化应激及其组蛋白乙酰化修饰的研究[D].广西南宁:广西大学,2014.
[6]张晓音,吴旻,李雨萌,等.脂多糖的效应及其机理研究进展[J].动物医学进展,2015,36(12):133-136.
[7]万幸,王培训,周联,等.脂多糖刺激前后小鼠肺肝脾组织中 TLRs 等受体的基因表达情况[C]//第三届全国中医药免疫学术研讨会论文汇编,湖南长沙:2006:91-98.
[8]袁红,周慧霞,兰秋艳,等.芦丁对脂多糖诱导急性肺损伤小鼠的作用及机制[J].实用药物与临床,2015,18(9):1011-1014.
[9]谭成明,房慧伶,胡庭俊.山豆根多糖对小鼠胸腺和脾脏淋巴细胞凋亡的影响[J].西南农业学报,2011,24(2):766-771.
[10]Wang X,Zhang H,Abel A M,et al.Protein kinase R (PKR) plays a pro-viral role in porcine reproductive and respiratory syndrome virus (PRRSV) replication by modulating viral gene transcription[J].Arch Virol,2016,161(2):327-333
[11]Yan Y,Xin A,Liu Q,et al.Induction of ROS generation and NF-κB activation in MARC-145 cells by a novel porcine reproductive and respiratory syndrome virus in southwest of China [J].BMC Vet Res,2015,11(1):232.
[12]Xu J K,Li M F,Sun R C.Identifying the impact of ultrasound-assisted extraction on polysaccharides and natural antioxidants fromEucommiaulmoidesOliver[J].Process Biochem,2015,50(3):473-481.
[13]Smiderle F R,Ruthes A C,Iacomini M.Natural polysaccharides from mushrooms:antinociceptive and anti-inflammatory properties[J].Polysaccharides:Bioact Biotechnol,2015:2151-2178.
[14]Fong D,Ariganello M B,Girard-Lauzière J,et al.Biodegradable chitosan microparticles induce delayed STAT-1 activation and lead to distinct cytokine responses in differentially polarized human macrophages in vitro[J].Acta Biomaterialia,2015,12:183-194.
Effect of Sophora subprostrate Polysaccharide on Cytokine Secretion Levels in Spleen of Mice Infected with Porcinere Productive and Respiratory Syndrome Virus
LI Fei,WEI Ying-yi,YANG Jian,LU Jing-ying,TAN Hong-lian,HU Ting-jun
(College of Animal Science and Technology,Guangxi University,Nanning,Guangxi,530005,China)
To investigate the effect ofSophorasubprostratepolysaccharide(SSP)on the cytokine secretion level in splenic lymphocytes of mice infected with PRRSV,Kunming mice were set as target animals and 70 mice were divided into 7 groups randomly (A,B,C,D,E,F and G groups),ten mice each group with half male and half female.According to our preliminary experimental conditions for establishing the oxidative stress model,the animals in groups of D,E,F and G were treated with 1.0 mL virus stock by three ways of oral,intranasal adminstration and intraperitoneal injection on the day 1,day 2 and day 3.The animals in groups of A,B and C were treated with 1.0 mL of normal saline.The mice in groups of A and D were intraperitoneally injected with normal saline at 0.2 mL per 10 g body weight on day 4,day 5 and day 6.The animals in group B were treated with lipopolysaccharide(LPS) at dose of 5.0 mg/kg body weight by intraperitoneal injection on day 4,day 5 and day 6.The animals in groups of C,E,F and G were treated with SSP at doses of 200,50,100,200 mg/kg body weight respectively on day 4,day 5 and day 6.On day 14,the animals were sacrificed and homogenates of murine spleen were prepared using physiological saline.ELISA method was used to determine the levels of TNF-α,IL-1β,IL-6,IL-8,IL-10,MCP-1 in the supernatant of homogenates.The levels of TNF-α,IL-1β,IL-6,IL-8,IL-10,MCP-1 significantly increased in the animals infected with PRRSV,SSP treatments at doses of 50 mg/kg and 100 mg/kg body weight significantly decreased above cytokines in the infected mice on day 14 post infection.SSP played an important role in anti-inflammation and anti-viral infection in PRRSV infected mice.
Sophorasubprostratepolysaccharide;Porcine reproductive and respiratory syndrome virus;mouse;cytokine
2016-01-01
国家自然科学基金项目(31260619)
李飞(1988-),男,河南南阳人,硕士研究生,主要从事中药免疫药理学研究。*通讯作者
S852.23
A
1007-5038(2016)09-0038-05

