犬细小病毒单克隆抗体的制备及其在胶体金免疫层析试纸研发中的应用
马 辉,权国辉,乔宏兴,郑 鸣,赵绪永,王永芬*,边传周
(1.河南牧业经济学院生物工程学院,河南郑州 450011;2.郑州职业技术学院材料工程系,河南郑州 450121)
犬细小病毒单克隆抗体的制备及其在胶体金免疫层析试纸研发中的应用
马辉1,权国辉2,乔宏兴1,郑鸣1,赵绪永1,王永芬1*,边传周1
(1.河南牧业经济学院生物工程学院,河南郑州 450011;2.郑州职业技术学院材料工程系,河南郑州 450121)
为制备犬细小病毒胶体金免疫层析试纸,将F81细胞中分离的CPV免疫Balb/c小鼠,取其脾细胞与骨髓瘤细胞融合,建立间接ELISA方法筛选分泌CPV单克隆抗体的杂交瘤细胞,获得1株能稳定分泌CPV单克隆抗体的杂交瘤细胞株,命名为3E2。3E2的亚类为IgG1型,腹水抗体效价为1.8×105,交叉试验表明,3E2可与CPV特异性结合,与其他犬常见病毒无交叉反应。用3E2单克隆抗体制备的检测CPV的胶体金免疫层析试纸条特异性良好,为诊断和研究CPV奠定了基础。
犬细小病毒;病毒分离;单克隆抗体;胶体金免疫层析试纸
犬细小病毒病是由犬细小病毒(Canine parvovirus,CPV)所引起的传染性疾病,可通过直接或间接接触传播,以剧烈的呕吐、腹泻和白细胞减少为主要特点,可引起犬急性心肌炎。犬细小病毒传播性强,发病率和病死率较高,且可感染狐、貉、狼等动物,对养犬业和皮毛动物等经济动物养殖业可造成巨大经济损失[1]。1977年,美国科学家最先从患肠炎的犬粪便中分离出CPV。1983年,徐汉坤等首次报道了犬细小病毒病在我国的出现。
CPV在分类上属细小病毒科,病毒呈圆形或六边形,无囊膜,直径约25 nm。病毒颗粒具有球型的衣壳,衣壳内包含单链线状DNA,在DNA两端各有一个发夹样的回文结构,DNA量占整个病毒粒子重量的25%~34%。CPV基因主要编码结构蛋白VP1、VP2、VP3和非结构蛋白NS1、NS2。VP1和VP2构成病毒的衣壳,其中VP2是主要结构成分和免疫原性蛋白,能够促使机体产生中和抗体[2]。VP1和VP2蛋白对病毒与宿主细胞之间的识别起重要作用,删除VP1或VP2蛋白的突变体均失去了对宿主细胞的感染能力。近年来,CPV非结构蛋白NS1被认为在病毒的致病性和细胞毒方面起主要作用,并在体外可引起肿瘤细胞凋亡[3-5]。
目前国内外对犬细小病毒的诊断主要通过临床症状诊断、血常规检查和试纸快速诊断等,前两者存在着依赖临床经验、特异性低等缺点,难以达到对犬细小病毒病快速诊断的要求;而快速诊断试纸条主要被国外产品所垄断[6]。本研究用F81细胞分离的CPV制备获得了单克隆抗体,并用单克隆抗体,初步制备了CPV的胶体金层析快速检测试纸条。
1 材料与方法
1.1材料
1.1.1实验动物、细胞株及毒株猫肾细胞系细胞(F81),购自中国兽医药品监察所;犬细小病毒病料,河南牧业经济学院动物医院提供;SP2/0多发性骨髓瘤细胞,河南牧业经济学院生物工程学院生物技术实验室保存; Balb/c小鼠和日本长耳大白兔,购自河南农业大学实验动物中心;含有CPV VP2基因的重组质粒pGEX-6p-1-VP2,河南牧业经济学院生物工程学院生物技术实验室构建并保存;犬瘟热病毒(CDV)、犬冠状病毒(CCV)和犬腺状病毒(CAV),河南牧业经济学院生物工程学院生物技术实验室鉴定并保存。
1.1.2主要试剂与药品dNTP、DNA提取试剂盒、琼脂糖、DNA Marker DL 2 000 和蛋白分子质量标准等,宝生物工程(大连)有限公司产品;DMEM、弗氏完全佐剂、弗氏不完全佐剂、50倍HAT贮存液,GIBCO公司产品;胎牛血清,Hyclone公司产品;HRP-羊抗鼠IgG、HRP-羊抗兔IgG、羊抗鼠IgG抗体、PEG 4000、DMSO、BSA及氯金酸,Sigma公司产品;硝酸纤维素膜(NC膜),Millipore公司产品;样品垫和PVC底板,上海金标生物科技有限公司产品;SBA Clonotyping System/HRP抗体亚类鉴定试剂盒,Southern Biotechnology公司产品;引物合成和序列测定由上海生工生物工程技术服务有限公司完成;CPV多抗IgG由河南牧业经济学院生物工程学院生物技术实验室制备;犬细小病毒阴性血清由河南牧业经济学院动物医院提供;其他常规用试剂为国产或进口分析纯。
1.2方法
1.2.1病毒的鉴定样品由河南牧业经济学院动物医院提供。采集出现血便、高热等疑似CPV感染的犬粪便,加入适量磷酸盐缓冲液,5 000 r/min离心10 min,收获上清液。按常规DNA提取方法提取DNA,置于-20℃保存备用。参照CPV基因序列(基因登录号: M19296.1),设计引物序列为:上游引物P1:5′-AATCACAGCAAACTCAAGCAGAC-3′;下游引物P2:5′-TAGCAAATTCATCACCTGTTCTTAG-3′。以提取的DNA样品为模板,使用Taq酶扩增,反应条件为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 60 s,共30个循环;最后72℃ 10 min。取PCR反应产物5 μL用 10 g/L琼脂糖凝胶电泳观察结果[7]。
1.2.2病毒的分离和抗原的制备将采集的病料加入含1 000单位/mL 青霉素和链霉素的DMEM细胞维持液(含20 mL/L胎牛血清)制成1∶9的悬液,混匀后5 000 r/min离心20 min,取上清,用0.22 μm微孔滤膜过滤,置-20℃保存备用。将单层的F81细胞用胰蛋白酶消化,按1∶2传代,按体积10%的病料上清同步接种F81细胞,置37℃、体积分数为5%的CO2培养箱中培养,设立阴性对照,同时逐日观察细胞病变并进行盲传[8-9]。
待细胞病变达到80%以上时,反复冻融3次,10 000 r/min 4℃离心30 min,收获上清,加入PEG 6000浓缩,经过Sepharose 4FF凝胶柱层析,收集洗脱峰即为CPV抗原,紫外分光法检测CPV浓度,保存于-80℃。
1.2.4小鼠的免疫将纯化的CPV抗原加等体积弗氏完全佐剂初次免疫6周龄Balb/c小鼠,每隔2周分别再注射2次以加强免疫。细胞融合前3 d再加强免疫1次注射抗原。
1.2.5杂交瘤细胞的筛选和McAb腹水制备按常规方法进行细胞融合,使用建立的间接ELISA方法筛选阳性杂交瘤细胞,有限稀释法进行克隆化培养,选择能够稳定分泌、效价较高的单个克隆进行培养。按常规方法制备腹水,并采用辛酸-硫酸铵盐析法和亲和层析法纯化腹水中的McAb[12]。
1.2.6McAb亚型鉴定及染色体计数①采用SBA Clonotyping System/HRP抗体亚类鉴定试剂盒测定制备的CPV McAb的Ig亚类。②选择生长良好的杂交瘤细胞,用秋水仙素阻断法进行染色体核型分析,在显微镜下选择染色体分散良好的细胞观察计数。
1.2.7McAb的特异性分析将犬细小病毒(CPV)、犬瘟热病毒(CPV)、犬冠状病毒(CPV)和犬腺病毒Ⅱ型(CAV)作为包被抗原进行间接ELISA,检测该单克隆抗体的特异性。
1.2.8胶体金抗体的制备将 200 mL 0.1 g/L氯金酸溶液,搅拌加热至沸腾,迅速加入2 mL 10 g/L柠檬酸三钠溶液,溶液颜色从浅黄逐渐变黑,然后变红,继续煮沸10 min,溶液冷却后微孔滤膜过滤,4℃下保存备用。将制备的胶体金,调整pH至8.0后加纯化后的3E2单抗搅拌,室温静止5 min,经低温高速离心法纯化获得胶体金抗体[13]。
1.2.9免疫试纸条的制备和初步鉴定在玻璃纤维上喷涂胶体金抗体。取蛋白浓度为1.5 mg/mL 的CPV多抗IgG标记在硝酸纤维素膜上,设为检测线;取蛋白浓度为1.0 mg/mL 的羊抗鼠IgG抗体喷在离检测线5 mm处,即为质控线;将喷有检测线和质控线的硝酸纤维素膜与样品垫、胶体金垫、NC膜、吸水纸组装成试纸条。取PCR和ELISA鉴定的犬细小病毒(CPV)、犬瘟热病毒(CDV)、犬冠状病毒(CCV)和犬腺病毒Ⅱ型(CAV),用制备的胶体金试纸条进行检测,验证其特异性。
2 结果
2.1PCR鉴定
通过PCR扩增,得到608 bp左右的预期大小目的片段,经测序与预期序列一致,证明样品中含有CPV(图1)。
2.2病毒的分离
从第3代开始一般会出现规律性细胞病变,接种病料上清液后约24 h~36 h,细胞出现弥散性颗粒,胞浆收缩,细胞变圆;约48 h病变细胞开始逐渐拉网、崩解、脱落;约72 h~96 h,细胞病变达80%以上时,收毒,置-80℃保存备用(图2)。

M.DNA 标准DL 2 000;1.阴性对照;2.目的片段;3.阴性对照
M.DNA Marker DL 2 000;1.Negative control;2.PCR products of CPV;3.Negative control
图1CPV PCR检测结果
Fig.1Detection of CPV by PCR
2.3间接ELISA方法建立
采用方阵滴定确定抗原的最佳包被浓度和阳性血清最佳稀释度,阳性判断标准为OD待检血清>0.4,且OD待检血清/OD标准阴性值≥2.1,当抗原的稀释浓度为1∶160,血清的稀释度为1∶80,阴性与阳性血清的OD 450 nm值相差最大(P/N=9.253)。建立了筛选犬细小病毒 McAb的间接ELISA方法(表1)。
2.4杂交瘤细胞株的筛选
经脾细胞与骨髓瘤细胞SP2/0细胞融合并筛选,获得1株能高效分泌抗CPV单克隆抗体的杂交瘤细胞株,命名为3E2。间接ELISA检测,3E2腹水效价为1∶1.8×105。
2.5McAb的Ig亚类鉴定
检测抗体的Ig亚类,结果表明,3E2亚类为IgG1型。

A.F81细胞;B.病变F81细胞
A.F81 cells;B.CPE of F81 cells

图2 CPV病毒的分离
2.6杂交瘤细胞染色体数目
Balb/c小鼠脾细胞的染色体为40条,SP2/0骨髓瘤细胞的染色体为62条。统计结果表明,该细胞株染色体数介于90条~100条,大约为小鼠脾细胞和SP2/0骨髓瘤细胞染色体数目之和,说明为两者融合产生(图3)。
2.7McAb的特异性检测
将3E2分别与犬细小病毒(CPV)、犬瘟热病毒(CDV)、犬冠状病毒(CCV)和犬腺病毒Ⅱ型(CAV)包被的ELISA板进行交叉反应试验,结果发现,3E2与CPV可发生阳性反应,与CDV、CCV和CAV不发生反应,表明制备的McAb与其他犬常见病毒没有交叉反应,制备的3E2单克隆抗体有良好的特异性(表2)。
2.8胶体金溶液的制备
制成的胶体金溶液日光下肉眼观察透明清亮、颜色为酒红色、无沉淀。经紫外分光光度计检测其最大吸收波长为525 nm。

图3 杂交瘤细胞的染色体分析Fig.3 Analysis of chromosones of hybridoma cells
2.9胶体金免疫层析试纸的特异性
特异性试验结果显示犬瘟热病毒(CDV)、犬冠状病毒(CCV)和犬腺病毒Ⅱ型(CAV)在胶体金免疫层析试纸检测线上均无条带,为阴性。犬细小病毒(CPV)在检测线上均出现特异性条带,为阳性(图4)。

表2 McAb交叉反应试验结果
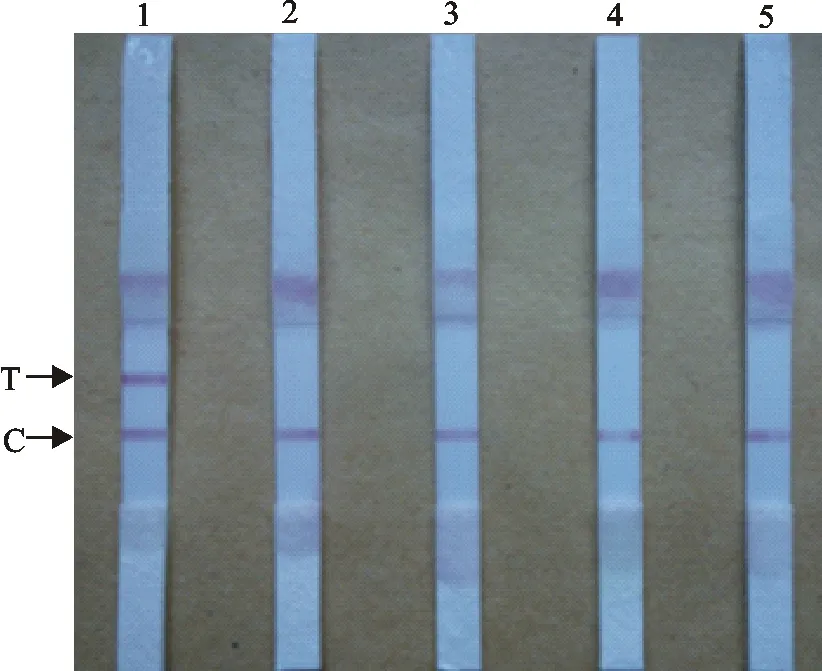
1.犬细小病毒;2.犬瘟热病毒;3.犬冠状病毒;4.犬腺病毒Ⅱ型;5.阴性对照
1.CPV;2.CDV;3.CCV;4.CAV;5.Negative control
图4胶体金试纸条特异性检测
Fig.4Specificity test of colloidal gold test strip detection
3 讨论
犬细小病毒病传播性强,发病率和病死率较高,且一年四季都有发生,绝大多数年龄、品种的犬类都可被传染,但幼犬和纯种犬更易被感染,病死率也高[14-15]。细小病毒感染犬类后,一旦发病治愈率特别低,没有特效药,早期确定犬细小病毒病并予以抗病毒、消炎、补液和止呕等治疗,可以提高疗效和存活率,因此,对CPV的早期检测就非常关键[16-19]。胶体金免疫层析试纸检测方法只需将待测溶液加入试纸条中,静止后一段时间观察结果,不需要仪器设备来读取结果,不需要操作者有专业技能,能减少很大检测工作量和节省大量检测费用,敏感性高,特异性好[20]。但目前我国市场上部分CPV试纸条主要以国外进口为主,价格较为昂贵,市场较为广阔。
我们以分离得到并纯化的CPV为抗原,多次腹腔注射免疫小鼠获得了能够分泌抗CPV McAb的脾细胞,ELISA试验结果表明该杂交瘤细胞产生的McAb只与CPV发生特异性反应,与CDV、CCV和CAV无明显的交叉反应,表明制备的3E2单克隆抗体有良好的特异性。另外,经间接ELISA检测,3E2腹水效价为1∶1.8×105。
本试验确定了标记的最佳条件,设定3E2为金标抗体、取蛋白浓度为1.5 mg/mL 的CPV多抗IgG标记为检测线,蛋白浓度为1.0 mg/mL的兔抗鼠IgG高免血清标记为质控线,初步建立了胶体金免疫层析方法。本试验建立的诊断方法特异性强,与其他3种犬常见病毒抗原无交叉反应,具有较好的重复性,与ELISA方法结果一致,可用于CPV的快速检测。下一步我们将在反应条件、稳定性及工艺上进一步改进,以期进一步提高检测灵敏度。
本研究分离并纯化了CPV,经免疫Balb/c小鼠后,通过杂交瘤技术获得了1株高亲和力和高特异性的杂交瘤细胞,经鉴定制备出的McAb效价高、特异性强。并在此基础上研发了胶体金免疫层析检测试纸条,快捷准确,在临床上具有很好的应用前景,有一定的社会和经济价值,并为犬细小病毒的深入研究奠定了基础。
[1] 赵建军,闫喜军,吴威.犬细小病毒:从起源到进化[J].微生物学报,2011,51(7): 869-875.
[2]Decaro N,Buonavoglia C.Canine parvovirus-a review of epidemiological and diagnostic aspects, with emphasis on type 2c [J].Vet Microbiol,2012,155(1):1-12.
[3]Santra L,Rajmani R S,Ravi Kumar G V,et al.Non-structural protein 1 (NS-1) gene of canine parvovirus-2 regresses chemically induced skin tumors in Wistar rats [J].Res Vet Sci,2014,97(2):292-296.
[4]Gupta S K,Sahoo A P,Rosh N,etal.Canine parvovirus NS1 induced apoptosis involves mitochondria,accumulation of reactive oxygen species and activation of caspases [J].Virus Res,2016,213(2):46-61.
[5]Gupta S K,Yadav P K,Gandham R K,et al.Canine parvovirus NS1 protein exhibits anti-tumor activity in a mouse mammary tumor model [J].Virus Res,2016, 213(2):289-298.
[6]Wang J,Liu L,Li R,et al.Rapid and sensitive detection of canine parvovirus type 2 by recombinase polymerase amplification [J].Arch Virol,2016,213(2):289-298.
[7]J萨姆布鲁克,D W拉塞尔.分子克隆实验指南[M].3版.黄培堂,等,译.北京:科学出版社,2002.
[8]周云朵,康真玉,陈月平,等.犬细小病毒的分离鉴定与生物学特性分析[J].畜牧兽医学报,2011,42(10):1402-1408.
[9]孟凡进,于志海,邱昌伟,等.犬细小病毒地方株的分离与生物学特性分析[J].动物医学进展,2014,35(9):15-19.
[10]马辉, 赵绪永.犬细小病毒VP2主要抗原表位区的原核表达载体构建及诱导表达[J].郑州牧业工程高等专科学校学报,2012,32(2):9-11.
[11]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000.
[12]Coligan J E.Current protocol in immunology[M].New York:Associates,2003.
[13]钱红,石峰,陈创夫,等.伯氏疏螺旋体外膜蛋白OspA胶体金免疫层析法快速检测技术的建立[J] .中国病原生物学杂志,2014,9(12):1075-1083.
[14]Zhong Z,Liang L,Zhao J,et al.First isolation of new canine parvovirus 2a from Tibetan mastiff and global analysis of the full-length VP2 gene of canine parvoviruses 2 in China [J].Int J Mol Sci,2014,15(7):12166-12187.
[15]张仁舟,杨松涛,冯昊,等.中国国内首次检测到犬细小病毒CPV-2c[J].中国病原生物学杂志,2010,5(4):246-249.
[16]Sun Y L,Yen C H,Tu C F.Visual detection of canine parvovirus based on loop-mediated isothermal amplification combined with enzyme-linked immunosorbent assay and with lateral flow dipstick [J].J Vet Med Sci,2014,76(4):509-516.
[17]Zhang C,Yu Y,Yang H,et al.Development of a PCR-RFLP assay for the detection and differentiation of canine parvovirus and mink enteritis virus[J].J Virol Meth,2014,210C:1-6.
[18]刘俊玮,刘娟,杜林林,等.复方参芩对犬细小病毒致心肌组织Bcl-2和Bax mRNA的影响[J] .畜牧兽医学报,2013,44(1):122-128.
[19]Mila H,Grellet A,Desario C,et al.Protection against canine parvovirus type 2 infection in puppies by colostrum-derived antibodies [J].J Nutr Sci,2014,3(11):1-4.
[20]樊淑华,王永立.胶体金免疫层析技术应用研究进展[J].动物医学进展,2014,35(10):99-103.
Development of Monoclonal Antibody and Colloidal Gold Immunochromatographic Assay for Detecting CPV
MA Hui1,QUAN Guo-hui2,QIAO Hong-xing1,ZHENG Ming1,ZHAO Xu-yong1,WANG Yong-fen1,BIAN Chuan-zhou1
(1.College of Biotechnology,Henan University of Animal Husabandry and Economy,Zhengzhou,Henan,450046,China;2.DepartmentofMaterialsScienceandEngineering,ZhengzhouTechnicalCollege,Zhengzhou,Henan,450121,China)
The canine arvovirus (CPV) isolated from dog feces was cultured and purified.SP2/0 myeloma cells SP2/0 were fused with spleen cells from CPV immunized Balb/c mice.Positive cells producing antibodies were screened by indirect ELISA,and a monoclonal antibody against CPV was generated and designated as 3E2.The monoclonal antibody belongs to IgG1.The titer of ascites was 1.8×105as detected by ELISA.No cross-reactions were observed between the McAb prepared and other canine viruses and the McAb could recognize CPV.Based on the McAb,the GICA was established by purified and gold labeled McAb 3E2.It could detect the CPV specifically.Therefore,the results indicated that the method had high specificity.It could serve as effective detection measure for clinic and further research of CPV.
CPV;virus isolation;monoclonal antibody;colloidal gold immune chromatography
2016-03-01
郑州市科技攻关计划项目(121PPTGG463);河南省科技攻关项目(142102310034);河南省高等学校科技创新团队项目(HUAHE2015001)
马辉(1980-),男,河南许昌人,讲师,博士,从事动物病原生物学研究。*通讯作者
S854.43;S852.659.2
A
1007-5038(2016)09-0026-05

