氯化钴诱导低氧对裸鼹鼠肝星形细胞增殖及凋亡的影响
肖 邦, 李 莉, 余琛琳, 赵善民, 林丽芳, 杨文静, 丛 薇, 崔淑芳(. 第二军医大学实验动物中心, 上海 00433; . 第二军医大学教学保障处, 上海 00433)
氯化钴诱导低氧对裸鼹鼠肝星形细胞增殖及凋亡的影响
肖 邦1, 李 莉2, 余琛琳1, 赵善民1, 林丽芳1, 杨文静1, 丛 薇1, 崔淑芳1
(1. 第二军医大学实验动物中心, 上海 200433; 2. 第二军医大学教学保障处, 上海 200433)
目的 比较研究氯化钴(CoCl2)对裸鼹鼠及C57BL/6J小鼠肝星形细胞增殖和凋亡的影响。方法 采用活细胞计数试剂盒(CCK8)法和流式细胞术分别检测不同浓度CoCl2对裸鼹鼠和小鼠肝星形细胞增殖活力以及和凋亡水平的影响。采用蛋白印迹测定CoCl2处理后裸鼹鼠肝星形细胞低氧诱导因子1α(HIF-1α)和凋亡相关蛋白(BCL2、BAX)的表达水平。结果 低浓度(50 μmol/L)CoCl2对C57BL/6j小鼠肝星形细胞增殖活性具有明显的抑制作用,并能显著提高其凋亡率,然而同样剂量的CoCl2能够显著提高裸鼹鼠肝星形细胞的增值活性,对细胞凋亡率亦无明显影响。高剂量CoCl2(>200 μmol/L)虽能导致裸鼹鼠肝星形细胞增殖活力的降低,及凋亡率的升高,但裸鼹鼠肝星形细胞的变化幅度明显小于小鼠。同时CoCl2处理后,裸鼹鼠肝星形细胞HIF-1α的表达或累积显著升高(P<0.05),BCL2/BAX比率显著上调(P<0.05)。结论 与C57BL/6J小鼠相比,裸鼹鼠肝星形细胞具有更强的抵抗CoCl2引起的化学性低氧损伤的能力。同时HIF-1α可能参与调控裸鼹鼠抵抗化学性低氧环境造成的损伤。
氯化钴(CoCl2); 裸鼹鼠; 肝星形细胞; 凋亡
裸鼹鼠(Heterocephalus glaber), 属于滨鼠科, 是生活在非洲肯尼亚、埃塞俄比亚、索马里等地区地下环境的一种啮齿类动物。由于洞穴环境中气体交换极不顺畅, 而且真社会化的生存方式使得大多数的裸鼹鼠生存在极其狭小的空间内, 导致氧气供应缺乏, 继而形成了一种低氧、高CO2的生存环境[1,2]。然而, 裸鼹鼠在这种极其恶劣的生存环境中却能保持身体健康, 寿命高达30年, 超过其他任何同体积的啮齿类动物[3,4]。因此, 这个物种对低氧环境具有极强的耐受力, 是研究耐低氧机制的天然的动物模型。前期研究[5,6]表明, 与其他生活在常氧环境的哺乳类动物相比, 裸鼹鼠在其生物进化的进程中逐渐掌握了一种使其机体有效地应对周围低氧环境的策略, 例如,裸鼹鼠可以通过降低其基础代谢率来有效地适应低氧环境。而与潜水类哺乳动物相似,裸鼹鼠也通过形态学和生理学的适应性改变更加适应周围的低氧环境。
氯化钴(CoCl2)是一种人工合成的化合物,常用于模拟化学低氧环境,建立低氧损伤模型,对于低氧性疾病发病机制的研究具有重要意义[8]。CoCl2模拟化学性低氧环境的主要机制是钴离子可以置换感受器含铁血红蛋白的Fe2+,降低氧气的亲和力,从而造成缺氧环境[9]。前期研究[10,11]表明,组织低氧最重要和直接的表现为低氧诱导因子1α (HIF-1α)表达水平显著性上调。在低氧应激过程中,HIF-1通过结合到靶基因的启动子上,进而激活下游基因的表达, 启动一系列生理生化应激反应,减少或消除氧气缺乏给机体带来的不利影响。在CoCl2模拟低氧性损伤的过程中, 机体通过抑制哺乳类动物最重要的氧平衡调节因子 HIF-1α的降解可能是其减少或消除低氧损伤的一种保护机制。
本试验比较研究了不同浓度CoCl2化合物对裸鼹鼠和小鼠肝星形细胞增殖活性及凋亡率的影响,初步阐释裸鼹鼠耐低氧的主要调节机制,为低氧性损伤疾病的防治提供新线索。
1 材料与方法
1.1 细胞来源及培养
参照相关文献报道的实验方法分离裸鼹鼠及小鼠肝星形细胞[12]。原代肝星形细胞用含10%胎牛血清、100 U/mL盘尼西林和100 mg/mL链霉素的DMEM培养基培养。培养箱培养条件设定为体积分数3%O2、5%CO2、92%N2。实验过程中,所有用于实验的细胞都为5~15代的细胞。
1.2 仪器及试剂
主要仪器有超净工作台、三气培养箱、流式细胞仪、高速低温离心机、恒温干燥箱、分光光度计等。主要试剂有CoCl2(Sigma, 美国)、DMEM培养基(Sigma, 美国)、CCK8细胞增殖活性检测试剂盒(Signalway antibody, 美国)、Annexin V-FITC/PI细胞凋亡检测试剂盒(Signalway antibody,美国)、抗HIF-1α一抗(Signalway antibody,美国)、抗BAX一抗(Signalway antibody,美国)、抗BCL2一抗(Abcam,英国)、HRP标记抗Actin抗体(Sigma,美国)、预染蛋白maker(Sigma,美国)。
1.3 活细胞计数试剂盒(CCK8)法检测细胞增殖活性
裸鼹鼠及小鼠肝脏星形细胞以1×105/mL的密度接种于96孔板, 每孔体积100 μL, 细胞生长到70%~80%的汇合程度时, 弃去原培养基, 加入100 μL含不同浓度CoCl2[0 μmol/L(对照组)、50 μmol/L、100 μmol/L、150 μmol/L、200 μmol/L、250 μmol/L]的培养基, 继续培养不同时间(12 h、24 h、48 h),在指定的时间点加入10 μL CCK8溶液,37 ℃孵育1 h,分光光度计测定吸光值。
1.4 细胞凋亡水平分析
裸鼹鼠及小鼠肝星形细胞以1×105个/mL的密度接种于6孔板。在体积分数3%O2条件下,细胞生长到每孔面积60%~70%的汇合程度时,弃去原培养基, 加入2 000 μL含不同浓度CoCl2[0 μmol/L(对照组)、50 μmol/L、100 μmol/L、150 μmol/L、 200 μmol/L、250 μmol/L]的培养基, 继续培养24 h,胰酶消化细胞, 冰预冷PBS洗涤细胞两遍, 最后用含5 μL膜联蛋白V(annexin V)-异硫氰酸荧光素(FITC)和5 μL碘化丙腚(PI)的300 μL孵育缓冲液重悬细胞, 37 ℃, 避光孵育30 min, 流式细胞仪检测细胞凋亡率。早期凋亡细胞和晚期凋亡细胞分别表现为PI阴性、annexin V阳性和PI阳性、annexin V阳性。
1.5 蛋白印迹分析
裸鼹鼠肝星形细胞以1×105个/mL的密度接种于6孔板,设置培养条件为体积分数3%O2、5%CO2、92%N2,细胞生长到70%~80%的汇合程度时,弃去原培养基,加入2 000 μL含不同浓度CoCl2[0 μmol/L(对照组)、50 μmol/L、100 μmol/L、150 μmol/L、200 μmol/L、250 μmol/L]的培养基,继续培养24 h。在设定的时间点用含1 mmol/L苯甲基磺酰氟(PMSF)的RIPA裂解液裂解细胞, 提取细胞总蛋白。蛋白经聚丙烯酰氨凝胶电泳分离(90 V,30 min, 120 V, 60 min), 然后转移至PVDF膜(300 mA,90 min)。5%脱脂牛奶封闭过夜,抗HIF-1α (1∶1 000)、抗BAX一抗(1∶1 000)、抗BCL2一抗(1∶1 000)、HRP标记Actin抗体(1∶2 000),4 ℃孵育2 h, 5%脱脂奶粉封闭液稀释的二抗孵育1 h,Kodak Gel Logic 4000 R成像系统(Carestream,美国)拍照。β-actin 作为内参对照,使得组间比较具备科学性。
1.6 统计分析
使用统计软件SPSS17.0对数据进行统计分析,除特殊表述外,所有实验数据或结果均经过3次独立重复试验。平均值比较采用最小差异(LSD)t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 CoCl2对裸鼹鼠及小鼠肝星形细胞增殖活性的影响
结果显示, 不同浓度CoCl2处理不同时间(12 h、24 h、48 h)后,小鼠肝星形细胞增殖活性显著降低(P<0.05)(图1A),这表明CoCl2对小鼠肝星形细胞增殖活性具有抑制作用,但这种抑制作用不具有浓度或时间依赖性。然而,低浓度(<100 μmol/L)CoCl2处理后, 裸鼹鼠肝星形细胞增殖活性显著上升(P<0.05),而高浓度(>200 μmol/L)CoCl2处理对裸鼹鼠肝星形细胞增殖活性产生显著抑制作用(图1B),这提示,低浓度CoCl2增强裸鼹鼠肝星形细胞增殖活性,而高浓度CoCl2抑制其增殖活性。
2.2 CoCl2对裸鼹鼠及小鼠肝星形细胞凋亡率的影响
CoCl2处理24 h后, 50 μmol/L浓度组与对照组相比, 小鼠肝星形细胞总凋亡率显著上升(P<0.05), 而随着CoCl2浓度的上升, 小鼠肝星形细胞总凋亡率上升不显著(图2A、C), 这与CoCl2对其增殖活性的抑制作用不具有浓度依赖性相符。然而, 与对照组相比, 不同浓度处理裸鼹鼠肝星形细胞24 h后, 其细胞总凋亡率发生少量上调(图2B、D)(P>0.05)。

图 1 CCK8检测CoCl
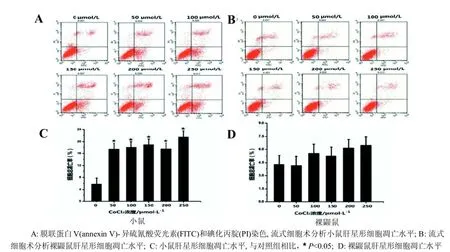
图 2 CoCl2处理24 h后裸鼹鼠及小鼠肝星形细胞凋亡水平
2.3CoCl2对裸鼹鼠肝星形细胞HIF-1α和凋亡相关蛋白的影响
CoCl2(100 μmol/L)处理裸鼹鼠肝星形细胞24 h后,HIF-1α的表达或累积显著上升(P<0.05),CoCl2(150 μmol/L、200 μmol/L)处理组HIF-1α的表达或累积与对照组相比,差异极显著(P<0.01)(图3A、B)。不同浓度CoCl2处理24 h后,与对照组相比,裸鼹鼠肝星形细胞中BCL2/BAX比率显著上调(P<0.05)(图3A、C)。
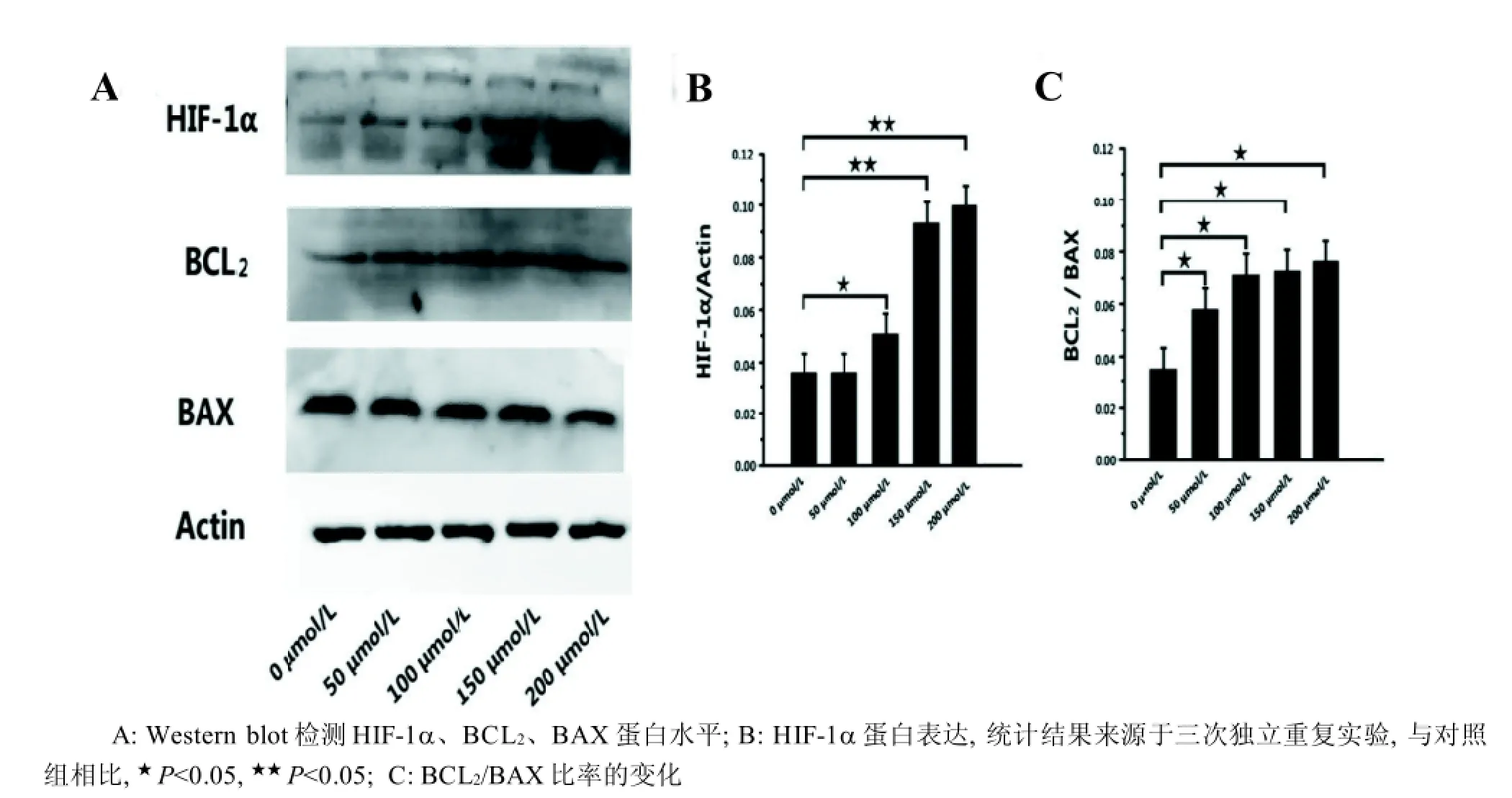
图 3 CoCl2处理24 h后裸鼹鼠肝星形细胞HIF-1α和凋亡相关蛋白水平
3 讨论
氧缺乏能够诱导一系列的细胞学、生理学及分子生物学变化,进而改变细胞的正常增殖、凋亡及损伤修复等进程[13]。因而, 脑缺血症常会造成大脑无法修复的急性损伤。人在缺氧环境中几分钟之内就会丧失意识[14]。而在一些哺乳类动物, 它们却可以长时间耐受周围环境性低氧。例如, 裸鼹鼠,与其他地上生活的哺乳类相比, 它通过形态学和生理学的适应性改变适应周围的低氧环境[15]。然而, 裸鼹鼠长时间耐受低氧环境的分子机制还不甚明了。
本实验中,采用药物CoCl2模拟化学性低氧环境,比较研究CoCl2对裸鼹鼠和小鼠肝星形细胞增殖活性及凋亡率的影响。实验结果显示,低浓度(50 μmol/L)CoCl2对小鼠肝星形细胞增殖活性具有明显的抑制作用,而且随着药物浓度的升高及处理时间的延长,这种抑制作用并未发生显著增强,这提示其不具有浓度及时间依赖性。然而,实验还显示,低浓度(<100 μmol/L)CoCl2增强裸鼹鼠肝星形细胞增殖活性,而高浓度(>200 μmol/L)CoCl2对裸鼹鼠肝星形细胞增殖活性产生显著抑制作用。这提示,CoCl2处理对裸鼹鼠肝星形细胞的增殖活性具有双重效应。低剂量CoCl2可能对裸鼹鼠肝星形细胞内稳态产生一种微干扰,活化转录因子或者激酶,增加某些具有细胞保护或者修复作用蛋白的表达(如生长因子、抗氧化因子、伴侣分子、免疫因子等),进而启动一系列修复损伤和维持细胞正常功能的机制。另外,数据也显示, 50 μmol/L浓度CoCl2处理24 h诱导小鼠肝星形细胞凋亡率显著上升,这与50 μmol/L浓度CoCl2显著性抑制小鼠肝星形细胞增殖活性结果一致。然而, 250 μmol/L浓度的CoCl2处理24 h也不能诱导裸鼹鼠肝星形细胞的凋亡率显著性上升。上述结果提示,与小鼠相比,裸鼹鼠肝星形细胞具有更强的抵抗CoCl2引起的化学性低氧损伤的能力。
目前的研究数据表明,在低氧应激过程中,低氧诱导因子1(HIF-1)通过结合到靶基因的启动子上,进而激活下游基因的表达,启动一系列生理生化应激反应,减少或消除氧气缺乏给机体带来的不利影响,从而在抵抗低氧环境过程中发挥重要作用。本研究中显示,CoCl2(100 μmol/L)处理24 h诱导裸鼹鼠肝星形细胞HIF-1α显著上调。已有研究数据表明,模拟低氧诱导或促进HIF-1α的累积增加,而HIF-1α可能具有抗凋亡作用[16]。因此,上述结果提示,裸鼹鼠肝星形细胞可能通过上调HIF-1α的表达,进而激活下游靶基因的表达来发挥抗凋亡作用,从而抵抗化学性低氧环境。
BCL2家族由抗凋亡成员和促凋亡成员组成,其成员组成一个复杂而精确的调控网络,在调控细胞凋亡过程中发挥重要作用[17]。在脊椎动物细胞中,BAX是BCL2家族的一个重要前凋亡蛋白,其与BCL2形成的异二聚体(BCL2/BAX)位于线粒体外膜,参与维持细胞线粒体外膜完整性,有利于细胞存活[18]。本实验中,CoCl2诱导裸鼹鼠肝星形细胞BCL2/BAX比率显著上调,作者推测,裸鼹鼠可能通过上调BCL2/BAX的表达来维持细胞线粒体外膜的完整性,从而抑制线粒体外膜通透性改变引起的细胞色素C等物质释放的过程,进而抑制细胞的凋亡[19]。进一步的研究表明, 低氧条件下,HIF-1α可以诱导抗凋亡或促凋亡基因的表达,参与调控细胞周期的进程,从而影响细胞的存活[20]。基于以上实验数据,作者推断,裸鼹鼠抵抗组织缺氧的一种机制可能是: 首先上调HIF-1α的表达,HIF-1α进而调控细胞凋亡相关蛋白BCL2/BAX表达的上调,从而来抑制细胞凋亡的发生。
实验结果表明,与对低氧敏感的小鼠相比,裸鼹鼠肝星形细胞具有更强的抵抗化学性低氧环境诱导的凋亡的能力。同时,HIF-1α和BCL2/BAX可能在其抗凋亡过程中发挥重要作用。
[1] Larson J, Park TJ. Extreme hypoxia tolerance of naked molerat brain [J]. Neuroreport, 2009, 20(18):1634-1637.
[2] 肖邦, 赵善民, 林丽芳, 等. 裸鼹鼠不同组织中低氧相关基因的表达 [J]. 实验动物与比较医学, 2014, 34(5):400-410.
[3] Buffenstein R, Jarvis JU. The naked mole rat-a new record for the oldest living rodent [J]. Sci Aging Knowledge Environ,2002, 2002(21):pe7.
[4] 赵善民, 林丽芳, 肖邦, 等. 低氧对裸鼹鼠皮肤成纤维细胞自噬水平及凋亡的影响 [J]. 实验动物与比较医学, 2014,34(5):405-410.
[5] Gesser H, Johansen K, Maloiy GM. Tissue metabolism and enzyme activities in the rodent Heterocephalus glaber, a poor temperature regulator [J]. Comp Biochem Physiol B, 1977,57(4):293-296.
[6] 林丽芳, 赵善民, 肖邦, 等. 裸鼹鼠成纤维细胞原代培养方法的建立 [J]. 实验动物与比较医学, 2013, 33(6):481-486.
[7] Johansen K, Lykkeboe G, Weber RE, et al. Blood respiratory properties in the naked mole rat Heterocephalus glaber, a mammal of low body temperature [J]. Respir Physiol, 1976,28(3):303-314.
[8] Yang SJ, Pyen J, Lee I, et al. Cobalt chloride-induced apoptosis and extracellular signal-regulated protein kinase 1/2 activation in rat C6 glioma cells [J]. J Biochem Mol Biol, 2004, 37 (4):480-486.
[9] Zhao J, Geng YU, Hua H, et al. Fenofibrate inhibits the expression of VEGFC and VEGFR-3 in retinal pigmental epithelial cells exposed to hypoxia [J]. Exp Ther Med, 2015,10(4):1404-1412.
[10] Wang GL, Jiang BH, Rue EA, et al. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension [J]. Proc Natl Acad Sci U S A, 1995, 92 (12):5510-5514.
[11] Semenza GL, Jiang BH, Leung SW, et al. Hypoxia response elements in the aldolase A, enolase 1, and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor 1 [J]. J Biol Chem, 1996, 271(51): 32529-32537.
[12] 李洋, 蔡双明, 张莉莉, 等. 大鼠原代肝细胞、 星状细胞、枯否细胞和肝窦内皮细胞的同步分离与培养[J]. 南方医科大学学报, 2014, 34(4):532-537.
[13] Yao KS, Clayton M, O’Dwyer PJ. Apoptosis in human adenocarcinoma HT29 cells induced by exposure to hypoxia [J]. J Natl Cancer Inst, 1995, 87(2):117-122.
[14] Zhou YF, Zheng XW, Zhang GH, et al. The effect of hypoxiainducible factor 1-alpha on hypoxia-induced apoptosis in primary neonatal rat ventricular myocytes [J]. Cardiovasc J Afr, 2010, 21(1):37-41.
[15] Grimes KM, Voorhees A, Chiao YA, et al. Cardiac function of the naked mole-rat: ecophysiological responses to working underground [J]. Am J Physiol Heart Circ Physiol, 2014,306(5):H730-737.
[16] Hochachka PW, Buck LT, Doll CJ, et al. Unifying theory of hypoxia tolerance: molecular/metabolic defense and rescue mechanisms for surviving oxygen lack [J]. Proc Natl Acad Sci U S A, 1996, 93(18):9493-9498.
[17] Valiollahpoor Amiri M, Deldar H, Ansari Pirsaraei Z. Impact of supplementary royal jelly on in vitro maturation of sheep oocytes: genes involved in apoptosis and embryonic development [J]. Syst Biol Reprod Med, 2015, 62(1):31-38.
[18] Dunleavy K. Aggressive B cell lymphoma: optimal therapy for MYC-positive, double-Hit, and triple-Hit DLBCL [J]. Curr Treat Options Oncol, 2015, 16(12):58.
[19] Wang B, Liu J, Gong Z. Resveratrol induces apoptosis in K562 cells via the regulation of mitochondrial signaling pathways [J]. Int J Clin Exp Med, 2015, 8(9):16926-16933.
[20] Sendoel A, Hengartner MO. Apoptotic cell death under hypoxia [J]. Physiology (Bethesda), 2014, 29(3):168-176.
Influence of Cobalt Chloride Induced Hypoxia on Proliferationand Apoptosis of Hepatic Stellate Cells in Naked Mole Rat
XIAO Bang1, LI Li2, YU Chen-lin, ZHAO Shan-min1, LIN Li-fang1,YANG Wen-jing1, CONG Wei1, CUI Shu-fang1
(1. Laboratory Animal Center; 2. Teaching Guarantee Department,Second Military University, Shanghai 200433, China)
Objective To compare and study the influence of cobalt chloride (CoCl2) on proliferation and apoptosis of hepatic stellate cells in the naked mole rat and C57BL/6J mouse, and preliminarily investigate the possible mechanism of hypoxic tolerance in naked mole rat. Methods Evaluating the effects of different concentrations of CoCl2on proliferation activity and apoptosis level of hepatic stellate cells in the naked mole rat and mouse by Cell Counting Kit-8 assay (CCK8) and flow cytometry. Detect the expression of hypoxia inducible factor 1α (HIF-1α) and apoptosis-related proteins (BCL2, BAX)of hepatic stellate cells in the naked mole rat after CoCl2treatment by Western blot assay. Results CoCl2significantly inhibited the proliferation and increased the apoptotic rate of hepatic stellate cells in C57BL/6j mice at a low concentration of 50 μmol/L. However, a same dose of CoCl2can significantly improve the proliferation of hepatic stellate cells in the naked mole rat but had no significant effect on its apoptotic rate. While high concentrations of CoCl2(> 200 μmol/L) showed a inhibition of proliferation and a rise of apoptotic rate of hepatic stellate cells in naked mole rat and mice, but the CoCl2-induced changes in hepatic stellate cells of the naked mole rat were much smaller than those of mice. Simultaneously, the expression of HIF-1α and the ratio of apoptosis-related proteins (BCL2/BAX) in hepatic stellate cells of the naked mole rat upregulated or accumulated significantly after treating with CoCl2(P<0.05). Conclusion Compared with C57BL/6J mice, the naked mole rat hepatic stellate cells had a greater ability of resistance to hypoxic damage caused by CoCl2. It was speculated that HIF-1α may be involved in the regulation of resistance to damage caused by hypoxic environment in naked mole rat.
Cobalt chloride(CoCl2); Naked mole rat; Hepatic stellate cells; Apoptosis
Q95-33
A
1674-5817(2016)01-0066-06
10.3969/j.issn.1674-5817.2016.01.014
2015-12-14
国家科技支撑计划课题(2015BAI09B02)、国家自然科学基金(31402028)、上海市科委基金(14140900200, 13140900400)、全军实验动物专项课题[SYDW(2014)007]联合资助
肖 邦, 男(1989-), 硕士生。E-mail: xiaobangjinli@163.com
崔淑芳, 教授。E-mail: youngstar_sf@163.com

