糖皮质激素对哮喘气道重塑大鼠骨桥蛋白水平及骨桥蛋白mRNA表达的影响
雷 琳,陈培芬,李国保,傅向东,刘 智,张香梅
糖皮质激素对哮喘气道重塑大鼠骨桥蛋白水平及骨桥蛋白mRNA表达的影响
雷 琳,陈培芬,李国保,傅向东,刘 智,张香梅
目的探讨糖皮质激素对哮喘气道重塑大鼠骨桥蛋白(OPN)水平及OPN mRNA表达的影响。方法2014年12月—2016年1月,选取30只雄性Wistar大鼠并采用随机数字表法分为正常对照组、哮喘模型组、糖皮质激素组,各10只。建立哮喘动物模型,哮喘模型组大鼠于造模第15天予以卵清蛋白(OVA)雾化吸入激发致敏;正常对照组大鼠于造模第15天予以等量0.9%氯化钠溶液腹腔注射及雾化吸入;糖皮质激素组大鼠处理同哮喘模型组,并于OVA雾化吸入激发致敏前1 h雾化吸入布地奈德混悬液(BUD)。比较3组大鼠气道壁厚度,支气管壁平滑肌厚度及胰岛素样生长因子-I(IGF-I)、神经生长因子(NGF)、核因子-κB(NF-κB)水平,OPN水平及OPN mRNA表达情况,并进行相关性分析。结果哮喘模型组大鼠气道壁厚度、支气管壁平滑肌厚度大于糖皮质激素组和正常组对照组(P<0.05);糖皮质激素组大鼠气道壁厚度、支气管壁平滑肌厚度大于正常组对照组(P<0.05)。哮喘模型组大鼠IGF-I、NGF、NF-κB水平高于糖皮质激素组和正常组对照组(P<0.05);糖皮质激素组大鼠IGF-I、NGF、NF-κB水平高于正常组对照组(P<0.05)。哮喘模型组大鼠OPN水平和OPN mRNA相对表达量高于糖皮质激素组和正常组对照组(P<0.05);糖皮质激素组大鼠OPN水平和OPN mRNA相对表达量高于正常组对照组(P<0.05)。哮喘气道重塑大鼠气道壁厚度、支气管壁平滑肌厚度及IGF-I、NGF、NF-κB水平分别与OPN水平(r值分别为0.91、0.84、0.80、0.79、0.83)、OPN mRNA相对表达量(r值分别为0.83、0.87、0.79、0.76、0.81)呈正相关(P<0.05)。结论糖皮质激素可抑制哮喘大鼠气道重塑的发生,延缓气道壁及支气管壁平滑肌增厚,降低IGF-I、NGF、NF-κB、OPN水平及OPN mRNA的表达。
气道重塑;糖皮质激素类;大鼠,Wistar;骨桥蛋白质;mRNA
雷琳,陈培芬,李国保,等.糖皮质激素对哮喘气道重塑大鼠骨桥蛋白水平及骨桥蛋白mRNA表达的影响[J].实用心脑肺血管病杂志,2016,24(8):54-58.[www.syxnf.net]
LEI L,CHEN P F,LI G B,et al.Impact of glucocorticoids on expressions of osteopontin and osteopontin mRNA of asthma rats with airway remodeling[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(8):54-58.
支气管哮喘(哮喘)是由多种细胞和细胞组共同参与的气道炎症,气道重塑是其典型表现之一[1]。研究表明,气道重塑发生于哮喘早期,呈慢性、进行性发展,可导致肺功能下降[2]。预防和逆转气道重塑在哮喘的治疗中具有积极作用,可有效改善患者肺功能。骨桥蛋白(OPN)是一种细胞外基质蛋白,其可与不同受体结合发挥多种生物效应,可导致气道炎症、细胞外基质沉积等。有研究表明,OPN是一种潜在的促炎性因子,可参与哮喘气道重塑[3]。糖皮质激素是临床治疗哮喘的一线药物,可改善患者气道炎症,缓解患者临床症状。目前,糖皮质激素对哮喘气道重塑患者OPN及其mRNA表达的影响尚不明确。布地奈德混悬液(BUD)是一种新型吸入糖皮质激素,其抗炎作用是二丙酸倍氯松的2倍,可通过调控炎症、细胞因子、抑制黏液腺肥大而参与气道重塑,临床应用广泛。本研究旨在探讨糖皮质激素对哮喘气道重塑大鼠OPN水平及OPN mRNA表达的影响,现报道如下。
1 材料与方法
1.1实验材料
1.1.1实验动物选取SPF级健康雄性Wistar大鼠30只,周龄7~11周,平均周龄(8.2±1.1)周;体质量160~200 g,平均体质量(182.6±4.1)g;购自广东省医学实验动物中心,动物合格证号:粤检证字第2002A008号;实验前1周饲养于动物实验中心动物房;饲养条件:室温22~28 ℃,相对湿度40%~70%,日光灯采光,12 h暗室,12 h光照,自由摄食、饮水。
1.1.2实验试剂卵清蛋白(OVA)购自Sigma公司,BUD购自澳大利亚Astra Zenexa公司,胰岛素样生长因子I(IGF-I)兔抗大鼠单克隆抗体购自武汉博士德生物公司,神经生长因子(NGF)抗体试剂盒购自武汉博士德生物公司,氢氧化铝干粉购自上海生物制品研究,小鼠抗大鼠OPN单克隆抗体购自美国Santa Cruz公司,核因子κB(NF-κB)亚单位兔抗大鼠单克隆抗体购自武汉博士德生物公司。
1.1.3实验仪器雾化吸入装置由上海化工机械厂有限公司提供,引物合成装置由上海生物工程技术有限公司提供。
1.2实验方法
1.2.1建立模型将OVA 100 mg和氢氧化铝干粉200 mg加入0.9%氯化钠溶液1 ml中配置成抗原溶液,实验第1天和第8天于大鼠腹腔内注射1.5 ml抗原溶液致敏,获得大鼠哮喘动物模型。
1.2.2分组2014年12月—2016年1月,采用随机数字表法将大鼠分为正常对照组、哮喘模型组、糖皮质激素组,各10只。(1)哮喘模型组大鼠于造模第15天予以OVA雾化吸入激发致敏,30 min/次,隔天1次,共8周。(2)正常对照组大鼠于造模第15天予以等量0.9%氯化钠溶液代替抗原液、雾化吸入液等进行腹腔注射及雾化吸入。(3)糖皮质激素组大鼠处理同哮喘模型组,并于OVA雾化吸入激发致敏前1 h雾化吸入BUD 4 mg/8 ml。
1.2.3标本采集各组大鼠于末次激发12 h经腹腔注射10%水合氯醛4 ml/kg麻醉,打开胸腔,取右肺肺门上段肺组织,置入4%多聚甲醛固定,送入病理科常规包埋、切片、HE染色。
1.3观察指标比较3组大鼠气道壁厚度、支气管壁平滑肌厚度,IGF-I、NGF、NF-κB水平,OPN水平和OPN mRNA表达情况,并进行相关性分析。
1.3.1气道壁厚度和支气管平滑肌厚度测量方法HE染色切片置于100倍光镜下,选内径<0.2 nm且横断面完整的小支气管,测量小气道周长(Pi)及最大直径上两个管壁厚度(T1、T2),气道壁厚度=(T1+T2)/Pi;于40倍光镜下选取完整的无软骨中小支气管横断面,采用医学图像分析系统进行图像采集,采用荧光笔描绘支气管基底膜周径(Pbm)、支气管平滑肌面积(Wam),并将测得数据标准化,支气管壁平滑肌厚度=Pbm/Wam。
1.3.2IGF-I、NGF、NF-κB水平检测方法采用免疫组化法检测气道上皮细胞IGF-I、NGF、NF-κB水平,IGF-I、NGF阳性染色均为黄褐色颗粒,NF-κB阳性染色为棕褐色颗粒,主要存在于上皮细胞的胞质中。随机选取5个小支气管切片,直径为100~200 μm,置于40倍光镜下观察,采用平均光密度值表示抗原表达量。
1.3.3OPN水平和OPN mRNA的表达采用免疫组化法检测肺组织OPN水平,严格按检测步骤进行切片、脱蜡、孵育、DAB染色,显微镜F观察,呈阳性后采用水充分冲洗,苏木素染色1 min,冲洗,0.5%~1.0%乙醇分化30 s,直至镜下可见胞核和核内染色,乙醇脱水,封片;镜下观察细胞呈棕黄色为阳性,采用图像分析软件测定阳性部位平均光密度,并取平均值。采用反转录-聚合酶链反应(RT-PCR)测定肺组织OPN mRAN表达情况,采用甘油醛-3-磷酸脱氢酶(GAPDH)作内参,内参长度为288 bp。上游引物:5′-TGCTGAGTACGTGGAG-3′;下游引物:5-TCGTGAGTACGTGGAGGTCTTCT-GAGTGGCAGTGAT-3′;OPN mRNA产物长度145 bp,上游引物:5′-CCAAGGAC-CAACTACAACC-3′;下游引物:5-TGCTGAGTACGTGGAGGTCTTCT-GAGTGGCAGTGAT-3′;扩增后得到相应目的基因片段,分析并测定每个目的基因及GAPDH的A450nm值,以其A450nm吸光度值表示基因相对表达量。

2 结果
2.1哮喘症状哮喘模型组大鼠激发第3天出现呼吸频率加快、面部发绀、行动迟缓等,部分大鼠闻及响亮呼吸音,口鼻有黏液流出,反复激发后大鼠毛色失光滑、反应迟钝;正常对照组大鼠无异常反应,正常生长;糖皮质激素组大鼠哮喘样症状较轻,且相对活跃。
2.2肺组织形态哮喘模型组大鼠肺组织经HE染色后于镜下观察发现,肺组织结构破坏,支气管周围有大量淋巴细胞、浆细胞等细胞浸润(见图1),支气管管壁、平滑肌明显增厚,管腔狭窄;正常对照组大鼠支气管、肺泡等结构基本正常,支气管管腔内无炎性渗出物和炎性细胞浸润,未出现支气管管壁、平滑肌增厚;糖皮质激素组大鼠肺泡结构基本正常,支气管浸润和支气管管壁、平滑肌增厚,但增厚程度较哮喘模型组轻。
2.3气道壁厚度、支气管壁平滑肌厚度3组大鼠气道壁厚度、支气管壁平滑肌厚度比较,差异有统计学意义(P<0.05);哮喘模型组大鼠气道壁厚度、支气管壁平滑肌厚度大于糖皮质激素组和正常组对照组,差异有统计学意义(P<0.05);糖皮质激素组大鼠气道壁厚度、支气管壁平滑肌厚度大于正常组对照组,差异有统计学意义(P<0.05,见表1)。
Table1Comparisonofairwaywallthicknessandbronchialsmoothmusclethicknessamongthethreegroups
注:与正常对照组比较,aP<0.05,与糖皮质激素组比较,bP<0.05
2.4IGF-I、NGF、NF-κB3组大鼠IGF-I、NGF、NF-κB水平比较,差异有统计学意义(P<0.05);哮喘模型组大鼠IGF-I、NGF、NF-κB水平高于糖皮质激素组和正常组对照组,差异有统计学意义(P<0.05);糖皮质激素组大鼠IGF-I、NGF、NF-κB水平高于正常组对照组,差异有统计学意义(P<0.05,见表2)。

表2 3组大鼠IGF-I、NGF、NF-κB水平比较
注:与正常对照组比较,aP<0.05,与糖皮质激素组比较,bP<0.05;IGF-I=胰岛素样生长因子I,NGF=神经生长因子,NF-κB=核因子κB
2.5OPN水平和OPN mRNA相对表达量3组大鼠OPN水平和OPN mRNA相对表达量比较,差异有统计学意义(P<0.05);哮喘模型组大鼠OPN水平和OPN mRNA相对表达量高于糖皮质激素组和正常组对照组,差异有统计学意义(P<0.05);糖皮质激素组大鼠OPN水平和OPN mRNA相对表达量高于正常组对照组,差异有统计学意义(P<0.05,见表3)。
Table3ComparisonofOPNandrelativeexpressionquantityofOPNmRNAamongthethreegroups
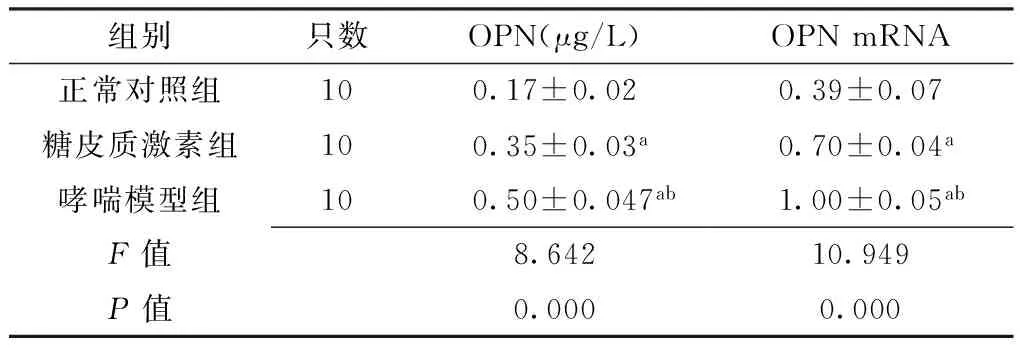
组别只数OPN(μg/L)OPNmRNA正常对照组100.17±0.020.39±0.07糖皮质激素组100.35±0.03a0.70±0.04a哮喘模型组100.50±0.047ab1.00±0.05abF值8.64210.949P值0.0000.000
注:与正常对照组比较,aP<0.05,与糖皮质激素组比较,bP<0.05;OPN=骨桥蛋白
2.6相关性分析大鼠气道壁厚度、支气管壁平滑肌厚度及IGF-I、NGF、NF-κB水平分别与OPN水平(r值分别为0.91、0.84、0.80、0.79、0.83)、OPN mRNA相对表达量(r值分别为0.83、0.87、0.79、0.76、0.81)呈正相关(P<0.05)。
3 讨论
目前,哮喘的发病机制尚不明确,以往临床认为可逆性气流阻塞是哮喘的主要特征,但随着对哮喘的深入研究发现,哮喘患者缓解期也存在肺功能低下。近年来,气道重塑在哮喘患者肺功能损伤中的作用受到临床医师的广泛关注,其呈慢性、渐进性发展,常伴随基底膜改变、气道平滑肌增厚等,故防治气道重塑是临床治疗哮喘的重点。
NGF属于神经营养蛋白家族,具有调节神经元生长,修复受损神经元的作用。有报道指出,NGF可诱导过敏反应[4]。有研究表明,气道重塑过程中可能有NGF的作用靶细胞,即结构细胞[5]。NGF通过诱导血管内皮生长因子释放而促进内皮细胞增殖、迁移,从而增加血管通透性;成纤维细胞迁移、分化为肌成纤维细胞可导致胶原沉积。IGF-I可促进人体多种细胞增殖、分化,使上皮中的成纤维细胞增殖,并参与气道重塑;激活Rho激酶途径,使支气管细胞呈慢性、进行性收缩,导致气道狭窄。NF-κB可调节炎性蛋白基因的转录,通过调控细胞因子、炎性因子、细胞间黏附分子而诱导气道重塑[6]。管频等[7]研究发现,NF-κB表达水平升高可导致气道重塑,加重肺功能损伤。李卫卫等[8]研究表明,NF-κB参与气道慢性炎性反应、成纤维细胞增殖。
OPN是一种是多功能细胞因子,嗜酸粒细胞、中性粒细胞、上皮细胞中均存在其受体,OPN与受体结合后可促使细胞增殖、分化,导致新生血管大量增生,基底膜明显增厚。国外研究表明,OPN缺乏可帮助小鼠拮抗OVA诱导的气道高反应,可能与抑制黏膜下炎性细胞浸润有关[9]。KOHAN等[10]通过体外培养OPN和正常小鼠成纤维细胞发现,OPN可抑制成纤维细胞迁移。
糖皮质激素是临床治疗哮喘的有效药物之一,可控制气道炎症、减少细胞浸润、改善支气管扩张、有效缓解哮喘症状。吸入糖皮质激素是常用的给药方式,可使药物直接作用于病灶,增加局部药物浓度,减少用药剂量,避免全身给药引起的多种不良反应。目前,临床采用糖皮质激素治疗哮喘的临床疗效确切[11]。邱容等[12]将90例哮喘缓解期患者分为对照组与观察组,对照组患者予以常规治疗,观察组患者在对照组基础上加用布地奈德治疗,结果显示,观察组患者炎性细胞水平明显降低,肺功能明显改善。有研究表明,早期予以糖皮质激素治疗在预防哮喘气道重塑中具有积极作用[13]。江丽娜等[14]研究发现,吸入布地奈德可通过下调NF-κB、基质金属蛋白酶-9而抑制气道重塑。
本研究结果显示,哮喘模型组大鼠气道壁厚度、支气管壁平滑肌厚度大于糖皮质激素组和正常组对照组,糖皮质激素组大鼠气道壁厚度、支气管壁平滑肌厚度大于正常组对照组;哮喘模型组大鼠IGF-I、NGF、NF-κB水平高于糖皮质激素组和正常组对照组,糖皮质激素组大鼠IGF-I、NGF、NF-κB水平高于正常组对照组;哮喘模型组大鼠OPN水平和OPN mRNA相对表达量高于糖皮质激素组和正常组对照组,糖皮质激素组大鼠OPN水平和OPN mRNA相对表达量高于正常组对照组;气道壁厚度、支气管壁平滑肌厚度及IGF-I、NGF、NF-κB水平分别与OPN水平、OPN mRNA相对表达量呈正相关。说明NGF、IGF-I、NF-κB参与了哮喘气道重塑,OPN在哮喘气道重塑过程中具有重要作用,而BUD可通过降低IGF-I、NGF、NF-κB、OPN水平及OPN mRNA相对表达量而抑制气道重塑的发生。
综上所述,糖皮质激素可抑制哮喘大鼠气道重塑的发生,延缓气道壁及支气管壁平滑肌增厚,降低IGF-I、NGF、NF-κB、OPN水平及OPN mRNA的表达,具有一定的参考价值。
作者贡献:雷琳、李国保、傅向东进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;陈培芬、傅向东、刘智、张香梅进行实验实施、评估、资料收集;李国保进行质量控制及审校。
本文无利益冲突。
[1]JANG A S,KWON H S,CHO Y S,et al.Identification of subtypes of refractory asthma in Korean patients by cluster analysis[J].Lung,2013,191(1):87-93.
[2]DA SILVA A L,MARTINI S V,ABREU S C,et al.DNA nanoparticle-mediated thymulin gene therapy prevents airway remodeling in experimental allergic asthma[J].J Control Release,2014(180):125-133.
[3]KOHAN M,BREUER R,BERKMAN N.Osteopontin induces airway remodeling and lung fibroblast activation in a murine model of asthma[J].Am J Respir Cell Mol Biol,2009,41(3):290-296.
[4]YANG Y G,TIAN W M,ZHANG H,et al.Nerve growth factor exacerbates allergic lung inflammation and airway remodeling in a rat model of chronic asthma[J].Exp Ther Med,2013,6(5):1251-1258.
[5]杨运刚.神经生长因子在支气管哮喘发病机制中的作用[J].国际儿科学杂志,2011,38(2):151-154.
[6]宋颖芳,洪景芳,柳德灵,等.1,25-二羟维生素D_3对哮喘气道重塑小鼠模型NF-κB信号通路的调控研究[J].中国药理学通报,2012,28(12):1704-1708.
[7]管频,于化鹏,李伟,等.慢性阻塞性肺疾病患者肺组织中核转录因子-κB、转化生长因子-β1表达与气道重塑的关系[J].中国老年学杂志,2015,35(2):313-314.
[8]李卫卫,李亚,李建生.NF-κB/TGF-β1/Smads通路在慢性阻塞性肺疾病气道重塑中的研究进展[J].国际呼吸杂志,2013,33(3):213-217.
[9]SIMOES D C,XANTHOU G,PETROCHILOU K,et al.Osteopontin deficiency protects against airway remodeling and hyperresponsiveness in chronic asthma[J].Am J Respir Crit Care Med,2009,179(10):894-902.
[10]KOHAN M,BREUER R,BERKMAN N.Osteopontin induces airway remodeling and lung fibroblast activation in a murine model of asthma[J].Am J Respir Cell Mol Biol,2009,41(3):290-296.
[11]王燕飞.糖皮质激素两种不同给药方法治疗婴幼儿哮喘效果分析[J].解放军医药杂志,2011,23(1):55-56.
[12]邱容,肖昌武,何正光,等.布地奈德福莫特罗吸入剂对支气管哮喘缓解期炎症因子及肺功能的影响[J].西部医学,2015,27(12):1819-1821.
[13]程琪,尚云晓,李淼,等.支气管上皮间质转化在哮喘气道重塑中的作用及糖皮质激素对其影响[J].中国小儿急救医学,2015,22(10):693-698.
[14]江丽娜,张爱美,冷振香,等.吸入布地奈德对哮喘大鼠气道重塑影响的研究[J].中国医刊,2012,47(12):75-76.
(本文编辑:李洁晨)
Impact of Glucocorticoids on Expressions of Osteopontin and Osteopontin mRNA of Asthma Rats with Airway Remodeling.
LEILin,CHENPei-fen,LIGuo-bao,FUXiang-dong,LIUZhi,ZHANGXiang-mei..
TheThirdDepartmentofPulmonaryMedicine,theThirdPeople′sHospitalofShenzhen,Shenzhen518112,China
ObjectiveTo investigate impact of glucocorticoids on expressions of osteopontin(OPN)and osteopontin mRNA(OPN mRNA)of asthma rats with airway remodeling.MethodsFrom December 2014 to January 2016,a total of 30 male Wistar rats were selected and divided into A group,B group and C group according to random number table,each of 10 rats.Animal model of asthma was prepared,rats of B group received aerosol inhalation of ovalbumin(OVA)to stimulate the sensitization on the 15th day of preparation of asthma model,meanwhile rats of A group received equivalent 0.9% sodium chloride injection,while rats of C group received aerosol inhalation of budesonide suspension 1 hour before aerosol inhalation of OVA.Airway wall thickness,bronchial smooth muscle thickness,IGF-I,NGF,NF-κB,OPN and expression of OPN mRNA were compared among the three groups,and their correlations were analyzed.ResultsAirway wall thickness and bronchial smooth muscle thickness of B group were statistically significantly larger than those of A group and C group(P<0.05);meanwhile airway wall thickness and bronchial smooth muscle thickness of C group were statistically significantly larger than those of A group(P<0.05).IGF-I,NGF and NF-κB of B group were statistically significantly higher than those of A group and C group(P<0.05);meanwhile IGF-I,NGF and NF-κB of C group were statistically significantly higher than those of A group(P<0.05).OPN and relative expression quantity of OPN mRNA of B group were statistically significantly higher than those of A group and C group(P<0.05);meanwhile OPN and relative expression quantity of OPN mRNA of C group were statistically significantly higher than those of A group(P<0.05).Of asthma rats with airway remodeling,airway wall thickness,bronchial smooth muscle thickness,IGF-I,NGF,NF-κB was positively correlated with OPN,respectively(r=0.91,0.84,0.80,0.79,0.83),was also positively correlated with relative expression quantity of OPN mRNA,respectively(r=0.83,0.87,0.79,0.76,0.81)(P<0.05).ConclusionGlucocorticoids can inhibit the occurrence of airway remodeling of rats with asthma,delay the incrassation of airway wall and bronchial smooth muscle,reduce the IGF-I,NGF,NF-κB,OPN and expression of OPN mRNA.
Airway remodeling;Glucocorticoids;Rats,Wistar;Osteopontin;mRNA
广东省医学科研基金立项课题(A2014639)
518112广东省深圳市第三人民医院肺三科(雷琳,李国保,傅向东,刘智),内二科(陈培芬),病理科(张香梅)
R 332
A
10.3969/j.issn.1008-5971.2016.08.014
2016-05-05;
2016-08-11)

