绶草萃取物体外抗氧化活性及其总酚含量比较
严 鑫 王 委 刘 量
(扬州大学医学院, 江苏 扬州 225009)
绶草萃取物体外抗氧化活性及其总酚含量比较
严鑫 王委 刘量
(扬州大学医学院, 江苏 扬州225009)
采用DPPH法、ABTS法测定绶草不同有机溶剂萃取物的体外抗氧化活性,并用福林酚法测定其总酚含量。结果表明:绶草各溶剂萃取物均有明显的体外抗氧化活性,且呈剂量依赖性;各溶剂萃取物的抗氧化活性强弱及总酚含量大小顺序均为:乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物。说明绶草不同萃取物体外抗氧化活性与总酚含量呈正相关,其中乙酸乙酯萃取物的清除DPPH·及ABTS+·的IC50值分别为(45.270±0.005),(75.420±0.015) μg/mL,总酚含量为(13.861±0.002)%。
绶草;萃取物;抗氧化活性;总酚
绶草(Spiranthessinensis(Pers.)Ames)为兰科绶草属植物,又名盘龙参、盘龙草、清明草等,生于草丛、湿草地或山坡中,中国各地均有分布[1-2]。绶草为药食同源植物,常用来制作药膳,具有滋补强身的作用[3]。绶草还是凉茶植物,用来制作夏季的消暑饮品,具有滋阴清热,化痰止咳的功效[4]。已有报道[5-7]显示绶草主要成分为包括二氢菲类、黄酮类、苯丙素类等在内的酚类成分,具有开发抗氧化剂的前景。但绶草不同萃取物抗氧化活性和总酚含量是否有差异还未见报道。
本研究拟采用DPPH法、ABTS法测定绶草各有机溶剂萃取物的抗氧化活性,采用福林酚法测定各萃取物的总酚含量,并比较两者的相关性,旨在为绶草后续化学成分的深入研究及抗氧化剂开发提供理论依据。
1 材料与方法
1.1材料
1.1.1试验原料
绶草:采购于安徽毫州,由扬州大学生命科学与技术学院金银根教授鉴定为兰科绶草属植物绶草S.sinensis,药用部位为带根全草。
1.1.2试剂
水溶性VE(Trolox):纯度97%,美国Sigma-Aldrich公司;
1,1-二苯基-2-三硝基苯肼(DPPH):纯度99%,美国Sigma-Aldrich公司;
2,2-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS):纯度98%,美国Sigma-Aldrich公司;
福林酚试液(Folin-Ciocalteu):1 mol/L,合肥博美生物公司;
没食子酸对照品:纯度98%,上海金穗生物科技有限公司;
甲醇、无水乙醇、碳酸钠、二甲亚砜(DMSO):分析纯,国药集团化学试剂有限公司。
1.1.3主要仪器设备
万分之一电子天平:BS124S型,北京赛多利斯仪器系统有限公司;
高速万能粉碎机:FW80型,天津市泰斯特有限公司;
循环水式真空泵:SHZ-D(III)型,巩义市予华仪器有限责任公司;
旋转蒸发器:RE-3000型,上海亚荣生化仪器厂;
数显恒温水浴锅:HH-4型,上海江星仪器有限公司;
数控超声波清洗器:KQ-500DE型,昆山禾创超声仪器有限公司;
多功能酶标仪:Synergy2型,美国博腾仪器有限公司;
紫外可见红外分光光度计:U-3900型,日本日立公司;
紫外可见分光光度计:UV-9600型,北京瑞利分析仪器公司。
1.2试验方法
1.2.1原料处理绶草干燥带根全草650 g,粉碎,用95%乙醇于85 ℃下回流提取2 h,重复提取5次,减压浓缩得总浸膏。将总浸膏自然挥干至无醇味,加入10倍蒸馏水分散,再分别用等体积石油醚、乙酸乙酯、正丁醇萃取,分别得石油醚、乙酸乙酯、正丁醇萃取物,减压浓缩并挥干试剂得相应的粉末,备用。
1.2.2抗氧化活性试验溶液配制
(1) DPPH溶液配制:精密称取DPPH试剂40.0 mg,无水乙醇定容于100 mL容量瓶中,再从中吸取20 mL定容于100 mL的容量瓶中,备用。
(2) ABTS溶液配制:精密称取ABTS试剂200.0 mg,用蒸馏水定容于50 mL容量瓶中,再精密称取35.0 mg过硫酸钾,用蒸馏水定容于50 mL容量瓶中,摇匀后与ABTS水溶液混合,在室温黑暗处反应12~16 h,产生ABTS阳离子自由基。从中吸取20 mL再定容于100 mL的容量瓶中,备用。
(3) 待测样品和阳性对照溶液配制:精密称取绶草3个萃取物粉末及水溶性VE各20.0 mg,用1 mL DMSO溶解,再加无水乙醇将样品稀释成终浓度为1.000,0.500,0.400,0.200,0.100,0.050,0.025 mg/mL的溶液,备用。
1.2.3抗氧化活性测定
(1) DPPH自由基清除:DPPH是以氮原子为中心的一种稳定自由基,有强氧化性,易被抗氧化剂还原[8]。往DPPH溶液中加入抗氧化剂时,由于其自由基的清除作用,DPPH溶液颜色消退,使得吸收光谱强度随加入的抗氧化剂的量的增加而减小,通过加入抗氧化剂前后吸光度的线性变化来计算自由基清除率[9-10]。
在96孔板中加入准备好的样品溶液100 μL,每个样品平行做3个,于517 nm紫外下测定吸光度Aj,再向其中加入DPPH试剂100 μL,37 ℃遮光放置反应30 min后,测量吸光度Ai。空白对照(溶解样品的试剂)与阳性对照测定方法相同,且需同批次测定并每批次测定一次,分别记录。根据式(1)计算清除率:

(1)
式中:
SR——DPPH自由基清除率,%;
Ai——加入DPPH后样品或阳性对照的吸光度;
Aj——未加入DPPH时样品或阳性对照的吸光度;
Ac——加入DPPH后空白对照的吸光度。
由于中药样品在高浓度时本身具有颜色,DPPH自由基清除后颜色也为黄色,会对试验结果产生一定影响,故计算中需要扣除样品背景影响即Aj,以保证试验结果的准确性。
(2) ABTS自由基清除:ABTS法是以ABTS为显色剂,经活性氧氧化后生成阳离子自由基ABTS+·,呈稳定的蓝绿色溶液;若向其中加入抗氧化物质,则会与ABTS+·反应而使反应体系褪色,在734 nm处检测溶液吸光度,以此来衡量该物质的抗氧化能力[11]。
在96孔板的各个孔中加入准备好的样品溶液100 μL,每个样品平行做3个,再往里加入ABTS试剂100 μL,常温反应5 min后,于734 nm紫外下测定吸光度As。由于ABTS+·清除后颜色为无色,对试验结果几乎无影响,故此时不需要测样品本身吸光度。根据式(2)计算清除率:

(2)
式中:
SR——ABTS自由基清除,%;
Ac——加入ABTS+·后空白对照的吸光度;
As——加入ABTS+·后样品或阳性对照的吸光度。
1.2.4多酚含量测定溶液配制采用福林酚法。参照文献[12],修改如下:各称取一定量的绶草萃取物溶于甲醇中,超声辅助溶解,并用0.22 μm微孔滤膜过滤溶解液,得供试品溶液。
(1) 对照品溶液的配制:精密称取没食子酸10.0 mg,置250 mL量瓶中,以适量甲醇溶解,定容,精密量取50 mL,采用倍半稀释法依次配制成质量浓度为40,20,10,5,2.5,1.25,0.625,0.312 5 μg/mL的没食子酸甲醇溶液备用。
(2) 样品溶液的配制:精密称取绶草3个萃取物各10.0 mg,置于100 mL量瓶中,用甲醇溶解并配制成质量浓度分别为0.1 mg/mL的样品溶液。
1.2.5测定条件的优化及方法学考察
(1) 测定波长的选择:取适量没食子酸标准溶液于容量瓶中,加入10%福林酚试剂2.5 mL,再加入20%碳酸钠溶液150 μL,30 ℃下反应一段时间,在500~900 nm波长范围内测定吸光度。
(2) 稳定性试验:取适量没食子酸标准品,于上述条件下操作,在最佳检测波长处测定反应后不同时间点(0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0 h)的吸光度。
(3) 精密度试验:精确吸取2.5 mL的对照品溶液,在最佳检测波长处测定其吸光度,重复6次,计算变异系数(RSD),评价该方法的精密度。
(4) 重复性试验:称取绶草乙醇总提取物适量,按供试品溶液的配制方法,平行配制6份供试品溶液,于上述条件下操作,在最佳检测波长处测定吸光度。
(5) 加样回收率试验:分别称取绶草乙醇总提取物6份,每份精确加入一定量的没食子酸溶液,按上述条件操作,在最佳检测波长处测定吸光度,计算没食子酸回收率。
1.2.6标准曲线的建立精密量取各浓度没食子酸对照品溶液适量,按1.2.5优化的条件操作,在最佳检测波长处测定吸光度,以没食子酸溶液浓度(μg/mL)为横坐标,吸光度为纵坐标,按浓度与吸光度相关关系求回归方程。
1.2.7样品总酚含量的测定精密量取样品溶液2.5 mL,按1.2.5优化的条件操作,在最佳检测波长处测定吸光度,重复3次,再根据标准曲线,计算出样品溶液中总酚含量。
1.2.8数据分析采用SPSS 16.0、Microsoft Excel 2013进行数据处理,并运用GraphPad Prism 5 绘制图表,计算IC50值。
2 结果与讨论
2.1抗氧化活性测定
本试验以水溶性VE(Trolox)为阳性对照,分析绶草乙醇提取物各萃取物对DPPH、ABTS自由基的清除能力,以IC50值评价其抗氧化活性,IC50值越小,其抗氧化活性越强。由图1、2可知,绶草的石油醚、乙酸乙酯及正丁醇萃取物均具有清除DPPH和ABTS自由基的能力。各萃取物在浓度0.025~1.000 mg/mL时,清除DPPH及ABTS自由基的能力随浓度增加而增大;在相同浓度下,各萃取物清除DPPH自由基的能力较ABTS自由基强。

图1 绶草不同萃取物对DPPH自由基的清除能力

图2 绶草不同萃取物对ABTS自由基的清除能力
由表1可知,乙酸乙酯萃取物清除两种自由基的IC50值最低,其次为正丁醇萃取物,石油醚萃取物IC50值最大,表明绶草不同萃取物体外氧化活性由强到弱依次为:乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物。乙酸乙酯萃取物抗氧化活性略弱于阳性对照VE。

表1 绶草不同萃取物抗氧化活性
2.2多酚含量的测定
2.2.1测定波长的选择由图3可知,在500~900 nm波长范围内,没食子酸的最大吸收波长为765 nm,因此选定765 nm作为检测波长。
2.2.2稳定性试验由图4可知,溶液在2 h后吸光度基本维持稳定,考虑到试验的效率,选择反应2 h后测定溶液的吸光度。

图3 没食子酸紫外吸收光谱图

图4 反应时间对吸光度的影响
2.2.3精密度试验按1.2.5的条件操作,在765 nm波长下,对福林酚法测定一定浓度的没食子酸对照品溶液进行精密度试验,重复6次,求得吸光度平均值为0.125,RSD为0.53%,表明仪器精密度良好。
2.2.4重复性试验重复6次测定一定量绶草乙醇提取物中多酚的含量,求得平均含量为6.83%,RSD为0.79%,表明该方法重复性良好。
2.2.5加样回收率试验由表2可知,用福林酚法测得没食子酸的加样回收率为95.05%~108.91%,平均回收率为100.99%,RSD为6.23%,上述试验结果说明该方法具有较高的准确性,可用于绶草不同萃取物多酚含量的测定。

表2 没食子酸加样回收率结果
2.3标准曲线的建立
根据不同浓度的没食子酸在765 nm波长下测定的吸光度,绘制标准曲线(见图5),得到线性回归方程为Y=0.048 7x+0.010 3,相关系数(r)为0.999 8。表明没食子酸标准品溶液在0.312 5~40.000 0 μg/mL范围内与吸光度呈良好的线性关系。

图5 没食子酸浓度与吸光度的标准曲线
2.4绶草不同萃取物总酚含量测定
用上述建立的方法,测定绶草3个不同萃取物的总酚含量。由图6可知,总酚含量分别为石油醚萃取物(5.67±0.005)%,乙酸乙酯萃取物(13.861±0.002)%;正丁醇萃取物(13.717±0.002)%。说明乙酸乙酯萃取物和正丁醇萃取物总酚含量相当,都高于石油醚萃取物;三者总酚含量由高到低依次为:乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物。结合2.1抗氧化活性结果,表明绶草不同萃取物抗氧化活性与总酚含量呈正相关。
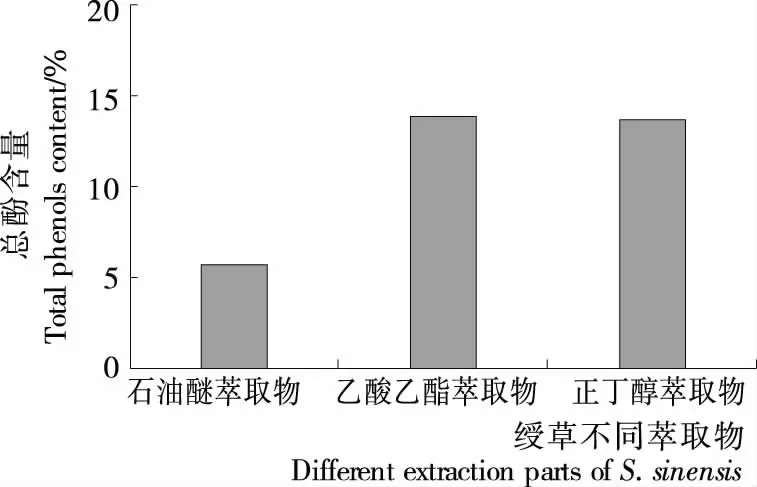
图6 绶草不同萃取物总酚含量
3 结论
本研究通过DPPH法、ABTS法评价了绶草不同萃取物体外抗氧化活性;建立了绶草不同萃取物总酚含量的测定方法,并经过了方法学考察。结果表明,绶草不同萃取物体外抗氧化活性与总酚含量呈正相关。基于前人[5-7]关于绶草化学成分的研究结果,推测绶草乙酸乙酯萃取物总酚含量较高、抗氧化活性较强可能与其中含有较多的菲类、黄酮类等酚类成分有关。提示在后续进行化学成分研究时,可将重点锁定在乙酸乙酯萃取物;通过活性导向分离的方法,实现该萃取物中抗氧化成分的快速靶向分离,并通过对分离所得单体成分的抗氧化活性评价,进一步阐明绶草抗氧化物质基础,为从绶草中寻找天然来源的抗氧化剂的深入研究提供一定的理论依据。
[1] 董必慧, 杨小兰.沿海滩涂濒危物种缓草的生长利用特性和保护策略[J]. 江苏农业科学, 2006(3):193.
[2] 陆静梅, 李桂兰, 杨风清. 我国东北地区兰科药用植物简介[J]. 中国野生植物资源, 1994(2): 21.
[3] 倪素碧. 兰花药膳滋补强身[J]. 植物杂志, 1999(3): 15.
[4] 林仁慧. 福建地方凉茶植物资源和药用价值调查研究[D]. 福建: 福建农业大学, 2014: 44-45.
[5] DONG Mei-ling, CHEN Guang, ZHOU Zhi-ming. Flavonoid Constituents fromSpiranthesauatralisLindl[J]. Chem. Pharm Bull, 2008, 56(11): 1 600-1 603.
[6] LIU Jing, LI Cong-ying, ZHONG Yu-jiao, et al. Chemical constituents fromSpiranthessinensis[J]. Biochem Syst Ecol, 2013, 47(8): 108-110.
[7] LIN Yun-lian, HUANG Ray-ling, DON Ming-jaw, et al. Dihydrophenanthrenes fromSpiranthessinensis[J]. J. Nat. Prod., 2000, 63(12): 1 608-1 610.
[8] 曹清明, 邬靖宇, 钟海燕. 油茶叶中黄酮的超声辅助提取及其抗氧化活性研究[J]. 食品与机械, 2015, 31(3): 162-166.
[9] ARTS M J T J, SEBASTIAAN D J, VOSS H P, et al. A critical appraisal of the use of the antioxidant capacity (TEAC) assay in defining optimal antioxidant structures [J]. Food Chem., 2003, 80(3): 409-414.
[10] GIRI A, OSAKO K, OKAMOTO A, et al. Antioxidative properties of aqueous and aroma extracts of squid miso prepared with Aspergillus oryzae-inoculated koji[J]. Food Res Int, 2011, 44(1): 317-325.
[11] LI Xi-can, LIN Jing, GAO Yao-xiang, et al. Antioxidant activity and mechanism of RhizomaCimicifugae[J]. Chem. Cent J., 2012(6): 140.
[12] 王艳, 周波, 钟海雁. 制取工艺对杏仁油中总酚含量及其抗氧化能力的影响[J]. 食品与机械, 2014, 30(6): 149-152.
Comparisons of antioxidant activities and contents of total phenols of different extraction parts from Spiranthes sinensis
YAN XinWANGWeiLIULiang
(SchoolofMedicine,YangzhouUniversity,Yangzhou,Jiangsu225009,China)
Theinvitroantioxidant activities of different extractions ofSpiranthessinensis(Pers.)Ames were evaluated through DPPH and ABTS assays, and the total phenols contents were determined by Folin-Ciocalteu method. It was shown that all the different extraction parts ofS.sinensishad significantinvitroantioxidant activities in a dose-dependent manner; The antioxidant activities and total phenols contents were both ordered as follows: ethyl acetate extraction>n-butanol extraction> petroleum ether extraction. The results showed that theinvitroantioxidant activities were positively correlated with the total phenols contents of different extraction parts ofS.sinensis, theIC50values of scavenging DPPH· and ABTS+· of ethyl acetate extraction part were (45.270±0.005) and (75.420±0.015) μg/mL, respectively, its total phenols content was (13.861±0.002)%.
Spiranthessinensis(Pers.)Ames; extraction; antioxidant activity; total phenols content
扬州市自然科学基金青年科技人才项目(编号:YZ2014022);扬州大学大学生学术科技创新基金项目(编号:x2016790)
严鑫,男,扬州大学医学院在读硕士研究生。
刘量(1980-),女,扬州大学医学院讲师,博士。
E-mail: enjoyyz@163.com
2015-12-15
10.13652/j.issn.1003-5788.2016.08.035

